一种酮咯酸液体组合物、其制备方法及应用与流程
一种酮咯酸液体组合物、其制备方法及应用
1.本技术要求享有2021年6月24日向中国国家知识产权局提交的,专利申请号为202110702722.1,发明名称为“一种酮咯酸液体组合物、其制备方法及应用”和2021年6月24日向中国国家知识产权局提交的,专利申请号为202110702691.x,发明名称为“一种酮咯酸液体组合物、其制备方法及应用”的在先申请的优先权。该在先申请的全文通过引用的方式结合于本技术中。
技术领域
2.本发明涉及一种酮咯酸液体组合物、其制备方法及应用,属于药物组合物领域。
背景技术:
3.酮咯酸是吡咯酸衍生物类非甾体抗炎药,为前列腺素合成酶抑制剂,具有强力止痛作用和中等抗炎、解热作用,主要通过阻断花生四烯酸代谢的环氧化酶,减少前列腺素的合成而发挥作用。
[0004][0005]
酣咯酸氨丁三醇是酮咯酸的盐型,是由美国辛迪斯制药公司研制,并于1990年在意大利首先上市的一种新型的可供注射给药的nsaid药物。酣咯酸氨丁三醇的镇痛作用强于抗炎作用,许多研究结果表明其缓解手术后疼痛优于吗啡,在临床上主要用于治疗手术后和产后剧痛或癌症中晚期疼痛、中等度或严重的外用性疼痛等。在标准的镇痛动物模型中,本品的镇痛活性是阿司匹林的800倍,比吲哚美辛和萘普生强,相当或优于保泰松。多次试验中,其消炎活性相当于或强于吲哚美辛,强于萘普生,并且明显优于保泰松。该药物的优点是无中枢神经系统损害和成瘾性等毒副作用,也无呼吸抑制或便秘等不良反应。
[0006]
目前,临床上使用的酮咯酸氨丁三醇主要有口服给药制剂和注射给药制剂,如片剂,胶囊,注射液等。其中,酮咯酸氨丁三醇注射液以其起效快的特点,得到了广泛使用。但是,目前原研注射液含有乙醇,而含有乙醇等有机溶媒的注射剂有一定毒性,注射时容易产生刺激性,降低病人依从性。另外,在临床上,酮咯酸氨丁三醇注射液时常与吗啡等注射液合用,而乙醇对吗啡的吸收代谢有一定的影响,增大不良反应发生的概率,因而含有乙醇的酮咯酸氨丁三醇注射液有增大不良反应的危险。此外,此注射液在长期放置中,会不断地产生白色的小点或结晶,影响可见异物及不溶性微粒,也有一定的安全隐患。
[0007]
因此,寻找物理、化学稳定、体内刺激性小、不良反应更低、更安全,更方便、患者用药顺应性好的酮咯酸剂型是目前急需解决的技术问题。
技术实现要素:
[0008]
为改善上述技术问题,本发明提供了一种酮咯酸液体组合物,其包括以下组分:酮咯酸或其药学上可接受的盐、稳定剂、渗透压调节剂、ph调节剂,以及任选存在或不存在的缓冲剂;
[0009]
其中,所述的酮咯酸液体组合物中不含乙醇;所述的酮咯酸或其药学上可接受的盐的浓度为0.15mmol/l~160.00mmol/l,所述的浓度是指酮咯酸或其药学上可接受的盐的摩尔量与所述的酮咯酸液体组合物体积的比值。
[0010]
根据本发明的实施方案,所述的酮咯酸液体组合物中,酮咯酸药学上可接受的盐优选酮咯酸氨丁三醇。
[0011]
根据本发明的实施方案,所述的酮咯酸液体组合物中,所述的酮咯酸或其药学上可接受的盐(例如酮咯酸氨丁三醇)的浓度优选0.15mmol/l~0.38mmol/l,或者30.00mmol/l~160.00mmol/l,例如39.50mmol/l~80.00mmol/l,其实例可以为39.85mmol/l或79.70mmol/l。
[0012]
根据本发明的实施方案,所述的酮咯酸液体组合物中,所述的稳定剂优选赖氨酸、精氨酸、葡甲胺、磷酸、羟丙基-β-环糊精和磺丁基-β-环糊精中的一种或多种;进一步优选精氨酸、葡甲胺、羟丙基-β-环糊精和磺丁基-β-环糊精中的一种或多种。所述的赖氨酸可以为l-赖氨酸和/或d-赖氨酸。所述的精氨酸可以为l-精氨酸和/或d-精氨酸。
[0013]
根据本发明的实施方案,所述的酮咯酸液体组合物中,所述的酮咯酸或其药学上可接受的盐与所述的稳定剂的摩尔比例优选1:0.005~1:30,进一步优选1:0.05~1:5,例如1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:1、1:1.5、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5或1:5。
[0014]
根据本发明的实施方案,所述的酮咯酸液体组合物中,所述的缓冲剂优选醋酸及其盐、硼酸及其盐、柠檬酸及其盐、酒石酸及其盐、草酸及其盐、碳酸及其盐和氨丁三醇及其盐中的一种或多种;进一步优选柠檬酸及其盐和醋酸及其盐中的一种或多种。其中,所述的盐可以为钠盐、钾盐、钙盐、氨盐或铵盐等。
[0015]
根据本发明的实施方案,所述的酮咯酸液体组合物中,所述的酮咯酸或其药学上可接受的盐与所述的缓冲剂的摩尔比例优选1:0~1:30,进一步优选1:0~1:5。当所述的酮咯酸液体组合物中存在缓冲剂时,所述的酮咯酸或其药学上可接受的盐与所述的缓冲剂的摩尔比例可以为1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:1、1:1.5、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5或1:5。
[0016]
根据本发明的实施方案,所述的酮咯酸液体组合物中,所述的ph调节剂优选盐酸、硫酸、醋酸、柠檬酸、氢氧化钠、碳酸氢钠和氨水中的一种或多种。
[0017]
根据本发明的实施方案,所述的酮咯酸液体组合物的ph范围优选6.0-9.0,进一步优选6.5-8.5,如7.0-8.0,例如7.2-7.6,其实例可以为7.4。
[0018]
根据本发明的实施方案,所述的酮咯酸液体组合物,所述的渗透压调节剂为氯化钠、甘露醇、葡萄糖和乳糖中的一种或多种。
[0019]
根据本发明的实施方案,所述的酮咯酸液体组合物的渗透压范围优选200mosmol/kg~500mosmol/kg,进一步优选260mosmol/kg~330mosmol/kg。
[0020]
根据本发明的实施方案,所述的酮咯酸液体组合物还包含水,如注射用水。
[0021]
根据本发明的实施方案,所述的酮咯酸液体组合物可以为口服液或注射液的形
式。
[0022]
本发明还提供所述的酮咯酸液体组合物的制备方法,包括将上文所述的组分混合。
[0023]
根据本发明的制备方法的实施方案,所述制备方法还包括将混合后的组分进行灭菌处理。
[0024]
本发明还提供一种冻干剂,其由所述的注射液制备,优选通过冻干工艺制备。
[0025]
本发明还提供了所述的酮咯酸液体组合物在制备用于预防和/或治疗炎症的药物中的应用,如在制备抗炎药,优选非甾体类抗炎药中的应用。
[0026]
本发明还提供了一种预防和/或治疗炎症的方法,其为给需要的患者提供治疗有效量的所述酮咯酸液体组合物。
[0027]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0028]
本发明所用试剂和原料均市售可得。
[0029]
本发明的积极进步效果在于:本发明的酮咯酸液体组合物改善了现有技术中酮咯酸制剂物理、化学稳定性差、体内刺激性较大、患者用药顺应性差、安全性不高等缺陷。所述酮咯酸液体组合物不含有机溶剂,并且具有稳定的物理和化学性质,体内刺激性小,不良反应发生率更低,安全性更好。并且,所述酮咯酸液体组合物的给药更方便,能够增进患者用药顺应性及临床用药的便利性,市场化前景好。
附图说明
[0030]
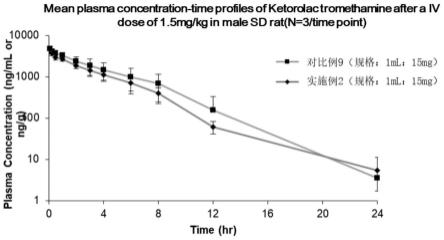
图1为sd大鼠单次静脉注射给予1.5mg/kg时,对比例9和实施例2样品的平均药-时曲线图(n=3/时间点);
[0031]
图2为sd大鼠单次肌肉注射给予6mg/kg时,对比例10和实施例3样品的平均药-时曲线图(n=3/时间点)
具体实施方式
[0032]
下面通过实施例的方式进一步说明本发明。但是,并不因此将本技术的保护范围拘囿于所述的实施例范围之中。
[0033]
下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0034]
实施例1
[0035]
处方组成:
[0036][0037][0038]
制备工艺:
[0039]
1)在室温85%处方量的注射用水中加入磺丁基-β-环糊精及氯化钠室温搅拌至完
全溶解;
[0040]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0041]
3)加入0.5mol/l氢氧化钠溶液调ph值至约7.4;
[0042]
4)补加注射用水至处方量;
[0043]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0044]
6)在121℃下,湿热灭菌15分钟;
[0045]
7)对灭菌后产品贴标,即得。
[0046]
实施例2
[0047]
处方组成:
[0048][0049]
制备工艺:
[0050]
1)在室温85%处方量的注射用水中加入磺丁基-β-环糊精及氯化钠室温搅拌至完全溶解;
[0051]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0052]
3)加入0.5mol/l氢氧化钠溶液调ph值至约7.4;
[0053]
4)补加注射用水至处方量;
[0054]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0055]
6)在121℃下,湿热灭菌15分钟;
[0056]
7)对灭菌后产品贴标,即得。
[0057]
实施例3
[0058]
处方组成:
[0059][0060]
制备工艺:
[0061]
1)在室温85%处方量的注射用水中加入磺丁基-β-环糊精及氯化钠室温搅拌至完全溶解;
[0062]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0063]
3)加入0.5mol/l氢氧化钠溶液调ph值至约7.4;
[0064]
4)补加注射用水至处方量;
[0065]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0066]
6)在121℃下,湿热灭菌15分钟;
[0067]
7)对灭菌后产品贴标,即得。
[0068]
实施例4
[0069]
处方组成:
[0070][0071]
制备工艺:
[0072]
1)在室温85%处方量的注射用水中加入磺丁基-β-环糊精及氯化钠室温搅拌至完全溶解;
[0073]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0074]
3)加入0.5mol/l氢氧化钠溶液调ph值至约7.4;
[0075]
4)补加注射用水至处方量;
[0076]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0077]
6)在121℃下,湿热灭菌15分钟;
[0078]
7)对灭菌后产品贴标,即得。
[0079]
实施例5
[0080]
处方组成:
[0081][0082]
制备工艺:
[0083]
1)在室温85%处方量的注射用水中加入羟丙基-β-环糊精及氯化钠室温搅拌至完全溶解;
[0084]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0085]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0086]
4)补加注射用水至处方量;
[0087]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0088]
6)在121℃下,湿热灭菌15分钟;
[0089]
7)对灭菌后产品贴标,即得。
[0090]
实施例6
[0091]
处方组成:
[0092][0093]
制备工艺:
[0094]
1)在室温85%处方量的注射用水中加入精氨酸及氯化钠室温搅拌至完全溶解;
[0095]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0096]
3)加入0.2mol/l盐酸溶液调ph值至约7.4;
[0097]
4)补加注射用水至处方量;
[0098]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0099]
6)在121℃下,湿热灭菌15分钟;
[0100]
7)对灭菌后产品贴标,即得。
[0101]
实施例7
[0102]
处方组成:
[0103][0104]
制备工艺:
[0105]
1)在室温85%处方量的注射用水中加入葡甲胺及氯化钠室温搅拌至完全溶解;
[0106]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0107]
3)加入0.2mol/l盐酸溶液调ph值至约7.4;
[0108]
4)补加注射用水至处方量;
[0109]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0110]
6)在121℃下,湿热灭菌15分钟;
[0111]
7)对灭菌后产品贴标,即得。
[0112]
实施例8
[0113]
处方组成:
[0114][0115]
制备工艺:
[0116]
1)在40%处方量的ph7.4柠檬酸盐缓冲液(0.2mol/l)中加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0117]
2)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0118]
3)补加ph7.4柠檬酸盐缓冲液(0.2mol/l)至处方量;
[0119]
4)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0120]
5)在121℃下,湿热灭菌15分钟;
[0121]
6)对灭菌后产品贴标,即得。
[0122]
实施例9
[0123]
处方组成:
[0124][0125]
制备工艺:
[0126]
1)在40%处方量的ph7.4醋酸盐缓冲液(2mol/l)中加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0127]
2)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0128]
3)补加ph7.4醋酸盐缓冲液(2mol/l)至处方量;
[0129]
4)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0130]
5)在121℃下,湿热灭菌15分钟;
[0131]
6)对灭菌后产品贴标,即得。
[0132]
对比例1
[0133]
处方组成:
[0134][0135]
制备工艺:
[0136]
1)在室温85%处方量的注射用水中加入氯化钠室温搅拌至完全溶解;
[0137]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0138]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0139]
4)补加注射用水至处方量;
[0140]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0141]
6)在121℃下,湿热灭菌15分钟;
[0142]
7)对灭菌后产品贴标,即得。
[0143]
对比例2
[0144]
处方组成:
[0145][0146]
制备工艺:
[0147]
1)在室温85%处方量的注射用水中加入聚乙二醇15-羟基硬脂酸酯及氯化钠室温搅拌至完全溶解;
[0148]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0149]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0150]
4)补加注射用水至处方量;
[0151]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0152]
6)在121℃下,湿热灭菌15分钟;
[0153]
7)对灭菌后产品贴标,即得。
[0154]
对比例3
[0155]
处方组成:
[0156][0157]
制备工艺:
[0158]
1)在室温85%处方量的注射用水中加入吐温80及氯化钠室温搅拌至完全溶解;
[0159]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0160]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0161]
4)补加注射用水至处方量;
[0162]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0163]
6)在121℃下,湿热灭菌15分钟;
[0164]
7)对灭菌后产品贴标,即得。
[0165]
对比例4
[0166]
处方组成:
[0167][0168]
制备工艺:
[0169]
1)在室温85%处方量的注射用水中加入聚氧乙烯35蓖麻油(elp)及氯化钠室温搅
拌至完全溶解;
[0170]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0171]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0172]
4)补加注射用水至处方量;
[0173]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0174]
6)在121℃下,湿热灭菌15分钟;
[0175]
7)对灭菌后产品贴标,即得。
[0176]
对比例5
[0177]
处方组成:
[0178][0179]
制备工艺:
[0180]
1)在室温85%处方量的注射用水中加入丙二醇及氯化钠室温搅拌至完全溶解;
[0181]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0182]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0183]
4)补加注射用水至处方量;
[0184]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0185]
6)在121℃下,湿热灭菌15分钟;
[0186]
7)对灭菌后产品贴标,即得。
[0187]
对比例6
[0188]
处方组成:
[0189][0190]
制备工艺:
[0191]
1)在室温85%处方量的注射用水中加入peg 400及氯化钠室温搅拌至完全溶解;
[0192]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0193]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0194]
4)补加注射用水至处方量;
[0195]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0196]
6)在121℃下,湿热灭菌15分钟;
[0197]
7)对灭菌后产品贴标,即得。
[0198]
对比例7
[0199]
处方组成:
[0200][0201]
制备工艺:
[0202]
1)在室温85%处方量的注射用水中加入edta室温搅拌至完全溶解;
[0203]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0204]
3)加入0.1mol/l氢氧化钠溶液调ph值至约7.4;
[0205]
4)补加注射用水至处方量;
[0206]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0207]
6)在121℃下,湿热灭菌15分钟;
[0208]
7)对灭菌后产品贴标,即得。
[0209]
对比例8
[0210]
处方组成:
[0211][0212][0213]
制备工艺:
[0214]
1)在室温85%处方量的注射用水中加入氨丁三醇及氯化钠室温搅拌至完全溶解;
[0215]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0216]
3)加入0.2mol/l盐酸溶液调ph值至约7.4;
[0217]
4)补加注射用水至处方量;
[0218]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0219]
6)在121℃下,湿热灭菌15分钟;
[0220]
7)对灭菌后产品贴标,即得。
[0221]
对比例9
[0222]
按照市售对照品披露的公开信息,采用与之相同的处方组成制备规格为1ml:15mg的样品,具体制备过程如下:
[0223]
处方组成:
[0224]
[0225]
制备工艺:
[0226]
1)在室温85%处方量的注射用水中加入乙醇及氯化钠室温搅拌至完全溶解;
[0227]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0228]
3)加入0.5mol/l氢氧化钠溶液调ph值至约7.4;
[0229]
4)补加注射用水至处方量;
[0230]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0231]
6)在121℃下,湿热灭菌15分钟;
[0232]
7)对灭菌后产品贴标,即得。
[0233]
对比例10
[0234]
按照市售对照品披露的公开信息,采用与之相同的处方组成制备规格为1ml:30mg的样品,具体制备过程如下:
[0235]
处方组成:
[0236][0237]
制备工艺:
[0238]
1)在室温85%处方量的注射用水中加入乙醇及氯化钠室温搅拌至完全溶解;
[0239]
2)加入酮咯酸氨丁三醇,搅拌至完全溶解;
[0240]
3)加入0.5mol/l氢氧化钠溶液调ph值至约7.4;
[0241]
4)补加注射用水至处方量;
[0242]
5)将药液用0.22μm聚醚砜滤膜过滤,向每支洁净的西林瓶中灌装1ml药液,压塞,轧盖;
[0243]
6)在121℃下,湿热灭菌15分钟;
[0244]
7)对灭菌后产品贴标,即得。
[0245]
实施例10
[0246]
高温试验和光照试验:
[0247]
将本发明实施例1~9、对比例1~8样品及21265dk批参比制剂(规格:15mg/ml;效期:2022.09.01;生产商:hospira,inc.)和13084dk批参比制剂(规格:30mg/ml;效期:2022.01.01;生产商:hospira,inc.)分别置于强光照射(4500
±
500lx)、高温(60℃)下放置10天,于第5天和10天分别取样测定外观性状、ph值、不溶性微粒、有关物质和含量,并与0天同批样品数据对比,结果见表1与表2。
[0248]
表1高温(60℃)试验结果
[0249]
[0250]
[0251][0252]
表2光照(4500
±
500lx)试验结果
[0253]
[0254][0255]
结果表明,本发明实施例1~9样品灭菌后为澄清状,均符合chp 2020版中国药典规定,且在高温(60℃)、光照条件下放置10天,其外观性状、有关物质、含量及ph值无明显变化;而对比例1和对比例5灭菌后样品澄清度不符合chp 2020版中国药典规定,对比例2、3、4灭菌后样品为澄清状,但在高温(60℃)条件放置10天,溶液外观性状发生明显变化,变为黄色澄清液体,且杂质含量增长明显;而对比例6、7、8灭菌后样品在高温(60℃)条件下放置10天外观性状不符合chp 2020版中国药典规定,稳定性较差。
[0256]
实施例11
[0257]
加速试验:
[0258]
将实施例2、实施例3及参比制剂(21265dk)样品置于温度40
±
2℃、相对湿度75
±
5%的恒温恒湿箱内储存6个月,于第1、2、3、6月分别取样检测,并与0天同批样品数据对比,结果见表3。
[0259]
表3加速试验结果
[0260][0261]
加速试验结果表明,实施例2、实施例3样品及参比制剂(21265dk,1ml:15mg)、参比制剂(15141dk,1ml:30mg)在加速条件下有关物质含量略有增长,但仍在chp 2020版中国药典规定范围内,其含量、外观性状、ph值无明显变化,说明实施例2、实施例3样品在加速条件下稳定性良好。
[0262]
实施例12
[0263]
长期试验:
[0264]
将实施例2、实施例3及参比制剂(21265dk,1ml:15mg)、参比制剂(15141dk,1ml:30mg)样品置于温度25
±
2℃、相对湿度60
±
5%的条件下放置24个月,并于第3、6、9、12、18、24月分别取样检测,并与0天同批样品数据对比,结果见表4。
[0265]
表4长期试验结果
[0266][0267]
长期试验结果表明,实施例2、实施例3样品及参比制剂(21265dk)在长期6月内有关物质、含量变化均在chp 2020版中国药典规定范围内,其外观性状、ph值无明显变化,说明实施例2、实施例3样品稳定性良好。
[0268]
实施例13
[0269]
血浆蛋白结合试验:
[0270]
采用平衡透析法考察供试品(实施例2和实施例3样品)与人血浆蛋白的结合率,并与市售对照品(酮咯酸氨丁三醇注射液)的人血浆蛋白结合率进行比较。
[0271]
供试品(实施例2样品,规格为1ml:15mg)和供试品(实施例3样品,规格为1ml:30mg)以及市售对照品酮咯酸氨丁三醇注射液(规格为1ml:15mg,生产商:hospira,inc.)和酮咯酸氨丁三醇注射液(规格为1ml:30mg,生产商:hospira,inc.)分别配制浓度为150ng/ml、1500ng/ml、15000ng/ml的血浆样品,37℃平衡透析6h,而后用lc-ms/ms法检测给药端样品、接收端样品和配制即刻(0h)样品,由此计算血浆蛋白结合率(ppb)和回收率,具体数据见表5。供试品以及市售对照品配制的血浆样品和pbs样品37℃振荡(100rpm)孵育6h,而后进行检测,考察样品稳定性,具体数据见表6。同时设立系统对照组,通过测定华法林(300ng/ml)的血浆蛋白结合率来评估测试系统是否适用,具体数据见表7。
[0272]
表5供试品和市售对照品与人血浆蛋白结合率和回收率
[0273][0274]
表6供试品和市售对照品在人血浆和pbs中的稳定性
[0275]
[0276][0277]
表7华法林与人血浆蛋白结合率和回收率
[0278][0279]
血浆蛋白结合试验结果:
[0280]
系统对照组华法林(300ng/ml)与人血浆蛋白的结合率均高于85%,表明测试系统适合本试验。在测试浓度150ng/ml、1500ng/ml和15000ng/ml下,供试品(实施例2样品,规格为1ml:15mg和实施例3样品,规格为1ml:30mg)与人血浆蛋白结合率为97.2%~98.4%,市售对照品酮咯酸氨丁三醇注射液(规格分别为1ml:15mg和1ml:30mg)与人血浆蛋白结合率为97.4%~98.3%,均表现出高蛋白结合率,且未见浓度依赖性,供试品和市售对照品的血浆蛋白结合率无差异。供试品和市售对照品在人血浆和pbs溶液中37℃孵育6h稳定。
[0281]
实施例14
[0282]
体外溶血试验:
[0283]
参照酮咯酸氨丁三醇注射液临床拟用信息,选择供试品的临床拟用浓度(15、30mg/ml)作为本试验浓度。将不同容量(0.5~0.1ml)的供试品1(实施例2样品,规格为1ml:15mg)、供试品2(实施例3样品,规格为1ml:30mg)市售对照品1(规格为1ml:15mg)市售对照品2(规格为1ml:30mg)和不同容量的(2.0~2.4ml)的氯化钠注射液分别加入到已有2.5ml 2%兔红细胞混悬液的玻璃试管中,同时以氯化钠注射液和灭菌注射用水分别作为阴性对照品和阳性对照品,每个试管的总体积为5.0ml,置于电热恒温箱中37℃温育3小时,观察红细胞的溶解和凝聚情况,具体试验方法见表8;供试品和市售对照品孵育在2%红细胞悬液后,15min,30min,45min,1h,2h和3h观察溶血和凝聚结果见表9。
[0284]
表8体外溶血试验方法
[0285][0286]
表9不同时间各试管溶血观察结果
[0287][0288]
体外溶血试验结果:
[0289]
供试品1(实施例2样品,规格为1ml:15mg)和供试品2(实施例3样品,规格为1ml:30mg)在体外未见兔红细胞溶血,均不引起兔红细胞凝聚。供试品和市售对照品(酮咯酸氨丁三醇注射液)结果均一致。
[0290]
实施例15
[0291]
豚鼠的主动全身过敏试验:
[0292]
通过供试品(实施例2样品,规格为1ml:15mg)于第1、3、5天肌肉注射致敏豚鼠3次,末次致敏给药后14天,对每组前3只动物足部静脉注射激发,激发后若供试品组(3~4组)动物和市售对照组均未出现过敏反应症状,则于一周后(末次致敏给药后21天)对每组剩余6只动物进行二次激发。观察豚鼠是否出现速发型过敏反应,并与市售对照品酮咯酸氨丁三醇注射液(规格为1ml:15mg)相比较,各组动物给药剂量和给药容量见表10;致敏性评价标
准见表11;供试品/对照品给予豚鼠的主动全身过敏反应统计见表12。
[0293]
表10动物分组、给药剂量和给药容量
[0294][0295]
致敏性评价参照下表11进行,并综合考虑阴性和阳性对照组的结果。
[0296]
表11全身致敏性评价标准
[0297][0298]
表12供试品/对照品给予豚鼠的主动全身过敏反应统计表
[0299][0300]
豚鼠的主动全身过敏试验结果:
[0301]
试验期间,1~5组动物激发前临床观察未见与供试品/市售对照品相关的异常反应。
[0302]
激发后,阴性对照组9只动物均未见过敏反应症状,过敏反应呈阴性。
[0303]
阳性对照组9只动物出现竖毛、搔鼻、咳嗽、排尿、呼吸困难、紫癜、步态不稳、痉挛、潮式呼吸等不同程度的过敏反应症状,其中5只动物死亡,过敏反应呈强阳性至极强阳性。
[0304]
供试品低、高剂量组和市售对照组9只/组动物均未见过敏反应症状,过敏反应呈阴性。
[0305]
在本试验条件下,供试品(实施例2样品,规格为1ml:15mg)以2和6mg/kg的剂量肌肉注射致敏3次,4和12mg/kg的剂量静脉注射激发,末次致敏后14天和21天,豚鼠均未见速发型过敏反应。供试品与市售对照品结果一致。
[0306]
实施例16
[0307]
肌肉刺激性试验:
[0308]
本实施例通过观察酮咯酸氨丁三醇注射液每天一次,共5次肌肉注射给予新西兰兔后对给药局部肌肉产生的刺激反应情况,并与市售对照品相比较。
[0309]
选用16只雄性新西兰兔,体重2.55~3.08kg,随机分为2组,8只/组,动物分组及给药浓度见表13。采用同体左右侧自身对照,所有动物左侧股四头肌肌肉注射给予阴性对照品(氯化钠注射液),组1动物右侧股四头肌肌肉注射给予浓度为30mg/ml的供试品(实施例3样品,规格为1ml:30mg),组2动物右侧股四头肌肌肉注射给予浓度为30mg/ml的市售对照品(酮咯酸氨丁三醇注射液)。给药容量为0.5ml/只。每天给药1次,共给药5天,即d1~d5,首次给药当天定义为d1。d8(末次药后72h
±
2h)将前每组3只动物实施安乐死,d19(末次药后14天)将剩余每组5只动物实施安乐死,保留给药局部并进行评价。
[0310]
表13动物分组及给药浓度
[0311][0312]
肌肉刺激性试验结果:
[0313]
临床观察:
[0314]
试验期间,动物未见与给药相关的异常临床表现。
[0315]
给药局部观察
[0316]
试验期间,动物给药局部观察未见供试品/市售对照品相关的异常。
[0317]
大体病理学:
[0318]
给药结束后72h
±
2h(d8)和恢复期结束(d19)安乐死,第1和2组动物大体观察可见右侧注射部位暗红色变色,显微镜下观察可见相关联的注射部位轻度间质出血。上述病变仅在右侧注射部位可见,而在左侧注射部位未见,因此认为与所给供试品和市售对照品相关。大体观察结果详见表14。
[0319]
表14供试品和市售对照品相关的大体病变
[0320][0321]
显微病理学:
[0322]
给药结束后72h
±
2h(d8)安乐死,第1和2组动物右侧注射部位显微镜下观察可见轻微到中度间质炎细胞浸润、轻度间质纤维化、轻微到轻度间质出血和轻微到轻度肌纤维变性/坏死伴/不伴肌纤维萎缩。上述病变程度重、发生率高,且仅在右侧注射部位可见,而在左侧注射部位未见,因此认为与所给供试品和市售对照品相关。
[0323]
表15给药结束后安乐死动物与供试品/对照品相关的显微镜下病变
[0324][0325]
恢复期结束(d19)安乐死,第1组动物右侧注射部位可见轻度间质出血和轻微到轻度肌纤维变性/坏死伴/不伴肌纤维萎缩。
[0326]
另外,第2组动物右侧注射部位可见轻微到轻度间质炎细胞浸润、轻度到中度间质纤维化、轻微间质出血、轻度到中度肌纤维变性/坏死伴/不伴肌纤维萎缩和轻微矿化。
[0327]
相比于给药结束后72h
±
2h(d8)安乐死,恢复期结束(d19)安乐死动物右侧注射部位病变的病变程度和发生率未见明显降低,提示上述病变未见恢复趋势。
[0328]
表16恢复期结束安乐死动物与供试品/对照品相关的显微镜下病变
[0329][0330]
本试验条件下,新西兰兔肌肉注射给予酮咯酸氨丁三醇注射液,每天给药1次,共给药5天,在30mg/ml的给药浓度下(给药容量为0.5ml/只),注射部位可见与供试品和市售对照品相关的大体和显微镜下病变。经过14天的恢复期,注射部位病变未见恢复趋势。综合给药结束后和恢复期结束安乐死动物病变来看,给予市售对照品动物右侧注射部位的病变发生率和病变程度稍重于给予供试品动物。
[0331]
实施例17
[0332]
血管刺激性试验:
[0333]
本实施例通过观察酮咯酸氨丁三醇注射液每天一次,共5次静脉注射给予新西兰兔后对给药局部产生的刺激反应情况,并与市售对照品相比较。
[0334]
选用16只雄性新西兰兔,体重2.74~3.74kg,随机分为2组,8只/组,动物分组及给药浓度见表17。采用同体左右侧自身对照,所有动物左耳缘静脉注射给予阴性对照品(氯化钠注射液),第1组动物右耳静脉给予供试品(实施例2样品,规格为1ml:15mg),给药浓度为15mg/ml,给药容量为1ml/只,第2组动物右耳静脉给予市售对照品(酮咯酸氨丁三醇注射液),给药浓度为15mg/ml,给药容量为1ml/只。每天给药1次,共给药5天,即d1~d5,首次给药当天定义为d1。d8(末次药后72h
±
2h)将每组前3只动物实施安乐死,d19(末次药后14天)将剩余每组5只动物实施安乐死,保留给药局部并进行评价。
[0335]
表17动物分组及给药浓度
[0336][0337]
血管刺激性试验结果:
[0338]
临床观察:
[0339]
试验期间,动物未见与给药相关的异常临床表现。
[0340]
给药局部观察:
[0341]
试验期间,动物给药局部观察未见供试品/市售对照品相关的异常。
[0342]
大体病理学:
[0343]
本试验过程中,末次药后72h(
±
2h)(d8)和末次药后14天(d19)实施安乐死的所有动物的注射部位(即给药局部)大体观察均未见异常病理改变。
[0344]
显微病理学:
[0345]
本试验过程中,末次药后72h(
±
2h)(d8)和末次药后14天(d19)实施安乐死的所有动物的注射部位(即给药局部)双侧五段静脉处显微镜观察均未见异常病理改变。
[0346]
第2组1只雄性动物(#2192610)的左侧给药部位可见轻微血管壁坏死和轻微血管周围纤维化。上述病变仅见于1只动物,且病变程度较低,因此认为是机械性损伤,与市售对照品不相关。
[0347]
试验条件下,新西兰兔重复静脉注射给予酮咯酸氨丁三醇注射液,给药浓度为15mg/ml,给药容量为1ml/只,末次药后72h(
±
2h)(d8)安乐死和末次药后14天(d19)安乐死的动物注射部位(即给药局部组织)未见与供试品/市售对照品相关的大体和显微镜下病理改变。
[0348]
实施例18
[0349]
药代动力学研究
[0350]
本实验采用12只雄性sd大鼠,单剂量经静脉(1.5mg/kg,使用实施例2样品,规格为1ml:15mg和对比例9,规格为1ml:15mg)及肌肉注射(6mg/kg,使用实施例3样品,规格为1ml:30mg和对比例10),并于给药后5分钟,15分钟,30分钟,1,2,3,4,6,8,12和24小时,采集血浆。然后采用液相色谱串联质谱(lc-ms/ms)分析方法用内标法定量测定大鼠血浆中酮咯酸氨丁三醇的浓度,通过winnonlin 8.2软件,按非房室模型计算其药动学参数,其结果如表18和表19所示,其pk曲线如图1和图2所示。
[0351]
表18:sd大鼠单次静脉注射给予1.5mg/kg不同酮咯酸氨丁三醇的制剂后酮咯酸氨丁三醇在sd大鼠体内的药代动力学
[0352][0353]
表19:sd大鼠单次肌肉注射给予6mg/kg不同酮咯酸氨丁三醇的制剂后酮咯酸氨丁三醇在sd大鼠体内的药代动力学
[0354][0355]
上述试验结果表明,本发明的酮咯酸液体组合物能够达到优异的暴露量,但体内刺激性显著减小,不良反应更低,安全性优异。并且,所述酮咯酸液体组合物用药更加方便,能够增进患者用药顺应性及临床用药的便利性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1