一种斑石鲷虹彩病毒灭活疫苗及其制备方法与流程
1.本发明属于灭活疫苗技术领域。更具体地,涉及一种斑石鲷虹彩病毒灭活疫苗及其制备方法。
背景技术:
2.斑石鲷(oplegnathus punctatus)俗称斑鲷、花金鼓或黑金鼓,英文名称spottedparrotfish,是我国名贵海水养殖鱼类新品种之一,养殖经济效益很高。随着养殖规模的不断扩大,斑石鲷病害的发生也越来越频繁和严重,给斑石鲷养殖行业的发展带来严重影响,也造成了巨大的经济损失。
3.虹彩病毒属大型二十面体状、细胞质型dna病毒,主要感染无脊椎动物和低等脊椎动物。虹彩病毒科(iridoviridae)共分为5个病毒属,即虹彩病毒属(iridovirus)、绿虹彩病毒属(chloriridovirus)、蛙病毒属(ranavirus)、淋巴囊肿病毒属(lymphocystivirus)和肿大细胞病毒属(megalocytivirus)。其中,肿大细胞病毒属病毒引起的细胞肿大虹彩病毒病是造成鱼类死亡的最主要病毒病之一,可感染多种海水或淡水养殖鱼类。斑石鲷虹彩病毒(spotted knifejaw iridovirus,skiv)隶属于肿大细胞病毒属,可导致斑石鲷等海水养殖鱼类发病并大量死亡,危害巨大。
4.疫苗是防控虹彩病毒的有效手段。例如,中国专利cn102178945a中公开了一种石斑鱼虹彩病毒灭活疫苗,注射此疫苗可以有效提高石斑鱼虹彩病毒(sgiv)攻毒后的养殖石斑鱼的存活率。除石斑鱼虹彩病毒灭活疫苗外,现有技术中还有关于大口黑鲈蛙虹彩病毒(lmbv)灭活疫苗及大菱鲆红体病虹彩病毒灭活疫苗等的报道。但对于斑石鲷虹彩病毒(skiv)的防控,目前尚未有有效的灭活疫苗,且灭活疫苗的制备也并非参照现有虹彩病毒灭活疫苗的制备方法替换抗原即可,使用不同病毒株,不同灭活方法以及不同佐剂制备得到的灭活疫苗的免疫保护效果均不同,没有统一的制备方案。因此,研发一种安全有效的斑石鲷虹彩病毒疫苗及其制备方法对斑石鲷虹彩病毒的防控具有重要意义。
技术实现要素:
5.本发明要解决的技术问题是克服现有上述技术的缺陷和不足,提供一种斑石鲷虹彩病毒灭活疫苗及其制备方法。
6.本发明的第一个目的是提供一种斑石鲷虹彩病毒灭活疫苗。
7.本发明的第二个目的是提供所述斑石鲷虹彩病毒灭活疫苗的制备方法。
8.本发明的第三个目的是提供所述斑石鲷虹彩病毒灭活疫苗在防治由斑石鲷虹彩病毒引发的病害中的应用。
9.本发明上述目的通过以下技术方案实现:
10.本发明利用分离得到的斑石鲷虹彩病毒sd株配伍白油等佐剂,制备得到了免疫保护效果好的斑石鲷虹彩病毒灭活疫苗,所述灭活疫苗可有效降低斑石鲷虹彩病毒感染后的养殖斑石鲷的死亡率。因此,本发明申请保护一种斑石鲷虹彩病毒灭活疫苗,包括灭活的斑
石鲷虹彩病毒sd株病毒液以及佐剂。
11.具体地,所述佐剂为白油佐剂、氢氧化铝胶佐剂或isa 201vg佐剂。
12.本发明还提供了所述斑石鲷虹彩病毒灭活疫苗的制备方法,包括以下步骤:
13.s1.制备斑石鲷虹彩病毒sd株病毒液;
14.s2.灭活步骤s1所得病毒液并进行灭活检验;
15.s3.将灭活检验合格的灭活病毒液与佐剂混合制备得到灭活疫苗。
16.所述斑石鲷虹彩病毒灭活疫苗的制备方法的具体步骤如下:
17.s1.将斑石鲷虹彩病毒sd株接种于斑石鲷脑细胞,当细胞病变率高于90%时,-20℃条件下反复冻融,收获病毒液,4℃保存备用;
18.s2.甲醛灭活步骤s1所得病毒液并进行灭活检验;
19.s3.将灭活检验合格的灭活病毒液与吐温-80混合制备成水相,将白油与司本-80混合煮沸后制备成油相,将水相与油相混合,10000~12000rpm乳化5~10分钟,制成油包水型灭活疫苗;或将灭活检验合格的灭活病毒液与氢氧化铝胶混合,200~1000rpm搅拌5~10分钟,制成氢氧化铝胶灭活疫苗;或将灭活检验合格的灭活病毒液与isa 201 vg混合,200~500rpm搅拌5~10分钟,制成水包油包水灭活疫苗。
20.具体地,步骤s1在斑石鲷脑细胞长成良好单层时,将其更换至含2%胎牛血清的leibovitz’s l-15培养液,随后将斑石鲷虹彩病毒sd株按体积比为1:1000的比例接种于斑石鲷脑细胞。
21.具体地,-20℃条件下反复冻融至少3次。
22.具体地,步骤s2所述甲醛灭活方法为:在步骤s1制备所得斑石鲷虹彩病毒sd株病毒液中加入甲醛溶液摇匀,4℃灭活96小时以上;所述病毒液与甲醛溶液的体积比为1000:1。
23.具体地,所述灭活检验方法为:取灭活病毒液作10倍稀释后,接种斑石鲷脑细胞(skb细胞)单层细胞(25cm2细胞瓶),接种3瓶,1ml/瓶,置于26℃培养箱中吸附1小时后弃去,于每瓶中加入10ml leibovitz’s l-15维持液(含2%胎牛血清),另设1瓶未接种的细胞为空白对照,置于26℃培养箱中培养5日,逐日观察是否有细胞病变效应(cpe)产生;若无cpe产生则将上一代的细胞冻融液再接种到下一代细胞瓶中,不弃接种液继续培养,如此进行,将细胞培养液盲传2代,观察是否有cpe产生;灭活彻底的病毒液传代过程中应无cpe产生。
24.具体地,步骤s3中所述灭活病毒液中的病毒含量为10
6.0
~10
7.0
tcid
50
/ml。
25.若灭活检验合格的灭活病毒液中的病毒含量高于所需浓度,可利用生理盐水对其进行稀释。
26.具体地,所用佐剂为白油时,灭活病毒液与吐温-80的体积比为96:4,白油与司本-80的体积质量比为96:4,水相与油相的体积比为1:2。
27.具体地,所用佐剂为氢氧化铝胶时,灭活病毒液与氢氧化铝胶的体积质量比为4:1。
28.具体地,所用佐剂为isa 201 vg时,灭活病毒液与isa 201 vg的质量比为1:1。
29.本发明还申请保护所述灭活疫苗在防治由斑石鲷虹彩病毒引发的斑石鲷虹彩病毒病或制备防治斑石鲷虹彩病毒病的产品中的应用。
30.本发明具有以下有益效果:
31.本发明提供了一种斑石鲷虹彩病毒灭活疫苗及其制备方法。本发明利用斑石鲷虹彩病毒sd株病毒液制备得到了安全性高、免疫保护效果好的斑石鲷虹彩病毒灭活疫苗,利用该灭活疫苗,可以有效降低斑石鲷虹彩病毒感染后的养殖斑石鲷的死亡率,可用于防治斑石鲷虹彩病毒病,填补了目前尚未有斑石鲷虹彩病毒灭活疫苗的空白,有助于斑石鲷虹彩病毒的防控。
附图说明
32.图1为斑石鲷虹彩病毒sd株接种于skb细胞后细胞的病变情况;其中左图为接种了病毒细胞,右图为正常细胞对照。
33.图2为斑石鲷虹彩病毒sd株的特异性鉴定结果,图中m为dl2000 dnamarker,1为斑石鲷虹彩病毒sd株,2为阴性对照。
具体实施方式
34.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
35.除非特别说明,以下实施例所用试剂和材料均为市购。
36.实施例1斑石鲷虹彩病毒sd株病毒液的制备
37.本发明所述斑石鲷虹彩病毒sd株由本发明发明人分离、鉴定得到("isolation,identification and genomic analysis of an isknv-type megalocytivirus from spotted knifejaw(oplegnathus punctatus)."aquaculture 532(2021):736032.),该毒株现保存于华南农业大学海洋学院水生动物医学实验室。
38.1、实验方法
39.(1)病毒繁殖
40.斑石鲷脑细胞(skb细胞)长成良好单层时,将其更换至含2%胎牛血清的leibovitz’s l-15培养液中,随后将斑石鲷虹彩病毒sd株按1:1000(v/v)的比例接种于斑石鲷脑细胞,当细胞病变率高于90%时,-20℃条件下反复冻融至少3次,收获病毒液并测定所得病毒液中的病毒含量,注明病毒液名称、收获日期、病毒代次等信息,4℃保存备用。
41.(2)病毒含量(tcid
50
)测定
42.将斑石鲷脑细胞悬液加至96孔微量培养板中,100μl/孔(细胞密度约为4
×
10
5.0
个/ml),置于26℃培养箱培养24小时,使细胞形成单层;取(1)中所得斑石鲷虹彩病毒sd株病毒液,用无血清leibovitz’s l-15培养基作10倍系列稀释,取10-3
~10-9
共7个稀释度的sd株病毒稀释液接种于单层细胞的96孔微量培养板中,100μl/孔,每个稀释度设6个孔,同时设6个正常细胞作对照孔,最后于每孔中补加含4%胎牛血清的leibovitz’s l-15培养液,100μl/孔,继续培养7日,观察细胞病变情况,按reed-muench法计算tcid
50
。
43.(3)特异性鉴定
44.使用斑石鲷虹彩病毒主衣壳蛋白(mcp)基因的特异性引物对斑石鲷虹彩病毒sd株病毒液进行特异性pcr鉴定,所述引物的核苷酸序列如下所示:
45.上游引物:atgtctgcaatctcaggtgcgaacg
46.下游引物:ttacaggatagggaagcctgcagcg
47.具体方法为:提取细胞培养液样品中的dna,dna的提取可使用市售商品化的dna抽提试剂盒,具体提取步骤参照使用的dna抽提试剂盒的说明书进行;pcr反应体系为:pcr反应预混液12.5μl,上、下游引物各1μl,dna模板1μl,加双蒸水至25μl。反应程序为:94℃预变性3分钟;94℃变性30秒,50℃退火30秒,72℃延伸90秒,共30个循环;72℃延伸7分钟;扩增产物经1%琼脂糖凝胶电泳后置紫外灯下观察;扩增产物回收并送测序。
48.2、实验结果
49.斑石鲷虹彩病毒sd株接种于斑石鲷脑细胞(skb细胞)后,细胞的病变情况如图1所示,其中左图为接种了病毒的细胞,右图为正常细胞对照。由图1所示结果可知,skb细胞在感染了斑石鲷虹彩病毒sd株后,细胞圆缩、脱落,产生了典型的细胞病变。另经测定,本实施例收获所得的斑石鲷虹彩病毒sd株f3病毒液中的病毒含量为10
7.0
tcid
50
/ml。
50.斑石鲷虹彩病毒sd株的特异性pcr鉴定结果如图2所示,图中m为dl2000dna marker,1为斑石鲷虹彩病毒sd株,2为阴性对照。由图2可知,本发明制备所得斑石鲷虹彩病毒sd株病毒液的主衣壳蛋白(mcp)基因的特异性pcr检测结果为阳性,扩增出了特异性条带;扩增片段的回收测序结果表明扩增所得序列为斑石鲷虹彩病毒mcp基因的cds区全长,长1362bp,经比对与genbank序列af371960.1一致;上述结果表明,本发明成功获得了斑石鲷虹彩病毒。
51.实施例2斑石鲷虹彩病毒sd株病毒液的灭活
52.本发明前期尝试了不同的病毒灭活方法,发现利用甲醛灭活的效果更好,在此基础上,对甲醛灭活浓度和灭活时间等进行进一步优化。
53.1、甲醛灭活
54.将实施例1制备所得斑石鲷虹彩病毒sd株病毒液分为相同的4份,取2份加入0.1%(v/v)的甲醛,另2份加入0.2%(v/v)的甲醛,摇匀,分别置于4℃和26℃条件下灭活;于灭活后的第24小时开始,每24小时取一次样做灭活检验;其中4℃灭活样品取样至168小时,26℃灭活样品取样至96小时。
55.2、灭活检验
56.取灭活病毒液作10倍稀释后,接种skb单层细胞(25cm2细胞瓶),接种3瓶,1ml/瓶,置26℃培养箱中吸附1小时后弃去,于每瓶中加入10ml leibovitz’sl-15培养液(含2%胎牛血清),另设1瓶未接种的细胞为空白对照,置26℃培养箱中培养5日,逐日观察是否有cpe产生;若无cpe产生,则将上一代的细胞冻融液再接种到下一代细胞瓶中,不弃接种液继续培养,如此进行,将细胞培养液盲传2代,观察是否有cpe产生;灭活彻底的病毒液传代过程中应无cpe产生。
57.灭活检验结果显示使用0.1%(v/v)的甲醛溶液在4℃灭活96小时以上,能完全灭活病毒液。
58.3、安全性检验
59.本发明将经甲醛灭活检验合格的病毒液与白油佐剂混合制备得到了灭活疫苗,通过一次超剂量接种免疫8~15g斑石鲷对灭活疫苗的安全性进行了试验。
60.(1)实验方法:取8~15g/尾的健康斑石鲷100尾,分为2组,每组50尾,1组为免疫
组,1组为对照组,停止喂饲24小时后进行注射;免疫组经腹腔注射制备所得的灭活疫苗,0.2ml/尾;对照组经腹腔注射生理盐水,0.2ml/尾;采用水温28~30℃循环水分箱饲养,连续观察14日,记录鱼的临床表现。
61.(2)实验结果
62.一次超剂量本发明所述灭活疫苗接种免疫8~15g斑石鲷,无不良反应,表明所述疫苗的安全性良好。
63.实施例3斑石鲷虹彩病毒灭活疫苗的制备
64.在实施例1所述斑石鲷虹彩病毒sd株病毒液和实施例2所述病毒液灭活方法的基础上,本发明利用不同的佐剂制备得到了不同的斑石鲷虹彩病毒灭活疫苗,所述疫苗的制备方法包括以下步骤:
65.s1.制备斑石鲷虹彩病毒sd株病毒液
66.此步骤同实施例1;在斑石鲷脑细胞长成良好单层时,将其更换至含2%胎牛血清的leibovitz’s l-15培养液,随后将斑石鲷虹彩病毒sd株按体积比为1:1000的比例接种于斑石鲷脑细胞,当细胞病变率高于90%时,-20℃条件下反复冻融3次,收获病毒液,4℃保存备用;
67.s2.甲醛灭活步骤s1所得病毒液并进行灭活检验
68.在制备所得斑石鲷虹彩病毒sd株病毒液中加入终浓度为0.1%(v/v)的甲醛溶液,摇匀后置于4℃条件下灭活96小时以上;
69.灭活检验:取灭活病毒液作10倍稀释后,接种skb单层细胞(25cm2细胞瓶),接种3瓶,1ml/瓶,置于26℃培养箱中吸附1小时后弃去,于每瓶中加入10ml leibovitz’s l-15维持液(含2%胎牛血清),另设1瓶未接种的细胞为空白对照,置于26℃培养箱中培养5日,逐日观察是否有细胞病变效应(cpe)产生。若无cpe产生则将上一代的细胞冻融液再接种到下一代细胞瓶中,不弃接种液继续培养,如此进行,将细胞培养液盲传2代,观察是否有cpe产生,灭活彻底的病毒液传代过程中应无cpe产生。
70.s3.将灭活检验合格的灭活病毒液与佐剂混合制备得到灭活疫苗
71.取灭活检验合格的斑石鲷虹彩病毒sd株病毒液,用无菌生理盐水调整灭活病毒液的浓度,与不同的佐剂混合制备得到灭活疫苗,使每毫升灭活疫苗中灭活前病毒的含量为0.32
×
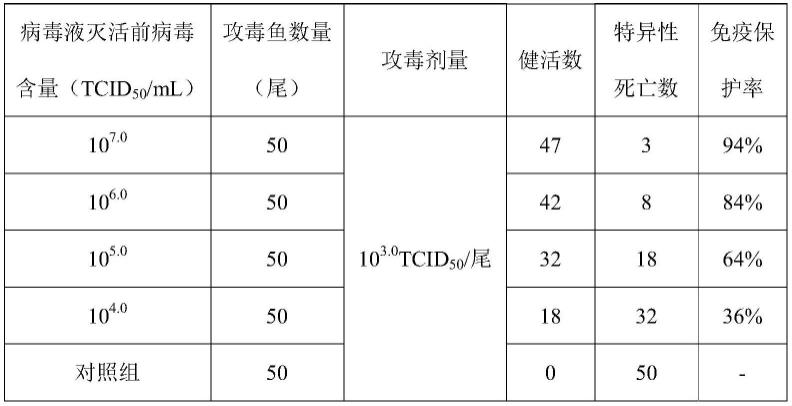
10
7.0
tcid
50
。
72.白油佐剂疫苗:
73.a.水相制备:将灭活病毒液与吐温-80按96:4(v/v)混匀制备成水相;
74.b.油相(白油佐剂)制备:将白油与司本-80按96:4(v/w)混合煮沸后制备成油相;
75.c.将1倍体积的水相缓慢倒入2倍体积的油相中,10000rpm乳化5分钟,制备得到油包水型灭活疫苗。
76.氢氧化铝胶疫苗:
77.将灭活病毒液与氢氧化铝胶按80:20(v/w)配比,1000rpm搅拌5min,制备成氢氧化铝胶疫苗。
78.montanide gel 02疫苗:
79.将灭活病毒液与gel 02按50:50(w/w)配比,1000rpm搅拌5min,制备成水溶性疫苗。
80.montanide ims 1313 vg疫苗:
81.将灭活病毒液与ims 1313 vg按50:50(w/w)配比,1000rpm搅拌5min,制备成微米乳剂型疫苗。
82.montanide isa 201 vg疫苗:
83.将灭活病毒液与isa 201 vg按50:50(w/w)配比,300rpm搅拌5min,制备成水包油包水型疫苗。
84.2、免疫保护效果检测
85.(1)实验方法:取8~15g/尾的健康斑石鲷小苗360尾,分为6组,每组60尾,5组为免疫组,1组为对照组,停止喂饲24小时后进行注射;免疫组分别经腹腔注射制备所得的不同佐剂的灭活疫苗,0.1ml/尾;对照组经腹腔注射生理盐水,0.1ml/尾;采用水温28~30℃循环水分箱饲养;
86.氢氧化铝胶疫苗免疫组在免疫21天后,取50尾进行攻毒,其余四组免疫组在免疫28天后攻毒;经腹腔注射0.1ml病毒含量为10
4.0
tcid
50
/ml的斑石鲷虹彩病毒sd株病毒液,即攻毒剂量为10
3.0
tcid
50
/尾,对照组采用相同处理;攻毒后连续观察14日,记录各组的死亡情况,以特异性死亡数计算死亡率,最后计算免疫保护率。
[0087][0088]
(2)实验结果
[0089]
免疫饲养过程中,除微米乳剂型疫苗组在免疫后第二天死亡2尾外,其余均无死亡,且均无不良反应,表明5组疫苗安全检验良好。免疫保护效果检测结果如表1所示,由表1所示结果可知,白油疫苗的保护率最高,为91.84%,氢氧化铝胶疫苗、isa 201水包油包水疫苗和gel 02水溶性疫苗也有不错的免疫保护效果,ims 1313微米乳剂疫苗则无免疫保护效果。
[0090]
表1
[0091]
组别免疫后攻毒数量死亡率免疫保护率白油疫苗50尾8%91.84%氢氧化铝胶疫苗50尾30%69.39%isa 201水包油包水疫苗50尾36%63.27%gel 02水溶性疫苗50尾52%46.94%ims 1313微米乳剂疫苗50尾94%4.08%对照组50尾98%-[0092]
实施例4斑石鲷虹彩病毒灭活疫苗抗原含量的优化
[0093]
1、实验方法
[0094]
将灭活检验合格的灭活病毒液用生理盐水稀释至含灭活前病毒含量为10
7.0
tcid
50
/ml、10
6.0
tcid
50
/ml、10
5.0
tcid
50
/ml和10
4.0
tcid
50
/ml,4组稀释的灭活病毒液按实施例3中疫苗制备方法制备成4组疫苗。
[0095]
取8~15g/尾健康斑石鲷300尾,分为5组,每组60尾,4组为免疫组,1组为对照组,停止喂饲24小时后进行注射;免疫组分别经腹腔注射上述4组疫苗,0.1ml/尾;对照组经腹腔注射生理盐水,0.1ml/尾;采用水温28~30℃循环水分箱饲养。
[0096]
免疫后28天,从免疫组和对照组中分别取50尾斑石鲷进行攻毒,经腹腔注射0.1ml病毒含量为10
4.0
tcid
50
/ml的斑石鲷虹彩病毒sd株病毒液。连续观察14日,记录各组的死亡情况,以特异性死亡数计算死亡率,免疫保护率公式如下:
[0097][0098]
2、实验结果
[0099]
结果如表2所示,为保证疫苗效力稳定以及获得较强保护,确定使用最低抗原含量为1
×
10
6.0
tcid
50
/ml配制成疫苗,此时每毫升灭活疫苗所含灭活前病毒量为0.32
×
10
6.0
tcid
50
。
[0100]
表2
[0101][0102]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1