一种山参活性冻干粉及其制备方法与应用与流程
1.本发明涉及野山参加工技术领域,尤其涉及一种山参活性冻干粉及其制备方法与应用。
背景技术:
2.人参(学名:panax ginseng,又称为亚洲参,在中国东北土名“棒槌”)是具有肉质的根,可药用。人参属于五加科,主要生长在东亚,特别是寒冷地区。人参是亚洲常见药材,北中美洲也普遍使用花旗参,许多草药铺和超市都能找到各式人参饮片及萃取物保健产品,用于愈后恢复、增强体力、调节荷尔蒙、降低血糖和控制血压、控制肝指数和肝功能保健等。人参根部所含皂苷是其有效成分,中国长白山野参皂苷成分较高,但取得不易,价格高昂。
3.人参之所以很稀奇,很名贵,主要与它的药用价值有关。在很早的医书《神农本草经》中就认为,人参有“补五脏、安精神、定魂魄、止惊悸、除邪气、明日开心益智”的功效,“久服轻身延年”。李时珍在《本草纲目》中也对人参极为推崇,认为它能"治男妇一切虚症"。几千年来,中草药中人参都被列为“上品”。加上人参形状特异,特别是野生的老山参,往往有人的形状,即所谓有头(根状茎,俗称芦头)、有体(主根)、有肩(根的上部)、有腿(例根)、有须(须根),由此更产生了种种神秘感,所谓“人参精”,“人参娃娃”,并编撰出了不少动人的故事。
4.人参对强身健体、益寿延年的效果确实不假。经现代医学研究及化验分析表明,人参内含有一种叫人参皂甙的化学物质,它对调节人的中枢神经系统、强心、抗疲劳、调节物质代谢等有明显功效,所以对治疗神经系统、心血管系统、内分泌系统及生殖系统的多种疾病有很好的治疗作用。
5.然而,人参是一种补气药,现有的人参或者人参冻干粉(如cn106942743a公开的生态人参口服冻干粉的制备方法),在其发挥治疗作用的同时,由于人参自身的药性,服用后往往会导致闭气,出现胸闷腹胀上火等症,进而限制其药效作用的发挥,影响其治疗效果。
技术实现要素:
6.本发明针对现有人参冻干粉食用后容易导致上火影响治疗效果的问题,提出一种山参活性冻干粉及其制备方法与应用。
7.为了实现上述目的,本发明提供如下技术方案:第一方面,本发明提供了一种山参活性冻干粉制备方法,包括以下步骤:鲜山参挑选切段,在-20℃下预冷冻2小时;然后将山参段真空冷冻干燥3小时,取出山参段检测水分含量,水分含量为35%~45%;再将山参段投入密封罐中,加入桑黄冷浸液或灵芝冷浸液中浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段二次真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉。
8.上述的山参活性冻干粉制备方法中,桑黄冷浸液的制备过程为:采用三年杨树生
的桑黄,挑选切片、清洗,采用冷浸乙醇在18~25℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为60%~70%。
9.上述的山参活性冻干粉制备方法中,灵芝冷浸液的制备过程为:灵芝挑选切片、清洗,采用冷浸乙醇在18~25℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为60%~70%。
10.第二方面,本发明还提供了一种山参活性冻干粉,采用上述的方法制备而成。
11.第三方面,本发明还提供了上述山参活性冻干粉在制备改善睡眠质量药物中的应用。
12.第四方面,本发明还提供了上述的山参活性冻干粉在制备增强免疫功能药物中的应用。
13.林下参,性味:性味甘、微苦,平。本发明中采用5年生鲜山参制备。
14.桑黄,性味:味微苦,性寒。根据最新itsrdna和nlsurdna测序分析结果和分类标准,全世界的桑黄类群有12个种,野生种主要存在温带、热带及亚热带地区,我国的桑黄零星分布在云南、西藏、湖北、安徽、河南、陕西、吉林等地。桑树、杨树、暴马丁香、松树、白桦树等半枯树干上易寄生桑黄。本发明中采用三年杨树生的桑黄。桑黄的主要药用化学成分有多糖类、黄酮类、三萜类、香豆素、麦角甾醇类、芳香酸和多种氨基酸类。本发明以桑黄性寒平衡林下参食后上火症状以提高其在增强免疫功能方面的治疗效果。
15.灵芝,性味:性温,味淡。灵芝的主要药用化学成分有:多糖,氨基酸多肽,核苷类,三萜类化合物等。本发明以灵芝性温平衡林下参食后上火症状以提高其在改善睡眠功能方面的治疗效果。
16.中药的浸出过程:(1)浸润与渗透浸提溶剂能否润湿药材,并渗透进入药材内部,是浸也其有效成分的必要条件。药材能否被润湿取决于所用溶剂与药材的性质。通常中药浸提采用的水和不同浓度乙醇等极性溶剂能润湿多数药材。加入表面活性剂、多脂成分的脱脂处理等,可加快润湿过程,有利于浸出。
17.(2)解吸与溶解药材干燥后,可溶性成分固结吸附于组织细胞内,浸出溶剂渗透进入药材需克服化学成分之间或化学成分与组织细胞之间的吸附力,才能将其溶解形成溶液。化学成分能否被溶剂溶解,取决于化学成分的结构和溶剂的性质,根据"相似相溶"规律,水能溶解极性大的生物碱盐、黄酮苷、皂苷等,也能溶出高分子胶体。由于增溶和助溶作用,还可溶出某些极性小的物质。高浓度乙醇能溶出少量极性小的苷元、香豆素和萜类等,也能溶出蜡、油脂等脂性杂质。溶剂中加入适量的酸、碱、表面活性剂,可增加有效成分的解吸与溶解。
18.(3)扩散进入药材组织细胞内的溶剂溶解大量化学成分后,药材内外出现浓度差。细胞外侧纯溶剂或稀溶液向药材内渗透,药材内高浓度溶液中的溶质不断地向周围低浓度方向扩散,直至内外浓度相等。浓度差是扩散的推动力。更新溶剂、加强搅拌或采用其他动态法浸提,均有利于浸出。
19.乙醇是极性有机溶剂,能与水以任意比例混溶。既可溶解极性成分,也能溶解亲脂性成分。适当浓度的乙醇可减少水溶性杂质的浸出。90%乙醇适于浸提挥发油、树脂、叶绿素等;70%~90%乙醇适于浸提香豆素、内酯、某些苷元等;50%~70%乙醇适于浸提生物碱、苷类等;50%以下的乙醇也可浸提一些极性较大的黄酮类、生物碱及其盐等;乙醇含量达40%时,
能延缓酯类、苷类等成分的水解,增加制剂的稳定性;20%以上乙醇具有防腐作用。本发明经过大量实验最终选择乙醇浓度为60%~70%。
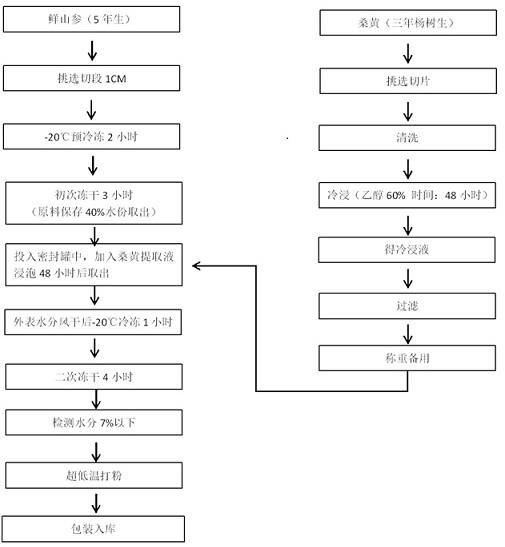
20.其中,提高浸提温度可加速成分的解吸、溶解和扩散,有利于浸出。但温度过高,热敏性成分易降解、高分子杂质浸出增加。本发明经过大量实验最终选择最佳浸提温度为18~25℃,更能保持桑黄和灵芝有效成分的生物活性。冷浸过程的完成需要一定的时间。当有效成分扩散达到平衡时,该浸提过程即已完成。长时间浸提,高分子杂质浸出增加,并易导致已浸出有效成分的降解。因此,有效成分扩散达到平衡时应停止浸提,分出浸提液。本发明经过大量实验最终选择最佳浸提时间为48小时。
21.预冻过程一方面要保护细胞内有效成分的主要性能不变,另一方面要获得冻结后细胞有合理的结构,以利于水分的升华。预冻效果主要由3个方面决定:预冻速率、预冻最低温度、预冻时间。预冻速率是影响细胞活性成分的重要因素,由于细胞对水分的渗透率不同,导致不同细胞预冻速率不同。快速冻结,胞内的水分来不及通过细胞膜渗出,胞内溶液过冷而结冰,细胞的体积膨大,最后导致细胞破裂;慢速冻结,胞外溶液中水分大量结冰,溶液的浓度提高,胞内的水分便大量向外渗透,导致细胞的剧烈收缩,造成细胞损伤。就本发明中人参而言,实验证明,快速冻结导致升华速率低,解吸速率快,慢速冻结反之,最终选择预冻速率介于快冻与慢冻之间,采用-20℃冷冻2小时。然后将山参段真空冷冻干燥3小时,目的是获得水分含量为35%~45%的山参段。如低于35%,影响后续二次冷冻后冻干样品结构的机械性能的稳定性,而高于45%则冻干不易成功,且后期复水也比较困难。
22.与现有技术相比,本发明的有益效果为:本发明提供的山参活性冻干粉制备方法,采用二次冻干工艺,并以桑黄冷浸液或灵芝冷浸液平衡林下参食后上火症状,制备得到的山参活性冻干粉,能够显著提高人参在增强免疫功能和改善睡眠功能方面的治疗效果。并通过研究证明,等剂量下,采用桑黄冷浸液平衡后的山参二次冻干粉对小鼠非特异性及特异性免疫功能的增强作用明显优于山参一次冻干粉,采用灵芝冷浸液平衡后的山参二次冻干粉改善小鼠睡眠的作用显著优于山参一次冻干粉。
附图说明
23.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图。
24.图1为本发明实施例1提供的山参活性冻干粉(桑黄冷浸液)制备方法工艺流图。
25.图2为本发明实施例5提供的山参活性冻干粉(灵芝冷浸液)制备方法工艺流图。
具体实施方式
26.为了更好地理解本技术方案,下面结合附图对本发明的方法做详细的说明。
27.实施例1山参活性冻干粉的制备采用三年杨树生的桑黄,挑选切片、清洗,采用冷浸乙醇在20℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为60%。
28.鲜山参(五年生)挑选切段0.8~1.2cm,在-20℃下预冷冻2小时;然后将山参段真空
冷冻干燥3小时,取出山参段检测水分含量,水分含量为40%;再将山参段投入密封罐中,加入桑黄冷浸液浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段二次真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉。
29.实施例2山参活性冻干粉的制备采用三年杨树生的桑黄,挑选切片、清洗,采用冷浸乙醇在25℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为65%。
30.鲜山参(五年生)挑选切段0.8~1.2cm,在-20℃下预冷冻2小时;然后将山参段真空冷冻干燥3小时,取出山参段检测水分含量,水分含量为35%;再将山参段投入密封罐中,加入桑黄冷浸液浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段二次真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉。
31.实施例3山参活性冻干粉的制备采用三年杨树生的桑黄,挑选切片、清洗,采用冷浸乙醇在18℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为70%。
32.鲜山参(五年生)挑选切段0.8~1.2cm,在-20℃下预冷冻2小时;然后将山参段真空冷冻干燥3小时,取出山参段检测水分含量,水分含量为45%;再将山参段投入密封罐中,加入桑黄冷浸液浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段二次真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉.实施例4山参活性冻干粉的制备灵芝挑选切片、清洗,采用冷浸乙醇在20℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为60%。
33.鲜山参(五年生)挑选切段0.8~1.2cm,在-20℃下预冷冻2小时;然后将山参段真空冷冻干燥3小时,取出山参段检测水分含量,水分含量为35%;再将山参段投入密封罐中,加入灵芝冷浸液浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段二次真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉。
34.实施例5山参活性冻干粉的制备灵芝挑选切片、清洗,采用冷浸乙醇在25℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为65%。
35.鲜山参(五年生)挑选切段0.8~1.2cm,在-20℃下预冷冻2小时;然后将山参段真空冷冻干燥3小时,取出山参段检测水分含量,水分含量为40%;再将山参段投入密封罐中,加入灵芝冷浸液浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段二次真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉。
36.实施例6山参活性冻干粉的制备灵芝挑选切片、清洗,采用冷浸乙醇在18℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为70%。
37.鲜山参(五年生)挑选切段0.8~1.2cm,在-20℃下预冷冻2小时;然后将山参段真空冷冻干燥3小时,取出山参段检测水分含量,水分含量为45%;再将山参段投入密封罐中,加入灵芝冷浸液浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段二次真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉。
38.对比例1山参一次冻干粉的制备
采用三年杨树生的桑黄,挑选切片、清洗,采用冷浸乙醇在20℃下浸泡48小时得冷浸液,过滤称重备用,乙醇浓度为60%。
39.鲜山参(五年生)挑选切段0.8~1.2cm,将山参段投入密封罐中,加入桑黄冷浸液浸泡48小时后取出;待山参段外表水分风干后,在-20℃下冷冻1小时;最将山参段真空冻干4小时,水分含量在7%以下,冷冻打粉,得到山参活性冻干粉。
40.试验例1山参一次冻干粉和山参二次冻干粉增强小鼠免疫功能的比较1材料与方法1.1动物清洁级icr雄性小白鼠,体重18.0~20.0g,吉林大学白求恩医学院动物实验中心提供,生产许可证号:scxk-(吉)2007-0003。实验在温度为24℃、湿度为60%的安静环境下进行。
41.1.2药材对比例1制备的山参一次冻干粉及实施例1的制备山参二次冻干粉,粉碎成400目的超微粉。
42.1.3方法1.3.1对小鼠网状内皮系统吞噬功能的影响70只小鼠随机分为对照组,山参一次冻干粉0.25、0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组,每组10只。对照组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,山参一次冻干粉及山参二次冻干粉各剂量组分别灌胃给予相应剂量的超微粉,每日1次,连续灌胃30天。末次药后1小时,每只小鼠尾静脉注射印度墨汁(以生理盐水稀释10倍)10ml/kg,分别于注射后1min及5min从小鼠内眦静脉采血20μl,溶于0.1%碳酸氢钠溶液中,以722分光光度计680nm处测量od值。于第二次采血后脱臼处死小鼠,取胸腺、脾脏和肝脏准确称重,以胸腺、肝脏和脾脏重量(mg)/体重(10g)计算胸腺、肝脏和脾脏系数,按下列公式计算吞噬指数(k)和吞噬活性(a)。
43.k=(lgod1-lgod2)/(t2-t1)a=体重/(肝重+脾重)
×
1.3.2对鸡红细胞诱导小鼠血清溶血素生成的影响70只小鼠随机分为对照组,山参一次冻干粉0.25、0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组,每组10只。对照组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,山参一次冻干粉及山参二次冻干粉各剂量组分别灌胃给予相应剂量的超微粉,每日1次,连续灌胃30天。给药第26天,每只小鼠腹腔注射5%(v/v)生理盐水鸡红细胞悬液0.2ml进行免疫。末次药后1小时,眼球取血,离心,取血清。用生理盐水稀释100倍,取稀释后血清0.5ml与5%(v/v)鸡红细胞悬液0.25ml,10%(v/v)补体0.25ml混匀,37
°
c恒温箱孵育30min,置2~4
°
c冰箱30min终止反应,1500r/min离心5min,取上清液200μl加入96孔版,每只小鼠设3副孔,在酶标仪540nm下读数,以od值作为血清血溶素指标。另设不加血清空白孔作对照孔。
44.1.3.3对小鼠t细胞转化功能的影响70只小鼠随机分为对照组,山参一次冻干粉0.25、0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组,每组10只。对照组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,山参一次冻干粉及山参二次冻干粉各剂量组分别灌胃给予相应剂量的超微粉,每日1次,连续灌胃30天。末次药后1小时,无菌取脾,用含10%小牛血清的1640培养液制成细胞浓度为1
×
107/ml脾细胞悬液。在96孔培养板中每孔加入100μl细胞悬液。每只小鼠设3副孔,加100μl1640培养液。另设cona刺激3副孔,每孔加入100μl脾细胞悬液及100μlcona。置于37
°
,5%co2培养箱孵育44h后每孔加入mtt10μl,继续置于37℃,5%co2培养箱中孵育4h。弃上清,每孔加入dmso100μl,微型震荡器震荡至结晶完全溶解。酶标仪570nm测量,按下列公式计算刺激指数(si)。
45.si=刺激孔od值/对照孔od值1.3.4对小鼠nk细胞活性的影响70只小鼠随机分为对照组,山参一次冻干粉0.25、0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组,每组10只。对照组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,山参一次冻干粉及山参二次冻干粉各剂量组分别灌胃给予相应剂量的超微粉,每日1次,连续灌胃30天。末次药后1小时,无菌取脾,用含10%小牛血清的1640培养液制成细胞浓度为1
×
106/ml脾细胞悬液。靶细胞取培养24~48h的k562细胞,调整细胞浓度为1
×
105/ml。u型96孔板加入脾细胞悬液100μl,每只小鼠设3副孔,加入靶细胞悬液100μl。另设效应细胞对照孔3副孔,加入脾细胞悬液100μl及1640完全培养液100μl。设靶细胞对照孔3副孔,加100μl靶细胞悬液及1640完全培养液。每孔加入mtt10μl(5mg/ml),置于37
°
5%co2孵育箱中共同孵育4h,离心,弃上清。每孔加入dmso100μl,微型振荡器震荡至结晶完全溶解,酶标仪570nm下读数。按下列方法计算nk细胞活性,以杀伤率(%)表示。
46.杀伤率(%)=[1-(实验组od值-效应细胞od值)/靶细胞od值]
×
100%1.4统计方法实验数据以
±
s表示,采用spss10.0统计软件中单因素方差分析进行均值比较,组间比较用t检验。
[0047]
2结果2.1对小鼠脏器系数及网状内皮系统吞噬能力的影响与对照组比较,山参一次冻干粉0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组均能明显提高小鼠胸腺和脾脏系数,增强吞噬指数k和吞噬活性α(p《0.05~p《0.001),见表1、2。
[0048]
表1山参冻干粉对小鼠脏器系数的影响(
±
s,n=10)与对照组比较*p《0.05,**p《0.01,***p《0.001
表2山参冻干粉对小鼠碳廓清能力的影响(
±
s,n=10)与对照组比较*p《0.05,**p《0.01,***p《0.0012.2对小鼠血清溶血素、淋巴细胞转化及nk细胞活性的影响与对照组比较,山参一次冻干粉0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组均能明显提高小鼠血清溶血素生成od值,t淋巴细胞刺激指数及nk细胞杀伤率(p《0.05或p《0.01),见表3。
[0049]
表3山参冻干粉对小鼠溶血素、淋巴细胞转化及nk细胞活性的影响(
±
s,n=10)与对照组比较*p《0.05,**p《0.013结论实验结果表明,山参一次冻干粉及山参二次冻干粉均能明显提高小鼠胸腺和脾脏系数,增强碳粒廓清吞噬指数和吞噬活性,具有诱导t淋巴细胞增值作用,可促进nk细胞对k562细胞的杀伤能力,提高鸡红细胞作为抗原诱导的小鼠抗体生成能力,提示其对机体网状内皮系统吞噬功能及体液免疫和细胞免疫具有增强作用。等剂量下,山参二次冻干粉对小鼠非特异性及特异性免疫功能的增强作用明显优于山参一次冻干粉。
[0050]
试验例2山参一次冻干粉和山参二次冻干粉改善小鼠睡眠功能的比较1材料与方法
1.1实验动物清洁级icr雄性小白鼠,体重19.0~21.0g,吉林大学白求恩医学院动物实验中心提供,生产许可证号:scxk-(吉)2007-0003。实验在温度为24℃、湿度为60%的安静环境下进行。
[0051]
1.2实验药材对比例1制备的山参一次冻干粉及实施例5制备的山参二次冻干粉,均由吉林省红五味生物技术有限公司提供,粉碎成400目的超微粉,批号:20220105。
[0052]
1.4实验方法1.4.1一次冻干和二次冻干山参粉对小鼠自主活动的影响70只小鼠随机分为对照组,山参一次冻干粉0.25、0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组,每组10只。对照组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,山参一次冻干粉及山参二次冻干粉各剂量组分别灌胃给予相应剂量的超微粉,每日1次,连续灌胃30天。末次给药后1h,把动物放入小鼠自主活动测定仪的暗箱中适应5min,记录5min内各组活动和站立次数,给药组和空白组交替进行,以避免同一台仪器不同检测孔灵敏度不同所造成的系统误差。按下式计算自主活动抑制率,比较组间差异。实验均在上午8:00-10:00,温度24℃,湿度60%,通风安静环境中进行。
[0053]
自主活动抑制率(%)=(空白组活动总数-给药组活动总数)/空白组活动总数
×
100%1.4.2一次冻干和二次冻干山参粉对小鼠阈剂量戊巴比妥钠睡眠时间和睡眠潜伏期的影响70只小鼠随机分为对照组,山参一次冻干粉0.25、0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组,每组10只。对照组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,山参一次冻干粉及山参二次冻干粉各剂量组分别灌胃给予相应剂量的超微粉,每日1次,连续灌胃30天。末次给药后1h,每只小鼠腹腔注射0.25%戊巴比妥钠溶液0.1ml/10g体重,以翻正反射消失1min以上为入睡指标,记录小鼠睡眠潜伏期和睡眠持续时间,睡眠时间大于120min者以120min计算。实验均在上午8:00-12:00,温度24℃,湿度60%,通风安静环境中进行。
[0054]
1.4.3一次冻干和二次冻干山参粉对小鼠阈下剂量戊巴比妥钠睡眠发生率的影响98只小鼠随机分为对照组,山参一次冻干粉0.25、0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组,每组14只。对照组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,山参一次冻干粉及山参二次冻干粉各剂量组分别灌胃给予相应剂量的超微粉,每日1次,连续灌胃30天。末次给药后1h,每只小鼠腹腔注射0.125%戊巴比妥钠溶液0.1mg/10g体重,以翻正反射消失1min为入睡指标,记录30min内小鼠的睡眠发生率和睡眠时间,小鼠睡眠时间超过30min者以30min计算。实验均在上午8:00-12:00,温度24℃,湿度60%,通风安静环境中进行。
[0055]
1.5统计方法实验数据以
±
s表示。数据的统计处理采用spss10.0统计软件中单因素方差分析进行均值比较。入睡动物发生率应用卡方检验,其它指标均采用student’st检验,p﹤0.05认为有统计学差异。
[0056]
2实验结果2.1对小鼠自主活动的影响
与对照组比较,山参一次冻干粉1.0g/kg组及山参二次冻干粉0.5、1.0g/kg组均可明显减少小鼠自主活动次数(p《0.05或p《0.01),见表4。
[0057]
表4山参冻干粉对小鼠自主活动的影响(
±
s,n=10)与对照组比较 *p《0.05,** p《0.012.2对小鼠戊巴比妥钠阈剂量睡眠潜伏期和睡眠时间的影响与对照组比较,山参一次冻干粉0.5、1.0g/kg组及山参二次冻干粉0.25、0.5、1.0g/kg组均可明显延长小鼠睡眠时间,缩短小鼠睡眠潜伏期(p《0.05或p《0.01),见表5。
[0058]
表5 山参冻干粉对小鼠戊巴比妥钠阈剂量睡眠潜伏期和睡眠时间的影响(
±
s,n=10)与对照组比较 *p《0.05,** p《0.012.3对小鼠阈下剂量戊巴比妥钠睡眠发生率的影响与对照组比较,山参一次冻干粉1.0g/kg组及山参二次冻干粉0.5、1.0g/kg组均可明显提高小鼠睡眠发生率(p《0.05或p《0.01),见表6。
[0059]
表6山参冻干粉对小鼠阈下剂量戊巴比妥钠睡眠发生率的影响(
±
s,n=14)
与对照组比较 *p《0.05,** p《0.013结论实验结果表明,山参一次冻干粉及山参二次冻干粉均能明显减少小鼠自主活动次数,可明显延长小鼠睡眠时间,缩短小鼠睡眠潜伏期,能明显提高小鼠睡眠发生率,提示其具有改善机体睡眠功能。等剂量下,山参二次冻干粉改善小鼠睡眠的作用显著优于山参一次冻干粉。
[0060]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,但这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1