兰索拉唑冻干粉针剂的生产方法与流程
本发明涉及一种兰索拉唑冻干粉针剂的生产方法,属药物制剂领域。
背景技术:
1、兰索拉唑属于质子泵抑制剂,化学名称:2-[[[3-甲基-4-(2,2,2-三氟乙氧基)-2-吡啶基]甲基]亚磺酰基-1h-苯并咪唑,分子量为369.4,化学结构式为:
2、
3、兰索拉唑分布于胃粘膜壁细胞的酸性环境后,转变为有活性的代谢物。这种代谢物与存在于酸生成部位的h+,k+-atp酶的巯基结合,通过抑制h+,k+-atp酶的活性而抑制酸分泌。该药抑制胃酸分泌作用呈剂量依赖性,药后24小时内对基础和刺激引起的胃酸分泌均有抑制作用。健康成人1次30mg,一日2次静脉给药,可见持续的胃酸分泌抑制作用。有报道在酸性条件下,血液凝固与血小板聚集受到很大损害。血液凝固所形成的纤维蛋白,在酸性条件下可被胃蛋白酶溶解。本药通过升高胃内ph值而改善血液凝固与血小板聚集功能,抑制胃蛋白酶的活性而发挥抑制出血的作用。另外,在酸性条件下,胃的损伤粘膜的修复受到抑制,本药通过抑制酸分泌而使胃内ph值上升,促进损伤粘膜的修复。
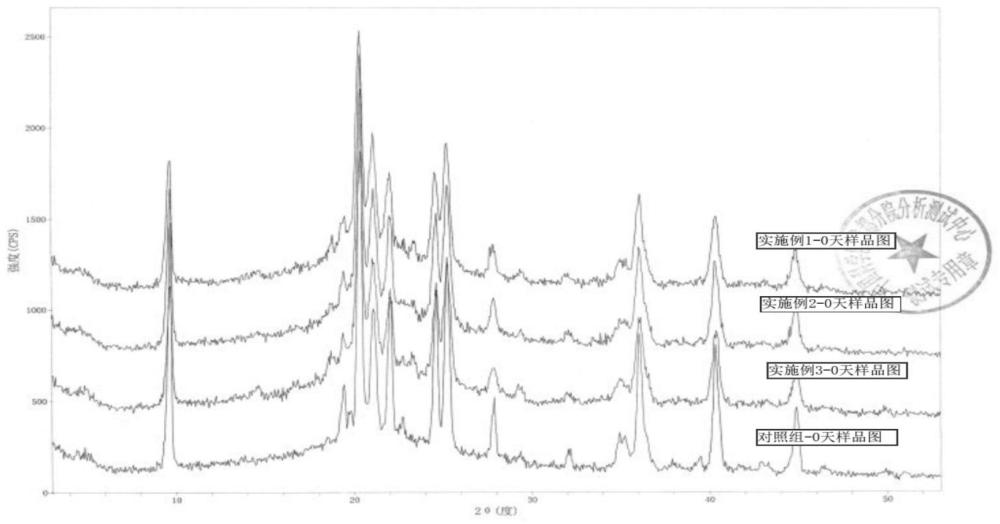
4、兰索拉唑原料为白色至类白色结晶性粉末,易溶于甲醇和二甲基甲酰胺,微溶于乙酸乙酯、二氯甲烷和乙腈,难溶于水。兰索拉唑化学性质不稳定,对ph非常敏感,在酸性和中性条件下溶解度降低,同时快速降解,生成大量的降解杂质和不溶性微粒。兰索拉唑在ph5.0的溶液中半衰期约0.5h,ph6.0的溶液中半衰期约为3h。随着ph发生变化,兰索拉唑溶解度变化较大,同时析出大量的不溶性微粒或微晶,进入人体后可能引起血管栓塞、过敏反应或热源样反应等不良反应,为避免注射用兰索拉唑在存储、使用过程中的晶型转变导致以上风险,原研产品(武田薬品工業株式会社的参比制剂(静注用30mg)被设计为具有稳定晶型特征的冻干粉针剂,同时成品的ph被严格限制在10.6~11.3的范围内。
5、中国专利cn1660091a公开了一种兰索拉唑注射剂组合物及其制备方法,但是该方法制备的产品为无定型,冻干制剂存储一定时间后复溶仍然具有不溶性微粒问题。专利cn101057846a公开了一种兰索拉唑注射剂组合物及其制备方法,虽然提升了兰索拉唑在溶液状态的化学稳定性,但是室温存储超过4小时仍然存在晶体现象,同时制剂成品的ph值超过原研产品的要求。专利cn102961344a公开了一种兰索拉唑注射剂组合物及其制备方法,对窄ph成品制剂的复溶及不溶性微粒无显著改善。
6、目前已上市的注射用兰索拉唑冻干粉针剂大部分为无定型冻干产品,存储过程中存在晶型转换,进而出现不溶性微粒增多的情况,带来潜在用药安全性问题。制剂的ph值上限被放宽至12以上(中国药典中兰索拉唑冻干产品ph为10.5~12.5)。为制备出与原研产品晶型和质量一致的产品,满足注射剂一致性评价对现有上市兰索拉唑冻干制剂质量升级的要求。本发明在大量实验研究的基础上,突破注射剂常规制备工艺思路,创造性的设计配液和冻干工艺,解决了兰索拉唑冻干粉针剂的晶型和复溶的不溶性微粒问题,保障了上市产品的安全性。
技术实现思路
1、本发明解决的第一个技术问题是提供一种具有特定晶型的兰索拉唑冻干粉针剂的生产方法。
2、本发明提供一种兰索拉唑冻干粉针剂的生产方法,包括以下步骤:
3、a、配液:充氮环境下,取兰索拉唑冻干粉针剂的组分,与注射用水混合配制为药液;所述兰索拉唑冻干粉针剂的组分包括兰索拉唑、助溶剂、赋形剂和ph调节剂;
4、b、过滤:将药液过滤得到滤液;
5、c、灌装及冻干:将滤液灌装到注射剂瓶中,半压塞,然后送入冻干机冻干,最后密封,即得兰索拉唑冻干粉针剂;
6、其中,开始灌装前,先将冻干机导热油温度降低至0~5℃;所述冻干依次包括预冻阶段、一次干燥阶段和二次干燥阶段;
7、所述预冻阶段工艺为:将导热油温度降至-40~-45℃,保温2~4h;再升温至0~5℃,保温1~4h;再降至-40~-45℃,保温3~5h,得到预冻品;
8、所述一次干燥阶段工艺为:将导热油升温至-20~-15℃,保温3~5h;再升温至-5~-10℃,保温2~5h;再升温至0~5℃,保温1~4h,得到一次干燥品;
9、所述二次干燥阶段工艺为:将导热油升温至10~20℃,保温1~3h;再升温至20~25℃,保温2~4h;当压力升测试实验△p≤30pa/min,到达干燥终点,结束冻干;
10、所述在一次干燥阶段和二次干燥阶段,保持冻干箱真空度在100pa以下。
11、本发明采用特定的冻干工艺,使制得的兰索拉唑冻干粉具有稳定的特定晶型,避免了兰索拉唑冻干产品在存储过程中的晶型转变导致不溶性微粒显著增加的问题,进而增加安全性风险,提高了药物的稳定性和安全性。
12、本发明创造性的提出了一种新的预冻工艺,包括一次预冻、退火和二次预冻。一般的退火操作是以一定的升温速率把冻结制品从冷却终温加热到低于其熔点的某一特定温度,并保持一段时间,目的是改变冰晶形态和大小分布。而本发明的退火操作与现有技术并不相同,其取得的技术效果亦不相同,本发明采用升高温度至0~5℃作为退火温度,有利于兰索拉唑在冻干过程中形成稳定的特定晶型。
13、在一种实施方式中,所述预冻阶段工艺中:将导热油温度降至-40~-45℃,所用降温时间为2~4h;升温至0~5℃,所用升温时间为2~4h;再降至-40~-45℃,所用降温时间为2~3h;
14、所述一次干燥阶段工艺中:将导热油升温至-20~-15℃,升温时间为1.5~3h;再升温至-5~-10℃,升温时间为0.5~3h;再升温至0~5℃,升温时间为0.5~3h;
15、所述二次干燥阶段工艺中:所述导热油升温至10~20℃,其升温时间为0.5~1h;所述升温至20~25℃,升温时间为0.3~2h。
16、在一种实施方式中:所述一次干燥阶段和二次干燥阶段中,保持冻干机的真空度在50pa以下。
17、在一种实施方式中:步骤a中,在进行配液时,配液体系的温度<10℃。所述配液体系的温度<10℃指的是:配液时,使用的注射用水的温度<10℃,且在混合搅拌过程中,药液的温度<10℃。
18、在一种实施方式中:步骤b中,所述过滤方法为:洁净氮气将药液压滤通过孔径为0.45μm过滤器进行过滤,得到中间体药液;中间体药液再通过孔径为0.22μm的除菌过滤器过滤得到滤液;优选的,中间体药液通过两个串联的孔径为0.22μm的除菌过滤器过滤得到滤液;更优选的,药液过滤过程中,保持药液温度<10℃。
19、在一种实施方式中:所述兰索拉唑冻干粉针剂由以下组分组成:兰索拉唑、助溶剂、赋形剂和ph调节剂;优选兰索拉唑、助溶剂、赋形剂和ph调节剂的重量比为30:10:60:3~4;进一步优选兰索拉唑、助溶剂、赋形剂和ph调节剂的重量比为30:10:60:3.45;更进一步优选:所述助溶剂为葡甲胺,赋形剂为甘露醇,ph调节剂为氢氧化钠。
20、在一种实施方式中,所述兰索拉唑冻干粉针剂的配液方法为:
21、(1)取注射用水,加入处方量20%~50%的助溶剂和处方量的ph调节剂,混匀,加入处方量的赋形剂,混匀,再加入处方量的兰索拉唑,混合至全部溶解,得溶液1;
22、取注射用水,加入剩余的助溶剂,混匀,得溶液2;
23、(2)将溶液1和溶液2混匀,并调节ph值至11.1~11.8;最后补加注射用水至全量,即得兰索拉唑冻干粉针剂冻干前的药液。
24、本发明在配液工艺中,采用特定的助溶剂加入方式:助溶剂分两步加入,且限定配制溶液1时,助溶剂的用量为处方量的20%~50%。实验结果发现,采用本发明的配液方式,相比于助溶剂的一次性加入方式,其制得的冻干粉针剂,不溶性微粒数显著降低且存储过程中比较稳定。
25、在一种实施方式中,所述步骤(2)中,调节ph采用0.5mol/l氢氧化钠溶液。
26、在一种实施方式中,所述步骤(1)中,溶液1中助溶剂加入量为处方量的20~30%;优选的,所述溶液1中助溶剂加入量为处方量的20%。
27、在一种实施方式中,步骤(1)中,溶液1所用的注射用水量为处方量的30%~60%,优选为处方量的30~40%;溶液2所用的注射用水量为处方量的20%~50%,优选为处方量的40%~50%;其中,注射用水处方量按照药液中兰索拉唑浓度为0.01~0.015g/ml确定。
28、在一种具体的实施方式中,兰索拉唑冻干粉针剂的生产可以采用如下操作进行:
29、a.配液
30、(1)取处方量30%~60%的注射用水,煮沸后存留于配料罐中,打开氮气阀门充氮至溶氧量低于2ppm后,待温度降低至10℃以下时,加入处方量20%~50%的葡甲胺和处方量的氢氧化钠,充分搅拌溶解30min,加入处方量甘露醇,充分搅拌溶解30min,再缓慢加入处方量的兰索拉唑原料,搅拌至全部溶解,得溶液1;
31、取处方量20%~50%的注射用水,煮沸后存留于配料罐中,打开氮气阀门充氮至溶氧量低于2ppm后,待温度降低至10℃以下时,加入剩余的葡甲胺搅拌30min溶解,得溶液2;
32、(2)将溶液1和溶液2混合,搅拌均匀,搅拌过程充氮保护,并加入0.5mol/l的氢氧化钠溶液调节ph值至11.1~11.8,补加剩余注射用水至全量,备用。
33、b.过滤
34、(1)切换至预过滤单元,洁净氮气将药液压滤通过0.45μm聚醚砜(pes)过滤器进行预过滤,得到中间体药液。在取样口取样,检测中间体药液的性状、ph值、含量。
35、(2)中间体药液在氮气保护下储存于缓冲罐中,药液温度应<10℃。
36、(3)将药液从缓冲罐压送至平衡罐,药液在输送过程中经过两级0.22μm的聚醚砜除菌过滤器过滤,得到滤液。
37、c.灌装及冻干
38、滤液灌装至中性硼硅玻璃管制注射剂瓶中,半压塞,进入冻干机冻干,密封即得本发明兰索拉唑冻干粉针剂。
39、其中,具体冻干操作为:
40、(1)开始灌装前,先将冻干机导热油温度降低至0~5℃,再进行灌装进箱;
41、(2)冻干:
42、预冻阶段:先将导热油降温至-40~-45℃,降温时间为2~4h,保温2~4h;保温结束后,升温至0~5℃,升温时间为2~4h,保温1~4h;保温结束后,降温至-40℃~-45℃,降温时间为2~3h,保温3~5h;
43、随后控制真空度至100pa以下,开始升华;
44、一次干燥阶段:先将导热油升温至-20℃~-15℃,升温时间为1.5~3h,保温3~5h;保温结束后,升温至-5℃~-10℃,升温时间为0.5~3h,保温2~5h;保温结束后,升温至0~5℃,升温时间为0.5~3h,保温1~4h;干燥过程控制真空度至100pa以下;
45、二次干燥阶段,先升温至10℃~20℃,升温时间为0.5~1h,保温1~3h,再升温至20~25℃,升温时间为0.3~2h,保温2~4h,当压力升测试实验△p≤30pa/min,到达干燥终点,结束整个干燥过程,真空压塞。
46、本发明兰索拉唑冻干粉针剂的包装材料优选为中性硼硅玻璃管制注射剂瓶和覆聚四氟乙烯/乙烯的共聚物膜氯化丁基橡胶塞。
47、本发明的有益效果:本发明兰索拉唑冻干粉针剂在特定的冻干程序,尤其结合特定的配液工艺制备而成,生产的兰索拉唑冻干粉针剂具有与原研产品相同的晶型和稳定性。本发明粉针剂未使用时,兰索拉唑以稳定的特定晶型的固体形式存放于专用容器中,避免了兰索拉唑冻干产品在存储过程中的晶型转变导致质量与原研产品不一致,进而增加安全性风险,提高了药物的稳定性和安全性。本发明兰索拉唑冻干粉针剂的稳定性、临床安全性好,制备工艺简单、成本适宜,适用于工业化大生产。
- 还没有人留言评论。精彩留言会获得点赞!