一种多肽在制备治疗缺血性脑卒中的药物中的应用
1.本发明属于医药技术领域,具体涉及一种多肽在制备治疗缺血性脑卒中的药物中的应用。
背景技术:
2.缺血性脑卒中是一种脑血管病,其发病率呈逐年上升趋势,常表现为肢体瘫痪、认知障碍等症状。目前常用药物阿替普酶(rtpa)溶栓治疗,但此方法治疗窗窄,并且存在许多溶栓禁忌症,故对开发治疗缺血性脑卒中的药物提出挑战。
3.大鼠大脑中动脉闭塞/再灌注(mcao/r)模型被普遍认为是局灶性脑缺血的标准动物模型,其基本原理是用线栓闭塞大脑中动脉起始部,造成大脑中动脉供血区缺血,从而使大鼠发生局灶性脑缺血,该方法稳定性好、重复性好、损伤小、梗死部位确切且成功率高;糖氧剥夺/复氧复糖(ogd/r)模型为离体缺血模型,通过直接通入n2的方式精确控制培养箱内co2和o2的浓度,同时剥夺细胞培养基中的糖,从而造成细胞缺氧缺糖的环境,模拟在体缺血的情况。
技术实现要素:
4.针对现有技术的不足,本发明的目的是提供一种多肽在制备治疗缺血性脑卒中的药物中的应用;在对缺血性脑卒中治疗作用的药理活性体内研究过程中,发现本发明的多肽可以显著改善大鼠神经功能缺陷,增强运动协调能力;减少脑梗死面积及脑神经元细胞的凋亡数量;降低脑炎症因子与氧化应激水平;在对缺血性脑卒中治疗作用的药理活性体外研究过程中,发现本发明的多肽可以提高hcmec/d3细胞的存活率,增强细胞迁移与修复能力,降低细胞活性氧水平。
5.本发明解决其技术问题采用的技术方案是:
6.第一方面,本发明提供了一种多肽及其相关材料在制备治疗缺血性脑卒中的药物中的应用;所述相关材料为能够编码所述多肽的多核苷酸或含有所述多核苷酸的载体;所述多肽选自如下a)或b):
7.a)氨基酸序列为nyepptvvpggdl,如seq id no.1所示,;
8.b)在a)所述的多肽氨基酸侧链基团上、a)所述多肽的氨基端或羧基端进行常规修饰得到的产物,或者为a)所述的多肽上连接用于多肽或蛋白检测或纯化的标签所得到的产物;
9.所述的常规修饰为氨基化、酰胺化、羟基化、羧基化、羰基化、烷基化、乙酰化、磷酸化、酯化、糖基化、环化或生物素化;
10.所述的标签为his、gst、egfp、mbp、nus、ha、igg、flag或c-myc等。
11.前文所述的多肽的获得,采用现有技术中的公知方法进行,既可以用多肽自动合成仪进行化学合成;通过将短肽序列推导出核苷酸序列,然后克隆到载体中进行生物合成;还可以从现有存在的生物体内进行大量提取和纯化等。
12.优选的,本发明保护前文所述多肽在制备治疗mcao/r致大鼠缺血性脑卒中,和/或,ogd/r致人脑微血管内皮细胞(hcmec/d3细胞)损伤的药物中的应用。
13.第二方面,本发明提供了一种用于预防和治疗缺血性脑卒中的药物,包含前文所述的多肽。
14.优选的,所述药物还包含一种或多种药学上可接受的载体。
15.更优选的,所述药学上可接受的载体为稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、吸收载体、表面活性剂或润滑剂等。
16.所述的药物可以进一步制成片剂、粒剂、胶囊、口服液或注射剂等多种形式,各种急性的药物可以按照药物领域的常规方法制备。
17.第三方面,本发明提供一种治疗缺血性脑卒中的方法,通过施用前文所述的多肽。
18.给药方法可根据药物的活性、毒性以及患者的耐受性等综合确定。
19.有益效果
20.本发明提供的一种多肽在制备治疗缺血性脑卒中的药物中的应用,具有如下优点和效果:
21.(1)在多肽nyepptvvpggdl对缺血性脑卒中治疗作用的药理活性体内研究过程中,发现多肽nyepptvvpggdl有助于大鼠体重增加,可以显著改善大鼠神经功能缺陷,增强运动协调能力;减少脑梗死面积及脑神经元细胞的凋亡数量;降低脑炎症因子与氧化应激水平。
22.(2)在多肽nyepptvvpggdl对缺血性脑卒中治疗作用的药理活性体外研究过程中,发现多肽nyepptvvpggdl可以提高hcmec/d3细胞的存活率,增强细胞迁移与修复能力,降低细胞活性氧水平。
23.通过以上研究,从体内、外系统地考察了多肽nyepptvvpggdl治疗mcao/r致缺血性脑卒中和ogd/r致脑内皮细胞损伤的药理活性,促进多肽nyepptvvpggdl的开发,有望开发为缺血性脑卒中的治疗药物。
附图说明
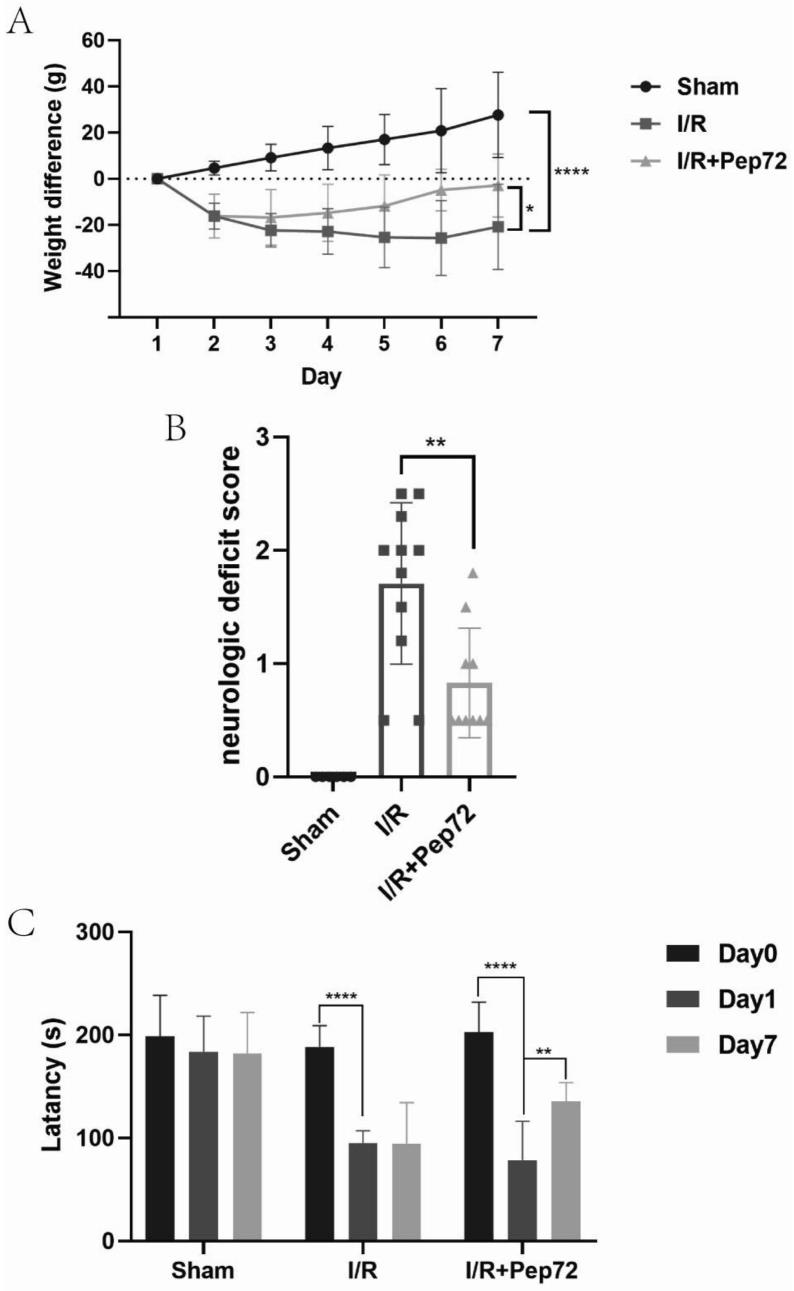
24.图1是本技术多肽nyepptvvpggdl改善mcao/r造模下缺血性脑卒中大鼠的体重和行为学,其中,(a)体重变化;(b)神经功能缺失行为学评分;(c)转棒实验潜伏期;
25.图2是本技术多肽nyepptvvpggdl降低mcao/r造模下缺血性脑卒中大鼠的脑梗死面积和神经元细胞凋亡,其中,(a、b)ttc染色图像及脑梗死面积百分比;(c、d)脑神经元细胞凋亡图像及凋亡百分比;
26.图3是本技术多肽nyepptvvpggdl降低mcao/r造模下缺血性脑卒中大鼠的脑炎症因子和氧化应激水平,其中,(a、b、c)脑il-6、il-1β、tnf-α水平;(d、e)脑mda、sod水平;
27.图4是本技术多肽nyepptvvpggdl保护ogd/r条件下的hcmec/d3细胞,其中,(a)细胞存活率;(b,c)细胞划痕图像及细胞迁移率;(d,e)细胞活性氧荧光图像及活性氧水平。
具体实施方式
28.下面结合附图和实施例,对本发明进行进一步的说明。所用试剂或者仪器设备未注明生产厂商的,均视为可以通过市场购买的常规产品。
29.本发明多肽nyepptvvpggdl的制备、纯化同cn112898385a。
30.实施例1多肽nyepptvvpggdl治疗mcao/r致缺血性脑卒中
31.步骤一:实验分组(6-7周周龄sd雄鼠,购自北京维通利华实验动物技术有限公司,n=6)
32.i)假手术组:假手术后,腹腔注射等体积生理盐水7天(0.5ml/200g)。
33.ii)造模组:造模后,腹腔注射等体积生理盐水7天(0.5ml/200g)。
34.iii)多肽10mg/kg组:造模后,腹腔注射等体积多肽nyepptvvpggdl 7天(0.5ml/200g)。
35.步骤二:建立大鼠大脑中动脉闭塞/再灌注(mcao/r)致缺血性脑卒中模型
36.i)大鼠颈正中切口,分离周围组织,暴露颈总动脉和颈内、颈外动脉。
37.ii)分离颈总动脉,沿颈总动脉依次分离出颈外动脉、颈内动脉,在颈内动脉上打一个松节,备用。动脉夹夹闭颈总动脉。双线结扎颈外动脉后在颈外动脉上剪开45
°
小口,向颈内方向插入线栓,游离颈外动脉残端,扎紧固定线,松开动脉夹。
38.iii)将包有硅胶的线栓小心地从颈外动脉插入颈内动脉,插入深度为2cm,线栓留置缺血2h后,将线栓拔出,使头端退到颈外动脉,实现中动脉再灌注。
39.iv)缝合伤口皮肤,等动物麻醉苏醒后放回笼中,术后予以注射生理盐水减少死亡率,且术中术后注意动物保温和监测生命体征,室温维持25℃为宜,注意术后护理。
40.步骤三:多肽nyepptvvpggdl对缺血性脑卒中大鼠的体重和行为学的影响
41.i)体重:给药后每日称量大鼠体重,作体重差值的时程图。
42.ii)神经功能缺失行为学评分:结合longa和bederson评分法进行神经行为学评分,分数越高表明神经功能缺损越严重。具体评分方法如下:无神经功能缺陷:0分;置于台面时瘫痪侧前爪不能完全伸展,提起尾巴后,瘫痪侧前肢回收并屈于腹下:1分;行走时向瘫痪侧转圈,且向瘫痪侧侧推动物的阻力较正常侧明显降低:2分;行走时向瘫痪侧倾倒:3分;不能自动行走,存在意识丧失现象:4分。
43.iii)转棒实验:造模前,大鼠于转棒仪上训练3天,每天3次,造模前1天将转棒程序时间设置为300s,速度由从0rpm加速到40rpm,记录大鼠在转棒上的潜伏期作为基础值;使用相同条件,造模后1天筛去未成模大鼠;造模后7天进行测试,记录大鼠在转棒上的潜伏期。
44.实验结果表明,给药后缺血性脑卒中大鼠的体重增加(图1.a),神经功能缺失行为学评分降低(图1.b),转棒实验潜伏期增长(图1.c),表明多肽nyepptvvpggdl能够增加缺血性脑卒中大鼠的体重,减轻神经功能缺失,改善运动协调能力。
45.步骤四:多肽nyepptvvpggdl对缺血性脑卒中大鼠的脑梗死面积和神经元细胞凋亡水平的影响
46.i)脑梗死面积:造模后7天处死大鼠,取脑组织,于-80℃冰冻数分钟后均匀切成2mm的切片,第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间。随后,将5个切片在2%2,3,5-三苯基四唑氯化物(ttc)中37℃孵育20-30min,用相机对这些脑切片进行成像,梗死区域呈现白色,而非梗死组织呈现红色,随后使用imagej软件分析和计算梗死面积。
47.ii)脑神经元细胞凋亡水平:
48.①
取材固定:大鼠股动脉放血,先后用生理盐水和4%多聚甲醛全身灌流,取脑组
织置于4%多聚甲醛固定过夜。
49.②
脱水:用20%蔗糖溶液脱水3d,30%蔗糖溶液脱水3d,每天换液。
50.③
包埋切片:脱水组织使用oct胶包埋,使用冰冻切片机切成50μm的脑片,pbs洗3次,每次5min。
51.④
封闭:将含0.3%triton、5%bsa溶液作为封闭液室温封闭脑片1.5-2h。
52.⑤
一抗孵育:用封闭液以1:350的比例配制neun抗体并于4℃过夜孵育,孵二抗前于室温放置2h。
53.⑥
二抗孵育:去除一抗,pbs洗涤脑片3次,与绿色荧光标记的二抗室温避光孵育1h,pbs洗涤3次。
54.⑦
脑片中加入tunel检测液,37℃避光孵育60min,pbs洗涤3次。
55.⑧
使用抗荧光淬灭封片液封片后在激光共聚焦显微镜下采集图片,通过imagej统计视野中神经元细胞凋亡的数量。
56.实验结果表明,多肽nyepptvvpggdl能够减少缺血性脑卒中大鼠的脑梗死面积(图2.a,图2.b),此外,给药后neun标记的神经元细胞的数量增加,tunel标记的凋亡神经元细胞数量减少(图2.c,图2.d),表明多肽nyepptvvpggdl能够降低神经元凋亡水平,促进神经元修复。
57.步骤五:多肽nyepptvvpggdl对缺血性脑卒中大鼠的脑炎症因子水平和氧化应激水平的影响
58.i)脑炎症因子和氧化应激水平:造模后7天处死大鼠,取脑缺血侧皮质区域,以1:9(w/v)的比例加入冰pbs匀浆,离心后取上清液,严格按照炎症因子(il-1β、il-6和tnf-α)试剂盒及氧化应激(mda、sod)试剂盒的说明书进行测定,反应结束后采用酶标仪读数,结果经蛋白校准后进行数据统计。
59.实验结果表明,给药后缺血性脑卒中大鼠脑的il-1β、il-6和tnf-α水平降低(图3.a,图3.b,图3.c),mda水平降低,sod水平升高(图3.d,图3.e),表明多肽nyepptvvpggdl能够降低缺血性脑卒中大鼠脑的炎症因子水平和氧化应激水平,增强抗氧化能力。
60.实施例2多肽nyepptvvpggdl治疗糖氧剥夺/复氧复糖(ogd/r)致脑内皮细胞损伤
61.步骤一:实验分组(人脑微血管内皮细胞hcmec/d3,购自atcc细胞库,n=6)
62.i)对照组:以8*10^3/孔点96孔板,12h贴壁后,换无血清培养基在正常条件下培养24小时,再换新鲜无血清培养基在正常条件下继续培养2h。
63.ii)造模组:以8*10^3/孔点96孔板,12h贴壁后,换无糖培养基在ogd/r下培养24小时,再换无血清培养基在正常条件下继续培养2h。
64.iii)多肽5μg/ml组:以8*10^3/孔点96孔板,12h贴壁后,换无糖培养基在ogd/r下培养24小时,再换以无血清培养基配制的多肽(5μg/ml)溶液在正常条件下继续培养2h。
65.iv)多肽1μg/ml组:以8*10^3/孔点96孔板,12h贴壁后,换无糖培养基在ogd/r下培养24小时,再换以无血清培养基配制的多肽(1μg/ml)溶液在正常条件下继续培养2h。
66.v)多肽0.2μg/ml组:以8*10^3/孔点96孔板,12h贴壁后,换无糖培养基在ogd/r下培养24小时,再换以无血清培养基配制的多肽(0.2μg/ml)溶液在正常条件下继续培养2h。
67.步骤二:建立糖氧剥夺/复氧复糖(ogd/r)致脑内皮细胞损伤的模型
68.i)状态良好的hcmec/d3细胞中加入无菌的0.25%胰酶1.5ml,置于37℃消化1min
后,加入含10%胎牛血清的培养基1ml终止消化,转入15ml无菌离心管中,1000rpm离心5min,弃去培养基,加入1ml新鲜培养基轻轻重悬。以8*10^3/孔点96孔板,待其12h贴壁后,换无糖培养基在37℃、5%co2、1.5%o2的环境中培养24小时,再换无血清培养基在在正常条件下继续培养2h。
69.步骤三:多肽nyepptvvpggdl对于ogd/r致脑内皮细胞损伤的药理活性研究
70.i)细胞存活率实验:将hcmec/d3细胞以8*10^3/孔点96孔板,12h贴壁后,换无糖培养基在ogd/r下培养24小时,各组再给予相应处理2h。加入110μl稀释后的cck-8溶液(无血清培养基:cck-8溶液=10:1),继续在37℃培养箱内继续孵育1h,测定在450nm处的吸光度。
71.实验结果表明,在ogd/r条件下,hcmec/d3细胞的存活率显著降低,给予多肽后,显著改善了ogd/r造成的细胞损伤,提高了hcmec/d3的存活率(图4.a)。表明多肽nyepptvvpggdl能够改善ogd/r造成的hcmec/d3细胞损伤,显著提高细胞存活率。
72.ii)细胞划痕实验:将hcmec/d3细胞接种于6孔板中,待细胞融合度达90%以上,用黄枪头沿直尺在各细胞孔底部划出直线,沿壁加入37℃pbs轻轻荡洗两次洗去细胞碎片,拍摄0h细胞划痕明场图像,换无糖培养基在ogd/r下培养24小时,各组再给予相应处理2h,沿壁加入37℃pbs轻轻荡洗两次洗去细胞碎片,拍摄24h细胞划痕明场图像,通过imagej计算24h细胞迁移率。
73.实验结果表明,在ogd/r条件下,hcmec/d3的细胞迁移率显著下降,给予多肽后,显著提高了细胞迁移率(图4.b,图4.c),表明多肽nyepptvvpggdl能够改善ogd/r造成的细胞迁移率下降,增强细胞迁移与修复能力。
74.iii)细胞活性氧(ros)测定:将hcmec/d3细胞以8*10^3/孔点96孔板,12h贴壁后,换无糖培养基在ogd/r下培养24小时,各组再给予相应处理2h。加入1:1000无血清培养基稀释的dcfh-da荧光探针与细胞于37℃避光共孵育30min,进行探针装载,随后用无血清培养基洗涤细胞三次,充分除去未进入细胞的dcfh-da。用活细胞成像仪拍摄绿色荧光图像,并在激发波长488nm、发射波长525nm下检测读数。
75.实验结果表明,在ogd/r条件下,hcmec/d3细胞的ros水平显著提高,给予多肽后,显著降低了细胞ros水平(图4.d,图4.e),表明多肽nyepptvvpggdl能够改善ogd/r造成的hcmec/d3细胞氧化应激水平增高。
76.本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1