一种Rab13基因和EGFR蛋白表达的抑制剂及应用
本发明涉及一种rab13基因和egfr蛋白表达的抑制剂,以及所述抑制剂在制备与egfr蛋白的高表达相关的疾病、egfr靶向药物耐药、rab13基因高表达相关疾病药物中的应用。
背景技术:
1、gtpases的rab家族是细胞膜转运的主要调控因子。人类中大约有70个rab成员,rab参与了从囊泡形成和运输到囊泡对接/栓系和融合的所有膜运输步骤。囊泡运输控制大量蛋白质的定位和水平,从而调节细胞功能,包括增殖、代谢、细胞粘附和细胞迁移。近年来,rab13越来越受到关注。现有研究证明:rab13水平在胶质母细胞瘤和癌中均发生改变,rab13 mrna在乳腺癌细胞的膜突起中被发现。前期研究表明:rab13在大鼠睾丸组织中的表达,并且发现rab13的表达是随着生精上皮周期的变化而变化;rab13在调节血睾屏障通透性过程中发挥的作用;rab13蛋白调控血管内皮细胞自噬;rab13在极化上皮细胞中通过回收核内体从tgn到细胞表面的胞外膜运输中发挥作用;rab13基因敲除可减少体外癌细胞迁移和侵袭;rab13基因敲低可减少体内癌细胞的扩散;rab13作用于激酶mst1的下游,将整合素lfa-1传递到细胞表面进行淋巴细胞运输。在人外周血单核细胞向破骨细胞分化过程中,rab13基因表达高度上调,并与小泡相关。
2、根据乳腺癌细胞表面激素受体(erα)、孕激素受体(pr)、人表皮生长因子受体2(her2)的表达情况,可将乳腺癌分为:管腔上皮a型(luminal a)、管腔上皮b型(luminalb)、her2过表达型(her2)和三阴性乳腺癌(triple-negative breast cancer,tnbc型)[1]。tnbc是预后最差的乳腺癌分型,占乳腺癌患者的15-20%[2]。tnbc易复发转移,累及肺、肝脏以及中枢神经系统,患者整体预后差需要进行全身治疗[3]。由于缺乏er、pr和her2的表达,针对其它乳腺癌分型的靶向治疗和内分泌治疗对tnbc无明显效果[4]。tnbc患者目前仍以放化疗为主,但存在易产生耐药性、治疗效果不佳以及药物昂贵等问题[3]。tnbc中也存在特异性高表达或过度激活的信号通路[5]。虽然,tnbc对parp抑制、mek抑制剂、pi3k抑制剂、血管生成抑制剂和src抑制剂等药物敏感[6-9],但仍缺乏有效的iii期临床试验数据佐证其疗效。目前,依然未见有效的tnbc靶向治疗方案。
3、egfr在三阴性乳腺癌中高表达,且与病人不良预后正相关[10]。egfr靶向治疗已成功应用于肺癌和结直肠癌等临床治疗中。egfr拮抗剂主要分为两类:1)靶向egfr胞外结构域的单克隆抗体(西妥昔单抗和帕尼单抗);2)靶向胞内酪氨酸激酶结构域的小分子抑制剂(tyrosine kinase inhibitors,tki):第一代非共价抑制剂厄洛替尼和吉非替尼;第二代共价抑制剂阿法替尼;第三代抑制剂奥西替尼以及第四代抑制剂eai001和eai045[11]。然而,egfr拮抗剂在tnbc治疗中收效甚微。转移性tnbc患者进行西妥昔单抗单药或与卡铂联合治疗的临床试验,结果显示西妥昔单抗单药的肿瘤应答率约6%;联合用药组应答率为18%[12]。在tnbc中进行吉非替尼联合表柔比星以及环磷酰胺治疗的ii期临床试验显示,联合用药组pcr(病理学完全缓解)率仅超出无吉非替尼组4.57%,并且药物副作用导致多数患者不能完成治疗[13]。
4、随着用药时间增长,非小细胞肺癌和结直肠癌等对egfr靶向药物敏感的肿瘤会产生耐药性。越来越多的研究聚焦egfr靶向药物的耐药机制。乳腺癌对egfr靶向药物亦不敏感,这是导致临床治疗效果不好的重要原因。而导致这种不敏感的主要机制可能有以下两点:1)tki针对egfr胞内酪氨酸激酶结构域设计并抑制其激活。非小细胞肺癌和结直肠癌中egfr胞内段激酶结构域激活性突变位点是大多数tki设计的依据。然而,有数据显示egfr激活性突变率非常低[14-16],非小细胞肺癌中常见的egfr突变亦很少出现在乳腺癌中[17-19]。2)egfr单抗(西妥昔单抗、帕尼单抗)的作用机制是竞争性地与其胞外结构域结合,从而抑制受体的二聚化、磷酸化和下游信号通路的激活。乳腺癌依然对这类靶向药物不敏感。这类药物的耐药性产生主要与egfr的内化和降解受损有关[20,21]。经过配体或者特异性抗体刺激后,egfr能够被内吞进入内核体,经过分选进一步进入溶酶体被降解或者再循环至细胞膜,该过程受egfr磷酸化、泛素化修饰等调控[22]。其实,无论egfr是否突变,其降解异常都可成为其耐药产生的重要原因。因此,通过靶向egfr降解异常来降低egfr的表达水平是提高egfr靶向药物临床疗效的重要理论依据,也是将egfr靶向药物应用于乳腺癌治疗的潜在理论基础。
5、甲基巴多索隆是reata制药和abbvie联合开发的口服抗氧化炎症调节剂,是齐墩果酸衍生的半合成三萜类化合物。其化学名为2-氰基-3,12-二氧代齐墩果-1,9(11)-二烯-28-酸甲酯,又名rta 402、cddo-methylester、cddo-me,分子式:c32h43no4,分子量:505.69,化学结构如下所示。
6、
7、它可有效激活keapl-nrf2通路,并抑制nf—kb炎症途径,减少促炎信号。同时,它也是一种ikk抑制剂,具有强的促凋亡和抗炎活性。在癌细胞中可诱导凋亡和自噬,具有抗氧化、抗炎等功效。体外研究表明:cddo-me作用于小鼠巨噬细胞,对具有强效的抑制活性,降低白血病hl-60,凋亡bax蛋白表达,抑制erk1/2的活化,并且它抑制bcl-2的磷酸化,这有助于诱导细胞凋亡。
8、cddo-me可有效地抑制(il)-1chemicalbookbeta,phorbolester,okadaicacid,hydrogenperoxide,lipopolysaccharide,和cigarettesmoke激活的组成型和可诱导的nf-κb的肿瘤坏死因子。体内研究:cddo-me(60mg/kg)体内用药,可减少肺肿瘤的数量,大小和降低严重程度。cddo-me还可显著降低lps刺激下的体内炎症因子的反应,诱导脾脏ho-1蛋白表达,对抗致死剂量的lps保护小鼠。文献报道,cddo-me可以通过抑制usp7、lrp6/fzd7膜受体复合体、mtor、wnt、hsp90、akt、erk、pkb、nf-κb、端粒酶逆转录酶、stat3、cyclin d1、egfr2、nrf2和ikk卵巢癌、乳腺癌、胰腺癌、肺癌、结直肠癌、急性骨髓性白血病、前列腺癌、黑色素瘤、骨肉瘤、脊髓瘤、神经胶质瘤、神经母细胞瘤、口腔鳞状上皮细胞癌和慢性粒细胞白血病(pmid:27780924,32015160,25364233,29118925,33584286)【23-27】。
9、申请号为2009101272661“基因rab13的拮抗剂的应用及包含该拮抗剂的药物”的专利公开了基因rab13的拮抗剂在制备用于抑制肿瘤细胞增殖和促进肿瘤细胞凋亡或者用于增强抗肿瘤药疗效的药物中的应用,其中所述的拮抗剂是针对基因rabl3所转录的mrna的sirna分子或者反义rna,并没有找到一种化合物可以抑制基因rab13表达。
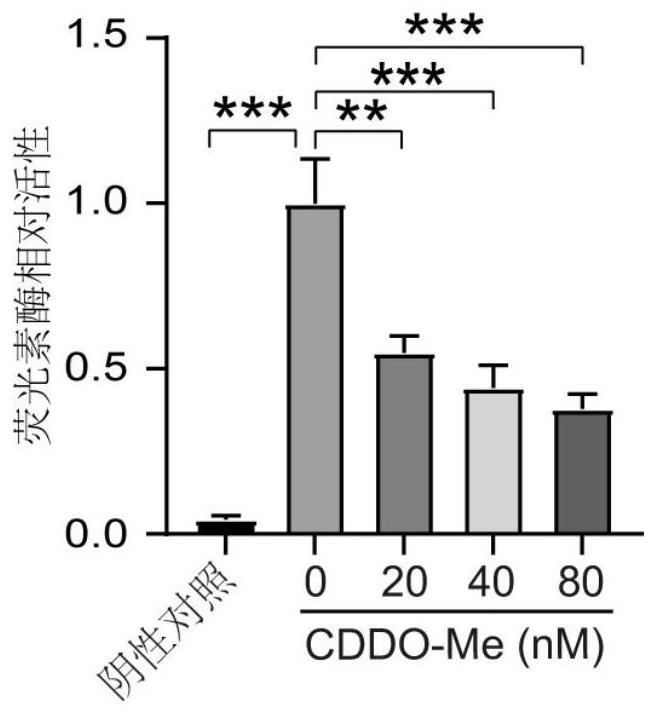
10、现有技术也没有报道过甲基巴多索隆对rab13基因的影响。发明人通过筛选fda批准化合物库,发现甲基多巴索隆(cddo-me)抑制rab13 mrna及蛋白表达水平表达并抑制rab13启动子活性。
11、参考文献:
12、1.blows fm,driver ke,schmidt mk,broeks a,van leeuwen fe,wesseling j,et al.subtyping of breast cancer by immunohistochemistry to investigate arelationship between subtype and short and long term survival:a collaborativeanalysis of data for 10,159 cases from 12 studies.plos med 2010;7:e1000279
13、2.o'reilly ea,gubbins l,sharma s,tully r,guang mh,weiner-gorzel k,etal.the fate of chemoresistance in triple negative breast cancer(tnbc).bbaclinical 2015;3:257-75
14、3.carey la,perou cm,livasy ca,dressler lg,cowan d,conway k,etal.race,breast cancer subtypes,and survival in the carolina breast cancerstudy.jama 2006;295:2492-502
15、4.bianchini g,balko jm,mayer ia,sanders me,gianni l.triple-negativebreast cancer:challenges and opportunities of a heterogeneous disease.nat revclin oncol 2016;13:674-90
16、5.sporikova z,koudelakova v,trojanec r,hajduch m.genetic markers intriple-negative breast cancer.clin breast cancer 2018;18:e841-e50
17、6.hoeflich kp,o'brien c,boyd z,cavet g,guerrero s,jung k,et al.invivo antitumor activity of mek and phosphatidylinositol 3-kinase inhibitorsin basal-like breast cancer models.clin cancer res 2009;15:4649-64
18、7.ibrahim yh,garcía-garcía c,serra v,he l,torres-lockhart k,prat a,etal.pi3k inhibition impairs brca1/2 expression and sensitizes brca-proficienttriple-negative breast cancer to parp inhibition.cancer discov 2012;2:1036-47
19、8.finn rs,dering j,ginther c,wilson ca,glaspy p,tchekmedyian n,etal.dasatinib,an orally active small molecule inhibitor of both the src andabl kinases,selectively inhibits growth of basal-type/"triple-negative"breastcancer cell lines growing in vitro.breast cancer research and treatment 2007;105:319-26
20、9.miller k,wang m,gralow j,dickler m,cobleigh m,perez ea,etal.paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breastcancer.n engl j med 2007;357:2666-76
21、10.jacot w,mollevi c,fina f,lopez-crapez e,martin pm,colombo pe,etal.high egfr protein expression and exon 9 pik3ca mutations are independentprognostic factors in triple negative breast cancers.bmc cancer 2015;15:986
22、11.ayati a,moghimi s,salarinejad s,safavi m,pouramiri b,foroumadi a.areview on progression of epidermal growth factor receptor(egfr)inhibitors asan efficient approach in cancer targeted therapy.bioorg chem 2020;99:103811
23、12.carey la,rugo hs,marcom pk,mayer el,esteva fj,ma cx,et al.tbcrc001:randomized phase ii study of cetuximab in combination with carboplatin instage iv triple-negative breast cancer.j clin oncol 2012;30:2615-23
24、13.bernsdorf m,ingvar c,l,tuxen m,jakobsen e,saetersdal a,etal.effect of adding gefitinib to neoadjuvant chemotherapy in estrogenreceptor negative early breast cancer in a randomized phase ii trial.2011;126:463-70
25、14.nakajima h,ishikawa y,furuya m,sano t,ohno y,horiguchi j,etal.protein expression,gene amplification,and mutational analysis of egfr intriple-negative breast cancer.breast cancer(tokyo,japan)2014;21:66-74
26、15.toyama t,yamashita h,kondo n,okuda k,takahashi s,sasaki h,etal.frequently increased epidermal growth factor receptor(egfr)copy numbersand decreased brca1 mrna expression in japanese triple-negative breastcancers.bmc cancer 2008;8:309
27、16.vora hh,patel na,thakore pm,shukla sn.immunohistochemicallocalization of wild-type egfr,e746-a750 frame deletion in exon 19,and l858rpoint mutation in exon 21 in triple-negative breast cancer.appliedimmunohistochemistry&molecular morphology:aimm 2015;23:653-60
28、17.levva s,kotoula v,kostopoulos i,manousou k,papadimitriou c,papadopoulou k,et al.prognostic evaluation of epidermal growth factorreceptor(egfr)genotype and phenotype parameters in triple-negative breastcancers.cancer genomics&proteomics 2017;14:181-95
29、18.sánchez-a,gallego e,de luque v,pérez-rivas lg,vicioso l,ribelles n,et al.lack of evidence for kras oncogenic mutations in triple-negative breast cancer.bmc cancer 2010;10:136
30、19.teng yh,tan wj,thike aa,cheok py,tse gm,wong ns,et al.mutations inthe epidermal growth factor receptor(egfr)gene in triple negative breastcancer:possible implications for targeted therapy.breast cancer res 2011;13:r35
31、20.grovdal lm,stang e,sorkin a,madshus ih.direct interaction of cblwith ptyr 1045 of the egf receptor(egfr)is required to sort the egfr tolysosomes for degradation.exp cell res 2004;300:388-95
32、21.wheeler dl,huang s,kruser tj,nechrebecki mm,armstrong ea,benaventes,et al.mechanisms of acquired resistance to cetuximab:role of her(erbb)family members.oncogene 2008;27:3944-56
33、22.yu jj,zhou dd,yang xx,cui b,tan fw,wang j,et al.trib3-egfrinteraction promotes lung cancer progression and defines a therapeutictarget.nat commun 2020;11:3660.
34、23.so jy,lin jj,wahler j,liby kt,sporn mb,suh n.a synthetictriterpenoid cddo-im inhibits tumorsphere formation by regulating stem cellsignaling pathways in triple-negative breast cancer.plos one 2014;9:e107616
35、24.ball ms,bhandari r,torres gm,martyanov v,eltanbouly ma,archambaultk,et al.cddo-me alters the tumor microenvironment in estrogen receptornegative breast cancer.sci rep 2020;10:6560
36、25.deeb d,gao x,dulchavsky sa,gautam sc.cddo-me induces apoptosis andinhibits akt,mtor and nf-kappab signaling proteins in prostate cancercells.anticancer res 2007;27:3035-44
37、26.qin dj,tang cx,yang l,lei h,wei w,wang yy,et al.hsp90 is a noveltarget molecule of cddo-me in inhibiting proliferation of ovarian cancercells.plos one 2015;10:e0132337
38、27.liby kt,sporn mb.synthetic oleanane triterpenoids:multifunctionaldrugs with a broad range of applications for prevention and treatment ofchronic disease.pharmacol rev 2012;64:972-1003。
技术实现思路
1、基于以上技术问题,本发明拟提供一种rab13基因抑制剂,其能够抑制rab13基因的表达,以降低rab13基因的表达产物的水平。
2、本发明技术方案如下:一种rab13基因抑制剂,为甲基巴多索隆(cddo-me),其能够抑制rab13基因的表达,以降低rab13基因的表达产物水平的抑制剂。
3、进一步地,所述的抑制剂在制备治疗与rab13基因高表达相关疾病的药物中的用途。
4、进一步地,所述的抑制剂在制备增强与rab13基因高表达相关的化疗药物敏感性药物中的用途。
5、进一步地,所述的抑制剂在制备增强egfr靶向药物敏感性药物中的应用。
6、本发明还保护所述的抑制剂甲基巴多索隆与其他抗肿瘤药物联合使用在制备肿瘤化疗药物中的应用。
7、进一步地,所述的抑制剂与rab13基因高表达相关的化疗药物联合使用在制备抗肿瘤药物中的应用。
8、进一步地,所述的抑制剂与egfr靶向药物联合使用在制备抗肿瘤药物中的应用。
9、优选地,所述的与rab13基因高表达相关疾病药物为dox、ptx、cis。
10、优选地,所述的egfr靶向药物为西妥昔单抗或吉非替尼。
11、本发明证明筛选到的基因rab13的抑制剂cddo-me可抑制基因rab13在细胞和动物体内水平的表达,可直接作用于rab13启动子,并且抑制其启动子活性;可以在mrna和蛋白水平抑制rab13的表达,这种抑制作用是通过抑制其启动子活性实现的。cddo-me促进肿瘤对化疗药(dox、ptx、cis)和egfr靶向药物的敏感性:可以降低化疗药物处理肿瘤细胞的ic50值;增加化疗药处理后肿瘤细胞的凋亡率;抑制化疗药引起的肿瘤干细胞富集;抑制化疗药处理后肿瘤原位复发。cddo-me处理抑制肿瘤干细胞干性(aldh+干细胞群和tumorsphere形成)。cddo-me处理抑制tam/caf条件性培养基引起的肿瘤干细胞富集。cddo-me处理抑制mmtv-pymt小鼠肿瘤生长,抑制mmtv-pymt小鼠肿瘤干性(aldh活性和tumorsphere形成),抑制肿瘤组织中tam/caf富集。cddo-me可以与rab13基因高表达相关的化疗药物和egfr靶向药物联合使用在制备抗肿瘤药物中的应用。
- 还没有人留言评论。精彩留言会获得点赞!