一种预防和/或治疗急性髓系白血病的联合用药物组合物及其应用的制作方法
1.本发明属于生物医药技术领域,涉及一种急性髓系白血病的新的预防或治疗方式,具有涉及一种预防和/或治疗急性髓系白血病的联合用药物组合物及其应用。
背景技术:
2.急性髓细胞白血病(acute myeloid leukemia,aml)是一种预后差、发展迅速的疾病,主要特征表现为低分化细胞的异常增殖,从而损害了正常的造血功能(参见arnone m,et al.acute myeloid leukemia stem cells:the challenges of phenotypic heterogeneity.cancers(basel).2020dec 12;12(12):3742.doi:10.3390/cancers12123742.pmid:33322769;pmcid:pmc7764578)。aml患者主要表现为复发性感染、贫血、易出血以及其他与细胞减少相关的症状(参见de kouchkovsky,i.;abdul-hay,m.acute myeloid leukemia:a comprehensive review and 2016update.blood cancer j.2016,6,e441)。异基因造血干细胞移植(hsct)是aml治疗策略之一,然而,近40%接受异体hsct治疗的患者复发,复发后生存率较差(参见bejanyan,n.et al.,2015.survival of patients with acute myeloid leukemia relapsing after allogeneic hematopoietic cell transplantation:a center for international blood and marrow transplant research study.biol.blood marrow transplant.21(3),454
–
459.)。采用常见的化疗方案(柔红霉素和阿糖胞苷)进行完全缓解(cr),随着年龄的增长,aml患者的治疗结果持续下降,患者的长期存活率不容乐观(参见juliusson,g.et al.,2009.age and acute myeloid leukemia:real world data on decision to treat and outcomes from the swedish acute leukemia registry.blood 113(18),4179
–
4187.)。因此,对于aml治疗新策略的研究迫在眉睫。
3.铁死亡是近年来发现的一种新型的细胞死亡类型,在细胞死亡过程中通常伴随着大量的铁积累和脂质过氧化,近年来的研究表明,铁死亡与许多疾病的病理生理过程密切相关,如肿瘤、神经系统疾病、缺血-再灌注损伤、肾脏损伤和血液疾病等(参见li j,cao f,yin hl,huang zj,lin zt,mao n,sun b,wang g.ferroptosis:past,present and future.cell death dis.2020feb 3;11(2):88.doi:10.1038/s41419-020-2298-2.pmid:32015325;pmcid:pmc6997353.)。david t.scadden等人研究表明抑制醛脱氢酶3a2(aldh3a2)能够诱导aml细胞发生铁死亡,为aml的治疗提供了新的靶点(参见yusuf rz,saez b,et al..aldehyde dehydrogenase 3a2 protects aml cells from oxidative death and the synthetic lethality of ferroptosis inducers.blood.2020sep 10;136(11):1303-1316.doi:10.1182/blood.2019001808.pmid:32458004;pmcid:pmc7483435.)。
4.西达本胺是深圳微芯生物公司独家发现且具有全球专利保护的新分子实体药物,是我国首个获批上市的原创化学新药,也是全球首个亚型选择性组蛋白去乙酰化酶(hdac)
口服抑制剂,属于机制新颖的表观遗传调控剂类药物。西格列他钠(chiglitazar sodium)是深圳微芯生物公司自主设计、合成、筛选和开发的新一代胰岛素增敏剂类新分子实体、主要用于治疗2型糖尿病。也成为全球首个获批治疗2型糖尿病的ppar全激动剂。ping-ping li等人的研究表明西格列他钠能够改善肥胖大鼠的胰岛素抵抗以及血脂异常(参见li pp,shan s,chen yt,ning zq,sun sj,liu q,lu xp,xie mz,shen zf.the pparalpha/gamma dual agonist chiglitazar improves insulin resistance and dyslipidemia in msg obese rats.br j pharmacol.2006jul;148(5):610-8.doi:10.1038/sj.bjp.0706745.epub 2006jun 5.pmid:16751799;pmcid:pmc1751868.)。
5.但是,西达本胺联合西格列他钠能否用于aml治疗、以及对aml相关细胞株的作用机制尚不清楚。
技术实现要素:
6.针对现有技术的不足,本发明的目的在于提供一种急性髓系白血病的新的预防或治疗方式,具有提供一种预防和/或治疗急性髓系白血病的联合用药物组合物及其应用。
7.为达到此发明目的,本发明采用以下技术方案:
8.第一方面,本发明提供一种预防和/或治疗急性髓系白血病的联合用药物组合物,所述联合用药物组合物包括hdac抑制剂和ppar激动剂。
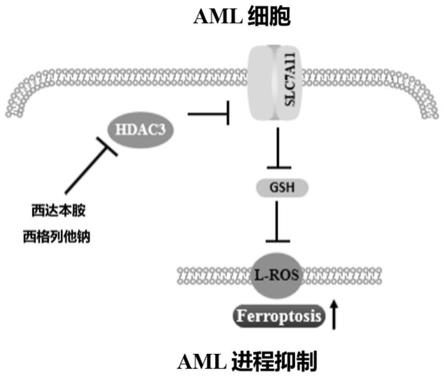
9.本发明所涉及的联合用药物组合物创造性地将hdac抑制剂和ppar激动剂进行联用作为预防或治疗急性髓系白血病的药物,本发明研究发现ppar激动剂联合hdac抑制剂具有比单一ppar激动剂或hdac抑制剂更显著抑制aml细胞增殖的作用、更显著诱导aml细胞凋亡的作用、更显著抑制aml细胞克隆形成能力的作用。本发明还通过铁死亡抑制剂回补实验以及细胞脂质过氧化水平检测证明ppar激动剂联合hdac抑制剂能够诱导aml细胞发生铁死亡;通过细胞gsh水平检测、rt-pcr以及wb实验证明ppar激动剂联合hdac抑制剂能够抑制aml细胞中与铁死亡相关的xc-系统;最后通过cdx小鼠模型证明ppar激动剂联合hdac抑制剂能够抑制小鼠aml成瘤进程,改善小鼠存活率。其抑制aml发生发展进程的作用机制示意图如图1所示。
10.本发明为急性髓系白血病的治疗提供了有效的药物联用策略,具有十分显著的意义。
11.优选地,所述hdac抑制剂包括:恩替诺特(entinostat)、伏立诺他(vorinostat)、帕比司他(panobinostat)、莫西司他(mocetinostat)、贝利司他(belinostat)、普雷司他(pracinostat)、罗米地辛(romidepsin)、西达本胺(chidamide)、或上述化合物在药学上可接受的盐、异构体、溶剂化物、代谢产物中的任意一种或至少两种的组合;
12.优选地,所述hdac抑制剂为西达本胺或其在药学上可接受的盐、异构体、溶剂化物、代谢产物中的任意一种或至少两种的组合。
13.优选地,所述ppar激动剂包括:西格列羧(chiglitazar)、非诺贝特(fenofibrate)、吉非罗齐(gemfibrozil)、非诺贝酸(fenofibric acid)、氟芬那酸(flufenamic acid)、布洛芬(ibuprofen)、苯扎贝特(bezafibrate)、吲哚美辛(indomethacin)、罗格列酮(rosiglitazone)、环丙贝特(ciprofibrate)、丙戊酸(valproic acid)、右旋布洛芬(dexibuprofen)、胺碘酮(amiodarone)、普拉睾酮(prasterone)、α-月见
草油酸(alpha-linolenic acid)、ppm-204(indeglitazar)、克利贝特(clinofibrate)、没药(myrrh)、棕榈酸(palmitic acid)、非诺洛芬(fenoprofen)、月桂酸(lauric acid)、硬脂酸(stearic acid)、氯贝丁酯(clofibrate)、二十二碳六烯酸(doconexent)、油酸(oleic acid)、曲格列酮(troglitazone)、ω-3脂肪酸(omega-3fatty acids)、二十碳五烯酸(icosapent)、肉豆蔻酸(myristic acid)、花生四烯酸(arachidonic acid)、异黄酮(isoflavone)、阿格列扎(aleglitazar)、瑞格列扎(reglitazar)、gft505(elafibranor)、莫格列扎(muraglitazar)、厄罗他非(ertiprotafib)、邻苯二甲酸(phthalic acid)、拉格列扎(ragaglitazar)、替格列扎(tesaglitazar)、gw-590735、白细胞三烯b4(leukotriene b4)、辛酸(caprylic acid)、gw501516(cardarine)、白藜芦醇(resveratrol)、n,n-双(3-(d-葡糖酰胺)丙基)脱氧胆酰胺(n,n-bis(3-(d-gluconamido)propyl)deoxycholamide)或上述化合物在药学上可接受的盐、异构体、溶剂化物、代谢产物中的任意一种或至少两种的组合。
14.优选地,所述ppar激动剂为西格列羧或其在药学上可接受的盐、异构体、溶剂化物、代谢产物中的任意一种或至少两种的组合。
15.优选地,所述药学上可接受的盐包括碱金属盐、碱土金属盐、铵盐或季铵盐中的任意一种,优选为碱金属盐,进一步优选为钠盐或钾盐。
16.优选地,所述ppar激动剂为西格列他钠、西格列他钾或其左旋体。
17.优选地,所述药物组合物还包括药学上可接受的辅料。
18.优选地,本发明所述联合用药物组合物可单独给药也可以与辅料搭配做成适当的剂型进行给药,所述药学上可接受的辅料包括载体、稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、乳化剂、助溶剂、增溶剂、渗透压调节剂、表面活性剂、包衣材料、着色剂、ph调节剂、抗氧剂、抑菌剂或缓冲剂中的任意一种或至少两种的组合。
19.所述至少两种的组合例如稀释剂和赋形剂的组合、乳化剂和助溶剂的组合、填充剂和粘合剂和润湿剂的组合等,其他任意的组合方式均可选择,在此便不再一一赘述。
20.优选地,所述联合用药物组合物为单一的复方制剂或两种单独的制剂的组合。
21.优选地,所述联合用药物组合物为两种单独的制剂的组合,两种单独的制剂同时施用或依次施用。
22.所述联合用药物组合物可以为单一的复方制剂形式,也可以为两种单独的制剂的组合;当为两种单独的制剂的组合时,其用药方式可以为同时施用,也可以为交叉施用或依次施用。
23.优选地,所述制剂为药剂学上可接受的任意一种剂型,例如片剂、散剂、混悬剂、颗粒剂、胶囊剂、溶液剂、灌肠剂、乳剂等。
24.优选地,所述hdac抑制剂的单位剂量为1-100mg,优选为5-80mg;进一步的,所述西达本胺或其在药学上可接受的盐、异构体、溶剂化物、代谢产物的单位剂量为5-100mg,优选为5-60mg。
25.优选地,所述ppar激动剂的单位剂量为1-50mg,优选为4-25mg;进一步的,所述西格列他钠的单位剂量为5-50mg,优选为10-20mg。
26.第二方面,本发明提供一种根据第一方面所述的预防和/或治疗急性髓系白血病的联合用药物组合物在制备预防、改善或治疗急性髓系白血病的药物中的应用。
27.第三方面,本发明提供一种根据第一方面所述的预防和/或治疗急性髓系白血病的联合用药物组合物在制备急性髓系白血病细胞的增殖抑制剂、凋亡促进剂或克隆形成抑制剂中的应用。
28.优选地,所述急性髓系白血病细胞为诱发急性髓细胞白血病的细胞株。
29.优选地,所述细胞株包括kg-1α细胞和/或kasumi-1细胞。
30.第四方面,本发明提供一种根据第一方面所述的预防和/或治疗急性髓系白血病的联合用药物组合物在制备以非诊断和/或治疗为目的的急性髓系白血病细胞的增殖抑制剂、凋亡促进剂或克隆形成抑制剂中的应用。
31.根据本发明的研究结果,所述联合用药物组合物具有显著地抑制急性髓系白血病细胞增殖的作用、显著地诱导急性髓系白血病细胞凋亡的作用、显著地抑制急性髓系白血病细胞的克隆形成作用,因此,该结果表明所述联合用药物组合物可以作为一种以非诊断和/或治疗为目的的急性髓系白血病细胞增殖抑制剂、凋亡促进剂或克隆形成抑制剂,用于科研领域,例如研究更多的急性髓系白血病细胞生长、凋亡、克隆形成和代谢机制或行为,筛选治疗急性髓系白血病的药物等等。
32.第五方面,本发明提供一种根据第一方面所述的预防和/或治疗急性髓系白血病的联合用药物组合物在制备与铁死亡相关的xc-系统的抑制剂中的应用。
33.优选地,所述与铁死亡相关的xc-系统为aml中与铁死亡相关的xc-系统。
34.第六方面,本发明提供一种根据第一方面所述的预防和/或治疗急性髓系白血病的联合用药物组合物在制备以非诊断和/或治疗为目的的与铁死亡相关的xc-系统的抑制剂中的应用。
35.根据本发明的研究结果,所述联合用药物组合物具有显著地抑制与铁死亡相关的xc-系统的作用,因此,该结果表明所述联合用药物组合物可以作为一种以非诊断和/或治疗为目的的与铁死亡相关的xc-系统抑制剂,用于科研领域。
36.第七方面,本发明提供一种根据第一方面所述的预防和/或治疗急性髓系白血病的联合用药物组合物在制备hdac3表达抑制剂或slc7a11表达抑制剂中的应用。
37.优选地,所述hdac3为aml中的hdac3;所述slc7a11为aml中的slc7a11。
38.第八方面,本发明提供一种根据第一方面所述的预防和/或治疗急性髓系白血病的联合用药物组合物在制备以非诊断和/或治疗为目的的hdac3表达抑制剂或slc7a11表达抑制剂中的应用。
39.在根据本发明的研究结果,所述联合用药物组合物具有显著地抑制hdac3表达或slc7a11表达的作用,因此,该结果表明所述联合用药物组合物可以作为一种以非诊断和/或治疗为目的的hdac3表达抑制剂或slc7a11表达抑制剂,用于科研领域,例如研究更多的hdac3或slc7a11表达行为。
40.相对于现有技术,本发明具有以下有益效果:
41.本发明所涉及的联合用药物组合物创造性地将hdac抑制剂和ppar激动剂进行联用作为预防或治疗急性髓系白血病的药物,本发明研究发现ppar激动剂联合hdac抑制剂具有比单一ppar激动剂或hdac抑制剂更显著抑制aml细胞增殖的作用、更显著诱导aml细胞凋亡的作用、更显著抑制aml细胞克隆形成能力的作用。本发明还通过铁死亡抑制剂回补实验以及细胞脂质过氧化水平检测证明ppar激动剂联合hdac抑制剂能够诱导aml细胞发生铁死
亡;通过细胞gsh水平检测、rt-pcr以及wb实验证明ppar激动剂联合hdac抑制剂能够抑制aml细胞中与铁死亡相关的xc-系统;最后通过cdx小鼠模型证明ppar激动剂联合hdac抑制剂能够抑制小鼠aml成瘤进程,改善小鼠存活率。本发明为急性髓系白血病的治疗提供了有效的药物联用策略,具有十分显著的意义。
42.本发明所涉及的联合用药物组合物抑制aml发生发展进程的作用机制示意图如图1所示:西达本胺联合西格列他钠能够抑制aml细胞株kg-1α与kasumi-1中hdac3/slc7a11途径,进而抑制了与铁死亡相关的xc-系统,诱导细胞发生铁死亡,最终抑制了aml发生发展进程。
附图说明
43.图1是本发明所涉及的联合用药物组合物抑制aml发生发展的作用机制示意图;
44.图2a为西达本胺联合西格列他钠处理kg-1α细胞24h后的细胞增殖抑制率结果图;
45.图2b为西达本胺联合西格列他钠处理kasumi-1细胞24h后的细胞增殖抑制率结果图;
46.图3a为西达本胺联合西格列他钠处理kg-1α细胞24h后的细胞凋亡水平流式检测结果图;
47.图3b为kg-1α细胞的凋亡率统计结果图;
48.图3c为西达本胺联合西格列他钠处理kasumi-1细胞24h后的细胞凋亡水平流式检测结果图;
49.图3d为kasumi-1细胞的凋亡率统计结果图;
50.图4a为西达本胺联合西格列他钠处理kg-1α细胞24h后的细胞克隆形成结果图;
51.图4b为kg-1α细胞的克隆形成结果统计图;
52.图4c为西达本胺联合西格列他钠处理kasumi-1细胞24h后的细胞克隆形成结果图;
53.图4d为kasumi-1细胞的克隆形成结果统计图;
54.图5a为铁死亡抑制剂ferrostatin-1(fer-1)能够回补西达本胺联合西格列他钠对kg-1α细胞增殖水平的抑制作用的结果图;
55.图5b为铁死亡抑制剂ferrostatin-1(fer-1)能够回补西达本胺联合西格列他钠对kasumi-1细胞增殖水平的抑制作用的结果图;
56.图5c为西达本胺联合西格列他钠处理kg-1α细胞24h后的脂质过氧化水平的结果统计图;
57.图5d为西达本胺联合西格列他钠处理kasumi-1细胞24h后的脂质过氧化水平的结果统计图;
58.图6a为西达本胺联合西格列他钠处理kg-1α细胞24h后的还原性谷胱甘肽(gsh)生成水平的结果统计图;
59.图6b为西达本胺联合西格列他钠处理kasumi-1细胞24h后的还原性谷胱甘肽(gsh)生成水平的结果统计图;
60.图6c为西达本胺联合西格列他钠处理kg-1α细胞24h后的slc7a11的mrna水平表达的结果统计图;
61.图6d为西达本胺联合西格列他钠处理kasumi-1细胞24h后的slc7a11的mrna水平表达的结果统计图;
62.图6e为西达本胺联合西格列他钠处理kg-1α细胞24h后的hdac3以及slc7a11的蛋白表达水平的western blot结果图;
63.图6f为西达本胺联合西格列他钠处理kasumi-1细胞24h后的hdac3以及slc7a11的蛋白表达水平的western blot结果图;
64.图7a为西达本胺联合西格列他钠处理cdx小鼠模型后在第7天和第14天时的活体成像图;
65.图7b为西达本胺联合西格列他钠处理cdx小鼠模型后小鼠的生存率统计图。
具体实施方式
66.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
67.实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。各实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
68.除非另有说明,本说明书中使用的全部专业术语和科学用语的含义均与本发明所属技术领域的技术人员一般理解的含义相同。但如有冲突,以包含定义的本说明书为准。
69.下述实施例所涉及的药物西达本胺(chidamide)和西格列他钠(chiglitazar)均由深圳微芯生物公司提供。
70.aml细胞株(包括kg1α、kasumi-1)由厦门大学医学院血液学研究所提供。
71.实施例1
72.联合用药物组合物对aml细胞株增殖的抑制作用
73.操作方法为:取数量为1
×
104对数生长期的aml细胞株(包括kg1α、kasumi-1细胞株)接种于96孔板,设置西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组、对照组;
74.实验组细胞的西达本胺单药浓度分别为1μm、2μm、4μm和8μm,对应的西格列他钠单药浓度分别为4μm、8μm、16μm和32μm,西达本胺与西格列他钠联合组浓度分别为1μm+4μm、2μm+8μm、4μm+16μm、8μm+32μm(前者为西达本胺,后者为西格列他钠),其中对照组细胞用相同体积的dmso处理;将对应体积的药物或者dmso与上述96孔细胞培养板中的细胞轻微振荡混匀后,在细胞培养箱(thermo)中培养24h后用cck8试剂盒(mce,上海)检测细胞增殖水平。
75.各组的细胞增殖水平结果如图2a(kg1α)和图2b(kasumi-1)所示;
76.结合上述结果可知,与单药相比,西达本胺联合西格列他钠对aml细胞株kg-1α与kasumi-1的增殖水平呈现出更加显著的抑制作用。
77.实施例2
78.联合用药物组合物对aml细胞株的诱导凋亡作用
79.操作方法为:取数量为2
×
105对数生长期的aml细胞株(包括kg1α、kasumi-1细胞株)接种于24孔板,设置西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组、对照组;
80.实验组细胞的西达本胺单药浓度分别为1μm、2μm、4μm和8μm,对应的西格列他钠单药浓度分别为4μm、8μm、16μm和32μm,西达本胺与西格列他钠联合组浓度分别为1μm+4μm、2μm+8μm、4μm+16μm、8μm+32μm(前者为西达本胺,后者为西格列他钠),其中对照组细胞用相同体积的dmso处理;将对应体积的药物或者dmso与上述24孔细胞培养板中的细胞轻微振荡混匀后,在细胞培养箱中培养24h后,4℃,300g离心5min收集细胞,pbs洗一次,再用annexin v/pi(thermofisher,usa)流式染色法检测细胞凋亡水平并统计细胞凋亡率。
81.图3a和图3b分别为西达本胺联合西格列他钠处理kg-1α细胞24h后的细胞凋亡水平流式检测结果图和凋亡率统计结果图;图3c和图3d为西达本胺联合西格列他钠处理kasumi-1细胞24h后的细胞凋亡水平流式检测结果图和凋亡率统计结果图。
82.由上述结果可知,与单药相比,西达本胺联合西格列他钠能够更显著地诱导aml细胞株kg-1α与kasumi-1的凋亡水平。
83.实施例3
84.联合用药物组合物对aml细胞株的克隆形成抑制作用
85.操作方法为:取2
×
105对数生长期aml细胞株kg-1α与kasumi-1分别接种于24孔细胞培养板中;
86.设置西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组、对照组;实验组细胞的西达本胺单药浓度为4μm,对应的西格列他钠单药浓度为16μm,西达本胺与西格列他钠联合组浓度为4μm+16μm(前者为西达本胺,后者为西格列他钠),其中对照组细胞用相同体积的dmso处理;将对应体积的药物或者dmso与上述24孔细胞培养板中的细胞轻微振荡混匀,在细胞培养箱中培养24h后通过活细胞计数再取其中500个细胞进一步通过软琼脂实验(lablead,北京)检测细胞的克隆形成能力。
87.图4a和图4b为西达本胺联合西格列他钠处理kg-1α细胞后的细胞克隆形成结果图以及统计结果图;图4c和图4d为西达本胺联合西格列他钠处理kasumi-1细胞后的细胞克隆形成结果图以及统计结果图。
88.所得结果表明,与单药相比,西达本胺联合西格列他钠显著抑制了aml细胞株kg-1α与kasumi-1的细胞克隆形成能力。
89.实施例4
90.西达本胺联合西格列他钠诱导aml细胞株发生铁死亡
91.操作方法为:首先,取1
×
104对数生长期aml细胞株kg-1α与kasumi-1分别接种于96孔细胞培养板中;
92.设置西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组、铁死亡抑制剂组、西达本胺与西格列他钠联合组与铁死亡抑制剂组、对照组;实验组细胞的西达本胺单药浓度为4μm,对应的西格列他钠单药浓度为16μm,铁死亡抑制剂ferrostatin-1(fer-1)(topscience,上海)浓度为2μm,西达本胺与西格列他钠联合组浓度为4μm+16μm(前者为西达本胺,后者为西格列他钠),西达本胺与西格列他钠联合组与铁死亡抑制剂组浓度为4μm+16μm+2μm(前者为西达本胺,中间为西格列他钠,后者为铁死亡抑制剂),其中对照组细胞用相同体积的dmso处理;将对应体积的药物或者dmso与上述96孔细胞培养板中的细胞轻微振荡混匀,在细胞培养箱中培养24h后用cck8试剂盒(mce,上海)检测细胞活力。
93.所得结果如图5a和图5b所示,表明铁死亡抑制剂ferrostatin-1(fer-1)能够回补
西达本胺联合西格列他钠对aml细胞株kg-1α与kasumi-1细胞增殖水平的抑制作用。
94.其次,取2
×
105对数生长期aml细胞株kg-1α与kasumi-1分别接种于24孔细胞培养板中;
95.设置西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组、对照组;实验组细胞的西达本胺单药浓度为4μm,对应的西格列他钠单药浓度为16μm,西达本胺与西格列他钠联合组浓度为4μm+16μm(前者为西达本胺,后者为西格列他钠),其中对照组细胞用相同体积的dmso处理;将对应体积的药物或者dmso与上述24孔细胞培养板中的细胞轻微振荡混匀,在细胞培养箱中培养24h,用10μm bodipy 581/591 c11(abclonal,武汉)在细胞培养箱中染色1h,4℃,300g离心5min收集细胞,pbs重悬后通过细胞流式检测检测kg-1α与kasumi-1细胞的脂质过氧化水平;
96.所得结果如图5c和图5d所示,表明西达本胺联合西格列他钠增强aml细胞株kg-1α与kasumi-1的脂质过氧化水平。
97.综上可得,西达本胺联合西格列他钠诱导aml细胞株kg-1α与kasumi-1发生铁死亡。
98.实施例5
99.西达本胺联合西格列他钠抑制aml细胞株中与铁死亡相关的xc-系统
100.操作方法为:首先,取2
×
105对数生长期aml细胞株kg-1α与kasumi-1分别接种于24孔细胞培养板中;
101.设置西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组、对照组;实验组细胞的西达本胺单药浓度为4μm,对应的西格列他钠单药浓度为16μm,西达本胺与西格列他钠联合组浓度为4μm+16μm(前者为西达本胺,后者为西格列他钠),其中对照组细胞用相同体积的dmso处理;将对应体积的药物或者dmso与上述24孔细胞培养板中的细胞轻微振荡混匀,在细胞培养箱中培养24h,4℃,300g离心5min收集细胞,pbs洗一次,最后通过gsh(还原性谷胱甘肽)检测试剂盒(abclonal,武汉)检测kg-1α与kasumi-1细胞的gsh生成水平;
102.所得结果如图6a和图6b所示,表明西达本胺联合西格列他钠抑制了aml细胞株kg-1α与kasumi-1的gsh生成水平。
103.其次,取1
×
106对数生长期aml细胞株kg-1α与kasumi-1分别接种于6cm细胞培养皿中;
104.设置西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组、对照组;实验组细胞的西达本胺单药浓度为2μm,对应的西格列他钠单药浓度为8μm,西达本胺与西格列他钠联合组浓度为2μm+8μm(前者为西达本胺,后者为西格列他钠),其中对照组细胞用相同体积的dmso处理;将对应体积的药物或者dmso与上述6cm细胞培养皿中的细胞轻微振荡混匀,在细胞培养箱中培养24h,4℃,300g离心5min收集细胞,取一半细胞用200μl ripa裂解液(thermo,usa)冰置裂解1h,提取总蛋白进行western blot,检测hdac3以及slc7a11的蛋白水平表达;
105.另一半细胞加500μl trizol试剂(transgen,北京),提取得到总rna,进一步用反转录试剂盒(transgen,北京)进行反转录实验得到总cdna,最后设计引物进行rt-pcr检测slc7a11基因在mrna水平的表达。
106.图6c和图6d为aml细胞株kg-1α与kasumi-1中slc7a11基因在mrna水平的表达,表明西达本胺联合西格列他钠抑制了slc7a11基因mrna水平的表达;
107.图6e和图6f为western blot检测结果,表明西达本胺联合西格列他钠抑制了aml细胞株kg-1α与kasumi-1中hdac3以及slc7a11的蛋白表达;
108.综上,西达本胺联合西格列他钠诱导aml细胞株kg-1α与kasumi-1中与铁死亡相关的xc-系统。
109.实施例6
110.西达本胺联合西格列他钠体内aml成瘤进程
111.具体操作方法如下:
112.(1)设置对照组、西达本胺单药组、西格列他钠单药组、西达本胺与西格列他钠联合组,其中,西达本胺和西格列他钠用0.5%的羧甲基纤维素钠配成悬浊液使用。
113.(2)构建cdx小鼠模型
114.通过慢病毒法稳定转染法将plv-luciferase-gfp质粒(厦门大学医学院血液学研究所提供)转染到kg-1α细胞株中,并构建稳定表达荧光素酶luciferase的kg-1α细胞。取1
×
106对数生长期的luciferase-gfp-kg-1α并通过尾静脉注射到nod-prkdc-/-il2rg-/-(nsg)小鼠体内进行成瘤,建立cdx小鼠模型。
115.(3)注射约14天后开始给药,西达本胺剂量为10mg/kg/day,西格列他钠剂量为10mg/kg/day,连续给药14天,通过活体成像系统检测小鼠成瘤进展,并且以给药起始日记为0天,统计实验结果及小鼠存活率。其中nsg小鼠购自厦门大学实验动物中心,并且由实验动物中心饲养。
116.所得结果如图7a和图7b所示,表明西达本胺联合西格列他钠抑制了cdx模型的成瘤进程,并且显著改善cdx模型的生存率。
117.申请人声明,本发明通过上述实施例来说明本发明的一种预防和/或治疗急性髓系白血病的联合用药物组合物及其应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
118.以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
119.另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1