氟比洛芬酯脂肪乳注射液制备工艺的制作方法
1.本发明涉及注射液生产技术领域,具体涉及氟比洛芬酯脂肪乳注射液制备工艺。
背景技术:
2.氟比洛芬酯是一种非甾体类静脉注射靶向镇痛药物,是氟比洛芬的酯类前体药物。相比于氟比洛芬,氟比洛芬酯可通过静脉注射避免了口服引起胃黏膜损伤等不良反应,具有作用持久、选择性强,起效时间短,不影响患者苏醒等优点,广泛应用于临床炎症性疼痛、癌痛及术后疼痛的治疗。
3.脂肪乳注射液为非均相液体制剂,属于热力学不稳定体系。在制备过程中,若乳粒分布不均匀,zeta电位绝对值低,再加上高温灭菌,可能会出现破乳、分层等现象,破乳后部分主药进入水中会导致含量降低;在长期放置的过程中易出现粒径增大、乳滴团聚等现象,不易储存。
4.现有的氟比洛芬酯脂肪乳注射液的制备工艺为分别制备呈水相和油相,然后将水相和油相混合制成初乳,然后将初乳经过高压均质获得氟比洛芬酯脂肪乳注射液,由于氟比洛芬酯脂肪乳注射液为人体静脉注射,理论上要求氟比洛芬酯脂肪乳注射液的粒径越小越好(小于500nm范围内),且ph值应当尽可能符合人体需要(弱酸性)。
5.在现有技术中,常采用均质机进行初乳的均质处理,虽然对设备要求不高,但是易导致粒径偏大,乳粒分布较宽,zeta电位绝对值较低。为了满足氟比洛芬酯脂肪乳注射液的粒径小且分布均匀,在均质时通常采用微射流匀化,不但粒径满足要求,且该方法制得样品质量稳定。另,现有技术在氟比洛芬酯脂肪乳注射液的生产过程中很难将ph控制在弱酸性,往往需要后期调节,后期调节ph值可能引入杂质和污染样品,易降低氟比洛芬酯脂肪乳注射液的安全性。
技术实现要素:
6.本发明的目的在于提供氟比洛芬酯脂肪乳注射液制备工艺,通过本发明所述工艺制备的氟比洛芬酯脂肪乳注射液的zeta电位绝对值较高,产品质量稳定,平均粒径、ph值均能符合人体需要,且该工艺能缩短配制时间,降低了污染风险、且有利于产品稳定。
7.本发明通过下述技术方案实现:
8.氟比洛芬酯脂肪乳注射液制备工艺,包括以下步骤:
9.s1、将甘油和磷酸氢二钠采用注射用水搅拌溶解,加注射用水至配制量的60%~80%,采用枸橼酸调节ph值至5.5~6.5,并将温度控制在63
±
2℃,作为水相;
10.s2、将大豆油、氟比洛芬酯和蛋黄卵磷脂混合搅拌溶解,将温度控制在68
±
2℃,作为油相;
11.s3、在搅拌状态下,将步骤s2配制的油相加入步骤s1配制的水相中配制成乳液,定重至全量,搅匀,乳液温度控制在55~70℃;
12.s4、采用高压微射流对步骤s3获得的乳液进行匀化均质,匀化压力为20000psi,匀
化3次,匀化温度为35~50℃;
13.s5、将匀化后药液经过滤、灌装、121℃*15min灭菌制得成品。
14.本发明中的20000psi相当于1379bar(1bar≈14.5psi),1bar就是一个大气压力。
15.本发明的水相不含蛋黄卵磷脂,即本发明的配制过程中将蛋黄卵磷脂规制在油相中,使得水相可以采用0.22μm聚醚砜滤芯进行过滤,去除细菌微生物等,使得制备的产品更安全,蛋黄卵磷脂在水相中不易溶解,如果将其规制在水相中,导致水相不能采用0.22μm聚醚砜滤芯进行过滤。
16.本发明通过在步骤s1是将水相的ph值控制在5.5~6.5,结合后续的步骤s2、步骤s3和s4,能够确保灭菌后的乳液的ph值在6.0~6.5,符合人体需要。
17.本发明通过将水相的温度控制在63
±
2℃、油相升温在68
±
2℃,不仅能够确保水相、油相的稳定性,且初乳通过将油水相混合比例为1:5~1:7、初乳液温度控制在55~70℃,形成了较稳定初乳液,为实现均质后粒径符合人体静脉注射需要提供了有利条件。通过采用高压微射流均质,实现灭菌后乳液粒径在200nm左右,90%粒子≤260nm,ph值为6.0~6.5,zeta电位为-50mv左右,产品质量稳定,适合人体静脉注射。
18.因此,通过本发明所述工艺制备的氟比洛芬酯脂肪乳注射液的粒径,zeta电位、ph值等质量稳定,均能符合人体需要。
19.进一步地,步骤s4中,每次匀化后将乳液由微射流转入周转罐中,然后将乳液温度冷却至35~50℃后再转入高压微射流进入下一次匀化。
20.进一步地,步骤s4中,最后一次匀化前,将乳液冷却至35~50℃。
21.进一步地,步骤s4中,最后一次匀化后,将乳液冷却至30
±
5℃。
22.进一步地,步骤s4中,第一次匀化后,对乳液进行溶氧检测;目的是取得溶解氧数据证明注射用水和前面的控氧操作没有问题,如果检测溶氧不合格,可以使用充氮来降低溶解氧水平。
23.进一步地,步骤s1中,水相采用过滤器进行过滤,所述过滤器为0.22μm的聚醚砜滤芯筒式滤器。
24.进一步地,油相与水相的混合比例为1:5~1:7。
25.优选地,油相与水相的混合比例为1:6。
26.进一步地,整个配制过程中进行氮气保护,控制溶氧小于2mg/l、残氧小于2%。
27.进一步地,步骤s4中,匀化温度为35~40℃。
28.进一步地,步骤s5中,匀化后药液经过3μm滤芯过滤。
29.本发明与现有技术相比,具有如下的优点和有益效果:
30.1、本发明的制备工艺,相比现有的高压均质技术,实现了高压制备,降低了均质次数,减少生产配制时间,降低了污染风险、且有利于产品稳定。
31.2、本发明的制备工艺制备的氟比洛芬酯脂肪乳注射液的平均粒径在200nm左右,90%粒子≤260nm,zeta电位为-50mv,zeta电位绝对值越高,体系越稳定,即溶解或分散可以抵抗聚集。整个工艺流程下来ph值在6.0~6.5之间,无需额外再调节ph值,提高了安全性。
32.3、本发明通过将蛋黄卵磷脂加入至油相,蛋黄卵磷脂作为表面活性剂略偏亲油性,加至油相更稳定,且水相可以采用0.22μm聚醚砜滤芯进行过滤,可去除细菌微生物等,
使得制备的产品更安全。
33.4、本发明通过控制油水相比例范围来提升氟比洛芬酯的包封率,使得氟比洛芬酯降解减少,同时提升了产品的安全性。
具体实施方式
34.为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
35.实施例1:
36.氟比洛芬酯脂肪乳注射液制备工艺,包括以下步骤:
37.s1、将甘油和磷酸氢二钠,采用注射用水搅拌溶解,加注射用水至配制量的70%,采用枸橼酸调节ph值至5.5~6.5,并将温度控制63
±
2℃,作为水相;
38.具体地:
39.配制罐1中加入1万ml的注射用水,在充氮气条件下,投入甘油(供注射用)1100g、磷酸氢二钠(na2hpo4)和枸橼酸适量,开启搅拌,搅拌频率为10~20hz,搅拌5~10min。关闭投料口,抽真空至-0.06mpa以下,再充氮气,如此反复进行3次以上,最后用氮气保持正压。开启氮气,将配制罐1内的溶液,经筒式滤器(聚醚砜滤芯,0.22μm)过滤到配制罐2,水相溶液转移完后,用注射用水淋洗配制罐1,洗液转移至配制罐2,加注射用水定容至3.5万ml,温度控制在61~65℃,必要时,加枸橼酸调节ph值至5.5-6.5,水相待用。
40.s2、将大豆油、氟比洛芬酯和蛋黄卵磷脂混合配制成油相,将油相升温至66~70℃;
41.具体地:
42.在氮气保护下,油罐加入大豆油5000g、氟比洛芬酯500g、蛋黄卵磷脂600g,关闭投料口,抽真空至-0.06mpa以下,再充氮气,如此反复进行3次以上,最后用氮气保持正压。开启搅拌(搅拌器频率为10~30hz),升温至66~70℃,搅拌10~20分钟,油相待用。
43.s3、初乳配制:在搅拌状态下,将步骤s2配制的油相加入步骤s1配制的水相中配制成乳液,油水相混合比例为1:6,乳液温度控制在55~65℃;
44.具体地:
45.开启配制罐2搅拌(搅拌器频率为10~30hz),用氮气将油相压入配制罐2中,转移结束后,用约2000ml注射用水淋洗油罐,淋洗水用氮气压入配制罐2中,继续搅拌5~10min制得初乳,加注射用水至5万ml,搅拌1~2min混匀。温度控制在55~65℃,待微射流匀化。
46.s4、微射流匀化:采用微射流对步骤s3获得的乳液进行匀化,均化压力为20000psi,匀化3次,温度为35~40℃。
47.在本实施例中,为了进一步控制匀化后乳液的质量:
48.步骤s4中,匀化压力为20000psi,匀化3次,每次匀化后将乳液由高压微射流转入周转罐中,然后将乳液温度冷却至35~40℃后再转入高压微射流进入下一次匀化。
49.步骤s4中,第1次匀化后,对乳液进行溶氧检测,确保溶氧小于2mg/l。
50.步骤s4中,最后一次匀化后,通过热交换器将乳液冷却至30
±
5℃。
51.s5、药液经过3μm滤芯过滤、灌装,灭菌条件为121℃、15min,制得成品。
52.整个配制过程中控制溶氧小于2mg/l、残氧小于2%。
53.具体地:
54.配制用管道及容器的残氧处理:配制系统(油罐、配制罐1、配制罐2)、均质系统(周转罐)和灌装系统(静置罐)整套系统在清洗后对管道和容器进行残氧处理,最后用氮气保持正压备用。
55.实施例2:
56.本实施例基于实施例1,与实施例1的区别在于:
57.步骤s3中乳液温度控制在65~70℃,步骤s4中乳液匀化温度为40~50℃,其余与实施例1一致。
58.对比例1:
59.本对比例基于实施例1,与实施例1的区别在于:
60.步骤s1中水相温度控制在50~60℃,步骤s2中油相温度控制在50~60℃,步骤s3中乳液温度控制在65~70℃,步骤s4中乳液匀化温度为25~35℃,其余与实施例1一致。
61.对比例2:
62.本对比例基于实施例1,与实施例1的区别在于:
63.步骤s4中采用高压均质机对步骤s3获得的乳液进行连续高压均质,在均质压力为750/75bar的条件下均质为5次和在均质压力为150/75bar的条件下均质2次。
64.对上述实施例1-实施例2,对比例1-对比例2所得的氟比洛芬酯脂肪乳注射液的关键指标进行检测,结果如表1所示:
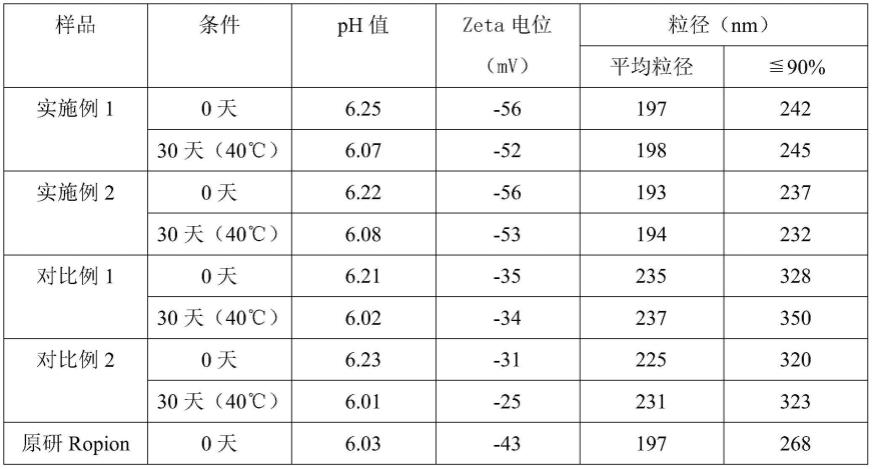
65.表1
[0066][0067]
由表1可知:
[0068]
1)、对本实施例1和实施例2制备的氟比洛芬酯脂肪乳注射液进行粒径、zeta电位和ph值检测,检测结果为:平均粒径为180~210nm,90%粒子≤260nm,zeta电位为-45~60mv,ph值为6.0~6.5。水相温度控制在61~65℃,油相温度控制在66~70℃,初乳液温度控制在55~70℃,s4匀化温度为35~50℃时,制备样品粒径及分布、zeta电位无明显差异。在本发明的温度控制范围的前提下,温度的变化对乳液的zeta电位、平均粒径及其分布无
明显影响,且产品质量稳定。
[0069]
2)、对对比例1制备的氟比洛芬酯脂肪乳注射液进行粒径、zeta电位和ph值检测,检测结果为:平均粒径为200~240nm,90%粒子≤360nm,ph值为6.0~6.5,zeta电位为-20~40mv。对照例1与实施例1、2数据对比可知,水相温度、油相温度、初乳和微射流匀化温度不在本发明范围内,产品的平均粒径更大且乳粒分布更宽,稳定性略差。
[0070]
3)、对对比例2制备的氟比洛芬酯脂肪乳注射液进行粒径、zeta电位和ph值检测,检测结果为:平均粒径为200~240nm,90%粒子≤330nm,ph值为6.0~6.5,zeta电位为-20~40mv。由对比例2与实施例1、2的数据对比可知:对比例制备乳液的粒径较大,分布较宽,稳定性差于实施例,即采用高压微射流进行均质处理时,明显提高了乳粒一致性、降低了乳液平均粒径,也增大了电位的绝对值,体系稳定性增加,故产品质量更稳定。
[0071]
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1