用于促进神经细胞修复与再生的EGCG与L-茶氨酸组合剂及其应用
用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂及其应用
技术领域
1.本发明涉及含茶有效成分的医药制品技术领域,尤其是涉及一种用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂及其应用。
背景技术:
2.目前,关于绿茶(camellia sinensis)及其核心功效成分表没食子儿茶素没食子酸酯(epigallocatechin ga11ate,egcg)与l-茶氨酸(l-theanine,n-ethy1-l-g1utamine)的神经保护作用的相关文献比较多,egcg与l-茶氨酸的分子结构式见图1。
3.egcg,表没食子儿茶素没食子酸酯,是一种黄酮类化合物,属于没食子酸酯化的黄烷-3-醇。egcg约占总儿茶素的50%左右,是茶多酚的主要代表性功能成分。近年来进行的广泛研究表明,绿茶对严重的慢性疾病如心血管和神经退行性病变,癌症,代谢综合征和2型糖尿病等表现出广泛的积极生物学活性,与egcg的强抗氧化剂和抗炎活性密切相关。egcg通过抑制集聚物毒性种子结构β-sheet形成,对蛋白质、磷脂类结构具有显著保护作用。egcg是靶向线粒体的药物,可调节线粒体代谢,包括线粒体生物发生,线粒体生物能学以及线粒体介导的细胞周期和凋亡。另外,egcg还能促进神经分化系细胞pc12神经轴突的生长。但是,egcg分子结构及其理化性质的局限限制了其功效和应用,主要表现在以下两方面:1)在人体生理条件下,egcg分子易被氧化,稳定性存在不足,生物利用率低,仅为2%~5%;体外的egcg也易受到温度、水、ph等因素的影响,尤其在液体环境中存放7天,其水解/降解率达到17%以上,即使在固体状态下,虽然稳定性相对会提高,但是对于温度较敏感,会在热环境下逐步降解,严重影响产品品质和egcg制剂/产品的开发,对于产品的制备、储存、流通等带来严重不良影响;2)egcg的味道非常苦涩,限制了其在医药食品方面的应用,消费者或患者直接口服时难以接受其苦涩味。
4.茶氨酸(l-theanine)为茶属植物中的特征性非蛋白质氨基酸,在茶(camelliasinensis)中约占茶叶游离氨基酸总量的50%,赋予茶叶鲜甘滋味的重要物质基础,而且具有调节脑神经功能、安神镇静、促进记忆与学习行为、预防血管性痴呆和脑源性生长因子的作用等脑保护活性。茶氨酸能抑制谷氨酸受体,调节谷氨酰胺的细胞外浓度,增加谷氨酰胺和谷胱甘肽的细胞内浓度,从而减弱氧化损伤,具有神经保护作用。
5.现有技术报道了茶氨酸和egcg协同增效用于预防肥胖病和高胆固醇血症 (参见,刘宝贵,陈致印,张杨玲,刘恩硕,韩淑敏,肖文军.l-茶氨酸与表没食子儿茶素没食子酸酯预防肥胖及高胆固醇血症的协同调节作用[j].食品工业科技,2022,43(03):341-350.),以及协同清除2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐(abts)、1,1-二苯基-2-三硝基苯肼(dpph)和羟自由基,进而达到对细胞氧化损伤的协同保护和修复作用(参见,刘晓慧,揭国良,林康,吴媛媛,王岳飞,屠幼英.egcg和茶氨酸对细胞氧化损伤的协同保护和修复作用研究[j].茶叶科学,2014,34(03):239-247.),但现有技术并没有公开利用茶氨酸和egcg同时用于神经细胞修复与再生的相关报道。
[0006]
蛋白毒性应激,线粒体功能障碍和基因组不稳定性等导致的细胞功能亢奋性,被认为是细胞衰老的主要普遍驱动力,与动脉粥样硬化、ⅱ型糖尿病、骨质疏松症和老年痴呆等老年退行性疾病的发生发展密切相关。细胞在各种应激条件下,促进mtor或者其它生长因子敏感的生长刺激通路,使细胞功能依然保持亢奋状态。衰老细胞的基因组和表观基因组受损伤后,主要通过nf-κb转录生成大量的衰老相关分泌物,向细胞外分别白介素、生长因子、蛋白酶、细胞因子、基质降解酶和金属蛋白酶类等,介导胰岛素抵抗,细胞信号反馈受阻,加速邻近细胞的衰老,介导衰老表观形态的形成。病理性aβ是神经毒性最强的形式,聚集率最高;目前有不少能够有效抑制aβ形成的药物,临床研究并没有效果。最开始的研究仅在细胞外基质内发现aβ淀粉样斑块。新的研究显示,在细胞内高尔基体、内质网和线粒体上也存在低水平的淀粉样斑块。神经细胞轴突中含有丰富的线粒体,在β-淀粉样蛋白应激下,很容易导致神经细胞和神经轴突退行性改变。细胞内积累大量有害和错误折叠的蛋白质,使信号反馈受阻,激活衰老基因的表达,加速细胞的衰老。
[0007]
因此,基于egcg和l-茶氨酸的理化特性,将egcg和l-茶氨酸共同用于神经细胞修复与再生的研究,对阿尔茨默病(ad)等神经系统退行性疾病的预防与治疗具有显著意义。
技术实现要素:
[0008]
本发明要解决的技术问题是:克服现有技术的不足,提供一种采用天然组分、组分简单且相互之间具有协同增效的用于促进神经细胞修复与再生的egcg 与l-茶氨酸组合剂,及将用于促进神经细胞修复与再生的egcg与l-茶氨酸用于制备预防/治疗神经系统退行性疾病疾病药物/食品的应用。
[0009]
本发明解决其技术问题所采用的技术方案之一是:
[0010]
用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,其主要活性成分包括egcg和l-茶氨酸,所述egcg的含量为10~50μmol/l(以下μmol/l 均简写为μm)或0.458~22.9μg/g;l-茶氨酸的含量为10~100μmol/l(液体制剂) 或1.74~17.42μg/g(固体制剂),所述egcg抑制淀粉样蛋白aβ
25-35
应激和炎症,降低淀粉样蛋白aβ
25-35
应激对茶氨酸保护细胞活性的干预,与茶氨酸协同靶向调控细胞周期,使神经细胞在淀粉样蛋白应激下保持静息态,促进细胞活力和轴突生长,并保持细胞蛋白的高保真结构。
[0011]
本发明用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,egcg 和l-茶氨酸通过抑制淀粉样蛋白应激、抗炎、保护线粒体、促进能量代谢等多靶点作用对淀粉样蛋白应激下的分化神经细胞具有修复和再生作用,二者表现显著的协同作用。具体表现为:egcg主要抑制淀粉样蛋白应激,l-茶氨酸主要作用于dna和rna等遗传物质,在egcg抑制淀粉样蛋白应激和炎症、促进新陈代谢的前提下,l-茶氨酸发挥对分化神经细胞的滋养作用,二者协同靶向调整细胞周期,使细胞处于静息态,具有促进细胞活力和轴突生长作用。
[0012]
在某一示范实施例中,egcg与l-茶氨酸的含量均为50μm。
[0013]
发明人通过实验发现,egcg用于孵育神经分化系细胞pc12,其浓度在 50μm内,对细胞活力影响不显著,但当egcg浓度达到100μm时,egcg具有显著降低细胞活力的作用;100μm浓度范围内的l-茶氨酸呈浓度依赖性促进细胞生长(即,浓度越高,对细胞的生长促进作用相应增强)。在aβ
25-35
应激条件下,随着egcg浓度增加,egcg显著抑制了aβ
25-35
对细胞活力的损伤,使细胞活力显著增加;茶氨酸没有抑制aβ
25-35
对细胞活力损伤的保护作用,但 50μm
茶氨酸对50μm的egcg抑制aβ
25-35
对细胞活力的损伤有显著的协同增强功效。
[0014]
所述egcg与l-茶氨酸组合剂还包括表没食子儿茶素(egc)、表没食子酸酯(ecg)或表儿茶素(ec)中的一种或多种egcg的衍生物,表没食子儿茶素(egc)、表没食子酸酯(ecg)或表儿茶素(ec)与egcg的配比可参考绿茶中各成分的比例进行配制。
[0015]
所述egcg与l-茶氨酸组合剂为绿茶(绿茶冲泡茶水)或绿茶提取物固体饮料。
[0016]
本发明解决其技术问题所采用的另一技术方案是:
[0017]
用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂在制备预防/治疗神经系统退行性疾病的药物/食品中的应用。
[0018]
用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂通过抑制淀粉样蛋白应激、下调aβ
25-35
应激导致的有丝分裂原/营养感应途径,调控细胞周期、促进轴突生长和静息态、上调aβ
25-35
应激条件下细胞sirt1和p-ampk表达水平、 egcg和茶氨酸同时下调p-mtor水平、抑制ldh生成、促进atp生成中的一种或多种途径的组合促进神经细胞的修复与再生,达到预防/治疗神经系统退行性疾病。
[0019]
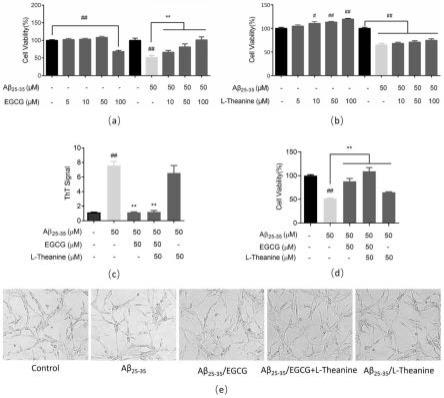
所述食品为绿茶或含egcg与l-茶氨酸组合剂的固体饮料,所述绿茶的用量为5~10g/天/人,确保体内获取的egcg和茶氨酸的含量足够对神经细胞产生修复与再生的作用,进而延缓神经细胞的衰退或凋亡,达到预防/治疗阿尔茨默病(ad)等神经系统退行性疾病的目的。
[0020]
本发明用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂的有益效果:
[0021]
1)egcg和l-茶氨酸通过抑制淀粉样蛋白应激、抗炎、保护线粒体、促进能量代谢等多靶点作用,尤其,当在egcg与淀粉样蛋白结合,促进细胞静止修复的前提下,l-茶氨酸进入细胞发挥神经元营养,促进轴突生长,对淀粉样蛋白应激下的分化神经细胞具有修复和再生作用,二者表现显著的协同作用。
[0022]
2)egcg和egcg+l-茶氨酸具有靶向抑制aβ
25-35
的β-sheet(all+)结构形成活性,显著促进细胞活性。
[0023]
3)egcg与l-茶氨酸的组合,有助于保护egcg不降解,提高egcg在体内的稳定性,促进egcg与aβ
25-35
的结合,从而增强egcg抑制淀粉样蛋白的应激作用,相应地减少egcg进入细胞的浓度,同时促进茶氨酸进入细胞发挥细胞保护作用;促进aβ
25-35
应激条件下nrf2/keap1的稳定结合,提高细胞内源性抗氧化作用。
[0024]
4)egcg与l-茶氨酸组合剂,其中egcg与l-茶氨酸具有dna保护作用,通过显著抑制细胞周期蛋白d1(cyclin d1)和细胞周期蛋白b1(cyclin b1) 的表达,并促进gap43的蛋白表达,下调aβ
25-35
应激导致的有丝分裂原/营养感应途径,调控细胞周期,进而使淀粉样蛋白应激下的神经细胞静息态、并促进神经细胞轴突生长。
[0025]
5)茶氨酸通过抑制ldh生成,egcg通过促进atp生成,两者通过不同的保护机制保护神经细胞的线粒体,具有显著的协同增效作用。茶氨酸上调 aβ
25-35
应激条件下细胞sirt1和p-ampk表达水平(p《0.01),egcg和茶氨酸同时下调p-mtor水平,协同促进神经细胞的能量代谢。
[0026]
6)该egcg与l-茶氨酸组合剂,对aβ
25-35
诱导神经分化系细胞pc12的细胞ad模型,能有效减缓轻度至中度受影响患者的ad进展,进而有效预防或治疗神经系统退行性疾病,对绿茶茶叶功能成分的开发与利用具有显著意义。
位点淀粉样蛋白裂解酶-1;aβ42:淀粉样蛋白1-42;il-6:白细胞介素6;nf-kb:核因子kappa-b;mtor:雷帕霉素的哺乳动物靶点;p-mtor:雷帕霉素的磷酸化哺乳动物靶标;sirt1: sirtuin1;ups:泛素结合蛋白;4-hne:4-羟基壬烯醛;rage:晚期糖基化终产物的受体;p62:螯合体1;sasp:衰老相关的分泌表型。
具体实施方式
[0037]
以下结合附图及实施例对本发明作进一步说明。
[0038]
本发明实验所需材料:egcg(≥99%)和l-茶氨酸(≥99%)均购自sigma-aldrich(st louis,mo,usa)。神经分化系细胞pc12细胞从细胞库(中国北京)订购。二抗(abcam),anti-gapdh、anti-histone h3、anti-cyclind1、 anti-cyclinb1、anti-il6、anti-ampk、anti-mtor、anti-sirt1、anti-nf-κb、 anti-nrf2、anti-keap1从cell signaling technology采购;用于westem blot分析的一抗:anti-klotho(novusbio),both rage andβ-amyloid(santa cruz biotechnology),anti-p62(epitomics)、anti-4-hne(millipore)、anti-multi ubiqutin mab(mbl)。western化学发光辣根过氧化物酶底物购自thermo fisher scientific。蛋白酶抑制剂混合物(beyotime)、bca蛋白质测定试剂(thermo fisher scientific)和放射免疫沉淀测定(ripa)裂解缓冲液(keygen biotech)。
[0039]
申请人对egcg与l-茶氨酸用于促进神经细胞修复与再生的浓度进行了筛选实验,具体如下:
[0040]
1)aβ
25-35
蛋白样品的孵育与制备
[0041]
aβ
25-35
是脑神经细胞外出现的β-淀粉样蛋白的毒性片段,不同处理组aβ
25-35
、 aβ
25-35
/egcg、aβ
25-35
/l-茶氨酸(茶氨酸)、aβ
25-35
/egcg+l-茶氨酸的孵育母液方法如下:egcg或l-茶氨酸浓度为1mm分别与1mm的aβ25-35混合,在37度培养箱中孵育7天,加入细胞使用前稀释20倍。协同研究处理组也用相应的孵育和配制方法,最后用于协同作用研究的浓度为aβ
25-35
50μm,50μm aβ
25-35
/50μm egcg、50μm aβ
25-35
/50μm l-茶氨酸和50μm aβ
25-35
/50μm egcg+50μm l-茶氨酸。下文中,50μm aβ
25-35
、50μm aβ
25-35
/50μm egcg、 50μm aβ
25-35
/50μm l-茶氨酸和50μm aβ
25-35
/50μm egcg+50μm l-茶氨酸分别简称为aβ
25-35
、aβ
25-35
/egcg、aβ
25-35
/l-茶氨酸和aβ
25-35
/egcg+l-茶氨酸。
[0042]
2)细胞培养
[0043]
神经分化系细胞pc12用含有10%fetal bovine serum(fbs)的dulbecco's modified eagle medium(dmem)(cromwell,ct,usa)的高糖培养基培养于细胞培养箱中,温度为37℃,空气含量为95%(v/v),co2含量为5%(v/v),细胞培养期间2d换液1次。
[0044]
2.1egcg或l-茶氨酸浓度孵育pc12细胞
[0045]
配制egcg或l-茶氨酸浓度为1mm,加入细胞使用前分别稀释10、20、 100或200倍,获得100μm、50μm、10μm、5μm的egcg或l-茶氨酸。当细胞融合至60-70%左右,分别加入不同浓度的egcg或l-茶氨酸,再继续在细胞培养箱中培养24h。
[0046]
2.2egcg或l-茶氨酸与aβ
25-35
共同孵育pc12细胞
[0047]
当细胞融合至60-70%左右,加入1)aβ
25-35
蛋白样品的孵育与制备中制备的 aβ
25-35
蛋白样品,分为control、aβ
25-35 50μm模型组、茶叶成分egcg或l-茶氨酸分别与50μm aβ
25-35
共孵育的处理组,继续在细胞培养箱中培养24h。
[0048]
3)药物处理及mtt分析
[0049]
将神经分化系细胞pc12按104/孔的密度接种于96孔细胞培养板中,按照2) 进行细胞培养。24h后弃除培养液,加入现配好的 3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyltetrazole ammonium bromide(mtt) (sigma aldrich,st louis,mo,usa)溶液100μl/孔,培养箱内孵育4h后吸除上清,加入dmso150ml/孔。摇床上恒温(37℃)震荡10min使细胞内晶体完全溶解,酶标仪检测od值(oa
570nm
),计算各组的细胞相对活力。细胞相对活力通过 mtt比色法检测细胞活力,并按百分比计算。
[0050]
4)tht荧光探针检测分析
[0051]
将10μl等分试样的aβ
25-35
溶液(1mm)与90μl tht(80μg/ml)在 tbs中混合,使用荧光板读数器(biotek)在λex和λem分别测量440nm和 485nm处的荧光值。
[0052]
5)透射电镜检查
[0053]
将标本切成1x1x3 mm3大小,用millonig磷酸盐缓冲液(ph=7.3)双重固定,在2.5%戊二醛溶液中,在环境温度下过夜运送到湖南长沙湘雅医院病理科 tem实验室,并采用3%醋酸双氧铀和硝酸铅双染色标本后,在日立ht-7700电子显微镜上检查和拍照。
[0054]
不同浓度的egcg孵育pc12细胞24h,mtt检测结果如附图2(a)所示, egcg在50μm浓度范围内,对细胞活力影响不显著,在100μm浓度时egcg 具有显著降低细胞活力的作用(p﹤0.01)。在aβ
25-35
致pc12细胞损伤模型中,与control组相比,aβ
25-35
处理组细胞活力下降近50%,aβ
25-35
/egcg处理组随着egcg浓度增加,细胞活力显著增加,在100μm时基本与control组细胞活力一致(p﹤0.01)(参见图2(a))。
[0055]
不同浓度的l-茶氨酸孵育pc12细胞24h,mtt检测结果如附图2(b)所示,不同浓度的l-茶氨酸直接孵育pc12细胞24h,100μm浓度范围内的l-茶氨酸呈浓度依赖性促进细胞生长,即,茶氨酸浓度越高,对pc12细胞的生长促进作用越强。在aβ
25-35
应激条件下,l-茶氨酸对细胞活性的保护作用较弱甚至无保护作用,说明aβ
25-35
淀粉样蛋白毒性对茶氨酸保护细胞活性有显著的负面、干预作用(参见图2(b))。以上结果表明,egcg在高浓度时对细胞表现一定毒性,但在aβ
25-35
毒性应激条件下,egcg呈浓度依耐性促进细胞活性,而l
‑ꢀ
茶氨酸与egcg呈现相反的趋势。
[0056]
tht荧光探针与富含β-sheet结构的分子相结合发出荧光,tht荧光探针是一种较为理想的检测淀粉样蛋白集聚体的方法,50μm egcg、50μm l-茶氨酸和50μm egcg+50μm l-茶氨酸分别与50μm aβ
25-35
混合后,在37℃孵育7d,利用tht荧光探针检测不同孵育组aβ
25-35
蛋白的β-sheet(all+)结构含量,其结果如附图2(c)所示。结果表明,aβ
25-35
组tht荧光值极显著增加(p﹤0.01),比空白对照组增加约8倍;aβ
25-35
/egcg与aβ
25-35
/egcg+l-茶氨酸的tht荧光值极显著下降(p﹤0.01),与control组荧光值基本一致;而aβ
25-35
/l-茶氨酸的tht荧光值与aβ
25-3
组没有显著差异(参见2(c))。egcg与aβ相互作用,明显形成小的非结构化aβ聚集体。结果表明egcg和egcg+l-茶氨酸具有靶向抑制aβ
25-35
的β-sheet(all+)结构形成活性,而l-茶氨酸抑制活性不显著。
[0057]
参见图2(d)和2(e),孵育好的不同aβ
25-35
蛋白样品分别与神经分化系细胞pc12孵育24h,mtt实验结果表明,与aβ
25-35
处理组相比,aβ
25-35
/egcg、 aβ
25-35
/egcg+l-茶氨酸和aβ
25-35
/l-茶氨酸表现显著促进细胞活性作用,其中, aβ
25-35
/egcg+l-茶氨酸组的细胞活力最强,活性优于对照组,且aβ
25-35
/egcg+ l-茶氨酸对细胞活性的促进作用也显著优于a
β
25-35
/egcg、aβ
25-35
/l-茶氨酸,说明egcg和l-茶氨酸对aβ
25-35
蛋白干预的pc12细胞活性的促进作用存在显著的协同增效作用。
[0058]
综上所述,茶氨酸可以在正常条件下呈浓度依赖性促进细胞生长。egcg 可以显著靶向抑制aβ
25-35
的毒性结构β-sheet(all+)形成活性,且egcg和l
‑ꢀ
茶氨酸组合后,egcg与淀粉样蛋白结合,抑制淀粉样蛋白应激和炎症,进而去除淀粉样蛋白aβ
25-35
对茶氨酸促进神经细胞生长作用的干预,促进茶氨酸对神经细胞的修复与再生。在淀粉样蛋白毒性应激条件下,egcg和l-茶氨酸对神经细胞的修复与再生有显著的协同增效作用。
[0059]
申请人基于egcg和茶氨酸对正常pc12细胞活性的作用效果,以及在 aβ
25-35
处理的pc12细胞活性的促进效果,初步确定了用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂中,egcg的浓度为的含量为10~50μmol/l(以下μmol/l均简写为μm)或0.458~22.9μg/g;l-茶氨酸的含量为10~100μmol/l (液体制剂)或1.74~17.42μg/g(固体制剂),进而确保该egcg与l-茶氨酸组合剂对神经细胞修复与再生的作用效果。
[0060]
实施例1
[0061]
本实施例的用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,其主要活性成分包括egcg和l-茶氨酸,所述egcg与l-茶氨酸的含量均为 50μm。
[0062]
申请人对egcg与l-茶氨酸对神经细胞的协同作用机理及效果做了深入研究分析,具体实验方法如下:
[0063]
①
流式测定细胞周期与凋亡实验
[0064]
将细胞以6
×
105密度接种于直径为10cm的培养皿种,按照2)中方法培养细胞。弃掉培养液,用预冷pbs洗两遍,细胞周期测定步骤如下:加入2ml 浓度70%的乙醇,涡旋混匀细胞,在-20℃孵育2h,离心去除乙醇,pbs清洗2 次,将细胞分至5ml流式细胞仪检测管,加入500μl pi/rnase染色缓冲液,混匀细胞,室温避光孵育15min,保存在4℃,1h内通过流式细胞仪检测。细胞凋亡测定步骤如下:加入1
×
的细胞结合缓冲液,将细胞分至5ml流式细胞仪检测管,每管1
×
105个细胞,加入fitc annexin v和pi染料各5μl,室温避光孵育15min,每管加入400μl 1
×
细胞结合缓冲液,1h内通过流式细胞仪检测。
[0065]
②
ftir红外光谱检测
[0066]
将细胞以6
×
105密度接种于直径为10cm的培养皿,按照2)中方法培养细胞。蛋白样品制备采用冷冻干燥法,-42℃,24h真空冷冻干燥,kbr放入烘箱 5h充分干燥去除水分。取约200mg kbr和2mg蛋白样品放入玛瑙钵中充分研磨,压片机压片制样。样品采用傅里叶变换红外光谱(ftir)进行检测。光谱范围为4000cm-1
至400cm-1
。以反射模式记录,光谱分辨率为4cm-1
。每个光谱累积64次扫描,酰胺i带位于1700cm-1-1600cm-1
,用于确定蛋清的二级结构,合成原始未处理光谱的光谱并使用omnic软件(thermonicolet)进行分析。
[0067]
③
线粒体膜电位测定
[0068]
线粒体膜电位检测采用荧光染料线粒体膜电位检测试剂盒(jc-1)染色试剂盒(碧云天生物技术研究院上海,中国)。将pc12细胞按5
×
104/孔的密度接种于24孔细胞爬片上,按照1.3进行细胞培养。弃掉培养液,用预冷pbs洗两遍,每孔加入300μl浓度为2μm的jc-1染料,于37℃,5%co2培养箱孵育30min。孵育结束后,吸除上清,用300μl的jc-1染色缓冲液(1
×
)清洗两遍,含dapi 的抗荧光猝灭剂封片,在荧光显微镜下观察。
[0069]
④
dapi荧光染色
[0070]
pbs避光漂洗3次,加适量dapi(1μg/ml)于切片上,保湿盒中避光复染2-3min;pbs避光漂洗3次,封片剂(甘油:pbs=1:1)封片,-20℃保存。
[0071]
⑤
乳酸脱氢酶细胞毒性检测(ldh cytotoxicity assay)
[0072]
乳酸脱氢酶细胞毒性检测是一种基于diaphorase催化的int显色反应,通过比色法检测细胞毒性时释放的乳酸脱氢酶活性值
31
。将pc12细胞按6
×
105/孔的密度接种于细胞培养皿中,按照1.3进行细胞培养。弃掉培养液,用pbs洗两遍,胰蛋白酶消化3min,离心(1000rpm,10min),收集细胞。加入500μl pbs,冰水浴中超声破碎四次(300w),每次3-5s,离心(4℃,2500rpm,10 min)收集细胞,严格按照试剂盒操作方法进行操作。
[0073]
⑥
atp检测试剂盒
[0074]
通常atp水平的下降表明线粒体的功能受损或下降
32
。3-(4,5-ripa lysate, protease inhibitor,adenosine triphosphate(atp)detection kit was purchased from (biyuntian biotechnology research institute shanghai,china).将pc12细胞按 1.5
×
105/孔的密度接种于6孔细胞培养板中,按照1.3进行细胞培养。弃掉培养液,用预冷pbs洗两遍,每孔加入200μl细胞裂解液,离心(4℃,12000rpm, 20min),收集上清,严格按照试剂盒操作方法进行操作。
[0075]
⑦
蛋白质印迹和酶联免疫(elisa)分析
[0076]
将pc12细胞按6
×
105/孔的密度接种于直径为10cm的培养皿中,按照1.3 进行细胞培养。弃掉培养液,用预冷的pbs清洗两遍,加入500μl含有1
×
cocktail (fermentas)和ripa缓冲液(普利莱)的裂解液,冰上裂解30min,每10min混匀一次,离心(4℃,12000rpm,20min)收集上清液保存在-80℃。用bca试剂盒(thermo)测定蛋白浓度,并采用sds-page分析等量样品(50μg)的蛋白。把经过电泳后的10%凝胶上的蛋白转移至硝酸纤维素膜上,然后用封闭液室温封闭1h,需缓慢摇荡。加入一抗,4℃过夜。室温下用tbst漂洗5min
×
5次,加入二抗,室温下孵育1h。用supersighnal westpico化学发光底物(pierce)显色 2min,曝光。另外,严格按照elisa试剂盒操作方法进行蛋白质的tnf-α表达量的检测。
[0077]
⑧
bodipy荧光染色
[0078]
pc12细胞以5
×
104/孔的密度接种于24孔细胞载玻片上,按照上述2)细胞培养和3)药物处理的实验方法进行培养。实验结束后,用pbs洗涤细胞两次,加入200μl/孔的固定剂10分钟。用pbs洗涤两次后,加入bodipy染色溶液 (invitrogen,usa)并在培养箱中培养30分钟。最后用荧光显微镜(zeiss, axio scope.a1)观察不同处理组细胞的染色情况。
[0079]
⑨
rna测序与基因表达分析
[0080]
收集不同处理组的细胞样品,每个处理组设置3个生物学重复。将样品送至华大bgi(深圳,中国)(www.genomics.cn)进行rna测序和基因表达分析。在对每个基因的表达水平进行标准化后,使用每千碱基转录物的片段数 (fpkm)计算每个基因的表达水平。在control、aβ
25-35
、aβ
25-35
/egcg、aβ
25-35
/l
‑ꢀ
茶氨酸、aβ
25-35
/egcg+l-茶氨酸的比较中(阈值|fold changes|≥2,p value≤0.05)。 tb tools用于绘制差异表达基因的热图。以基因本体(go)和京都基因与基因组百科全书(kegg)注释及其分类结果作为依据,将差异基因划分到不同类型的生物通路中去,使用r软件中的phyper函数进行富集分析,计算p value并进行fdr校正,当p value≤0.05时显著富集。利用search tool for the retrieval of interacting genes(string)数据库获取基因相互作用网络,并使用 cytosacpe3.7.2软件
对网络进行可视化和核心基因的筛选,对其主要功能进行分类。
[0081]
1)egcg和l-茶氨酸协同抑制淀粉样蛋白应激
[0082]
western-blotting分析表明,aβ
25-35
组,β-amyloid蛋白大量生成,4-hne积累,蛋白ups和p62修饰的蛋白增加,rage蛋白表达上调,nf-κb核转录水平增加约75%(p《0.01),tnf-α含量升高(p《0.01),淀粉样蛋白等集聚物形成和炎症通路显著上调,egcg与egcg+l-茶氨酸具有显著抑制作用,l-茶氨酸功效次之。
[0083]
nrf2/keap1是细胞内源性抗氧化信号通路。参见图3(a)和(b),aβ
25-35
组细胞nrf2蛋白核内/核外的表达水平比值显著降低(p《0.01),说明nrf2核转入显著降低,功能失调的nrf2在胞质中积累,aβ
25-35
/egcg与aβ
25-35
/egcg+l
‑ꢀ
茶氨酸处理组nrf2蛋白核转入水平显著增加(p《0.01);keap1蛋白在aβ
25-35
组中表达显著上调(p《0.01),而在其他处理中显著降低,说明了氧化应激状态下nrf2/keap1结合不稳定被释放出来,egcg、egcg+l-茶氨酸和l-茶氨酸促进aβ
25-35
应激条件下nrf2/keap1的稳定结合,提高细胞内源性抗氧化作用。
[0084]
β-折叠形成是淀粉样蛋白生成的关键早期步骤。收集不同处理组细胞样品进行冷冻干燥和红外光谱检测,1700-1600cm-1
红外吸峰谱及其拟合分析结果如图 3(c)所示,aβ
25-35
组细胞样品的红外吸峰向低波数转移,β-sheet结构(1640-1625 cm-1
)百分含量显著增加;egcg显著抑制β-sheet结构形成;而l-茶氨酸显著抑制aβ
25-35
的β-sheet结构形成,促进无序结构和α-helix结构的含量;由于egcg 与l-茶氨酸的组合,有助于保护egcg不降解,促进egcg与aβ
25-35
的结合,从而更好地抑制淀粉样蛋白的应激,aβ
25-35
/egcg+l-茶氨酸组的吸收峰和二级结构拟合峰几乎与control组一致。与其它组相比,aβ
25-35
组的无序结构(1640 cm-1-1648cm-1
)显著减少,其中aβ
25-35
/egcg+l-茶氨酸组细胞的无序结构含量最多,而aβ
25-35
/egcg+l-茶氨酸组的无序结构含量与control组基本一致。
[0085]
2)egcg和l-茶氨酸协同调控细胞周期、并促进轴突生长
[0086]
图4(a)所示的dapi核染色结果表明,aβ
25-35
组细胞细胞核发生了显著变化,形态不一,部分细胞核增大且高染;aβ
25-35
/egcg+l-茶氨酸组细胞核均匀,染色较浅,与对照组基本一致。即,aβ
25-35
组dna损伤较严重,egcg+l
‑ꢀ
茶氨酸具有dna保护作用。
[0087]
图4(d)和4(e)所示的细胞周期和凋亡检测结果表明,与control组相比, aβ
25-35
处理组s期有一定程度的增加,同时细胞凋亡显著增加,表明aβ
25-35
应激增加细胞丝裂源活性,使细胞处于亢奋状态,进一步诱导凋亡发生。与aβ
25-35
组相比,aβ
25-35
/egcg细胞g0期增加,细胞凋亡率减少约69%。aβ
25-35
/l-茶氨酸的细胞周期与细胞凋亡率几乎与aβ
25-35
处理组一致。aβ
25-35
/egcg+l-茶氨酸协同组s期百分含量大幅度增加,与对照组相比增加约57%,细胞凋亡率减少约46.4%。
[0088]
细胞周期蛋白d1(cyclin d1)和细胞周期蛋白b1(cyclin b1)分别是细胞周期g1和g2期的标志物,cyclin b1促使细胞进行g2/m期转变,cyclin d1 则调控细胞进行g1/s期转变,它们均是细胞周期的调节因子,在静息态的分化神经细胞中cyclin d1和cyclin b1的表达量较低,以防细胞周期再进入而对神经细胞具有伤害作用。gap43是一种神经特异性的蛋白质,参与神经细胞生长、突触发育形成和神经细胞再生。图4(b)和4(c)所示的western-blotting结果表明,与对照组相比,aβ
25-35
组的cyclin d1和cyclin b1表达增加,aβ
25-35
/egcg 和aβ
25-35
/egcg+l-茶氨酸具有显著抑制作用(p《0.01);而aβ
25-35
/l-茶氨酸组仅对cyclin b1具有显著抑制作用(p《0.01),对cyclin d1无效。aβ
25-35
组的神经轴突生长因子
gap43表达显著减少(p《0.01),aβ
25-35
/egcg+l-茶氨酸组和aβ
25-35
/l-茶氨酸组gap43的蛋白表达水平均显著上调(p《0.01)。
[0089]
参见图4(f),明场拍照与扫描电镜(sem)结果表明,与对照组相比,aβ
25-35
组胞体扁平,表面结构塌陷,轴突萎缩;与aβ
25-35
处理组相比,aβ
25-35
/egcg、 aβ
25-35
/egcg+l-茶氨酸和aβ
25-35
/l-茶氨酸均有一定改善作用,其中 aβ
25-35
/egcg+l-茶氨酸组细胞饱满,表面结构丰富,轴突粗壮且明显,这与mtt 结果相符(图2(d))。透射电镜(tem)结果表明,与正常组相比,aβ
25-35
组细胞的细胞膜表面和细胞内细胞器内有纤维状的集聚物(图4(f)红色箭头标注所示),细胞膜被破坏,细胞线粒体空泡化明显,细胞核异染色质集聚, aβ
25-35
/egcg+l-茶氨酸处理组细胞膜表面和细胞内没有检测到纤维状集聚物。
[0090]
根据图3和图4的实验结果推测,在egcg抑制aβ
25-35
细胞内外聚集的前提下,egcg+l-茶氨酸协同通过下调aβ
25-35
应激导致的有丝分裂原/营养感应途径,调控细胞周期,具有促进轴突生长和静息态的作用。
[0091]
3)egcg和l-茶氨酸协同促进细胞能量代谢
[0092]
由图5(a)和(b)所示的jc-1染色检测结果可知,aβ
25-35
组红色/绿色荧光强度比值显著减低(p《0.01),而aβ
25-35
/egcg、aβ
25-35
/l-茶氨酸与 aβ
25-35
/egcg+l-茶氨酸的比值显著增加(p《0.01),表明aβ
25-35
组线粒体膜电位下,茶叶活性成分处理组均显著增加,其中egcg+l-茶氨酸协同组线粒体膜电位均高于aβ
25-35
/egcg、aβ
25-35
/l-茶氨酸,即,egcg+l-茶氨酸相互之间对线粒体的保护作用有协同促进作用;egcg+l-茶氨酸协同组线粒体膜电位甚至高于对照组,对线粒体的保护作用极其显著。
[0093]
参见图5(c),培养液的ldh检测结果表明:与aβ
25-35
组细胞相比, aβ
25-35
/egcg+l-茶氨酸与aβ
25-35
/l-茶氨酸表现显著抑制ldh生成作用 (p《0.01)。图5(d)所示的atp检测结果表明,与aβ
25-35
组细胞相比, aβ
25-35
/egcg与aβ
25-35
/egcg+l-茶氨酸均极显著促进atp生成,分别增加约4 倍和6倍,而aβ
25-35
/l-茶氨酸没有表现活性。
[0094]
综上结果可知,egcg与茶氨酸在保护线粒体的机制存在较大差异,两者不同的作用机制互补,具有显著的协同增效作用。
[0095]
图5(e)所示的线粒体和能量代谢通路相关的蛋白质表达检测结果表明,与control组相比,aβ
25-35
组线粒体抗衰老因子klotho蛋白表达显著下降 (p《0.01)。egcg+l-茶氨酸对aβ
25-35
应激条件下的细胞klotho蛋白表达增加约65%(p《0.01),而egcg与l-茶氨酸单独作用基本无效。在热量限制时sirt1 和p-ampk蛋白高表达,而p-mtor低表达,与细胞能量代谢状态密切相关,并通过影响细胞物质代谢的多个环节维持细胞能量供求平衡。aβ
25-35
组细胞内 sirt1和p-ampk表达水平显著降低,p-mtor显著升高(p《0.01)。egcg+l
‑ꢀ
茶氨酸和l-茶氨酸显著上调aβ
25-35
应激条件下细胞sirt1和p-ampk表达水平 (p《0.01),egcg有效果,但不显著。egcg、l-茶氨酸和egcg+l-茶氨酸均下调p-mtor水平(p《0.01)。结果表明egcg和l-茶氨酸均能促进能量代谢,且egcg与l-茶氨酸表现一定协同性。结果表明,在aβ
25-35
应激条件下, egcg优先于淀粉样蛋白结合,而l-茶氨酸由于分子量小,亲水性强,优先进入细胞,l-茶氨酸上调热量限制样能量代谢通路功效优于egcg。
[0096]
4)egcg+l-茶氨酸对aβ
25-35
诱导的pc12细胞退行性变的转录组分析
[0097]
在不同处理组差异基因富集分析(|fold changes|≥2,qvalue≤0.05)基础上进行go分析,结果表明,与control组相比,aβ
25-35
组对转录、细胞增殖、炎症、老化、细胞外基质
等影响显著,其中在extracellular space共有24个显著差异基因,总体表现淀粉样应激对细胞内外具有广泛的影响(参见图6(a))。 aβ
25-35
/egcg组差异基因主要富集在细胞翻译、细胞外基质、伤口愈合、生长因子刺激和钙离子通路(血管生成的正向调节、对缺氧的反应、细胞外基质、细胞质、胞质溶胶、肌动蛋白丝结合)等(参见图6(b)),表现广泛的细胞内外作用;aβ
25-35
/l-茶氨酸组差异基因主要富集在与遗传物质dna或rna结合、细胞分化、胰岛素和促性腺激素的反应(转录活性的dna、skeletal musclecell differentiation、response to insulin、response to gonadotropin)等通路(参见图6(d));aβ
25-35
/egcg+l-茶氨酸组差异基因主要富集在转录活性的dna 或rna结合、促性腺激素、女性孕激素、细胞分化等(response to progesterone, female pregnancy,skeletal muscle cell differentiation和positive regulation of geneexpression等)(参见图6(c)),与aβ
25-35
/l-茶氨酸组比较相似。
[0098]
由于aβ
25-35
/l-茶氨酸组的degs较少,为了更全面观察通路互作关系,根据|fold changes|≥1.2and q(adjusted p value)≤0.05的筛选条件筛选degs进行互作关系ppi分析,其结果如图7所示:与control组相比,aβ
25-35
组的degs对代谢(脂质、碳水化合物、氨基酸和能量代谢)(图7(a)黄色块)以及遗传物质相关(细胞生长与死亡、细胞群落与内分泌系统、遗传信息加工、复制与修复、免疫系统等信号转导)(图7(a)绿色块)和炎症免疫系统(图7(a) 粉红色块)等通路影响显著。与aβ
25-35
组相比,aβ
25-35
/egcg的degs主要作用于抗炎(图7(b)粉红色块)、脂质和能量代谢途径(图7(b)黄色块)等网络;aβ
25-35
/l-茶氨酸的degs主要作用于细胞周期、免疫调节、dna和rna 等遗传物质(图7c绿色块)和免疫调节(图7(d),粉色块);aβ
25-35
/egcg+ l-theannie组(参见7(c)黄色、绿色和粉色块)在细胞周期、mapk、代谢、信号转导、遗传信息处理和轴突引导发育等通路互作性强,结合了aβ
25-35
/egcg 和aβ
25-35
/l-茶氨酸组的通路(参见7(b)和(d))特点。上述结果表明:egcg 与l-茶氨酸存在协同互促作用,且明确了egcg与l-茶氨酸的协作机制:在 aβ
25-35
应激条件下,l-茶氨酸发挥功效非常有限,而在egcg抑制aβ
25-35
应激前提下,l-茶氨酸能够充分发挥对细胞周期、免疫调节、dna和rna等遗传物质的影响。淀粉样蛋白应激介导的神经细胞退化是多方面作用的结果,而 egcg与l-茶氨酸的协同表现多靶点和有效的保护作用。
[0099]
图7(e)所示的脂滴bodipy荧光染色结果表明:在aβ
25-35
应激条件下,细胞内脂滴结构变得模糊变小,或融合成大面积的脂斑;而egcg和egcg+l
‑ꢀ
茶氨酸显着降低了细胞内脂滴的含量。该结果与促进脂质和能量代谢的转录组 egcg的结论高度一致。
[0100]
综上所述,本实施例的用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,对淀粉样蛋白aβ
25-35
引起的神经细胞损伤,能有效修复与再生,进而达到预防和/或防止阿尔茨海默病(ad)等神经系统退行性疾病,因此,申请人提出:用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂在制备预防/ 治疗神经系统退行性疾病的药物/食品中的应用,进而开发茶叶活性成分的新应用领域。
[0101]
用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂在制备预防/治疗神经系统退行性疾病的药物/食品中的应用,具体应用方法可以为以下任意一种:
[0102]
1)用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂制备在预防/ 治疗神经系统退行性疾病的食品中的应用:食品可以是直接将绿茶冲泡饮用,每人每天饮用5~10g绿茶茶水,达到预防/治疗神经系统退行性疾病;或者,将含egcg与l-茶氨酸组合剂添加
至常规的固体饮料或糕点中,进而获取到本实施例中egcg与l-茶氨酸组合剂所需的活性成分,达到预防/治疗神经系统退行性疾病。
[0103]
2)用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂制备在预防/ 治疗神经系统退行性疾病的药品中的应用:将egcg与l-茶氨酸组合剂与常见的药用辅料混合后制成药剂,供神经系统退行性疾病患者日常服用;或者,神经系统退行性疾病患者直接服用本实施例的egcg与l-茶氨酸组合剂,单日服用量控制egcg≤100μmol/l。
[0104]
实施例2
[0105]
本实施例的用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,其主要活性成分包括egcg和l-茶氨酸,所述egcg与l-茶氨酸的含量分别为 50μm、100μm。
[0106]
实施例3
[0107]
本实施例的用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,其主要活性成分包括egcg和l-茶氨酸,所述egcg与l-茶氨酸的含量分别为 30μm、50μm。
[0108]
实施例4~7
[0109]
实施例4~7中,用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂中活性成分的含量如表1所示。
[0110]
表1实施例4~7中,用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂中活性成分的含量
[0111]
序号egcgl-茶氨酸实施例410μm50μm实施例550μm10μm实施例625μm100μm实施例740μm80μm
[0112]
实施例2~7所述的用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂在制备预防/治疗神经系统退行性疾病的药物/食品中的应用,同实施例1所述,在此不再赘述。
[0113]
需要说明的是,本发明用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,还可以含有药学上可接受的载体,或食品加工所需的成型剂、粘合剂等辅料。
[0114]
本发明用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,还可以包含egcg的衍生物,如表没食子儿茶素(egc)、表没食子酸酯(ecg)或表儿茶素(ec),表没食子儿茶素(egc)、表没食子酸酯(ecg)或表儿茶素(ec)与egcg的配比可参考绿茶中各成分的比例进行配制。
[0115]
本发明用于促进神经细胞修复与再生的egcg与l-茶氨酸组合剂,优先选择绿茶等天然资源进行提取获得其活性成分,或直接从天然资源中获取,如将绿茶冲泡茶水获得egcg与l-茶氨酸组合剂;也可以考虑利用已有分离纯化的 egcg和l-茶氨酸进行复配制成,以上技术特征的改变,本领域的技术人员通过文字描述可以理解并实施,故不再另作附图加以说明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1