多个化合物在制备治疗骨髓增殖性肿瘤的药物中的应用
1.本发明涉及医药技术领域,特别涉及多个化合物在制备治疗骨髓增殖性肿瘤的药物中的应用。
背景技术:
2.骨髓增殖性肿瘤(myeloproliferative neoplasmas,mpns)是指分化相对成熟的一系或多系骨髓细胞克隆性增殖所致的一组肿瘤性疾病。在临床表现为一种或多种血细胞增生,伴肝、脾或淋巴结肿大。2016年世界卫生组织(who)对骨髓肿瘤进行分类修订,将真性红细胞增多症(polycythemia vera,pv)、原发性骨髓纤维化(primary myelofibrosis,pmf)、原发性血小板增多症(essential thrombocythemia,et)归入费城阴性经典骨髓增殖性肿瘤(philadelphia-negative classical骨髓增殖性肿瘤)的范畴。骨髓增殖性肿瘤为克隆性造血干细胞疾病,主要的疾病驱动基因突变包括jak2v617f、calr、mpl突变,其中jak2v617f突变是最常见的类型,可见于95%的pv、50-60%的et和55-65%的pmf患者。基因的活化带来jak-stat通路的激活从而导致疾病的发生。全球每年新增骨髓增殖性肿瘤患者约20万,给医疗卫生系统带来沉重的负担。
3.在芦可替尼(ruxolitinib,rux)面世之前,骨髓增殖性肿瘤的常用治疗药物包括羟基脲及聚乙二醇-重组干扰素-α2a。羟基脲只能缓解症状却不能抑制克隆性造血,长期使用可能会增加骨髓增生异常综合征和急性髓系白血病的风险。而干扰素则因存在较高的毒副反应限制了其使用。芦可替尼作为jak1/jak2抑制剂,被fda批准一线用于对中、高危骨髓纤维化(myelofibrosis,mf),并作为二线药物用于羟基脲(hydroxyurea,hu)耐药或不能耐受的pv患者。二期、三期临床试验结果提示,与最佳疗法相比,rux能够减少中、高危mf和pv患者的脾脏体积和减轻症状。但是芦可替尼在使用过程中也存在许多问题,comfort和response临床试验结果显示,接受芦可替尼治疗的mf患者贫血更重。更严重的是,长时间使用rux等i型jak抑制剂可诱导耐药的发生,在接受治疗1年的mf病人中,超过40%病人出现耐药,在临床研究中也发现了几种jak抑制剂之间的交叉耐药。2019年8月,美国fda批准了新型口服jak2选择性抑制剂fedratinib用于成人中、高危原发性或继发性(pv后或et后)mf,其中包括以前接受过芦可替尼治疗的患者。fda同时予以黑框警示fedratinib可能引起脑病,包括韦尼克脑病的风险。为了进一步评估fedratinib的有效性及安全性,新的多中心iiib期临床实验(nct03755518)正在进行。目前的jak抑制剂不能显著减少突变等位基因负荷,因此其治疗潜力有限。骨髓移植是唯一治愈骨髓增殖性肿瘤的方法,但是仍然有一些问题需要解决。移植方式和方案的选择还不确定,选择同种异体移植还是单倍体同种移植尚不清楚。此外,当选择移植时,必须考虑到移植相关死亡率和骨髓增殖性肿瘤的长期性。目前骨髓移植主要用于治疗高危的骨髓纤维化患者,但其他类型的骨髓增殖性肿瘤患者选择骨髓移植的时机需要进一步探讨和研究证实。骨髓移植费用昂贵,在目前的医疗环境下,对大多数患者来说无法选择该治疗手段。
4.尽管芦可替尼是骨髓增殖性肿瘤治疗的里程碑药物,但芦可替尼目前适用的范围
较窄,骨髓抑制作为常见的副反应限制了其在主要适应症mf中的应用。芦可替尼不能减少突变基因的负荷,这意味着芦可替尼治疗不能使疾病达到分子水平的缓解,无法从根本上治疗骨髓增殖性肿瘤。尤其是在出现芦可替尼耐药后,治疗药物有限是目前面临的重大挑战。
技术实现要素:
5.有鉴于此,本发明的目的在于针对目前骨髓增殖性肿瘤治疗中存在的问题,对骨髓增殖性肿瘤病人尤其是对芦可替尼耐药的骨髓增殖性肿瘤病人提供一种有效、安全、可靠的药物。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了三个化合物在制备治疗骨髓增殖性肿瘤的药物中的应用。本技术中涉及的化合物包括:ro5126766,agerafenib或raf265中的一种或多种。
8.作为优选,骨髓增殖性肿瘤包括真性红细胞增多症、原发性血小板增多症或骨髓纤维化,所述骨髓纤维化包括原发性骨髓纤维化、继发于真性红细胞增多症的骨髓纤维化或继发于原发性血小板增多症的骨髓纤维化。
9.本发明还提供了五种化合物在制备治疗具有耐药性的骨髓增殖性肿瘤的药物中的应用。本技术中涉及的化合物包括:mln2480,ro5126766,agerafenib,raf265或belvarafenib中的一种或多种。
10.在本发明提供的实施例中,具有耐药性的骨髓增殖性肿瘤包括具有芦可替尼耐药性的骨髓增殖性肿瘤。
11.作为优选,具有耐药性的骨髓增殖性肿瘤包括具有耐药性的真性红细胞增多症、具有耐药性的原发性血小板增多症或具有耐药性的骨髓纤维化,所述骨髓纤维化包括原发性骨髓纤维化、继发于真性红细胞增多症的骨髓纤维化或继发于原发性血小板增多症的骨髓纤维化。
12.本发明还提供了化合物在制备抑制hel细胞的增殖的药物中的应用。本技术中涉及的化合物包括:ro5126766,agerafenib或raf265中的一种或多种。
13.本发明还提供了五种化合物在制备抑制具有耐药性的hel细胞的增殖的药物中的应用。本技术中涉及的化合物包括但不限于:mln2480,ro5126766,agerafenib,raf265或belvarafenib中的一种或多种。
14.本发明还提供了化合物在制备促进hel细胞的凋亡的药物中的应用。本技术中涉及的化合物为:raf265。
15.本发明还提供了化合物在制备促进具有耐药性的hel细胞的凋亡的药物中的应用。本技术中涉及的化合物包括:mln2480和/或raf265。
16.作为优选,药物还包含药学上可接受的辅料。
17.作为优选,药物的剂型为口服制剂或注射制剂。
18.mln2480在包括黑色素瘤的临床前模型中,显示出较好的抗肿瘤活性。mln2480能够较好的通过血脑屏障,可用于治疗星形细胞瘤等神经系统肿瘤及黑色素瘤脑转移。mln2480已通过了i期临床试验(nct02327169;nct01425008),推荐的ii期剂量(recommend phase ii dose,rp2d)为420mg/m2(不超过600mg),每周一次口服,显示出较好的安全性和
较低毒副作用。2021年5月开始招募低级别胶质瘤患者拟进行ii期临床试验(nct04775485)。mln2480的分子式为c
17h12
cl2f3n7o2s,分子量506.3,结构式如式i所示。
[0019][0020]
ro5126766又称为vs-6766或ch512766。一项针对ch5126766的首次人体研究(nct00773526)中,对进展或转移的实体瘤显示出较好的抗肿瘤活性及可耐受的副作用,建议2期剂量为2.7mg,每周连续服用4天,持续4周,直到疾病进展、不可接受的毒性或患者戒断。ch512766的分子式为c
21h18
fn5o5s,分子量471.46,结构式如式ii所示。
[0021][0022]
agerafenib又称为rxdx-105或cep-32496。在一项成神经细胞瘤的临床前研究中,agerafenib在体外能够抑制成神经细胞瘤细胞的增殖和集落形成能力,与传统的化疗药物具有协同效应,同时在成神经细胞瘤小鼠模型中,能够显著抑制肿瘤的生长及延长小鼠的生存期。针对非小细胞肺癌患者的i/ib临床试验(nct01877811)中,rxdx-105显示出较好的抗肿瘤活性,推荐的2期剂量为275mg每天。agerafenib的分子式为c
24h22
f3n5o5,分子量517.46,结构式如式iii所示。
[0023][0024]
raf265的分子式为c
24h16
f6n6o,分子量518.41,结构式如式iv所示。
[0025][0026]
belvarafenib的分子式为c
23h16
clfn6os,分子量478.93,结构式如式v所示。
[0027][0028]
由上述技术方案可知,本发明提供了五种化合物在制备治疗骨髓增殖性肿瘤的药物中的应用。所述骨髓增殖性肿瘤包括真性红细胞增多症、原发性血小板增多症或骨髓纤维化以及芦可替尼耐药性的骨髓增殖性肿瘤,所述骨髓纤维化包括原发性骨髓纤维化、继发于真性红细胞增多症的骨髓纤维化或继发于原发性血小板增多症的骨髓纤维化。本发明具有的技术效果为:
[0029]
化合物ro5126766,agerafenib,raf265用于骨髓增殖性肿瘤的治疗给广大骨髓增殖性肿瘤的患者提供了新的治疗途径,给临床医生及患者提供了更多选择。对于芦可替尼耐药的骨髓增殖性肿瘤患者,五种化合物(mln2480,ro5126766,agerafenib,raf265或belvarafenib)能为患者提供继续的口服药物治疗,免于接受骨髓移植。以上化合物可以化学合成,成本较生物制剂要低。且申请中的化合物均已经通过i期临床试验,安全性较好。部分已顺利通过ii期临床试验,将来用于临床治疗,具有较好的临床应用前景。
附图说明
[0030]
图1示实施例1:芦可替尼耐药的骨髓增殖性肿瘤细胞模型hel
re
的建立结果图;
[0031]
图2示实施例2:化合物处理两种骨髓增殖性肿瘤细胞,通过celltiter-lumi
tm
发光法检测细胞增殖的结果图;a为mln2480处理hel细胞增殖结果图;b为ro5126766处理hel细胞增殖结果图;c为agerafenib处理hel细胞增殖结果图;d为为raf265处理hel细胞增殖结果图;e为belvarafenib处理hel细胞增殖结果图;具体数值见表1;
[0032]
图3示实施例3:化合物处理两种骨髓增殖性肿瘤细胞,使用annexin v-pi染色后流式检测细胞凋亡的结果图;a为mln2480处理hel细胞凋亡结果图;b为ro5126766处理hel细胞凋亡结果图;c为agerafenib处理hel细胞凋亡结果图;d为raf265处理hel细胞凋亡结果图;e为belvarafenib处理hel细胞凋亡结果图;具体数值见表2;
[0033]
图4示实施例4:化合物处理两种芦可替尼耐药的骨髓增殖性肿瘤细胞,通过celltiter-lumi
tm
发光法检测细胞增殖的结果图;a为mln2480处理hel
re
细胞增殖结果图;b
为ro5126766处理hel
re
细胞增殖结果图;c为agerafenib处理hel
re
细胞增殖结果图;d为raf265处理hel
re
细胞增殖结果图;e为belvarafenib处理hel
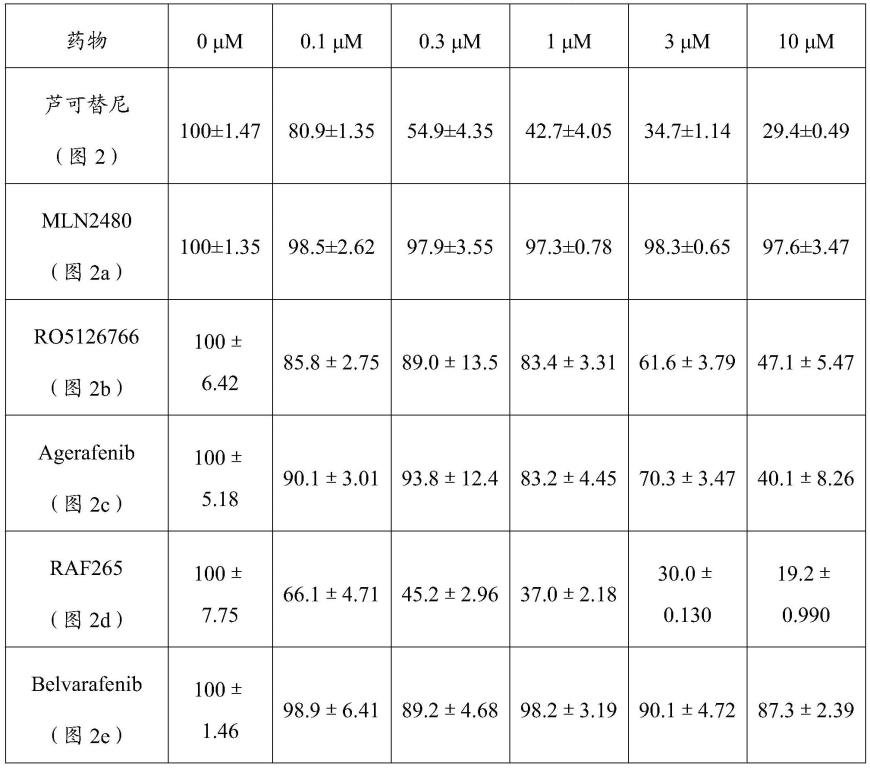
re
细胞增殖结果图;具体数值见表3;
[0034]
图5示实施例5:化合物处理两种芦可替尼耐药的骨髓增殖性肿瘤细胞,使用annexinv-pi染色后流式检测细胞凋亡的结果图;amln2480处理hel
re
细胞凋亡结果图;b为ro5126766处理hel
re
细胞凋亡结果图;c为agerafenib处理hel
re
细胞凋亡结果图;d为raf265处理hel
re
细胞凋亡结果图;e为belvarafenib处理hel
re
细胞凋亡结果图。具体数值见表4。
具体实施方式
[0035]
本发明公开了五种化合物在制备治疗骨髓增殖性肿瘤的药物中的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0036]
在本发明中,通过细胞系模型来明确五种化合物对骨髓增殖性肿瘤细胞(耐药与非耐药)的抑制作用。
[0037]
在一些实施方案中,本发明基于常用的含jak2-v617f突变的人源骨髓增殖性肿瘤细胞系,即hel细胞(human erythroleukemia cell line,人红白血病细胞),建立了芦可替尼耐药细胞模型hel
re
。耐药模型的构建方法为使用低于细胞ic50浓度开始加芦可替尼,缓慢递增至高浓度,维持细胞不被杀灭,通过比较ic50来验证模型的构建是否成功。
[0038]
在一些实施方案中,本发明使用递增浓度的化合物处理骨髓增殖性肿瘤细胞株(hel),通过celltiter-lumi
tm
发光法检测细胞的增殖。结果显示,ro5126766,agerafenib,raf265可成功抑制hel细胞的增殖。
[0039]
在一些实施方案中,本发明使用递增浓度的化合物处理骨髓增殖性肿瘤细胞株(hel),使用annexinv-pi染色后流式检测细胞的凋亡情况。结果显示,raf265可促进hel细胞的凋亡。
[0040]
由此可见,ro5126766,agerafenib,raf265化合物可用于治疗骨髓增殖性肿瘤疾病,raf265效果更优。
[0041]
进一步的,在一些实施方案中,本发明使用递增浓度的化合物处理芦可替尼耐药的骨髓增殖性肿瘤细胞(hel
re
),通过celltiter-lumi
tm
发光法检测细胞的增殖。结果显示,这些化合物可成功抑制hel
re
细胞的增殖。
[0042]
在一些实施方案中,本发明使用递增浓度的化合物处理芦可替尼耐药的骨髓增殖性肿瘤细胞(hel
re
),使用annexinv-pi染色后流式检测细胞的凋亡情况。结果显示,mln2480,raf265可促进hel
re
细胞的凋亡。
[0043]
由此可见,这五种化合物可用于治疗芦可替尼耐药的骨髓增殖性肿瘤疾病,mln2480及raf265效果更优。
[0044]
进一步的,本发明提供了化合物在制备抑制hel细胞的增殖、促进hel细胞的凋亡的药物中的应用。
[0045]
综上所述,本发明提供了三种化合物在制备治疗骨髓增殖性肿瘤的药物中的应用;所述化合物包括但不限于:ro5126766、agerafenib或raf265中的一种或多种。
[0046]
进一步的,所述骨髓增殖性肿瘤为真性红细胞增多症、原发性血小板增多症和骨髓纤维化(包括原发性骨髓纤维化、继发于真性红细胞增多症的骨髓纤维化和继发于原发性血小板增多症的骨髓纤维化)和具有耐药性的骨髓增殖性肿瘤。
[0047]
在一些实施方案中,所述具有耐药性的骨髓增殖性肿瘤为芦可替尼耐药性的骨髓增殖性肿瘤。
[0048]
在一些实施方案中,所述具有耐药性的骨髓增殖性肿瘤为具有耐药性的真性红细胞增多症、具有耐药性的骨髓纤维化(包括原发性骨髓纤维化、继发于真性红细胞增多症的骨髓纤维化和继发于原发性血小板增多症的骨髓纤维化)以及具有耐药性的原发性血小板增多症。
[0049]
其中,所述药物为mln2480,ro5126766,agerafenib,raf265,belvarafenib。
[0050]
进一步的,所述药物还包括药学上可接受的辅料。
[0051]
所述药物可以为当前药品领域任何剂型,包括口服制剂或注射制剂。
[0052]
各药物剂型可根据该剂型实际需要选取合适的可接受辅料来制备,这属于本领域常规的剂型制备技术。如制成胶囊剂、片剂、注射粉剂等。
[0053]
本发明中所用试剂或仪器均可由市场购得。
[0054]
下面结合实施例,进一步阐述本发明:
[0055]
实施例1、常见芦可替尼耐药细胞模型的建立(hel
re
)。
[0056]
一、材料与方法
[0057]
1、细胞系
[0058]
hel(human erythroleukemia cell line)、芦可替尼耐药的hel细胞均培养于含20%热灭活胎牛血清(gibco)及1%青霉素/链霉素的rpmi培养基(gibco)。
[0059]
芦可替尼耐药的hel模型即hel
re
模型,构建方法为使用低于原始细胞ic50浓度开始加芦可替尼,缓慢递增至高浓度,维持细胞不被杀灭。我们的起始浓度为0.1μm,细胞出现增殖就加药,加药梯度为1.25倍递增,终浓度为2.0μm。4-6周后获得稳定的耐药细胞。
[0060]
2、化合物
[0061]
芦可替尼及其他化合物均购自selleck公司,溶于dmso,母液浓度为10mm,冻存于-80℃,工作液采用rpmi培养基稀释至指定倍数后处理细胞。芦可替尼具体为磷酸芦可替尼。
[0062]
3、体外抑制试验
[0063]
为了检测抑制剂的抗增殖效应,上述细胞系以每孔3000个细胞/100μl体系培养,加入递增浓度的芦可替尼(hel细胞浓度梯度:0,0.1,1,2.5,5μm;或0,0.1,0.3,1,3,10μm,dmso补齐至等量。设4个平行重复组,并设3个空白孔(不含细胞的培养液孔)。48小时后通过celltiter-lumi
tm
发光法(碧云天)检测细胞的增殖。多功能酶标仪读数,ic50通过graph padprism计算得来。
[0064]
细胞增殖率计算公式:细胞增殖率=(加药组luminescence值-空白孔平均luminescence值)/(dmso对照组luminescence值-空白孔平均luminescence值)
×
100%。
[0065]
评价模型是否构建成功的方法是比较耐药细胞与原始细胞的ic50,比值为耐药指数,大于3即为构建成功。
[0066]
二、结果分析
[0067]
图1中,hel细胞ic50为2.31(1.42-4.36)μm,hel
re
细胞ic50为44.7(16.0-370)μm,其耐药指数为19.0,提示耐药模型hel
re
的成功构建图中增殖率结果显示为平均数
±
标准差,图中hel
re
细胞vs hel细胞增殖率的比较采用t检验(***p《0.001),ic50显示为均数。结果分析中显示为均数(95%可信区间)。
[0068]
实施例2、部分化合物可抑制骨髓增殖性肿瘤细胞的增殖
[0069]
为了检测化合物对骨髓增殖性肿瘤耐药细胞增殖能力的影响,方法为分别使用递增浓度的芦可替尼及化合物处理hel原始细胞株,通过celltiter-lumi
tm
发光法检测细胞的增殖,方法同实施例1,结果见图2,数值见表1。
[0070]
表1 hel细胞药物处理平均增殖率%
±
标准差
[0071][0072]
图2a反映了在hel细胞中,芦可替尼处理组药物浓度(平均增殖率%
±
标准差)为:0μm(100
±
1.47)(图中未显示)、0.1μm(80.9
±
1.35)、0.3μm(54.9
±
4.35)、1μm(42.7
±
4.05)、3μm(34.7
±
1.14)、10μm(29.4
±
0.49);mln2480处理组药物浓度(平均增殖率)为:0μm(100
±
1.35)(图中未显示)、0.1μm(98.5
±
2.62)、0.3μm(97.9
±
3.55)、1μm(97.3
±
0.78)、3μm(98.3
±
0.65)、10μm(97.6
±
3.47)。这提示mln2480不能抑制hel细胞的增殖。图2b反映在hel细胞中,ro5126766处理组药物浓度(平均增殖率)为:0μm(100
±
6.42)(图中未显示)、0.1μm(85.8
±
2.75)、0.3μm(89.0
±
13.5)、1μm(83.4
±
3.31)、3μm(61.6
±
3.79)、10μm(47.1
±
5.47)。这提示ro5126766能抑制hel细胞的增殖,该效应随药物浓度增加而增加。图2c反
映在hel细胞中,agerafenib处理组药物浓度(平均增殖率)为:0μm(100
±
5.18)(图中未显示)、0.1μm(90.1
±
3.01)、0.3μm(93.8
±
12.4)、1μm(83.2
±
4.45)、3μm(70.3
±
3.47)、10μm(40.1
±
8.26)。这提示agerafenib能抑制hel细胞的增殖,该效应随药物浓度增加而增加。图2d反映在hel细胞中,raf265处理组药物浓度(平均增殖率)为:0μm(100
±
7.75)(图中未显示)、0.1μm(66.1
±
4.71)、0.3μm(45.2
±
2.96)、1μm(37.0
±
2.18)、3μm(30.0
±
0.130)、10μm(19.2
±
0.990)。这提示raf265能抑制hel细胞的增殖,该效应随药物浓度增加而增加,其抑制效果优于芦可替尼。图2e反映在hel细胞中,belvarafenib处理组药物浓度(平均增殖率)为:0μm(100
±
1.46)(图中未显示)、0.1μm(98.9
±
6.41)、0.3μm(89.2
±
4.68)、1μm(98.2
±
3.19)、3μm(90.1
±
4.72)、10μm(87.3
±
2.39)。这提示belvarafenib不能抑制hel细胞的增殖。图中化合物各个浓度处理组与dmso处理组增殖率的比较采用t检验(*p《0.05,**p《0.01,***p《0.001)。
[0073]
实施例3、部分化合物可促进骨髓增殖性肿瘤细胞的凋亡
[0074]
一、材料与方法
[0075]
1、细胞系与抑制剂同实施例1。
[0076]
2、细胞凋亡检测
[0077]
为了检测抑制剂的促凋亡效应,分别使用芦可替尼及化合物处理hel原始细胞株24小时(浓度:0、0.1、0.5、1μm或0,0.1,0.3,1,3,10μm),补齐dmso至等量。设3个平行重复组,使用annexin v和pi染色后流式细胞术检测细胞的凋亡情况。
[0078]
细胞凋亡率计算公式:细胞凋亡率=早期凋亡细胞比率(annexin v
+
/pi-)+晚期凋亡细胞及坏死细胞比率(annexin v
+
/pi
+
)。
[0079]
二、结果分析
[0080]
数值见表2。
[0081]
表2 hel细胞药物处理平均凋亡率%
±
标准差
[0082][0083]
图3a中,hel细胞芦可替尼处理组药物浓度(平均凋亡率%
±
标准差)为:0μm(7.39
±
0.387)(图中未显示)、0.1μm(7.40
±
0.059)、0.3μm(7.46
±
0.679)、1μm(8.61
±
0.403)、3μm(7.19
±
0.209)、10μm(6.36
±
0.036);mln2480处理组药物浓度(凋亡率)为0μm(6.09
±
0.756)(图中未显示)、0.1μm(4.61
±
2.768)、0.3μm(3.85
±
0.101)、1μm(5.53
±
1.22)、3μm(10.04
±
2.663)、10μm(8.8
±
1.063);这提示mln2480不能促进骨髓增殖性肿瘤细胞的凋亡。图3b反映在hel细胞中,ro5126766处理组药物浓度(平均凋亡率)为:0μm(4.34
±
1.39)(图中未显示)、0.1μm(6.00
±
0.290)、0.3μm(6.96
±
1.16)、1μm(6.11
±
0.640)、3μm(8.32
±
2.69)、10μm(6.73
±
1.20)。这提示ro5126766不能促进hel细胞的凋亡。图3c反映在hel细胞中,agerafenib处理组药物浓度(平均凋亡率)为:0μm(6.30
±
0.450)(图中未显示)、0.1μm(4.41
±
0.630)、0.3μm(4.98
±
1.09)、1μm(3.42
±
0.140)、3μm(5.27
±
0.490)、10μm(5.43
±
0.720)。这提示agerafenib不能促进hel细胞的凋亡。图3d反映在hel细胞中,raf265处理组药物浓度(平均凋亡率)为:0μm(5.23
±
1.05)(图中未显示)、0.1μm(7.24
±
1.30)、0.3μm(7.19
±
0.400)、1μm(8.11
±
0.260)、3μm(10.7
±
1.22)、10μm(12.8
±
1.44)。这提示raf265能促进hel细胞的凋亡,该效应随药物浓度增加而增加,其抑制效果优于芦可替尼。图3e反映在hel细胞中,belvarafenib处理组药物浓度(平均凋亡率)为:0μm(5.56
±
0.130)(图中未显示)、0.1μm(6.58
±
0.760)、0.3μm(7.42
±
0.950)、1μm(7.80
±
0.700)、3μm(7.17
±
1.31)、10μm(7.55
±
0.160)。这提示belvarafenib不能促进hel细胞的凋亡。图中化合物各个浓度处理组与dmso处理组凋亡率的比较采用t检验(*p《0.05,**p《0.01,***p《0.001)。
[0084]
实施例4、五种化合物可抑制耐药骨髓增殖性肿瘤细胞的增殖。
[0085]
为了检测五种化合物对骨髓增殖性肿瘤耐药细胞增殖能力的影响,方法为分别使用递增浓度的芦可替尼及五种化合物处理hel
re
,通过celltiter-lumi
tm
发光法检测细胞的增殖。方法同实施例1,结果见图4,数值见表3。
[0086]
表3 hel-re细胞药物处理平均增殖率%
±
标准差
[0087][0088]
[0089]
图4a反映了在hel
re
细胞中,芦可替尼处理组药物浓度(平均增殖率%
±
标准差)为:0μm(100
±
3.79)(图中未显示)、0.1μm(105
±
2.08)、0.3μm(105
±
3.59)、1μm(104
±
9.46)、3μm(109
±
4.39)、10μm(96.0
±
3.69);mln2480处理组药物浓度(平均增殖率)为:0μm(100
±
4.37)(图中未显示)、0.1μm(103.1
±
8.58)、0.3μm(75.1
±
3.54)、1μm(46.5
±
9.45)、3μm(18.9
±
4.22)、10μm(10.3
±
0.490)。这提示mln2480可抑制耐药骨髓增殖性肿瘤细胞的增殖,该效应随药物浓度增加而增加。图4b反映了在hel
re
细胞中,ro5126766处理组药物浓度(平均增殖率)为:0μm(100
±
1.82)(图中未显示)、0.1μm(48.1
±
3.37)、0.3μm(41.4
±
3.16)、1μm(35.2
±
2.89)、3μm(31.5
±
1.90)、10μm(27.7
±
2.34)。这提示ro5126766能抑制hel
re
细胞的增殖,该效应随药物浓度增加而增加。图4c反映了在hel
re
细胞中,agerafenib处理组药物浓度(平均增殖率)为:0μm(100
±
4.00)(图中未显示)、0.1μm(4.26
±
0.460)、0.3μm(2.77
±
0.430)、1μm(2.75
±
0.940)、3μm(2.21
±
0.0400)、10μm(1.86
±
0.230)。这提示agerafenib能抑制hel
re
细胞的增殖,该效应随药物浓度增加而增加。图4d反映了在hel
re
细胞中,raf265处理组药物浓度(平均增殖率)为:0μm(100
±
4.58)(图中未显示)、0.1μm(92.0
±
3.92)、0.3μm(67.2
±
3.70)、1μm(35.8
±
3.88)、3μm(21.8
±
1.48)、10μm(3.45
±
0.580)。这提示raf265能抑制hel
re
细胞的增殖,该效应随药物浓度增加而增加。图4e反映了在hel
re
细胞中,belvarafenib处理组药物浓度(平均增殖率)为:0μm(100
±
6.75)(图中未显示)、0.1μm(104
±
6.13)、0.3μm(92.4
±
2.45)、1μm(70.4
±
3.11)、3μm(45.4
±
2.33)、10μm(31.1
±
3.60)。这提示belvarafenib能抑制hel
re
细胞的增殖,该效应随药物浓度增加而增加。图中化合物各个浓度处理组与对应浓度芦可替尼处理组增殖率的比较采用t检验(*p《0.05,**p《0.01,***p《0.001)。
[0090]
实施例5、部分化合物可促进耐药骨髓增殖性肿瘤细胞的凋亡
[0091]
为了检测化合物对骨髓增殖性肿瘤耐药细胞存活能力的影响,方法为分别使用递增浓度的芦可替尼及化合物处理hel
re
,使用annexin v和pi染色后流式检测细胞的凋亡情况。方法同实施例3,结果见图5,数值见表4。
[0092]
表4 hel-re细胞药物处理平均凋亡率%
±
标准差
[0093][0094]
图5a中,hel
re
细胞芦可替尼处理组药物浓度(平均凋亡率%
±
标准差)为:0μm(8.89
±
1.19)(图中未显示)、0.1μm(12.4
±
0.540)、0.3μm(13.0
±
1.03)、1μm(10.8
±
1.02)、3μm(10.2
±
0.880)、10μm(10.6
±
1.33);mln2480处理组药物浓度(凋亡率)为0μm(6.69
±
1.14)(图中未显示)、0.1μm(6.54
±
0.560)、0.3μm(7.80
±
0.900)、1μm(10.9
±
0.390)、3μm(15.5
±
0.580)、10μm(13.8
±
0.775)。这说明mln2480可促进芦可替尼耐药的骨髓增殖性肿瘤细胞的的凋亡,该效应随药物浓度的增加而增加。图5b反映在hel
re
细胞中,ro5126766处理组药物浓度(平均凋亡率)为:0μm(6.12
±
0.270)(图中未显示)、0.1μm(6.25
±
0.920)、0.3μm(5.88
±
1.25)、1μm(7.32
±
1.74)、3μm(4.71
±
0.350)、10μm(5.42
±
0.830)。这提示ro5126766不能促进hel
re
细胞的凋亡。图5c反映在hel
re
细胞中,agerafenib处理组药物浓度(平均凋亡率)为:0μm(7.60
±
1.74)(图中未显示)、0.1μm(7.05
±
0.920)、0.3μm(5.33
±
0.430)、1μm(5.11
±
0.210)、3μm(7.37
±
0.220)、10μm(8.22
±
0.390)。这提示agerafenib不能促进hel
re
细胞的凋亡。图5d反映在hel
re
细胞中,raf265处理组药物浓度(平均凋亡率)为:0μm(6.23
±
0.300)(图中未显示)、0.1μm(6.48
±
0.480)、0.3μm(7.31
±
0.140)、1μm(8.24
±
0.730)、3μm(11.9
±
0.520)、10μm(19.1
±
3.75)。这提示raf265能促进hel
re
细胞的凋亡,该效应随药物浓度增加而增加。图5e反映在hel
re
细胞中,belvarafenib处理组药物浓度(平均凋亡率)为:0μm(5.15
±
0.730)(图中未显示)、0.1μm(5.55
±
0.440)、0.3μm(5.40
±
0.570)、1μm(5.71
±
0.260)、3μm(6.05
±
0.430)、10μm(7.13
±
0.450)。这提示belvarafenib不能促进hel
re
细胞的凋亡。图中化合物各个浓度处理组与对应浓度芦可替尼处理组凋亡率的比较采用t检验(*p《0.05,**p《0.01,***p《0.001)。
[0095]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1