用于治疗癌症的方法和组合物与流程
本发明提供了治疗表达wt1的癌症,减少表达wt1的癌症的发生率和诱导针对表达wt1的癌症的免疫应答的方法,以及用于相同目的的组合物。
背景技术:
技术实现思路
1、本发明提供治疗,减少针对表达wt1的癌症的发生率和诱导针对表达wt1的癌症的免疫应答的方法,以及包含用于相同目的的免疫原性组合物的组合物。在一个实施方案中,本发明提供用于这种用途的方法,其包括向有需要的受试者施用(a)针对表达wt1的癌症的一种或多种wt1肽或细胞毒性t细胞(ctl),和(b)一种或多种检查点抑制剂。一种或多种wt1肽可以通过向受试者施用一种或多种试剂施用受试者,导致一种或多种wt1肽的递送和诱导针对表达wt1的癌症的免疫应答。可以使用的这些wt1递送剂的实例包括:(i)分离的wt1肽,(ii)编码所述至少一种wt1肽的核酸,和(iii)包含或呈递所述至少一种wt1肽或编码至少一种wt1肽的核酸的免疫细胞。
2、一种或多种wt1肽可以是作为wt1蛋白片段的天然肽,或者它们可以是具有一种或多种可以增强其免疫原性的修饰的这种肽。这样的修饰可以是氨基酸改变(例如不规则的肽)或任何其他修饰。ctl包括体外或离体制备的wt1特异性ctl,或者它们可以从供体获得。wt1递送剂或ctl可以与载体,赋形剂或稀释剂一起提供在组合物中,其中可以是佐剂。下文描述用于本文实施方法和组合物中的肽组分的非限制性选择。
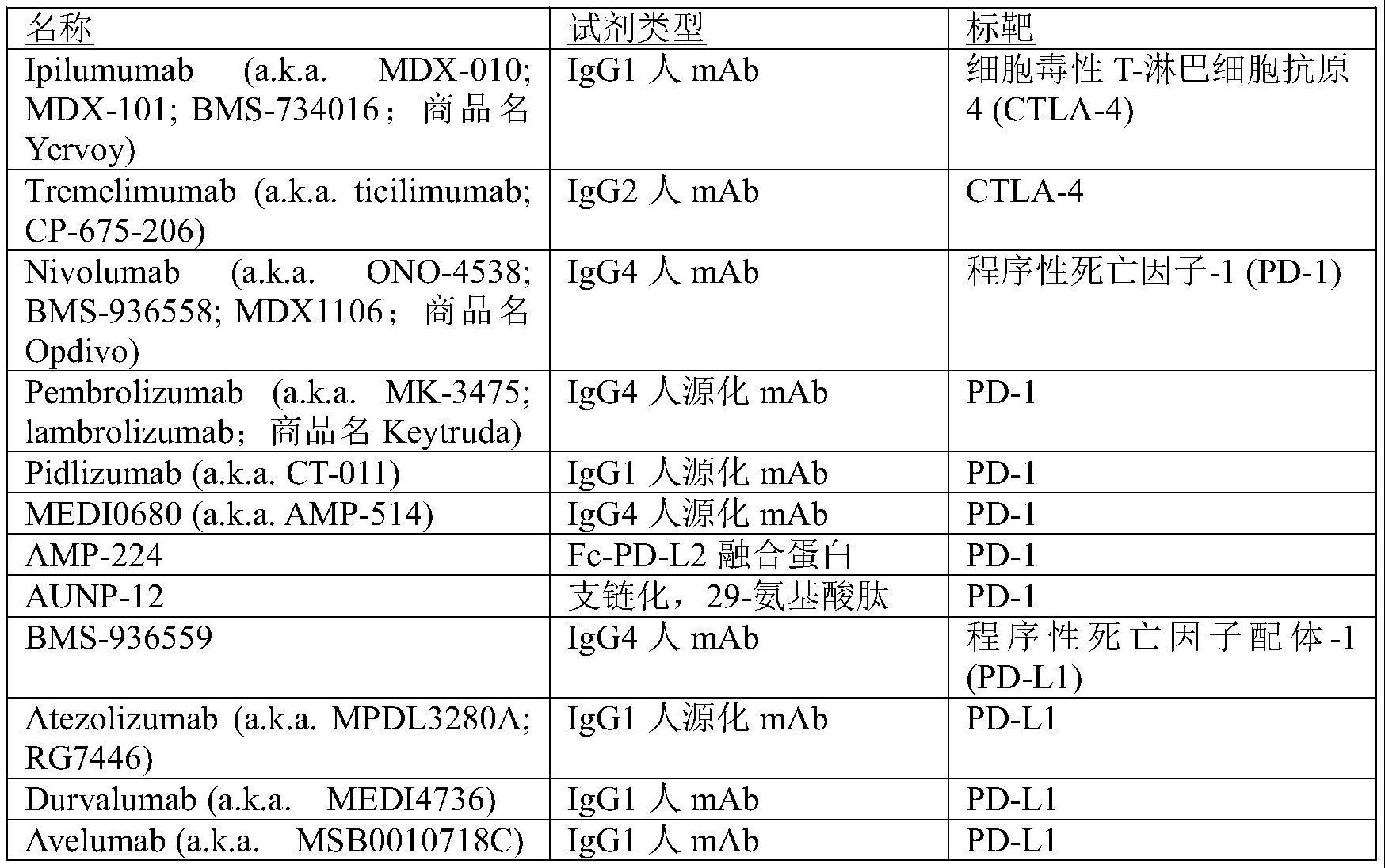
3、一种或多种检查点抑制剂(也称为免疫检查点抑制剂)是阻断或抑制免疫检查点蛋白质的化合物或试剂。作为检查点抑制剂的化合物或试剂的非限制性实例包括小分子,肽和抗体。抗体的非限制性实例包括nivolumab(纳武利尤单抗)(opdivo)、pembrolizumab(派姆单抗)(keytruda)、pidilizumab(ct-011)、medi0680(amp-514)、amp-224、aunp-12、bms 936559、atezolizumab(mpdl3280a)、durvalumab(medi4736)、avelumab(msb0010718c)、bms935559(mdx-1105)、rhigm12b7、bms-986016、gsk2831781、imp321、lirilumab(bms-986015)、iph2101(1-7f9)、indoximod(nlg 9189)、nlg 919、incb024360、pf-05082566、urelumab(bms-663513)和medi6469。
4、在一个实施方案中,实施以下方法,其中将一种或多种wt1递送剂或ctl和一种或多种检查点抑制剂各自根据最大程度上有益于受试者的时间表施用于受试者。因此,所述一种或多种wt1递送剂或ctl和所述一种或多种检查点抑制剂不一定是在同一时间,或者甚至在相同组合物中,或者各自持续相同的时间,或者各自通过相同途径施用。每个wt1肽可以按照特定的时间表来施用,每个检查点抑制剂也是如此。在一个实施方案中,所述至少一种wt1肽和所述至少一种检查点抑制剂的施用方案是同时发生的。在一个实施方案中,所述至少一种wt1肽和所述至少一种检查点抑制剂的施用方案重叠。在一个实施方案中,至少一种wt1递送剂或ctl和至少一种检查点抑制剂存在于相同的组合物中。在一个实施方案中,本文实施的方法提供了与单独的wt1递送试剂或ctl和检查点抑制剂相比,治疗、减少针对表达wt1的癌症的免疫应答的发生率和诱导针对表达wt1的癌症的免疫应答的增加或增强的能力。在一个实施方案中,由本文所述方法提供的治疗,降低发生率和诱导针对表达wt1的癌症的免疫应答的能力大于单独的wt1递送剂或单独的ctl与单独的检查点抑制剂(一种或多种)的作用的组合。
5、wt1递送剂或ctl的剂量水平和施用方案以及检查点抑制剂的剂量水平和施用方案,施用途径以及施用的其它方面被优化以使受试者获得最大益处。本文中的实施方案提供了治疗、减少针对表达wt1的癌症的发生率和诱导针对表达wt1的癌症免疫应答的改善的方法,以及用于相同目的的改善的组合物。
6、适用于本文实施方法的癌症是表达wt1蛋白或其片段的任何癌症。在一个实施方案中,癌症是卵巢癌。在另一个实施方案中,癌症是间皮瘤。在另一个实施方案中,癌症是白血病。在其他实施方案中,癌症是维尔姆斯氏瘤(wilms'tumor),急性骨髓性白血病(aml),慢性粒细胞白血病(cml),骨髓增生异常综合征(mds),黑色素瘤,胃癌,前列腺癌,胆道癌,泌尿系统癌症,成胶质细胞瘤,软组织肉瘤,骨肉瘤或非小细胞肺癌(nsclc)。
7、发明详述
8、本发明提供了治疗表达wt1的癌症,减少表达wt1的癌症的发生率和诱导针对表达wt1的癌症的免疫应答的方法,以及包含用于相同目的的免疫原性组合物的组合物。在一个实施方案中,本发明提供用于这种用途的方法,其包括向有需要的受试者施用(a)一种或多种wt1肽或细胞毒性t细胞(ctl),和(b)一种或多种检查点抑制剂。一种或多种wt1肽可以通过向受试者施用一种或多种试剂施用受试者,导致一种或多种wt1肽的递送和诱导针对表达wt1的癌症的免疫应答。可以使用的这些wt1递送剂的实例包括:(i)分离的wt1肽,(ii)编码所述至少一种wt1肽的核酸,和(iii)包含或呈递所述至少一种wt1肽或编码至少一种wt1肽的核酸的免疫细胞。
9、卵巢癌是美国妇女中最常见的妇科恶性肿瘤之一,也是妇女癌症死亡的第五常见原因。每年诊断超过22,000例,每年估计有15,500例死亡[1]。大多数患者在发病时有广泛的疾病[2]。晚期疾病的5年生存率仍低于30%[1]。尽管对于许多患者可以预期在初始化疗后完全缓解临床症状,但对常规护理常常进行二次剖腹探查的回顾表明,少于50%的患者实际上没有疾病[3]。此外,近二分之一的阴性二次手术患者复发并需要额外治疗[4]。许多患者将通过额外的化疗获得第二次完整的临床反应。但是,几乎所有患者在9-11个月的短暂缓解期后都会复发[5]。需要延长缓解或预防复发的有效策略,因为随后的缓解持续时间越来越短,直到化疗耐药广泛发展[2]。
10、已经显示抗体和t细胞效应器均在卵巢癌模型中提供益处。已经注意到抗体可以减少早期组织侵袭[6]。临床前模型还通过使用被动施用和疫苗诱导的抗体,证明循环肿瘤细胞的清除和消除系统性微转移。关于t细胞效应器,全球性激活的免疫应答已被证明与晚期卵巢癌患者改善的临床预后有关。zhang等人发现肿瘤浸润的t细胞在肿瘤细胞岛(tumorcell islets)内的存在与无进展生存期和总生存期的改善有关[7]。相反,t调节细胞的浸润使预后更差[8]。
11、卵巢癌患者在第二次或更大缓解期的数据证实它们以可预测的方式复发[9]。近年来,卵巢癌已被多种新的基于免疫的方法所针对。抗体疗法包括oregovomab[10],它是一种针对ca125抗原的单克隆抗体疗法;abagovomab[11],它是一种针对ca-125的抗独特型抗体;和曲妥单抗[12],它是一种单克隆人源化抗her2抗体。其他策略包括细胞因子疗法,如干扰素-γ[13,14]和il-2[15]。其他抗原如lewis y[16],muc1[17],hla限制性肽ny-eso-1b[18]和kh-1-klh缀合物的主动免疫也已被评估。先前的策略一直无效,需要新的治疗方法来提高卵巢治疗效果以及许多用当前治疗方法治疗无效的其它癌症。
12、wt1是指维尔姆斯氏瘤1(wilms'tumor 1)或wt1基因的基因产物。wilms的肿瘤抑制基因(wt1)首先在儿童肾脏肿瘤中被发现,但wt1在多种其他血液恶性肿瘤和实体瘤(包括间皮瘤)中也有高表达[19,20]。wt1最初是通过对染色体11p13区域的cdna作图鉴定的。wt1 cdna编码含有四个kruppel锌指的蛋白质,并且含有选择性剪接的复杂模式,导致四种不同的转录因子。每个wt1亚型具有不同的dna结合和转录活性[21],并且可以正向或负向调节参与细胞增殖,分化,凋亡,器官发育和性别决定的各种基因。胚胎发育过程中wt1通常在中胚层来源的组织中表达,包括肾,性腺,心脏,间皮细胞和脾脏[22]。在正常成人组织中,正常cd34+造血干细胞,肌上皮祖细胞,肾足细胞以及睾丸和卵巢中的一些细胞的细胞核中wt1表达水平被限制在低水平[23]。wt1在小鼠和人类中高度同源(氨基酸水平为96%),具有相似的组织分布和功能[24,25]。虽然最初描述为肿瘤抑制基因,但wt1蛋白似乎参与肿瘤发生。
13、wt1蛋白在卵巢癌中的强表达加上其提出的作用机制使其成为许多其他也表达wt1蛋白的癌症中的免疫治疗的合理靶标,所述癌症例如但不限于间皮瘤,白血病,维尔姆斯氏瘤,急性骨髓性白血病(aml),慢性粒细胞白血病(cml),骨髓增生异常综合征(mds),黑色素瘤,胃癌,前列腺癌,胆道癌,泌尿系统癌症,成胶质细胞瘤,软组织肉瘤,骨肉瘤和非小细胞肺癌症(nsclc)。在卵巢癌中,表达是如此频繁以至于病理学家通常对wt1使用免疫组织化学染色(具有描述表达并确定为“阳性”或“阴性”以帮助区分上皮性卵巢癌与其他肿瘤的标准化惯例方法)。wt1对浆液性卵巢癌是特别敏感的且是特异性标记[26]。卵巢组织微阵列表明,70-80%的浆液性卵巢癌表达wt1,因此大多数患者将有目标并有资格参加研究。
14、用于本文目的的一种或多种wt1肽可以是天然肽,其是wt1蛋白质的片段。在一个实施方案中,wt1肽是rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seqid no:2),lvrhhnmhqrnmtkl(seq id no:3)或nkryfklshlqmhsr(seq id no:4)。在另一个实施方案中,所述肽是sgqarmfpnapylpscles(seq id no:5)或qarmfpnapylpscl(seq idno:6)。在另一个实施方案中,所述肽是rmfpnapyl(seq id no:7),slgeqqysv(seq id no:8),allpavpsl(seq id no:9),nlgatlkgv(seq id no:10),dlnallpav(seq id no:11),gvfrgiqdv(seq id no:12),kryfklshl(seq id no:13),alllrtpys(seq id no:14),cmtwmqmnl(seq id no:15),nmhqrnmtk(seq id no:16),qmnlgatlk 17),fmcaypgcnk(seqid no:18)或klshlqmhsr(seq id no:19)。
15、在另一个实施方案中,wt1肽是nqmnlgatl(seq id no:20),nlmnlgatl(seq idno:21),nymnlgatl(seq id no:22),cmtwnqmnlgatlkg(seq id no:23),cmtwnlmnlgatlkg(seq id no:24),wnqmnlgatlkgvaa(seq id no:25),wnlmnlgatlkgvaa(seq id no:26),mtwnqmnlgatlkgv(seq id no:27),twnqmnlgatlkgva(seq id no:28),cmtwnlmnlgatlkg(seq id no:29),mtwnlmnlgatlkgv(seq id no:30),twnlmnlgatlkgva(seq id no:31),wnlmnlgatlkgvaa(seq id no:32),mtwnymnlgatlkgv(seq id no:33),twnymnlgatlkgva(seq id no:34),cmtwnqmnlgatlkgva(seq id no:35),wnqmnlgat(seq id no:36),twnqmnlga(seq id no:37),mtwnqmnlg(seq id no:38),cmtwnlmnlgatlkgva(seq id no:39),wnlmnlgat(seq id no:40),mnlgatlkg(seq id no:41),mtwnqmnlg(seq id no:42),cmtwnymnlgatlkgva(seq id no:43),mnlgatlkg(seq id no:44),mtwnqmnlg(seq id no:45),galrnptac(seq id no:46),gylrnptac(seq id no:47),galrnptal(seq id no:48),yalrnptac(seq id no:49),gllrnptac(seq id no:50),rqrphpgal(seq id no:51),ryrphpgal(seq id no:52),yqrphpgal(seq id no:53),rlrphpgal(seq id no:54),rirphpgal(seq id no:55),galrnptac(seq id no:56),galrnptal(seq id no:57),rqrphpgal(seq id no:58),rlrphpgal(seq id no:59),rirphpgal(seq id no:60),qfpnhsfkhedpmgq(seq id no:61),qfpnhsfkhedpmgq(seq id no:62),hsfkhedpm(seq idno:63),hsfkhedpy(seq id no:64),hsfkhedpk(seq id no:65),krpfmcaypgcykry(seq idno:66),sekrpfmcaypgcnk(seq id no:67),krpfmcaypgcnk(seq id no:68),fmcaypgcn(seq id no:69),fmcaypgcy(seq id no:70)或fmcaypgck(seq id no:71)。
16、在另一个实施方案中,wt1肽来自rqrphpgal(seq id no:72),galrnptac(seq idno:73),plphfppsl(seq id no:74),hfppslppt(seq id no:75),thspthppr(seq id no:76),aildflllq(seq id no:77),pgclqqpeq(seq id no:78),pgclqqpeqqg(seq id no:79),klgaaeasa(seq id no:80),asgsepqqm(seq id no:81),rdlnallpav(seq id no:82),ggcalpvsga(seq id no:83),gaaqwapvl(seq id no:84),ldfappgas(seq id no:85),ldfappgasay(seq id no:86),saygslggp(seq id no:87),pappppppp(seq id no:88),acrygpfgp(seq id no:89),sgqarmfpn(seq id no:90),rmfpnapyl(seq id no:91),psclesqpa(seq id no:92),nqgystvtf(seq id no:93),hhaaqfpnh(seq id no:94),hsfkhedpm(seq id no:95),chtptdsct(seq id no:96),ctgsqalll(seq id no:97),tdsctgsqa(seq id no:98),rtpyssdnl(seq id no:99),nlyqmtsqle(seq id no:100),wnqmnlgat(seq id no:101),nqmnlgatl(seq id no:102),wnqmnlgatlk(seq id no:103),cmtwnqmnlgatlkg(seq id no:104),nlgatlkgv(seq id no:105),lgatlkgvaa(seq id no:106),tlgvaags(seq id no:107),gyesdnhtt(seq id no:108),fmcaypgcnk(seq id no:109),krpfmcaypgc(seq id no:110),rkfsrsdhl(seq id no:111),lkthttrtht(seq idno:112),nmhqrnhtkl(seq id no:113),llaaildfl(seq id no:114),clqqpeqqgv(seq idno:115),dlnallpav(seq id no:116),allpavpsl(seq id no:117),vldfappga(seq idno:118),cmtwnqmnl(seq id no:119),qarmfpnapy(seq id no:120),alrnptacpl(seq idno:121),ypgcnkryf(seq id no:122)或apvldfappgasayg(seq id no:123)。
17、在另一个实施方案中,wt1肽是wo2005053618,wo2007047763,wo2007047764,wo2007120673,us20060084609,wo2014113490和wo2013106834中描述的任何天然wt1肽。前述内容通过引用整体并入本文。
18、在另一个实施方案中,wt1肽是us20110070251a1,us7063854b1,us7063854,us7901693,us7662386,us7,063,854,us7115272,us7368119,us7329410,us7144581,us7323181,us7655249,us7,553,494,us7608685,us7380871,us7030212,us7807792,us7517950,us2010/0166738,us2011/0070251,us2009/0143291和wo2003037060中描述的任何天然wt1肽。前述内容通过引用整体并入本文。
19、在另一个实施方案中,wt1肽是us7666985b2,us20080070835a1,us20070128207a1,us7915393b2,us20110136141a1,us7598221b2,us20100111986a1,us20100092522a1,us20030082194a1和wo2001025273a2中描述的任何天然wt1肽。前述内容通过引用整体并入本文。
20、所述一种或多种wt1肽可以是经修饰的wt1肽片段,例如含有一种或多种异质修饰以增强针对天然肽序列的免疫原性。在一个实施方案中,wt1肽是ymfpnapyl(seq id no:124)。在另一个实施方案中,所述肽是sgqaymfpnapylpscles(seq id no:125)。在另一个实施方案中,肽是qaymfpnapylpscl(seq id no:126)。在另一个实施方案中,肽是ylgeqqysv(seq id no:127),yllpavpsl(seq id no:128),ylgatlkgv(seq id no:129),ylnallpav(seq id no:130),glrrgiqdv(seq id no:131),klyfklshl(seq id no:132),alllrtpyv(seq id no:133),ymtwnqmnl(seq id no:134),nmyqrnmtk(seq id no:135),nmhqrvmtk(seq id no:136),nmyqrvmtk(seqid no:137),qmylgatlk(seq id no:138),qmnlgvtlk(seq id no:139),qmylgvtlk(seq id no:140),fmyaypgcnk(seq id no:141),fmcaypfcnk(seq id no:142),fmyaypfcnk(seq id no:143),klyhlqmhsr(seq id no:144),klshlqmhsk(seq id no:145)和klyhlqmhsk(seq id no:146)中任一。
21、在另一个实施方案中,wt1肽是nqmnlgatl(seq id no:147),nlmnlgatl(seq idno:148),nymnlgatl(seq id no:149),cmtwnqmnlgatlkg(seq id no:150),cmtwnlmnlgatlkg(seq id no:151),wnqmnlgatlkgvaa(seq id no:152),wnlmnlgatlkgvaa(seq id no:153),mtwnqmnlgatlkgv(seq id no:154),twnqmnlgatlkgva(seq id no:155),cmtwnlmnlgatlkg(seq id no:156),mtwnlmnlgatlkgv(seq id no:157),twnlmnlgatlkgva(seq id no:158),wnlmnlgatlkgvaa(seq id no:159),mtwnymnlgatlkgv(seq id no:160),twnymnlgatlkgva(seq id no:161),cmtwnqmnlgatlkgva(seq id no:162),wnqmnlgat(seq id no:163),twnqmnlga(seq id no:164),mtwnqmnlg(seq id no:165),cmtwnlmnlgatlkgva(seq id no:166),wnlmnlgat(seq id no:167),mnlgatlkg(seqid no:168),mtwnqmnlg(seq id no:169),cmtwnymnlgatlkgva(seq id no:170),mnlgatlkg(seq id no:171),mtwnqmnlg(seq id no:172),galrnptac(seq id no:173),gylrnptac(seq id no:174),galrnptal(seq id no:175),yalrnptac(seq id no:176),gllrnptac(seq id no:177),rqrphpgal(seq id no:178),ryrphpgal(seq id no:179),yqrphpgal(seq id no:180),rlrphpgal(seq id no:181),rirphpgal(seq id no:182),galrnptac(seq id no:183),galrnptal(seq id no:184),rqrphpgal(seq id no:185),rlrphpgal(seq id no:186),rirphpgal(seq id no:187),qfpnhsfkhedpmgq(seq id no:188),qfpnhsfkhedpmgq(seq id no:189),hsfkhedpm(seq id no:190),hsfkhedpy(seq idno:191),hsfkhedpk(seq id no:192),krpfmcaypgcykry(seq id no:194),sekrpfmcaypgcnk(seq id no:194),krpfmcaypgcnk(seq id no:195),fmcaypgcn(seq idno:196),fmcaypgcy(seq id no:197),or fmcaypgck(seq id no:198)中任一修饰的wt1肽。
22、在另一个实施方案中,wt1肽是wo2005053618,wo2007047763,wo2007047764,wo2007120673,us20060084609,wo2014113490和wo2013106834中描述的任何修饰的wt1肽。前述内容通过引用整体并入本文。
23、在另一个实施方案中,wt1肽是us20110070251a1,us7063854b1,us7063854,us7901693,us7662386,7,063,854,us7115272,us7368119,us7329410,us7144581,us7323181,us7655249,us7,553,494,us7608685,us7380871,us7030212,us7807792,us7517950,us2010/0166738,us2011/0070251,us2009/0143291和wo2003037060中描述的任何修饰的wt1肽。前述内容通过引用整体并入本文。
24、在另一个实施方案中,wt1肽是us7666985b2,us20080070835a1,us20070128207a1,us7915393b2,us20110136141a1,us7598221b2,us20100111986a1,us20100092522a1,us20030082194a1和wo2001025273a2中描述的任何修饰的wt1肽。前述内容通过引用整体并入本文。
25、用于本文所述目的的一种或多种wt1肽可以是单一肽或肽的组合。每种肽可以是天然wt1肽或修饰的wt1肽。如果使用两种或更多种肽,每种可以单独(在分开的制剂中)或与另一种或多种肽(在相同制剂中)组合施用。一种或多种肽可以与载体,稀释剂或赋形剂组合施用。在一个实施方案中,所述肽与佐剂组合施用。每种肽可以与不同的佐剂或佐剂组合施用,或者肽可以以两种或更多种肽的组合和佐剂组合的佐剂的形式施用。含有一种或多种肽的免疫原或组合物在本文中可以被称为疫苗,肽疫苗,wt1疫苗等。
26、佐剂可以是任何类别的,例如明矾盐和其他矿物质佐剂,细菌产物或细菌衍生的佐剂,抗衰老剂(例如皂苷),水包油(o/w)和油包水(w/o)乳剂,脂质体佐剂,细胞因子(例如il-2,gm-csf,il-12和ifn-γ)和α-半乳糖苷神经酰胺类似物。佐剂的非限制性实例包括montanide乳剂,qs21,弗氏完全佐剂或不完全佐剂,磷酸铝,氢氧化铝,卡介苗(bcg)和明矾。在一个实施方案中,佐剂是增强针对wt1肽的免疫系统ctl应答的试剂,例如含有源自橄榄油的植物级(vg)油酸的表面活性剂甘露醇单油酸酯(montanide isa 51 vg w/o乳液)。佐剂可以施用在与一种或多种wt1肽相同的组合物,或与一种或多种检查点抑制剂相同的组合物,或以与一种或多种wt1肽和一种或多种检查点抑制剂相同的组合物,或与一种或多种wt1肽和一种或多种检查点抑制剂分开的组合物中。
27、在一个实施方案中,用于本文目的的一种或多种wt1肽是来自ymfpnapyl(seq idno:124),rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seq id no:2)和sgqaymfpnapylpscles(seq id no:125)中任意两种肽的组合。在一个实施方案中,用于本文目的的一种或多种wt1肽是来自ymfpnapyl(seq id no:124),rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seq id no:2)和sgqaymfpnapylpscles(seq idno:125)中任意三种肽的组合。在一个实施方案中,用于本文目的的一种或多种wt1肽是以下四种肽的组合:ymfpnapyl(seq id no:124),rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seq id no:2)和sgqaymfpnapylpscles(seq id no:125)。在一个实施方案中,出于本文的目的,任何一种或多种肽可与任何上述组合一起使用。
28、在一个实施方案中,wt1肽包含氨基酸序列sgqaymfpnapylpscles(seq id no:125),并且其中所述肽在hla i类或ii类结合基序的一级或二级锚定残基中具有一个或多个点突变。在一个实施方案中,wt1肽与氨基酸序列sgqaymfpnapylpscles(seq id no:125)具有至少83%的序列相同性。在一个实施方案中,wt1肽的长度为20-26个氨基酸,并且包含氨基酸序列sgqaymfpnapylpscles(seq id no:125)。在另一个实施方案中,wt1肽的长度为17或18个氨基酸并且包含氨基酸序列sgqaymfpnapylpscles(seq id no:125)的片段。在另一个实施方案中,wt1肽与氨基酸序列sgqaymfpnapylpscles(seq id no:125)具有至少88%的序列相同性,或至少93%的序列相同性。在另一个实施方案中,任何上述肽在hla i类结合基序的一级或二级锚定残基中具有一个或多个点突变。在一个实施方案中,所述肽在i类结合基序的2或9位或在i类结合基序的1、3、5、6、7或8的二级锚定残基位置具有点突变。在一个实施方案中,hla i类结合基序的1位肽被改变为甘氨酸,苏氨酸或苯丙氨酸;在一个实施方案中,hla i类结合基序的2位改变为亮氨酸或异亮氨酸;在一个实施方案中,hlai类结合基序的第6位改变为缬氨酸,谷氨酰胺或组氨酸;或者在一个实施方案中,hla i类结合基序的第9位改变为缬氨酸,丙氨酸,苏氨酸,异亮氨酸或半胱氨酸。
29、在一个实施方案中,用于本文的目的的一种或多种wt1肽是来自ymfpnapyl(seqid no:124),rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seq id no:125)和sgqaymfpnapylpscles(seq id no:2)中的两种,三种或四种肽的组合,并组合wo2014113490公开的那些中的一种或多种天然或修饰的wt1肽,例如nqmnlgatl(seq idno:147),nlmnlgatl(seq id no:148),nymnlgatl(seq id no:149),cmtwnqmnlgatlkg(seqid no:150),cmtwnlmnlgatlkg(seq id no:151),wnqmnlgatlkgvaa(seq id no:152),wnlmnlgatlkgvaa(seq id no:153),mtwnqmnlgatlkgv(seq id no:154),twnqmnlgatlkgva(seq id no:155),cmtwnlmnlgatlkg(seq id no:156),mtwnlmnlgatlkgv(seq id no:157),twnlmnlgatlkgva(seq id no:158),wnlmnlgatlkgvaa(seq id no:159),mtwnymnlgatlkgv(seq id no:1260),twnymnlgatlkgva(seq id no:161),cmtwnqmnlgatlkgva(seq id no:162),wnqmnlgat(seq id no:163),twnqmnlga(seq idno:164),mtwnqmnlg(seq id no:165),cmtwnlmnlgatlkgva(seq id no:166),wnlmnlgat(seq id no:167),mnlgatlkg(seq id no:168),mtwnqmnlg(seq id no:169),cmtwnymnlgatlkgva(seq id no:170),mnlgatlkg(seq id no:171),mtwnqmnlg(seq idno:172),galrnptac(seq id no:173),gylrnptac(seq id no:174),galrnptal(seq idno:175),yalrnptac(seq id no:176),gllrnptac(seq id no:177),rqrphpgal(seq idno:178),ryrphpgal(seq id no:179),yqrphpgal(seq id no:180),rlrphpgal(seq idno:181),rirphpgal(seq id no:182),galrnptac(seq id no:183),galrnptal(seq idno:184),rqrphpgal(seq id no:185),rlrphpgal(seq id no:186),rirphpgal(seq idno:187),qfpnhsfkhedpmgq(seq id no:188),qfpnhsfkhedpmgq(seq id no:189),hsfkhedpm(seq id no:190),hsfkhedpy(seq id no:191),hsfkhedpk(seq id no:192),krpfmcaypgcykry(seq id no:194),sekrpfmcaypgcnk(seq id no:194),krpfmcaypgcnk(seq id no:195),fmcaypgcn(seq id no:196),fmcaypgcy(seq id no:197)或fmcaypgck(seq id no:198)。
30、组合中的每种肽可以在其自己的制剂内分开施用,或者组合的两种,三种,四种,五种或更多种肽可以在相同制剂中一起施用。
31、根据患者的临床表现,持续时间或患者的病程,合并症和临床护理的其他方面,可以优化剂量水平或每种肽,每种肽或肽组合的施用频率,施用持续时间和免疫的其他方面疾病。关于本文实施方法的免疫接种组分的特定方面,本发明并非如此限制。
32、在一个实施方案中,wt-1疫苗包含280mcg的上述四种肽中的各种(ymfpnapyl(seqid no:124),rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seq id no:2)和sgqaymfpnapylpscles(seq id no:125)),总体积为0.7ml(每种肽0.4mg/ml)。在一个实施方案中,在每个剂量(0.5ml)下施用200mcg的每种肽。在一个实施方案中,在每个剂量下施用100至2000mcg的每种肽。在一个实施方案中,在10周的过程中每隔一周施用前述剂量(即,6次施用)。在一个实施方案中,施用是皮下的。在一个实施方案中,佐剂在施用前与疫苗混合(乳化)。在一个实施方案中,在施用之前,用1.0ml佐剂乳化0.5ml疫苗(即每种肽200μg)。在另一个实施方案中,在注射疫苗之前或之后,佐剂在与疫苗相同的部位注射。在一个实施方案中,佐剂是乳剂。在一个实施方案中,乳液是montanide乳剂。在一个实施方案中,montanide乳剂是免疫佐剂montanide isa 51vg。在本发明的实践中,还将检查点抑制剂连同wt1疫苗施用于受试者,如下面进一步描述的。
33、如上所述,所述一种或多种wt1肽可作为免疫原性组合物施用以引发针对表达wt1的癌症的免疫应答,或者在另一个实施方案中,所述一种或多种wt1肽使用体外或离体方法可用于制备wt1特异性所述ctl,所述ctl在施用于患者后将针对表达wt1的癌症。在一个实施方案中,使用一种或多种wt1肽来体外诱导ctl的产生,使用例如来自细胞系的细胞。在另一个实施方案中,所述一种或多种wt1肽用于诱导取自患者的细胞样品中ctl的产生,其中离体诱导的ctl被输注回有需要的相同患者。在另一个实施方案中,所述一种或多种wt1肽用于诱导从供体获取的细胞样品中ctl的产生,其中将体外诱导的ctl输注到不是供体的有需要的患者体内。在另一个实施方案中,给不需要治疗的患者的受试者施用本文所述的一种或多种wt1肽以诱导ctl的形成,然后将其从供体转移给患者。这些实施方案中的每一个都是本发明的其他方面,以及用于治疗癌症或降低癌症发生率或其复发的wt1特异性细胞的来源,如本文所述。
34、在所有前述方法中,无论是使用来自细胞系的免疫细胞的体外或离体方法,接种患者以诱导针对表达wt1的癌症的ctl应答,或获得来自供体的wt1特异性ctl,患者或不是患者的供体的情况下,检验点抑制剂的组合使用被体现在本文中,无论用于治疗,降低癌症发生率还是其复发的方法是通过用一种或多种wt1肽或体外或在供体受试者体外产生ctl。在所有这些方法中,本文具体体现了一种或多种检查点抑制剂的组合使用。可以将一种或多种检查点抑制剂施用给用一种或多种wt1肽免疫的患者。检查点抑制剂可以体外或离体使用以增强随后输注到患者体内的wt1特异性ctl的形成。一种或多种检查点抑制剂可用于供体受试者中以增强wt1特异性ctl的形成,然后将其转移至患者体内。检查点抑制剂可以用于接受在体外,离体或在供体中制备的ctl的患者,无论体外,离体或供体是否也被施用检查点抑制剂。在后面的实施方案中,相同或不同的一种或多种检查点抑制剂可用于体外,离体或供体受试者和患者体内。
35、免疫检查点调节免疫系统中的t细胞功能。t细胞在细胞介导的免疫中起核心作用。检查点蛋白与特定配体相互作用,这些特定配体向t细胞发送信号并基本上关闭或抑制t细胞功能。癌细胞通过驱动其表面上的检查点蛋白质的高水平表达来利用该系统,从而导致在进入肿瘤微环境的t细胞表面上表达检查点蛋白质的t细胞的控制,从而抑制抗癌免疫应答。因此,检查点蛋白的抑制将导致t细胞功能的恢复和对癌细胞的免疫应答。免疫检查点抑制剂(或检查点抑制剂)是阻断或抑制免疫检查点蛋白质(即阻断或抑制检查点受体或检查点受体配体)的化合物或试剂。检查点蛋白的实例包括但不限于ctla-4,pd-l1,pd-l2,pd1,b7-h3,b7-h4,btla,hvem,tim3,gal9,lag3,vista,ido,kir,2b4(属于cd2家族分子并且在所有nk细胞和记忆cd8+t细胞上表达),cd160(也称为by55),cgen-15049,chk1和chk2激酶,a2ar和各种b-7家族配体。程序性死亡-1(pd-1)是涉及调节t细胞活化的分子的免疫球蛋白超家族(igsf)的成员。pd-1在1992年被确认为一种基因在经历细胞死亡的t细胞杂交瘤中上调时获得了其“程序性死亡”的名称。pd-1的结构由一个igsf结构域,一个跨膜结构域和一个含有免疫受体酪氨酸抑制基序(itim)和免疫受体酪氨酸基开关基序(itsm)的胞内结构域组成[38]。pd-1具有两种结合伴侣:pd-l1(b7-h1,cd274)和pd-l2(b7-dc,cd273)。pd-l1广泛表达于造血系和非造血系[39,40]。它发现于t细胞,b细胞,巨噬细胞,nk细胞,dc和肥大细胞以及周围组织中[41,42]。pd-1参与代表肿瘤逃避免疫监视和清除的一种手段[43]。nivolumab已经证明pd-1途径的阻断,其在免疫活性小鼠癌症模型中显示出活性[44]。
36、检查点抑制剂的非限制性实例包括小分子,肽和抗体。抗体的非限制性实例包括nivolumab(opdivo),pembrolizumab(keytruda),pidilizumab(ct-011),medi0680(amp-514),amp-224,aunp-12,bms 936559,atezolizumab(mpdl3280a),durvalumab(medi4736),avelumab(msb0010718c),bms935559(mdx-1105),rhigm12b7,bms-986016,gsk2831781,imp321,lirilumab(bms-986015),iph2101(1-7f9),indoximod(nlg 9189),nlg 919,incb024360,pf-05082566,urelumab(bms-663513)和medi6469
37、nivolumab(opdivo)是在活化的t和b淋巴细胞上靶向pd-1受体的完全人igg4单克隆抗体[47]。pembrolizumab(keytruda)是靶向pd-1的抗体的另一个非限制性实例。阻断,抑制或靶向检查点蛋白的其它化合物和试剂包括正在进行测试且尚未在市场上销售的化合物。本发明不受特定检查点抑制剂的限制。表1中列出了可以使用的检查点抑制剂的非限制性实例。
38、表1.检查点抑制剂的实例
39、
40、
41、在一个实施方案中,向受试者施用两种或更多种检查点抑制剂的组合。在一个实施方案中,检查点抑制剂的组合选自表1中的那些。所述两种或更多种检查点抑制剂可以相对于彼此并且相对于一种或多种wt1肽同时或连续地施用。在另一个实施方案中,两种或更多种检查点抑制剂的组合靶向两种不同的检查点蛋白,例如pd-1(例如nivolumab或其他pd-1抑制剂)和ctla-4(例如ipilumumab或其他ctla-4抑制剂),相对于彼此且并且相对于一种或多种wt1肽同时或连续地施用于受试者。在一个实施方案中,两种或更多种检查点抑制剂的组合靶向两种或更多种不同的检查点蛋白:ctla-4,pd-l1,pd-l2,pd1,b7-h3,b7-h4,btla,hvem,tim3,gal9,lag3,vista,kir,2b4,cd160,cgen-15049,chk 1激酶,chk2激酶,a2ar和b-7家族配体。在一个实施方案中,靶向两种或更多种不同检查点蛋白的两种或更多种检查点抑制剂的组合选自表1中的那些。
42、可根据患者的临床表现,疾病的持续时间或病程,合并症和临床护理的其他方面来优化剂量水平,剂量频率,剂量持续时间和检查点抑制剂施用的其他方面。关于本文实施方法的检查点抑制剂组分的特定方面,本发明并非如此限制。
43、在一个实施方案中,在12周的过程中每2周3mg/kg的nivolumab剂量和时间表选择。在一个实施方案中,施用是静脉内的。在一个实施方案中,检查点抑制剂施用的过程与wt1疫苗施用的过程同时进行。在一个实施方案中,检查点抑制剂施用的过程与wt1疫苗施用的过程重叠。在一个实施方案中,检查点抑制剂施用的过程在与wt1疫苗施用的过程大致相同的时间开始。
44、在一个实施方案中,wt1疫苗包含200mcg的每种肽ymfpnapyl(seq id no:124),rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seq id no:2)和sgqaymfpnapylpscles(seq id no:125),组合在总体积0.5ml中,用1.0mlmontanide isa51 vg乳化,并每2周皮下施用6次;和nivolumab,3mg/kg,通过每两周60分钟输注静脉内施用7次施用,与wt1疫苗同时开始。
45、在一个实施方案中,本文体现了这样的方法,其中将所述一种或多种wt1肽和所述一种或多种检查点抑制剂各自根据最大程度上有益于所述患者的时间表施用于受试者。因此,所述一种或多种wt1肽和所述一种或多种检查点抑制剂不一定同时或甚至以相同组合物或每种相同的持续时间施用。每个wt1肽可以按照特定的时间表来施用,可以是每个检查点抑制剂。在一个非限制性实施方案中,所述一种或多种wt1肽和一种或多种检查点抑制剂存在于相同的组合物中。
46、如本文所述,剂量水平和剂量方案包括wt1肽或肽(单独或一起施用)的频率和持续时间以及一种或多种检查点抑制剂(分别或一起施用)的频率和持续时间,施用途径,和施用的其他方面被优化以使患者受试者受益最大。当供体受试者是wt1肽或肽的接受者以及用于产生wt1特异性ctl以供给患者的检查点抑制剂或抑制剂时,也考虑这些相同的方面。
47、在一个实施方案中,提供了含有至少一种wt1肽和至少一种检查点抑制剂的组合物。在一个实施方案中,组合物中的一个或多个wt1肽在本文公开的那些之中。在一个实施方案中,检查点抑制剂在本文公开的那些之中。在一个实施方案中,组合物包含来自以下的一种、两种、三种wt1肽:ymfpnapyl(seq id no:124),rsdelvrhhnmhqrnmtkl(seq id no:1),pgcnkryfklshlqmhsrkhtg(seq id no:2)和sgqaymfpnapylpscles(seq id no:125)。在一个实施方案中,组合物包含ymfpnapyl(seq id no:124),rsdelvrhhnmhqrnmtkl(seq idno:1),pgcnkryfklshlqmhsrkhtg(seq id no:2)和sgqaymfpnapylpscles(seq id no:125)。在一个实施方案中,组合物包含检查点抑制剂nivolumab,pembrolizumab或其组合。该组合物可以进一步包含赋形剂,稀释剂或载体。该组合物还可以包含一种或多种佐剂。
48、前述实施方案提供了针对表达wt1的癌症的改善的治疗,减少其发生率和诱导针对其免疫应答的方法,以及用于相同目的的组合物。下面进一步描述本发明的其他方面。
49、在一个实施方案中,修饰的wt1肽具有一个或多个改变的氨基酸,在本文中称为突变的wt1肽。在一个实施方案中,突变的wt1肽包含:(a)人类白细胞抗原(hla)ii类分子的结合基序;和(b)包含在hla i类分子的结合基序的一个或多个锚定残基中的点突变的hlai类分子的结合基序。在另一个实施方案中,该肽长度为11个或更多个氨基酸。在某些其他实施方案中,所述肽的长度为11-22、11-30、16-22或16-30个氨基酸。在另一个实施方案中,该点突变位于hlai类分子结合基序的1-3个锚定残基中。在另一个实施方案中,该点突变位于hla i类分子结合基序的1个锚定残基中。在另一个实施方案中,该点突变位于hlai类分子结合基序的2个锚定残基中。在另一个实施方案中,该点突变位于hlai类分子结合基序的1-2个锚定残基中。在另一个实施方案中,该点突变位于hlai类分子结合基序的2-3个锚定残基中。在另一个实施方案中,该点突变位于hlai类分子结合基序的1-4个锚定残基中。每种可能性代表本发明的单独实施例。
50、在另一个实施方案中,本发明提供了治疗患有表达wt1的癌症的受试者的方法,所述方法包括向所述受试者施用至少一种wt1肽和至少一种检查点抑制剂,由此治疗患有wt1-表达癌症。
51、在另一个实施方案中,本发明提供了降低受试者中表达wt1的癌症或其复发的发生率的方法,所述方法包括向受试者施用至少一种wt1肽和至少一种检查点抑制剂,从而在受试者中降低表达wt1的癌症或其复发的发生率。
52、在另一个实施方案中,本发明提供诱导wt1蛋白特异性ctl形成和增殖的方法,所述方法包括使淋巴细胞群与至少一种wt1肽和至少一种检查点抑制剂接触,从而诱导wt1蛋白特异性ctl的形成和增殖。
53、在另一个实施方案中,本发明提供诱导(a)wt1蛋白特异性cd8+淋巴细胞,和(b)wt1蛋白特异性的cd4+淋巴细胞的形成和增殖的方法,所述方法包括使淋巴细胞群与至少一种wt1肽和至少一种检查点抑制剂接触,从而诱导(a)wt1蛋白特异性cd8+淋巴细胞,和(b)对wt1蛋白具有特异性的cd4+淋巴细胞的形成和增殖。
54、在一个实施方案中,与如果仅使用单独的wt1肽或单独的检查点抑制剂的方法使用相比,前述用于治疗表达wt1的癌症,降低wt1表达癌症的发生率或诱导wt1蛋白特异性t细胞应答的形成和增殖的方法具有更好的效果。在一个实施方案中,wt1疫苗的施用过程和一种或多种检查点抑制剂的施用过程同时发生(concurrent),重叠(overlap)或同时期发生(contemporaneous),使得对疫苗的生物应答通过施用一种或多种检查点抑制剂来增强。同时施用包括wt1疫苗接种过程以诱导wt1特异性ctl,并施用一种或多种检查点抑制剂以增强针对癌症的ctl的活性。在一个实施方案中,wt1疫苗施用的过程可以在检查点抑制剂治疗开始之前结束,只要检查点抑制剂疗法增强wt1疫苗施用引发的ctl的有效性即可。在一个实施方案中,检查点抑制剂疗法的第一次施用与最后的wt1疫苗施用在同一天。在一个实施方案中,将wt1疫苗接种的结束和检查点抑制剂疗法的开始相隔1-7天或1-4周。
55、如本文所述,wt1肽可以是wt1蛋白的天然片段或连续氨基酸序列,或者它们可以具有一个或多个氨基酸序列修饰以增强免疫原性或该肽以及对表达wt1的癌症的免疫力的发展的任何其他有益性质。在某些实施方案中,改变一种或多种氨基酸以增强免疫原性。在一个实施方案中,使用方法使用分离的,突变的wt1肽,其包含:(a)人类白细胞抗原(hla)ii类分子的结合基序;和(b)hla i类分子的结合基序,其在hlai类分子的结合基序的1个或更多个锚定残基中具有点突变。在另一个实施方案中,肽的长度为11个或更多个氨基酸。每种可能性代表本发明的单独实施例。
56、在另一个实施方案中,“点突变”表示片段相对于蛋白质的天然序列发生突变,从而产生hla i类分子结合基序。在另一个实施方案中,“点突变”增强了存在于天然序列中的hla i类分子结合基序的结合能力。每种可能性代表了本发明使用方法的单独实施例。
57、在另一个实施方案中,所述点突变位于hla i类分子结合基序的1-3个锚定残基中。在另一个实施方案中,该点突变位于hla i类分子结合基序的1个锚定残基中。在另一个实施方案中,该点突变位于hla i类分子结合基序的2个锚定残基中。在另一个实施方案中,该点突变位于hla i类分子结合基序的1-2个锚定残基中。在另一个实施方案中,该点突变位于hla i类分子结合基序的2-3个锚定残基中。在另一个实施方案中,该点突变位于hla i类分子结合基序的1-4个锚定残基中。每种可能性代表本发明的单独实施例。
58、在另一个实施方案中,本发明的肽长度为11-453个氨基酸(aa)。在另一个实施例中,长度是12-453个aa。在另一个实施例中,长度是13-453个aa。在另一个实施例中,长度是14-453个aa。在另一个实施例中,长度是15-453个aa。在另一个实施例中,长度是16-453个aa。在另一个实施例中,长度为17-453个aa。在另一个实施例中,长度是18-453个aa。在另一个实施例中,长度是19-453aa。在另一个实施例中,长度是20-453个aa。
59、在另一个实施例中,长度是11-449aa。在另一个实施例中,长度是12-449个aa。在另一个实施例中,长度是13-449个aa。在另一个实施例中,长度是14-449aa。在另一个实施例中,长度是15-449个aa。在另一个实施例中,长度是16-449aa。在另一个实施例中,长度是17-449aa。在另一个实施例中,长度是18-449个aa。在另一个实施例中,长度是19-449aa。在另一个实施例中,长度是20-449个aa。
60、在另一个实施方案中,长度是11-30个aa。在另一个实施例中,长度是16-22aa。在另一个实施例中,长度是19个aa。在另一个实施方案中,肽的长度为15-23个aa。在另一个实施例中,长度是15-24aa。在另一个实施例中,长度是15-25aa。在另一个实施例中,长度是15-26aa。在另一个实施例中,长度是15-27aa。在另一个实施例中,长度是15-28aa。在另一个实施例中,长度是14-30aa。在另一个实施例中,长度是14-29aa。在另一个实施例中,长度是14-28aa。在另一个实施例中,长度是14-26aa。在另一个实施例中,长度是14-24aa。在另一个实施例中,长度是14-22aa。在另一个实施例中,长度是14-20aa。在另一个实施例中,长度是16-30aa。在另一个实施例中,长度是16-28aa。在另一个实施例中,长度是16-26aa。在另一个实施例中,长度是16-24aa。在另一个实施例中,长度是16-22aa。在另一个实施例中,长度是18-30aa。在另一个实施例中,长度是18-28aa。在另一个实施例中,长度是18-26aa。在另一个实施例中,长度是18-24aa。在另一个实施例中,长度是18-22aa。在另一个实施例中,长度是18-20aa。在另一个实施例中,长度是20-30aa。在另一个实施例中,长度是20-28aa。在另一个实施例中,长度是20-26aa。在另一个实施例中,长度是20-24aa。在另一个实施例中,长度是22-30aa。在另一个实施例中,长度是22-28aa。在另一个实施例中,长度是22-26aa。在另一个实施例中,长度是24-30aa。在另一个实施例中,长度是24-28aa。在另一个实施例中,长度是24-26aa。
61、在另一个实施方案中,用于本发明的方法和组合物的肽比用于结合hla ii类分子的最小长度更长,在另一个实施方案中,其为约12aa。在另一个实施方案中,增加hla ii类结合肽的长度使得能够结合多于一个hla ii类分子。在另一个实施方案中,增加长度使得能够结合其结合基序未知的hla ii类分子。在另一个实施方案中,增加长度使得能够结合hla i类分子。在另一个实施方案中,hla i类分子的结合基序是已知的。在另一个实施方案中,hla i类分子的结合基序是未知的。每种可能性代表本发明的单独实施例。
62、以上肽长度中的每一个表示本发明的单独实施方案。
63、在另一个实施方案中,作为主要组织相容性复合物(mhc)分子已知的hla分子结合肽并将它们呈递给免疫细胞。因此,在另一个实施方案中,肽的免疫原性部分由其对hla分子的亲和力决定。hla i类分子与cd8分子相互作用,cd8分子通常存在于细胞毒性t淋巴细胞(ctl)上。hla ii类分子与cd4分子相互作用,cd4分子通常存在于辅助性t淋巴细胞上。
64、在另一个实施方案中,本发明的肽是免疫原性的。在另一个实施方案中,术语“免疫原性”是指刺激,引发或参与免疫应答的能力。在另一个实施方案中,引发的免疫应答是细胞介导的免疫应答。在另一个实施方案中,免疫应答是细胞介导的应答和体液应答的组合。
65、在另一个实施方案中,结合hla分子-肽复合物的t细胞被激活并诱导增殖并裂解表达包含该肽的蛋白质的细胞。t细胞通常最初由“专职”抗原呈递细胞(“apc”;例如树突细胞,单核细胞和巨噬细胞)激活,其呈现促进t细胞活化而非无反应或凋亡的共刺激分子。在另一个实施方案中,如本文所述,所述反应是不均一的,使得ctl裂解表达具有与本发明的肽同源的aa序列或用于首先刺激t细胞的不同肽的蛋白质的肿瘤细胞。
66、在另一个实施方案中,t细胞与本发明的肽相遇诱导其分化为效应器和/或记忆t细胞。随后在效应物或记忆t细胞和相同肽之间遇到,或者在另一个实施方案中与本发明的不规则的肽之间的相遇导致更快和更强烈的免疫应答。在另一个实施方案中,通过测量暴露于肽的t细胞群体的增殖程度来衡量这样的应答。在另一个实施例中,这样的应答由下面列举的任何方法来测量。
67、在另一个实施方案中,如本文所述,将受试者暴露于肽或包含本发明肽的组合物/细胞群,所述组合物/细胞群不同于表达的天然蛋白质,其中随后宿主免疫应答与天然蛋白质/抗原发展。
68、在另一个实施方案中,本发明的肽,组合物和疫苗刺激导致肿瘤细胞溶解的免疫应答。在所有前述实施方案中,检查点抑制剂的同时使用增强针对肿瘤的免疫应答。
69、在另一个实施方案中,本发明肽的hla i类分子结合基序包含在肽的hla ii类分子结合基序内。在另一个实施方案中,hla i类分子结合基序与hla ii类分子结合基序重叠。在另一个实施方案中,hla i类分子结合基序不与hla ii类分子结合基序重叠。每种可能性代表本发明的单独实施例。
70、在另一个实施方案中,结合基序包含在本发明的肽中的hla ii类分子是hla-dr分子。在另一个实施方案中,hla ii类分子是hla-dp分子。在另一个实施方案中,hlaii类分子是hla-dq分子。
71、在另一个实施方案中,hla ii类分子是hla-drb分子。在另一个实施方案中,hlaii类分子是drb101。在另一个实施方案中,hlaii类分子是drb301。在另一个实施方案中,hlaii类分子是drb401。在另一个实施方案中,hla ii类分子是drb701。在另一个实施方案中,hla ii类分子是drb1101。在另一个实施方案中,hlaii类分子是drb1501。在另一个实施方案中,hla ii类分子是本领域已知的任何其他hla-drb分子。在另一个实施方案中,hlaii类分子是hla-dra分子。在另一个实施方案中,hla ii类分子是hla-dqa1分子。在另一个实施方案中,hlaii类分子是hla-dqb1分子。在另一个实施方案中,hla ii类分子是hla-dpa1分子。在另一个实施方案中,hlaii类分子是hla-dpb1分子。在另一个实施方案中,hlaii类分子是hla-dma分子。在另一个实施方案中,hlaii类分子是hla-dmb分子。在另一个实施方案中,hla ii类分子是hla-doa分子。在另一个实施方案中,hla ii类分子是hla-dob分子。在另一个实施方案中,hla ii类分子是本领域已知的任何其他hlaii类分子。
72、在另一个实施方案中,本发明的肽结合2种不同的hla ii类分子。在另一个实施方案中,所述肽结合三种不同的hla ii类分子。在另一个实施方案中,所述肽结合四种不同的hla ii类分子。在另一个实施方案中,所述肽结合五种不同的hlaii类分子。在另一个实施方案中,所述肽结合六种不同的hla ii类分子。在另一个实施方案中,所述肽结合多于六种不同的hla ii类分子。
73、在另一个实施方案中,由本发明的肽结合的hlaii类分子由给定hlaii类基因座处的两个或更多个不同的等位基因编码。在另一个实施方案中,hla ii类分子由基因座上的三个不同的等位基因编码。在另一个实施方案中,hla ii类分子由基因座处的四个不同的等位基因编码。在另一个实施方案中,hla ii类分子由基因座上的五个不同的等位基因编码。在另一个实施方案中,hla ii类分子由基因座上的六个不同的等位基因编码。在另一个实施方案中,hla ii类分子由一个基因座上多于六个不同的等位基因编码。
74、在另一个实施方案中,由肽结合的hla ii类分子在两个不同的基因座处由hlaii类基因编码。在另一个实施方案中,hla ii类分子由2个或更多个不同基因座的hla ii类基因编码。在另一个实施方案中,hlaii类分子由3个不同基因座的hla ii类基因编码。在另一个实施方案中,hla ii类分子由3个或更多个不同基因座的hla ii类基因编码。在另一个实施方案中,hlaii类分子4个不同的基因座的hlaii类基因编码。在另一个实施方案中,hlaii类分子由4个或更多个不同的基因座的hla ii类基因编码。在另一个实施方案中,hla ii类分子由5个不同基因座的hla ii类基因编码。在另一个实施方案中,hlaii类分子由5个或更多个不同基因座处的hlaii类基因编码。在另一个实施方案中,hla ii类分子由6个不同基因座的hlaii类基因编码。在另一个实施方案中,hla ii类分子由6个或更多个不同基因座的hla ii类基因编码。在另一个实施方案中,hla ii类分子由多于6个不同基因座的hlaii类基因编码。每种可能性代表本发明的单独实施例。
75、在另一个实施方案中,本发明的肽结合2种不同的hla-drb分子。在另一个实施方案中,所述肽结合三种不同的hla-drb分子。在另一个实施方案中,所述肽结合四种不同的hla-drb分子。在另一个实施方案中,所述肽结合五种不同的hla-drb分子。在另一个实施方案中,所述肽结合六种不同的hla-drb分子。在另一个实施方案中,所述肽结合多于六种不同的hla-drb分子。
76、在另一个实施方案中,由wt1肽结合的hlaii类分子由2个不同基因座的hla ii类基因编码。在另一个实施方案中,结合的hla分子由2个或更多个不同的基因座的hlaii类基因编码。在另一个实施方案中,结合的hla分子由3个不同基因座的hla ii类基因编码。在另一个实施方案中,结合的hla分子由3个或更多个不同基因座的hla ii类基因编码。在另一个实施方案中,结合的hla分子由4个不同的基因座的hlaii类基因编码。在另一个实施方案中,结合的hla分子由4个或更多个不同的基因座的hla ii类基因编码。在另一个实施方案中,结合的hla分子由超过4个不同的基因座的hla ii类基因编码。在其他实施方案中,所述基因座选自hla-drb基因座。在另一个实施方案中,hla ii类结合肽是hla-dra结合肽。在另一个实施方案中,该肽是hla-dqa1结合肽。在另一个实施方案中,肽是hla-dqb1结合肽。在另一个实施方案中,所述肽是hla-dpa1结合肽。在另一个实施方案中,肽是hla-dpb1结合肽。在另一个实施方案中,肽是hla-dma结合肽。在另一个实施方案中,肽是hla-dmb结合肽。在另一个实施方案中,该肽是hla-doa结合肽。在另一个实施方案中,肽是hla-dob结合肽。在另一个实施方案中,该肽与本领域已知的任何其他hlaii类分子结合。每种可能性代表本发明的单独实施例。
77、在另一个实施方案中,本发明的肽结合到由从drb 101,drb 301,drb 401,drb701,drb 1101和drb 1501选择的2种不同的hla-drb等位基因编码的hla-drb分子。在另一个实施方案中,所述肽结合由选自drb 101,drb 301,drb 401,drb 701,drb 1101和drb1501的3种不同的hla-drb等位基因编码的hla-drb分子。在另一个实施方案中,所述肽与hla结合通过从drb 101,drb 301,drb 401,drb 701,drb 1101和drb 1501选择在另一个实施方案4种不同的hla-drb等位基因编码-drb分子,所述肽结合由5种不同的hla-编码hla-drb分子从drb 101,drb 301,drb 401,drb 701,drb 1101和drb 1501选择。在另一个实施方案中drb等位基因,所述肽结合由以下各hla-drb等位基因编码的hla-drb分子:drb 101,drb 301,drb 401,drb 701,drb 1101和drb 1501。每个可能性表示本发明的单独实施例。
78、上述每个hla ii类分子,类型,类别及其组合代表本发明的单独实施方案。
79、在另一个实施方案中,结合基序包含在本发明的肽中的hla i类分子是hla-a分子。在另一个实施方案中,hla i类分子是hla-b分子。在另一个实施方案中,hla i类分子是hla-c分子。在另一个实施方案中,hla i类分子是hla-a0201分子。在另一个实施方案中,该分子是hlaa1。在另一个实施方案中,hla i类分子是hlaa2。在另一个实施方案中,hla i类分子是hlaa2.1。在另一个实施方案中,hla i类分子是hlaa3。在另一个实施方案中,hla i类分子是hlaa3.2。在另一个实施方案中,hla i类分子是hlaa11。在另一个实施方案中,hlai类分子是hlaa24。在另一个实施方案中,hla i类分子是hlab7。在另一个实施方案中,hlai类分子是hla b27。在另一个实施方案中,hla i类分子是hla b8。每种可能性代表本发明的单独实施例。
80、在另一个实施方案中,本发明的方法和组合物的hla i类分子结合wt1肽结合hlai类分子的超家族。在另一个实施方案中,超家族是a2超家族。在另一个实施方案中,超家族是a3超家族。在另一个实施方案中,超家族是a24超家族。在另一个实施方案中,超家族是b7超家族。在另一个实施方案中,超家族是b27超家族。在另一个实施方案中,超家族是b44超家族。在另一个实施方案中,超家族是c1超家族。在另一个实施方案中,超家族是c4超家族。在另一个实施方案中,超家族是本领域已知的任何其他超家族。每种可能性代表本发明的单独实施例。
81、在另一个实施方案中,本发明肽的hla i类分子结合基序相对于肽的未突变对应物表现出对hla i类分子的增加的亲和力。在另一个实施方案中,该点突变增加了分离的,突变的wt1肽对hla i类分子的亲和力。在另一个实施方案中,亲和力的增加相对于分离的,未突变的wt1肽的亲和力(对于相同的hla i类分子),其中衍生出分离的,突变的wt1肽。每种可能性代表本发明的单独实施例。
82、在另一个实施方案中,本发明的方法和组合物的hla i类分子结合wt肽具有9-13个aa的长度。在另一个实施例中,长度是8-13aa。在另一个实施方案中,所述肽具有本文列举的本发明的肽的任何长度。
83、在另一个实施方案中,hla i类分子结合wt肽具有8个aa的长度。在另一个实施方案中,该肽具有9个aa的长度。在另一个实施方案中,该肽具有10个aa的长度。如本文所提供的,9-10aa的天然和不规则的肽显示出对hla i类分子的实质性结合以及通过ctl引起细胞因子分泌和细胞溶解的能力。
84、在另一个实施方案中,嵌入本发明的wt1肽内的hla i类分子结合wt1肽具有上述长度中的1个。每种可能性代表本发明的单独实施例。在一个实施方案中,wt1肽是比hla i类分子结合wt1肽长的肽。较长长度的肽被细胞降解至适合hla 1类分子呈递的长度。
85、在另一个实施方案中,被hla i类分子结合wt1肽结合的hla i类分子是hla-a分子。在另一个实施方案中,hla i类分子是hla-a2分子。在另一个实施方案中,hlai类分子是hla-a3分子。在另一个实施方案中,hlai类分子是hla-a11分子。在另一个实施方案中,hlai类分子是hla-b8分子。在另一个实施方案中,hla i类分子是hla-0201分子。在另一个实施方案中,hla i类分子结合本领域已知的任何其他hla i类分子。每种可能性代表本发明的单独实施例。
86、在另一个实施方案中,本发明的肽保留结合多个hla ii类分子的能力,如从其衍生本发明肽的分离的wt1肽所显示的。
87、在本文的所有方面中,可用于本文疫苗中或用于体外,离体或在供体中产生ctl的一种或多种wt1肽,天然或修饰的肽或肽序列的选择匹配患者或捐献者的hla类型在此被体现。
88、在另一个实施方案中,衍生本发明肽的wt1分子具有以下序列:
89、mgsdvrdlnallpavpslgggggcalpvsgaaqwapvldfappgasaygslggpapppappppppppphsfikqepswggaepheeqclsaftvhfsgqftgtagacrygpfgppppsqassgqarmfpnapylpsclesqpairnqgystvtfdgtpsyghtpshhaaqfpnhsfkhedpmgqqgslgeqqysvpppvygchtptdsctgsqalllrtpyssdnlyqmtsqlecmtwnqmnlgatlkgvaagssssvkwtegqsnhstgyesdnhttpilcgaqyrihthgvfrgiqdvrrvpgvaptlvrsasetsekrpfmcaypgcnkryfklshlqmhsrkhtgekpyqcdfkdcerrfsrsdqlkrhqrrhtgvkpfqcktcqrkfsrsdhlkthtrthtgktsekpfscrwpscqkkfarsdelvrhhnmhqrnmtklqlal(seq id no:199;genbank登陆号ay245105)。
90、在另一个实施方案中,wt1分子具有以下序列:
91、aaeasaerlqgrrsrgasgsepqqmgsdvrdlnallpavpslgggggcalpvsgaaqwapvldfappgasaygslggpapppappppppppphsfikqepswggaepheeqclsaftvhfsgqftgtagacrygpfgppppsqassgqarmfpnapylpsclesqpairnqgystvtfdgtpsyghtpshhaaqfpnhsfkhedpmgqqgslgeqqysvpppvygchtptdsctgsqalllrtpyssdnlyqmtsqlecmtwnqmnlgatlkghstgyesdnhttpilcgaqyrihthgvfrgiqdvrrvpgvaptlvrsasetsekrpfmcaypgcnkryfklshlqmhsrkhtgekpyqcdfkdcerrfsrsdqlkrhqrrhtgvkpfqcktcqrkfsrsdhlkthtrthtgekpfscrwpscqkkfarsdelvrhhnmhqrnmtklqlal(seq id no:200;genbank登陆号nm_000378)。
92、在另一个实施方案中,wt1分子具有以下序列:
93、mqdpastcvpepasqhtlrsgpgclqqpeqqgvrdpggiwaklgaaeasaerlqgrrsrgasgsepqqmgsdvrdlnallpavpslgggggcalpvsgaaqwapvldfappgasaygslggpapppappppppppphsfikqepswggaepheeqclsaftvhfsgqftgtagacrygpfgppppsqassgqarmfpnapylpsclesqpairnqgystvtfdgtpsyghtpshhaaqfpnhsfkhedpmgqqgslgeqqysvpppvygchtptdsctgsqalllrtpyssdnlyqmtsqlecmtwnqmnlgatlkgvaagssssvkwtegqsnhstgyesdnhttpilcgaqyrihthgvfrgiqdvrrvpgvaptlvrsasetsekrpfmcaypgcnkryfklshlqmhsrkhtgekpyqcdfkdcerrfsrsdqlkrhqrrhtgvkpfqcktcqrkfsrsdhlkthtrthtgekpfscrwpscqkkfarsdelvrhhnmhqrnmtklqlal(seq id no:201;genbank登陆号np_077742)。
94、在另一个实施方案中,wt1分子包括以下序列:
95、mghhhhhhhhhhssghiegrhmrrvpgvaptlvrsasetsekrpfmcaypgcnkryfklshlqmhsrkhtgekpyqcdfkdcerrffrsdqlkrhqrrhtgvkpfqcktcqrkfsrsdhlkthtrthtgekpfscrwpscqkkfarsdelvrhhnmhqrnmtklqlal(seq id no:202)。
96、在其他实施方案中,wt1蛋白包含以下genbank序列条目之一中列出的序列之一:nm_024426,nm_024425,nm_024424,nm_000378,s95530,d13624,d12496,d12497,ah003034或x77549。在其他实施方案中,wt1蛋白具有上述genbank序列条目之一中列出的序列之一。在另一个实施方案中,wt1蛋白是本领域已知的任何wt1蛋白。在另一个实施方案中,wt1蛋白具有本领域已知的任何其他wt1序列。
97、在另一个实施方案中,用于本发明目的的肽衍生自wt1蛋白的片段。在另一个实施方案中,衍生方法包括在hlai类分子结合基序的锚定残基中引入点突变。在另一个实施方案中,衍生方法由在hlai类分子结合基序的锚定残基中引入点突变组成。在另一个实施方案中,本发明的肽与wt1蛋白的相应片段仅在hla i类分子结合基序锚定残基中的点突变处不同。在另一个实施方案中,本发明的肽的hla i类分子结合基序与相应的wt1序列仅在锚定残基中的点突变处不同。每种可能性代表本发明的单独实施例。
98、在另一个实施方案中,本发明肽的衍生方法还包括氨基酸(aa)到aa类似物的一种或多种修饰。在另一个实施方案中,衍生方法进一步包括连接两个或更多个aa的一个或更多个肽键的修饰。在另一个实施方案中,aa类似物或肽键修饰是以下列举的aa类似物或肽键修饰中的一种。每种可能性代表本发明的单独实施例。
99、在另一个实施方案中,来源于本发明的肽(野生型序列中的“对应物”)的wt1蛋白的未突变片段具有序列sgqarmfpnapylpscles(seq id no:5)。在另一个实施方案中,未突变的wt1片段具有序列qarmfpnapylpscl(seq id no:6)。在另一个实施方案中,未突变的wt1片段具有序列lvrhhnmhqrnmtkl(seq id no:3)。在另一个实施方案中,未突变的wt1片段具有序列rsdelvrhhnmhqrnmtkl(seq id no:1)。在另一个实施方案中,未突变的wt1片段具有序列nkryfklshlqmhsr(seq id no:4)。在另一个实施方案中,未突变的wt1片段具有序列pgcnkryfklshlqmhsrkhtg(seq id no:2)。在另一个实施方案中,未突变的wt1片段是含有hla ii类分子结合基序的任何其他wt1片段。在另一个实施方案中,未突变的wt1片段是含有hla-dr分子结合基序的任何其他wt1片段。
100、在另一个实施方案中,未突变的wt1片段含有多个hla-dr分子结合基序。在另一个实施方案中,未突变的wt1片段是含有hla-drb分子结合基序的任何其他wt1片段。在另一个实施方案中,未突变的wt1片段含有多个hla-drb分子结合基序。在另一个实施方案中,本发明的肽相比于其对应物区别仅为其含有的点突变不同。在另一个实施方案中,本发明的肽相比于其对应物区别仅为hlai类锚定残基中的突变不同。每种可能性代表本发明的单独实施例。
101、在另一个实施方案中,本发明的肽保留了结合ii类hla分子的能力,如来源于该肽的未突变的wt1片段所显示的。在另一个实施方案中,本发明的肽保留结合多个hla ii类分子的能力,如未突变的wt1片段所显示的。每种可能性代表本发明的单独实施例。
102、在另一个实施方案中,本发明提供了包含aa序列gatlkgvaagssssvkwt(seq idno:203)和lkgvaagssssvkwt(seq id no:204)的分离的肽。
103、在本发明的方法和组合物的另一个实施方案中,“肽”是指通过肽键连接的亚基aa的化合物。在另一个实施方案中,该肽包含aa类似物。在另一个实施方案中,该肽是肽模拟物。在另一个实施方案中,本发明的肽包含下文列举的aa类似物之一。在另一个实施方案中,亚基通过肽键连接。在另一个实施方案中,亚基通过另一种类型的键连接,例如,酯,醚等。在另一个实施方案中,本发明的肽是以下列举的肽模拟物类型之一。每种可能性代表本发明的单独实施例。
104、在另一个实施方案中,本发明的方法和组合物的肽以高亲和力与其中包含其结合基序的hla i类分子结合。在其他实施方案中,hla i类分子是本文列举的任何hla i类分子。在另一个实施方案中,肽以中等亲和力与hlai类分子结合。在另一个实施方案中,肽以显著的亲和力与hla i类分子结合。在另一个实施方案中,肽以可测量的亲和力与hla i类分子结合。在另一个实施方案中,该肽展现出对hla i类分子的稳定结合。每种可能性代表本发明的单独实施例。
105、在另一个实施方案中,本发明的方法和组合物的肽以高亲和力与其中包含其结合基序的hla ii类分子结合。在其他实施方案中,hla ii类分子是本文列举的任何hla ii类分子。在另一个实施方案中,所述肽以高亲和力与多于1种hla ii类分子结合。在另一个实施方案中,所述肽以中等亲和力与hlaii类分子结合。在另一个实施方案中,所述肽以中等亲和力结合超过1种hla ii类分子。在另一个实施方案中,肽以显著的亲和力与hla ii类分子结合。在另一个实施方案中,所述肽以显著亲和力结合超过1种hla ii类分子。在另一个实施方案中,肽以可测量的亲和力与hla ii类分子结合。在另一个实施方案中,所述肽以可测量的亲和力与多于1种hla ii类分子结合。在另一个实施方案中,该肽展现出与hla ii类分子的稳定结合。在另一个实施方案中,所述肽表现出对超过1种hla ii类分子的稳定结合。每种可能性代表本发明的单独实施例。
106、在另一个实施方案中,本发明的方法和组合物的肽以显著的亲和力结合hla i类分子和hla ii类分子。在另一个实施方案中,所述肽以高亲和力结合hla i类分子和hla ii类分子。在另一个实施方案中,所述肽以中等亲和力结合hla i类分子和hla ii类分子。在另一个实施方案中,所述肽以可测量的亲和力结合hla i类分子和hla ii类分子。每种可能性代表本发明的单独实施例。
107、在另一个实施方案中,“片段”是指长度为11或更多的aa的肽。在另一个实施方案中,本发明的肽片段长度为16个或更多个aa。在另一个实施方案中,片段长度为12个或更多个aa。在另一个实施方案中,片段是13个或更多个aa。在另一个实施方案中,片段是14或更多的aa。在另一个实施方案中,片段是15个或更多个aa。在另一个实施方案中,片段是17个或更多个aa。在另一个实施方案中,片段是18或更多的aa。在另一个实施方案中,片段是19或更多的aa。在另一个实施方案中,片段是22个或更多个aa。在另一个实施方案中,片段是8-12个aa。在另一个实施方案中,该片段是约8-12个aa。在另一个实施方案中,片段是16-19个aa。在另一个实施方案中,该片段是约16-19个aa。在另一个实施方案中,片段是10-25个aa。在另一个实施方案中,片段是约10-25个aa。在另一个实施例中,片段具有任何其他长度。每种可能性代表本发明的单独实施例。
108、在另一个实施方案中,本发明提供了包含本发明的分离的肽与至少1种另外的wt1肽的组合物。在某些实施方案中,提供了包含至少2种本发明不同分离肽的组合物。在某些实施方案中,提供了包含至少3种或至少4种本发明不同分离肽的组合物。每种可能性代表本发明的单独实施例。在某些实施方案中,本发明的组合物是疫苗。
109、在另一个实施方案中,本发明的方法和组合物的肽以显著的亲和力结合hla ii类分子,而衍生自原始肽的肽以显著的亲和力结合hla i类分子。
110、在另一个实施方案中,“亲和力”是指抑制50%标准肽与所示mhc分子结合所必需的肽浓度。在另一个实施方案中,“高亲和力”是指亲和力使得对于标准肽的结合的50%抑制需要浓度为约500纳摩尔(nm)或更少的肽。在另一个实施方案中,需要约400nm或更少的肽浓度。在另一个实施方案中,结合亲和力是300nm。在另一个实施方案中,结合亲和力是200nm。在另一个实施方案中,结合亲和力是150nm。在另一个实施方案中,结合亲和力是100nm。在另一个实施方案中,结合亲和力是80nm。在另一个实施方案中,结合亲和力是60nm。在另一个实施方案中,结合亲和力是40nm。在另一个实施方案中,结合亲和力是30nm。在另一个实施方案中,结合亲和力是20nm。在另一个实施方案中,结合亲和力是15nm。在另一个实施方案中,结合亲和力是10nm。在另一个实施方案中,结合亲和力是8nm。在另一个实施方案中,结合亲和力是6nm。在另一个实施方案中,结合亲和力是4nm。在另一个实施方案中,结合亲和力是3nm。在另一个实施方案中,结合亲和力是2nm。在另一个实施方案中,结合亲和力是1.5nm。在另一个实施方案中,结合亲和力是1nm。在另一个实施方案中,结合亲和力是0.8nm。
111、在另一个实施方案中,结合亲和力是0.6nm。在另一个实施方案中,结合亲和力是0.5nm。
112、在另一个实施方案中,结合亲和力是0.4nm。在另一个实施方案中,结合亲和力是0.3nm。
113、在另一个实施方案中,结合亲和力小于0.3nm。
114、在另一个实施方案中,“亲和力”是指与mhc分子的结合强度的量度。在另一个实施方案中,使用本领域已知的方法测量亲和力以测量竞争性结合亲和力。在另一个实施方案中,使用本领域已知的方法测量亲和力以测量相对结合亲和力。在另一个实施方案中,该方法是竞争性结合测定法。在另一个实施方案中,该方法是放射免疫测定或ria。在另一个实施例中,该方法是biacore分析。在另一个实施例中,该方法是本领域已知的任何其他方法。在另一个实施方案中,该方法产生与已知亲和力的参考肽的ic50相关的ic50。
115、每种类型的亲和力和亲和力测量方法代表本发明的单独实施方案。
116、在另一个实施方案中,“高亲和力”是指0.5-100nm的ic50。在另一个实施方案中,ic50是1-100nm。在另一个实施方案中,ic50是1.5-200nm。在另一个实施方案中,ic50是2-100nm。在另一个实施方案中,ic50是3-100nm。在另一个实施方案中,ic50是4-100nm。在另一个实施方案中,ic50是6-100nm。在另一个实施方案中,ic50是10-100nm。在另一个实施方案中,ic50是30-100nm。在另一个实施方案中,ic50是3-80nm。在另一个实施方案中,ic50是4-60nm。在另一个实施方案中,ic50是5-50nm。在另一个实施方案中,ic50是6-50nm。在另一个实施方案中,ic50是8-50nm。在另一个实施方案中,ic50是10-50nm。在另一个实施方案中,ic50是20-50nm。在另一个实施方案中,ic50是6-40nm。在另一个实施方案中,ic50是8-30nm。在另一个实施方案中,ic50是10-25nm。在另一个实施方案中,ic50是15-25nm。每个亲和力和亲和力范围代表本发明的单独实施方案。
117、在另一个实施方案中,“中等亲和力”是指100-500nm的ic50。在另一个实施方案中,ic50是100-300nm。在另一个实施方案中,ic50是100-200nm。在另一个实施方案中,ic50是50-100nm。在另一个实施方案中,ic50是50-80nm。在另一个实施方案中,ic50是50-60nm。每个亲和力和亲和力范围代表本发明的单独实施方案。
118、在另一个实施方案中,“显著亲和力”是指足够的亲和力以介导携带识别mhc分子-肽复合物的t细胞受体(tcr)的t细胞识别靶细胞。在另一个实施方案中,该术语是指足够的亲和力以介导携带识别mhc分子-肽复合物的tcr的t细胞识别癌细胞。在另一个实施方案中,该术语是指足够的亲和力以介导呈递该肽的树突细胞激活幼稚t细胞。在另一个实施方案中,该术语是指足够的亲和力以介导呈递该肽的apc激活幼稚t细胞。在另一个实施方案中,该术语是指足够的亲和力以介导呈递该肽的树突细胞对记忆t细胞的再激活。在另一个实施方案中,该术语是指足够的亲和力以介导呈递该肽的apc对记忆t细胞的再激活。在另一个实施方案中,该术语是指足够的亲和力以介导呈递该肽的体细胞对记忆t细胞的再激活。每种可能性代表本发明的单独实施例。
119、在另一个实施方案中,“可测量的亲和力”指通过免疫学测定可测量的足够的亲和力。在另一个实施方案中,免疫学测定是本文列举的任何测定。每种可能性代表本发明的单独实施例。
120、在另一个实施方案中,本发明的方法和组合物的肽结合hla分子的超家族。hla分子的超家族享有非常相似或相同的结合基序。在另一个实施方案中,超家族是hlai类超家族。在另一个实施方案中,超家族是hla ii类超家族。每种可能性代表本发明的单独实施例。
121、在另一个实施方案中,术语“hla结合肽”,“hla i类分子结合肽”和“hla ii类分子结合肽”是指以可测量的亲和力结合hla分子的肽。在另一个实施方案中,这些术语是指以高亲和力结合hla分子的肽。在另一个实施方案中,这些术语是指以足够亲和力结合hla分子以活化t细胞前体的肽。在另一个实施方案中,这些术语是指以足够的亲和力结合hla分子以介导t细胞识别的肽。在其他实施方案中,hla分子是本文列举的任何hla分子。每种可能性代表本发明的单独实施例。
122、在另一个实施方案中,本发明的方法和组合物的肽是不规则的(heteroclitic)。在另一个实施方案中,“不规则的”是指产生识别不规则的肽所衍生自的不规则的原始肽(例如不含锚定残基突变的肽)的免疫应答的肽。在另一个实施方案中,“原始肽”是指wt1蛋白的片段。例如,通过将残基5突变为精氨酸,从野生型wt1肽sgqarmfpnapylpscles(seq idno:5)产生具有序列sgqaymfpnapylpscles(seq id no:124)的称为“wt1122a1”的肽。不规则的突变引入cd8+wt1肽rmfpnapyl(seq id no:7)肽产生的ymfpnapyl(seq id no:124),wt1a1肽。在另一个实施方案中,“不规则的”是指产生免疫应答的肽,所述免疫应答识别衍生自不规则的肽的原始肽,其中通过用不规则的肽接种疫苗产生的免疫应答大于用原始肽接种产生的免疫应答。在另一个实施方案中,“不规则的”免疫应答是指识别衍生自改良肽的原始肽(例如不含锚定残基突变的肽)的免疫应答。在另一个实施方案中,“不规则的”免疫应答是指识别衍生自不规则的肽的原始肽的免疫应答,其中通过用不规则的肽接种所产生的免疫应答大于用原始肽接种所产生的免疫应答。在另一个实施方案中,通过用不规则的肽疫苗接种产生的免疫应答的量级大于基本上等于对用原始肽接种疫苗的应答的免疫应答。在另一个实施方案中,通过用不规则的肽的疫苗接种产生的免疫应答的量级大于对原始肽接种疫苗的应答小于免疫应答的量级。每种可能性代表本发明的单独实施例。
123、在另一个实施方案中,本发明的不规则的肽诱导相对于衍生自不规则的肽的wt1肽(“天然肽”)增加至少2倍的免疫应答。在另一个实施方案中,相对于天然肽增加3倍。在另一个实施方案中,相对于天然肽增加5倍。在另一个实施方案中,相对于天然肽增加7倍。在另一个实施方案中,相对于天然肽增加10倍。在另一个实施方案中,相对于天然肽增加15倍。在另一个实施方案中,相对于天然肽增加20倍。在另一个实施方案中,相对于天然肽增加30倍。在另一个实施方案中,相对于天然肽增加50倍。在另一个实施方案中,相对于天然肽增加100倍。在另一个实施方案中,相对于天然肽增加150倍。在另一个实施方案中,相对于天然肽增加200倍。在另一个实施方案中,相对于天然肽增加300倍。在另一个实施方案中,相对于天然肽增加500倍。在另一个实施方案中,相对于天然肽增加1000倍。在另一个实施方案中,相对于天然肽增加超过1000倍。每种可能性代表本发明的单独实施例。
124、在另一个实施方案中,本发明的不规则的肽是hlai类不规则的肽。在另一个实施方案中,本发明的不规则的肽是hla ii类不规则的肽。在另一个实施方案中,本发明的不规则的ii型肽在ii类结合残基中突变。在另一个实施方案中,如本文所例示的,以类似于hlai类不规则的肽的鉴定和测试的方式鉴定和测试本发明的不规则的ii类肽。每种可能性代表本发明的单独实施例。
125、在另一个实施方案中,“锚定基序”或“锚定残基”是指hla-结合序列中特定位置上的一个或一组优选残基。例如,位置1、2、3、6和9处的残基被用作锚定残基。在另一个实施方案中,hla结合序列是hlaii类结合序列。在另一个实施方案中,hla结合序列是hla i类结合序列。在另一个实施方案中,对应于锚定基序的位置是那些在结合hla分子中起重要作用的位置。在另一个实施方案中,锚定残基是一级锚定基序。在另一个实施方案中,锚定残基是二级锚定基序。每种可能性代表本发明的单独实施例。
126、在另一个实施方案中,“锚定残基”是hlai类结合基序的位置1、3、6和9中的残基。在另一个实施方案中,该术语是指hlai类结合基序的位置1、2、6和9。在另一个实施方案中,该术语是指hlai类结合基序的位置1、6和9。在另一个实施方案中,该术语是指hla i类结合基序的位置1、2和9。在另一个实施方案中,该术语是指hla i类结合基序的位置1、3和9。在另一个实施方案中,该术语是指hla i类结合基序的2和9位。在另一个实施方案中,该术语是指hlai类结合基序的位置6和9。每种可能性代表本发明的单独实施例。
127、用于鉴定mhc ii类表位的方法是本领域众所周知的。在另一个实施方案中,使用tepitope(meister ge,roberts cg等,vaccine 199513:581-91)预测mhc ii类表位。在另一个实施方案中,使用epimatrix(de grootas,jesdale bm等,aids res humretroviruses 199713:529-31)鉴定mhc ii类表位。在另一个实施方案中,使用预测方法(yu k,petrovsky n等,mol med.200288:137-48)鉴定mhc ii类表位。在另一个实施方案中,使用syfpeithi表位预测算法鉴定mhc ii类表位。syfpeithi是一个包含4500多种已知结合i类和ii类mhc分子的肽序列的数据库。syfpeithi提供基于某些氨基酸在沿着mhc结合沟的某些位置上的存在的评分。理想的氨基酸锚点价值10点,不寻常的锚点价值6-8点,辅助锚点价值4-6点,首选残基值1-4点;对-1和-3之间的结合分数具有负的氨基酸效应。hla-a*0201的最高分数是36。
128、在另一个实施方案中,使用rankpep鉴定mhc ii类表位。rankpep使用位置特异性评分矩阵(pssm)或来自已知与给定mhc分子结合的比对肽组作为mhc肽结合预测因子的概况。rankpep包括关于肽的得分的信息和预测肽相对于产生最大得分的共有序列的最佳或百分位得分,以及所选择的概况。rankpep包括102和80个pssm的选择,分别用于预测肽与mhc i和mhc ii分子的结合。用于预测不同大小的肽结合剂的几种pssm通常可用于每种mhci分子。
129、在另一个实施方案中,使用svmhc(donnes p,elofsson a.prediction of mhcclass i binding peptides,使用svmhc.bmc bioinformatics.2002 sep 11;3:25)鉴定mhc ii类表位。在另一个实施方案中,使用本领域已知的任何其他方法鉴定mhc ii类表位。在另一个实施方案中,利用上述方法鉴定mhc ii类结合将通过向wt1序列中引入mhc i类锚定残基突变而受到干扰。每种可能性代表本发明的单独实施例。
130、鉴定mhc i类表位的方法在本领域中是公知的。在另一个实施方案中,使用bimas软件预测mhc i类表位。bimas评分基于计算mhc-i/β2-微球蛋白/肽复合物的理论半衰期,其是肽结合亲和力的量度。该程序使用关于长度为8-10个氨基酸的hla-i肽的信息。肽对mhc的结合亲和力越高,该肽代表表位的可能性就越高。bimas算法假定肽中的每个氨基酸独立地贡献于与i类分子的结合。对结合至关重要的主要锚定残基在表中具有显著高于1的系数。不利氨基酸具有小于1的正向系数。如果不知道氨基酸对结合的贡献是有利与否,则分配值1。将分配给氨基酸的所有值相乘,并将得到的运行分数乘以常数以产生解离半时间的估计值。
131、在另一个实施方案中,使用syfpeithi鉴定mhc i类表位。在另一个实施方案中,使用svmhc(donnes p,elofsson a.prediction of mhc class i binding peptides,usingsvmhc.bmc bioinformatics.2002 sep 11;3:25)鉴定mhc i类表位。在另一个实施方案中,使用netmhc-2.0(通过'查询委员会'人工神经网络方法对肽-mhc结合的敏感定量预测“,buus s,lauemoller sl,worning p,kesmir c,frimurer t,corbet s,fomsgaard a,hilden j,holma,brunak s.tissue antigens.,62:378-84,2003)。在另一个实施方案中,使用本领域已知的任何其他方法鉴定mhc i类表位。在另一个实施方案中,利用上述方法鉴定可通过将锚定残基突变引入wt1序列而产生的mhc i类表位。每种可能性代表本发明的单独实施例。
132、在另一个实施方案中,增强mhc结合的突变位于hla i类结合基序的1位残基上。在另一个实施方案中,残基变成酪氨酸。在另一个实施方案中,残基变成甘氨酸。在另一个实施方案中,残基变成苏氨酸。在另一个实施方案中,残基变成苯丙氨酸。在另一个实施方案中,残基变成本领域已知的任何其他残基。在另一个实施方案中,位置1处的取代(例如酪氨酸)稳定了位置2锚定残基的结合。
133、在另一个实施方案中,突变位于hla i类结合基序的2位。在另一个实施方案中,残基变成亮氨酸。在另一个实施方案中,残基变成缬氨酸。在另一个实施方案中,残基变成异亮氨酸。在另一个实施方案中,残基变成甲硫氨酸。在另一个实施方案中,残基变成本领域已知的任何其他残基。
134、在另一个实施方案中,突变位于hla i类结合基序的6位。在另一个实施方案中,残基变成缬氨酸。在另一个实施方案中,残基变成半胱氨酸。在另一个实施方案中,残基变成谷氨酰胺。在另一个实施方案中,残基变成组氨酸。在另一个实施方案中,残基变成本领域已知的任何其他残基。
135、在另一个实施方案中,突变位于hla i类结合基序的第9位。在另一个实施方案中,突变改变了其c末端位置的残基。在另一个实施方案中,残基变成缬氨酸。在另一个实施方案中,残基变成苏氨酸。在另一个实施方案中,残基变成异亮氨酸。在另一个实施方案中,残基变成亮氨酸。在另一个实施方案中,残基变成丙氨酸。在另一个实施方案中,残基变成半胱氨酸。在另一个实施方案中,残基变成本领域已知的任何其他残基。
136、在另一个实施方案中,该点突变位于一级锚定残基中。在另一个实施方案中,hlai类一级锚定残基是位置2和9。在另一个实施方案中,该点突变位于二级锚定残基中。在另一个实施方案中,hla i类二级锚定残基是位置1和8。在另一个实施方案中,hla i类二级锚定残基是位置1、3、6、7和8.在另一个实施方案中,点突变位于从位置4、5和8中选择的位置。每种可能性表示本发明的单独实施例。
137、在另一个实施方案中,所述点突变在选自hla i类结合基序的位置1、2、8和9的位置的1个或更多个残基上。在另一个实施方案中,所述点突变在选自位置1、3、6和9的位置的1个或更多个残基上。在另一个实施方案中,所述点突变在选自位置1、2、6和9的位置的1个或更多个残基上。在另一个实施方案中,所述点突变在选自位置1、6和9的位置的1个或更多个残基上。在另一个实施方案中,所述点突变在选自位置1、2和9的位置的1个或更多个残基上。在另一个实施方案中,点突变在选自位置1、3和9的位置的1个或更多个残基上。在另一个实施方案中,点突变在选自位置2和9的位置的1个或更多个残基上。在另一个实施方案中,点突变在选自位置6和9位的位置的1个或更多个残基上。每个可能性代表本发明的单独实施方案。
138、在另一个实施方案中,突变位于hla i类结合基序的4位。在另一个实施方案中,突变位于hla i类结合基序的5位。在另一个实施方案中,突变位于hla i类结合基序的7位。在另一个实施方案中,突变位于hla i类结合基序的8位。每种可能性代表本发明的单独实施例。
139、上述锚定残基和取代中的每一个代表本发明的单独实施方案。
140、在另一个实施方案中,通过hla ii类基序锚定残基的突变产生或改善本发明肽中的hla ii类结合位点。在另一个实施方案中,修饰的锚定残基位于p1位置。在另一个实施方案中,锚定残基位于p2位置。在另一个实施方案中,锚定残基位于p6位置。在另一个实施方案中,锚定残基位于p9位置。在另一个实施方案中,锚定残基选自p1,p2,p6和p9位置。在另一个实施方案中,锚定残基位于p3位置。在另一个实施方案中,锚定残基位于p4位置。在另一个实施方案中,锚定残基位于p5位置。在另一个实施方案中,锚定残基位于p6位置。在另一个实施方案中,锚定残基位于p8位置。在另一个实施方案中,锚定残基位于p10位置。在另一个实施方案中,锚定残基位于p11位置。在另一个实施方案中,锚定残基位于p12位置。在另一个实施方案中,锚定残基位于p13位置。在另一个实施方案中,锚定残基位于本领域已知的hla ii类分子的任何其他锚定残基处。在另一个实施方案中,p1,p2,p6和p9以外的残基充当二级锚定残基;因此,突变它们可以改善hla ii类结合。在另一个实施方案中,上述残基的任何组合是突变的。每种可能性代表本发明的单独实施例。
141、在另一个实施方案中,本发明提供了在受试者中诱导抗间皮瘤免疫应答的方法,所述方法包括使所述受试者接触免疫原性组合物的步骤,所述免疫原性组合物包含(a)wt1蛋白;(b)wt蛋白的片段;(c)编码wt1蛋白的核苷酸分子;或(d)编码wt1蛋白片段的核苷酸分子,和至少一种检查点抑制剂,从而在受试者中诱导抗间皮瘤免疫应答。
142、在另一个实施方案中,本发明提供治疗患有间皮瘤的受试者的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)wt1蛋白;(b)wt蛋白的片段;(c)编码wt1蛋白的核苷酸分子;或(d)编码wt1蛋白片段的核苷酸分子,和至少一种检查点抑制剂,从而治疗患有间皮瘤的受试者。
143、在另一个实施方案中,本发明提供了减少受试者中间皮瘤发生率或其复发的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)wt1蛋白;(b)wt蛋白的片段;(c)编码wt1蛋白的核苷酸分子;或(d)编码wt1蛋白片段的核苷酸分子,和至少一种检查点抑制剂,从而降低受试者中间皮瘤的发生率或其复发。
144、当涉及任何蛋白质或肽时,术语“同源性”,“同源的”等指在比对序列和引入缺口之后,如果需要,达到最大百分比同源性,并且不考虑任何保守取代作为序列相同性的一部分后,候选序列中与相应的天然多肽的残基相同的aa残基的百分比。用于比对的方法和计算机程序在本领域中是公知的。
145、在另一个实施方案中,当提及任何核酸序列时,术语“同源性”类似地指示候选序列中与相应天然核酸序列的核苷酸相同的核苷酸百分比。
146、在另一个实施方案中,通过本领域充分描述的方法,通过计算机算法确定序列比对的同源性。在其他实施方案中,核酸序列同源性的计算机算法分析包括利用任何数量的可用软件包,例如blast,domain,beauty(blast增强比对实用程序),genpept和trembl软件包。
147、考虑到空位的数目以及每个间隙的长度(需要引入用于这两个序列的最佳比对),两个序列之间的百分比相同性是由序列共享的相同位置的数目(即,相同性%=相同位置的数量/位置的总数量×100)的函数。两个序列之间的序列比较和相同性百分比的确定可以使用序列分析软件中的数学算法来完成。蛋白质分析软件使用分配给各种取代,缺失和其他修饰(包括保守性氨基酸取代)的相似性度量来匹配相似的序列。
148、两个氨基酸序列之间的相同性百分比可以通过例如使用needleman和wunsch(j.mol.biol.48:444-453(1970))算法来确定,该算法已被并入gcg中的gap程序中软件包(可从www.gcg.com获得),使用blossum 62矩阵或pam250矩阵,空位权重为16、14、12、10、8、6或4,长度权重为1、2,3、4、5或6。使用fasta也可以比较多肽序列,应用默认或推荐的参数。gcg version 6.1,fasta(例如fasta2和fasta3)中的程序提供了查询和搜索序列之间的最佳重叠区域的比对和百分比序列相同性(pearson,methods enzymol.1990;183:63-98;pearson,methods mol.biol.2000;132:185-219)。两个氨基酸序列之间的相同性百分比也可以使用已被合并到align程序(版本2.0)中的e.meyers和w.miller(comput.appl.biosci。,1988;11-17)的算法来确定,使用pam120权重残基表,空位长度罚分为12,空位罚分为4。
149、用于将序列与数据库中包含的其他序列进行比较的另一种算法是使用默认参数的计算机程序blast,特别是blastp。参见例如altschul等,j.mol.biol。生物学。1990;215:403-410;altschul等人,nucleic acids res。1997;25:3389-402(1997);每个在此通过引用并入。本发明的蛋白质序列可以用作“查询序列”来执行针对公共数据库的搜索以例如识别相关序列。这种搜索可以使用altschul等人的xblast程序(版本2.0)来执行。1990(同上)。可以用xblast程序进行blast蛋白质搜索,得分=50,字长=3以获得与本发明的wt1肽同源的氨基酸序列。为了获得用于比较目的的空位比对,可以如altschul等,1997(同上)中所述使用空位blast。当使用blast和gapped blast程序时,可以使用各个程序的默认参数(例如,xblast和nblast)。
150、在另一个实施方案中,关于同源序列的“同源性”是指与本文公开的序列的百分比相同性大于70%,71%,72%,73%,74%,75%,76%,77%,78%,79%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%。每种可能性代表本发明的单独实施例。
151、在另一个实施方案中,本发明提供了包含肽和至少一种检查点抑制剂的组合物。在另一个实施方案中,组合物还包含药学上可接受的载体。在另一个实施方案中,该组合物还包含佐剂。在另一个实施方案中,组合物包含2种或更多种本发明的肽。在另一个实施方案中,组合物进一步包含下文列出的任何添加剂,化合物或赋形剂。在另一个实施方案中,佐剂是明矾盐或其他矿物佐剂,细菌产物或细菌衍生的佐剂,抗衰老剂(例如皂苷),o/w或w/o乳剂,脂质体佐剂,细胞因子(例如il-2,gm-csf,il-12和ifn-γ)或α-半乳糖神经酰胺类似物。在另一个实施方案中,佐剂是qs21,弗氏完全佐剂或不完全佐剂,磷酸铝,氢氧化铝,bcg或明矾。在其他实施例中,载体是在此列举的任何载体。在其他实施方案中,佐剂是本文列举的任何佐剂。每种可能性代表本发明的单独实施例。
152、在另一个实施方案中,本发明提供了包含本发明的肽和至少一种检查点抑制剂的疫苗。在另一个实施方案中,疫苗还包含载体。在另一个实施方案中,疫苗还包含佐剂。在另一个实施方案中,疫苗还包含载体和佐剂的组合。在另一个实施方案中,疫苗还包含apc。在另一个实施方案中,疫苗还包含apc和载体或佐剂的组合。在另一个实施方案中,疫苗是基于细胞的组合物。每种可能性代表本发明的单独实施例。
153、在另一个实施方案中,本发明提供了包含本发明的肽和至少一种检查点抑制剂的免疫原性组合物。在另一个实施方案中,免疫原性组合物还包含载体。在另一个实施方案中,免疫原性组合物还包含佐剂。在另一个实施方案中,免疫原性组合物还包含载体和佐剂的组合。每种可能性代表本发明的单独实施例。
154、在另一个实施方案中,术语“疫苗”是指当引入受试者时提供对其特定疾病,病症或症状的预防性或治疗性应答的物质或组合物。在另一个实施方案中,本发明包含基于肽的疫苗,其中所述肽包含本文列出的任何实施方案,任选地还包含免疫调节化合物例如细胞因子,佐剂等。
155、在其他实施方案中,本发明的方法的组合物或疫苗和本发明的组合物还包含佐剂。在另一个实施方案中,佐剂是montanide isa 51。montanide isa 51含有天然可代谢油和精制乳化剂。在另一个实施方案中,佐剂是gm-csf。在另一个实施方案中,佐剂是匙孔血蓝蛋白(klh),其可以缀合至肽抗原或可以与肽一起施用。在另一个实施方案中,重组gm-csf是在酵母(酿酒酵母)载体中生长的人蛋白质。gm-csf促进造血祖细胞,apc以及树突细胞和t细胞的克隆扩增和分化。
156、在另一个实施方案中,佐剂是细胞因子。在另一个实施方案中,佐剂是生长因子。在另一个实施方案中,佐剂是细胞群。在另一个实施方案中,佐剂是qs21。在另一个实施方案中,佐剂是弗氏不完全佐剂。在另一个实施方案中,佐剂是磷酸铝。在另一个实施方案中,佐剂是氢氧化铝。在另一个实施方案中,佐剂是bcg。在另一个实施方案中,佐剂是明矾。在另一个实施方案中,佐剂是白细胞介素。在另一个实施方案中,佐剂是趋化因子。在另一个实施方案中,佐剂是本领域已知的任何其他类型的佐剂。在另一个实施方案中,wt1疫苗包含两种上述佐剂。在另一个实施方案中,wt1疫苗包含大于两种的上述佐剂。每种可能性代表本发明的单独实施例。
157、在另一个实施方案中,用于本发明方法的wt1疫苗可以是编码本发明的一种或多种wt1肽的一种或多种核酸分子(dna或rna)。在该实施方案的实践中,施用包含编码一种或多种wt1肽的核酸分子(核酸疫苗)的疫苗,并向患者施用一种或多种检查点抑制剂。在本发明的所有其他实施方案中,核酸疫苗可以用来代替肽疫苗。核酸可以作为病毒载体的一部分被单独引入,或者被引入细胞内,可能作为质粒或被整合到细胞的核酸中。细胞载体可以是患者的细胞,从患者身上移除,或者是来自供体的细胞或细胞系。细胞可以是抗原呈递细胞,例如树突细胞或单核细胞/巨噬细胞谱系细胞。细胞载体选自细胞,如自体细胞,同种异体细胞,细胞系,树突细胞或抗原呈递细胞,或任何上述细胞融合到杂交细胞中。
158、wt1肽或编码它的核酸或其以本文所述任何形式的其载体可以暴露于ctl的离体或体内。如果体外或离体,细胞可以生长或扩增,然后引入患者体内。
159、如本文可互换使用的,术语“核酸”,“核酸分子”,“寡核苷酸”和“多核苷酸”包括单链或多核苷酸中的超过一个核苷酸的rna,dna或rna/dna杂交序列双面形式。该术语包括包含至少一种修饰的“修饰的核苷酸”,所述修饰包括例如但不限于:(a)可选的连接基团,(b)嘌呤的类似形式,(c)嘧啶的类似形式,或(d)类似的糖。对于类似连接基团的实例,嘌呤,嘧啶和糖例如参见pct公开号wo 95/04064。本发明的核酸序列可以通过任何已知的方法制备,包括合成的,重组的,离体生成或其组合,以及利用本领域已知的任何纯化方法。如本文所用,术语“核酸疫苗”包括dna疫苗和rna疫苗,以及包含病毒或非病毒载体的疫苗。
160、在另一个实施方案中,本发明的用途提供了包含核酸分子(dna或rna)的载体。在其他实施方案中,用于实施本发明的组合物或疫苗可以包含本发明的wt1肽的任何实施方案及其组合。每种可能性代表本发明的单独实施例。
161、在另一个实施方案中,用于实施本发明的疫苗或本发明的组合物包含衍生自相同wt1片段的两种肽,每种含有不同的hla i类不规则的肽。在另一个实施方案中,两种hla i类不规则的多肽在不同的hla i类分子锚定残基中含有突变。在另一个实施方案中,两种hla i类不规则的多肽在相同的锚定残基中含有不同的突变。每种可能性代表本发明的单独实施例。
162、在另一个实施方案中,用于本发明的组合物中的肽结合两种不同的hla ii类分子。在另一个实施方案中,肽结合三种不同的hla ii类分子。在另一个实施方案中,肽结合四种不同的hla ii类分子。在另一个实施方案中,所述肽结合五种不同的hla ii类分子。在另一个实施方案中,肽与超过五种不同的hla ii类分子结合。在另一个实施方案中,组合物中的肽结合相同的hla ii类分子。
163、在另一个实施方案中,本发明组合物或使用方法中的每种肽结合一组hla ii类分子。在另一个实施方案中,每种肽结合不同组的hla ii类分子。在另一个实施方案中,组合物中的肽结合相同组的hla ii类分子。在另一个实施方案中,两种肽结合不同的但重叠的hla ii类分子。在另一个实施方案中,两种或更多种肽结合同一组hla ii类分子,而另一种肽结合不同组。在另一个实施方案中,两种或更多种肽与hla ii类分子的重叠组结合,而另一种肽结合不同组。
164、在另一个实施方案中,用于本发明实践中或本发明组合物中的肽结合两种不同的hla i类分子。在另一个实施方案中,所述肽结合三种不同的hla i类分子。在另一个实施方案中,所述肽结合四种不同的hla i类分子。在另一个实施方案中,所述肽结合五种不同的hla i类分子。在另一个实施方案中,所述肽与超过五种不同的hla i类分子结合。在另一个实施方案中,组合物中的肽结合相同的hla i类分子。
165、在另一个实施方案中,用于本发明实践中或本发明组合物中的每种肽均结合一组hla i类分子。在另一个实施方案中,每种肽结合不同组的hla i类分子。在另一个实施方案中,组合物中的肽与同一组hla i类分子结合。在另一个实施方案中,两种肽结合不同的但重叠的hla i类分子。在另一个实施方案中,两种或更多种肽结合同一组hla i类分子,而另一种肽结合不同组。在另一个实施方案中,两种或更多种肽结合hla i类分子的重叠组,而另一种肽结合不同组。
166、在另一个实施方案中,“一组hla ii类分子”或“一组hla i类分子”是指在特定基因座由不同等位基因编码的hla分子。在另一个实施方案中,该术语是指具有特定结合特异性的hla分子。在另一个实施方案中,该术语是指具有特定肽共有序列的hla分子。在另一个实施方案中,该术语是指hla ii类分子的超家族。每种可能性代表本发明的单独实施例。
167、上述组合物和组合物中的每一种代表本发明的单独实施方案。
168、本文描述的关于本发明的肽,核酸,组合物和疫苗的任何实施方案可以用于本发明的任何方法中。肽,核酸,组合物或疫苗与方法的每种组合代表其单独的实施方案。
169、在另一个实施方案中,本发明提供了治疗患有表达wt1的癌症的受试者的方法,所述方法包括向所述受试者施用如本文所述的wt1疫苗和检查点抑制剂,由此治疗患有表达wt1的癌症的受试者。在另一个实施方案中,本发明提供了治疗患有表达wt1的癌症的受试者的方法,所述方法包括向所述受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的本发明组合物,由此治疗患有表达wt1的癌症的受试者。在另一个实施方案中,本发明提供了治疗患有表达wt1的癌症的受试者的方法,所述方法包括向所述受试者施用免疫原性组合物如疫苗和检查点抑制剂,由此治疗患有表达wt1的癌症的受试者。
170、在另一个实施方案中,本发明提供抑制或终止受试者中表达wt1的癌症的进展的方法,所述方法包括向受试者施用至少一种wt1肽和至少一种检查点抑制剂,从而抑制或阻止表达wt1的癌症的进展。在另一个实施方案中,本发明提供抑制或终止受试者中表达wt1的癌症的进展的方法,所述方法包括向所述受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的组合物,由此抑制或阻止表达wt1的癌症的进展。在另一个实施方案中,本发明提供抑制或阻止受试者中表达wt1的癌症的进展的方法,所述方法包括向所述受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的免疫原性组合物,例如本发明的疫苗,由此抑制或阻止表达wt1的癌症的进展。
171、在另一个实施方案中,本发明提供了减少受试者中表达wt1的癌症的发生率的方法,所述方法包括向所述受试者施用至少一种wt1肽和至少一种检查点抑制剂,由此减少受试者中表达wt1的癌症的发生率。在另一个实施方案中,本发明提供了减少受试者中表达wt1的癌症的发生率的方法,所述方法包括向受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的本发明组合物,从而降低受试者中表达wt1的癌症的发生率。在另一个实施方案中,本发明提供了降低受试者中表达wt1的癌症的发生率的方法,所述方法包括向所述受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的本发明的免疫原性组合物例如疫苗,从而降低受试者中表达wt1的癌症的发生率。
172、在另一个实施方案中,本发明提供了降低受试者中表达wt1的癌症的复发率的方法,所述方法包括向所述受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的组合物,从而降低受试者中表达wt1的癌症复发的发生率。在另一个实施方案中,本发明提供降低受试者中表达wt1的癌症的复发率的方法,所述方法包括向受试者施用包含至少一种wt1肽和至少一个检查点的本发明的组合物,从而降低受试者中表达wt1的癌症复发的发生率。在另一个实施方案中,本发明提供降低受试者中表达wt1的癌症的复发率的方法,所述方法包括向所述受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的本发明的免疫原性组合物例如疫苗,从而降低受试者中表达wt1的癌症复发的发生率。
173、在另一个实施方案中,本发明提供克服受试者对表达wt1的癌症的t细胞耐受性的方法,所述方法包括向受试者施用至少一种wt1肽和至少一种检查点抑制剂,由此克服t细胞对表达wt1的癌症的耐受性。在另一个实施方案中,本发明提供了克服受试者对表达wt1的癌症的t细胞耐受性的方法,所述方法包括向受试者施用包含至少一种wt1肽和至少一个检查点的本发明组合物,从而克服对表达wt1的癌症的t细胞耐受性。在另一个实施方案中,本发明提供了克服受试者对表达wt1的癌症的t细胞耐受性的方法,所述方法包括向所述受试者施用包含至少一种wt1肽和至少一种检查点抑制剂的本发明的免疫原性组合物例如疫苗,由此克服表达wt1的癌症的t细胞耐受性。
174、在另一个实施方案中,本发明提供了治疗患有表达wt1的癌症的受试者的方法,其包括(a)通过本发明的方法,诱导识别癌症的恶性细胞的人细胞毒性t淋巴细胞(ctl)的供体形成和增殖;和(b)将人ctl注入受试者中,由此治疗患有癌症的受试者。在一个实施方案中,向所述供体施用至少一种wt1肽,并将来自所述供体的ctl注入所述受试者中,并向所述受试者施用检查点抑制剂,从而治疗患有癌症的受试者。在一个实施方案中,向供体施用至少一种wt1肽和至少一种检查点抑制剂,并且将来自所述供体的ctl注入受试者和受试者中,从而治疗患有癌症的受试者。在一个实施方案中,向供体施用至少一种wt1肽和至少一种检查点抑制剂,并将来自所述供体的ctl注入受试者中,并向受试者施用检查点抑制剂,由此治疗患有癌症的受试者。
175、在另一个实施方案中,本发明提供了治疗患有表达wt1的癌症的受试者的方法,其包括(a)通过本发明的方法诱导识别癌症的恶性细胞的人ctl的离体形成和增殖,其中人免疫细胞来自供体;和(b)将人ctl注入受试者中,由此治疗患有癌症的受试者。在一个实施方案中,检验点抑制剂包括在离体步骤中。在另一个实施方案中,将检查点抑制剂施用于受试者。在另一个实施方案中,离体步骤都包括检查点抑制剂,并且还向受试者施用检查点抑制剂。
176、用于离体免疫疗法的方法是本领域众所周知的,并且描述于例如davis id等人(blood dendritic cells generated with flt3 ligand and cd40 ligand prime cd8+t cells effective in cancer patients.j immunother.2006sep-oct;29(5):499-511)和mitchell ms等人(the cytotoxic t cell response to peptide analogs of thehla-a*0201-restricted muc1 signal sequence epitope,m1.2.cancer immunolimmunother.20067月28日)。每种方法代表了本发明的一个单独的实施例。
177、在另一个实施方案中,本发明提供诱导wt1蛋白特异性ctl形成和增殖的方法,所述方法包括使淋巴细胞群体接触本发明的免疫原性组合物例如疫苗以及至少一种检查点抑制剂,从而诱导wt1蛋白特异性ctl的形成和增殖。在另一个实施方案中,免疫原性组合物包含与本发明的肽相关的抗原呈递细胞(apc)和检查点抑制剂。在另一个实施方案中,本发明提供诱导wt1蛋白特异性ctl形成和增殖的方法,所述方法包括使淋巴细胞群体接触本发明的肽或组合物以及至少一种检查点抑制剂,由此诱导wt1蛋白特异性ctl的形成和增殖。在另一个实施方案中,本发明提供诱导wt1蛋白特异性ctl形成和增殖的方法,所述方法包括使淋巴细胞群接触本发明的疫苗以及至少一种检查点抑制剂,从而诱导wt1蛋白特异性ctl的形成和增。在另一个实施方案中,ctl对于表达wt1的细胞是特异性的。在另一个实施方案中,靶细胞是表达wt1的癌症的细胞。每种可能性代表本发明的单独实施例。
178、在另一个实施方案中,本发明提供诱导受试者中wt1蛋白特异性ctl形成和增殖的方法,所述方法包括使所述受试者接触本发明的免疫原性组合物例如疫苗以及至少一种检查点抑制剂,从而诱导受试者中wt1蛋白特异性ctl的形成和增殖。在另一个实施方案中,免疫原性组合物包含与本发明肽的混合物相关的apc,其与至少一种检查点抑制剂一起施用。在另一个实施方案中,本发明提供诱导对象中wt1蛋白特异性ctl形成和增殖的方法,所述方法包括使所述对象与肽以及至少一种检查点抑制剂或本发明的组合物接触,从而诱导受试者中wt1蛋白特异性ctl的形成和增殖。在另一个实施方案中,本发明提供诱导受试者中wt1蛋白特异性ctl的形成和增殖的方法,所述方法包括使所述受试者与本发明的疫苗以及至少一种检查点抑制剂接触,从而诱导受试者中wt1蛋白特异性ctl的形成和增殖。在另一个实施方案中,靶细胞是表达wt1的癌症的细胞。在另一个实施方案中,所述受试者具有表达wt1的癌症。在另一个实施方案中,ctl对于表达wt1的细胞是特异性的。
179、在另一个实施方案中,本发明提供了在受试者中产生不规则的免疫应答的方法,其中所述不规则的免疫应答针对表达wt1的癌症,所述方法包括向所述受试者施用至少一种异质wt1肽以及至少一种检查点抑制剂或本发明的组合物,从而产生不规则的免疫应答。在另一个实施方案中,本发明提供了在受试者中产生不规则的免疫应答的方法,其中所述不规则的免疫应答针对表达wt1的癌症,所述方法包括向所述受试者施用本发明的免疫原性组合物例如疫苗以及至少一种检查点抑制剂,从而在受试者中产生不规则的免疫应答。在另一个实施方案中,本发明提供了在受试者中产生不规则的免疫应答的方法,其中所述不规则的免疫应答针对表达wt1的癌症,所述方法包括向受试者施用本发明的疫苗以及至少一个检查点抑制剂,从而产生不规则的免疫应答。
180、每种方法代表本发明的单独实施方式。
181、在另一个实施方案中,表达wt1的癌症是急性骨髓性白血病(aml)。在另一个实施方案中,表达wt1的癌症是慢性骨髓性白血病(cml)。在另一个实施方案中,表达wt1的癌症与骨髓增生异常综合征(mds)相关。在另一个实施方案中,表达wt1的癌症是mds。在另一个实施方案中,表达wt1的癌症是非小细胞肺癌(nsclc)。在另一个实施方案中,表达wt1的癌症是食管鳞状细胞癌。在另一个实施方案中,表达wt1的癌症是急性淋巴细胞白血病(all)。在另一个实施方案中,表达wt1的癌症是骨或软组织肉瘤。在另一个实施方案中,表达wt1的癌症是维尔姆斯氏瘤。在另一个实施方案中,表达wt1的癌症是白血病。在另一个实施方案中,表达wt1的癌症是血液学癌症。在另一个实施方案中,表达wt1的癌症是淋巴瘤。在另一个实施方案中,表达wt1的癌症是促结缔组织型小圆细胞肿瘤。在另一个实施方案中,表达wt1的癌症是间皮瘤。在另一个实施方案中,表达wt1的癌症是恶性间皮瘤。在另一个实施方案中,表达wt1的癌症是胃癌。在另一个实施方案中,表达wt1的癌症是结肠癌。在另一个实施方案中,表达wt1的癌症是肺癌。在另一个实施方案中,表达wt1的癌症是乳腺癌。在另一个实施方案中,表达wt1的癌症是生殖细胞肿瘤。在另一个实施方案中,表达wt1的癌症是恶性胸膜间皮瘤。在另一个实施方案中,表达wt1的癌症是多发性骨髓瘤。在另一个实施方案中,表达wt1的癌症是骨髓性白血病。在另一个实施方案中,表达wt1的癌症是星形细胞癌。在另一个实施方案中,表达wt1的癌症是成胶质细胞瘤(例如,多形性成胶质细胞瘤)。在另一个实施方案中,表达wt1的癌症是结肠直肠腺癌。在另一个实施方案中,表达wt1的癌症是卵巢癌(例如浆液性,上皮性或子宫内膜癌)。在另一个实施方案中,表达wt1的癌症是乳腺癌。在另一个实施方案中,表达wt1的癌症是黑色素瘤。在另一个实施方案中,表达wt1的癌症是头颈部鳞状细胞癌。在另一个实施方案中,表达wt1的癌症是胰腺导管细胞癌。在另一个实施方案中,表达wt1的癌症是神经母细胞瘤。在另一个实施方案中,表达wt1的癌症是子宫癌。在另一个实施方案中,表达wt1的癌症是甲状腺癌。在另一个实施方案中,表达wt1的癌症是肝细胞癌。在另一个实施方案中,表达wt1的癌症是甲状腺癌。在另一个实施方案中,表达wt1的癌症是肝癌。在另一个实施方案中,表达wt1的癌症是肾癌(例如肾细胞癌)。在另一个实施方案中,表达wt1的癌症是卡波西肉瘤(kaposi’s sarcoma)。在另一个实施方案中,表达wt1的癌症是肉瘤。在另一个实施方案中,表达wt1的癌症是任何其他癌或肉瘤。
182、在另一个实施方案中,表达wt1的癌症是实体瘤。在另一个实施方案中,实体肿瘤与表达wt1的癌症相关。在另一个实施方案中,实体瘤与骨髓增生异常综合征(mds)相关。在另一个实施方案中,实体瘤与非小细胞肺癌(nsclc)相关。在另一个实施方案中,实体瘤与肺癌相关。在另一个实施方案中,实体瘤与乳腺癌相关。在另一个实施方案中,实体瘤与结直肠癌相关。在另一个实施方案中,实体瘤与前列腺癌相关。在另一个实施方案中,实体瘤与卵巢癌有关。在另一个实施方案中,实体瘤与肾癌相关。在另一个实施方案中,实体瘤与胰腺癌相关。在另一个实施方案中,实体瘤与脑癌相关。在另一个实施方案中,实体瘤与胃肠癌相关。在另一个实施方案中,实体瘤与皮肤癌有关。在另一个实施方案中,实体瘤与黑色素瘤相关。
183、在另一个实施方案中,怀疑通过本发明的方法治疗的癌症或肿瘤表达wt1。在另一个实施方案中,wt1表达尚未通过测试实际肿瘤样品来验证。在另一个实施方案中,癌症或肿瘤在许多情况下是已知表达wt1的类型。在另一个实施例中,该类型在大多数情况下表达wt1。
184、表达wt1的每种类型的癌症或肿瘤以及怀疑表达wt1的癌症或肿瘤代表本发明的单独实施方案。
185、表2中提供了可以使用本发明的组合物和方法治疗的非详尽的癌症类型列表。
186、表2.癌症类型的实例
187、
188、
189、
190、在另一个实施方案中,本发明的多种肽与至少一种检查点抑制剂一起用于刺激本发明方法中的免疫应答。
191、如本文所提供的,可以使用本发明的方法产生引发抗原特异性cd8+ t细胞应答的不规则的肽。可以鉴定引发对多种hla ii类分子的cd4+ t细胞应答的wt1肽。cd4+ t细胞识别与apc上hla ii类分子结合的肽。在另一个实施方案中,抗原特异性cd4+ t细胞应答有助于cd8+细胞毒性t细胞(ctl)应答的诱导和维持。
192、在另一个实施方案中,由于它们结合hla i类和hla ii类分子的能力,与至少一种检查点抑制剂一起施用的本发明的肽表现出增强的引发ctl应答的能力。在另一个实施方案中,由于检查点抑制剂增加wt1特异性ctl的存活和增殖的能力,与至少一种检查点抑制剂一起施用的本发明的肽显示增强的引发ctl应答的能力。在另一个实施方案中,与至少一种检查点抑制剂一起施用的本发明疫苗具有激活或诱发识别wt1抗原的cd4+和cd8+ t细胞的优点。在另一个实施方案中,相对于单独任一群体的活化,激活或引发cd4+和cd8+ t细胞都提供了协同抗wt1免疫应答。在另一个实施方案中,由于本发明的肽结合多个hla ii类亚型的能力,本发明的肽的增强的免疫原性在多个hla ii类亚型的个体中显示出来。每种可能性代表本发明的单独实施例。
193、在另一个实施方案中,活化的cd4+细胞通过准许树突细胞增强免疫力,从而维持细胞毒性t细胞的活化和存活。在另一个实施方案中,活化的cd4+ t细胞通过与肿瘤细胞直接接触或通过激活凋亡途径诱导肿瘤细胞死亡。例如,间皮瘤肿瘤细胞能够在hla i类和ii类分子的背景下处理和呈递抗原。
194、本领域技术人员将理解本文公开的方法以设计能够结合hla i类和hla ii类分子的其他wt1衍生肽。该方法还能够设计结合本发明的wt1衍生肽的免疫原性组合物和疫苗。每种可能性代表本发明的单独实施例。
195、在另一个实施方案中,与本发明的至少一种检查点抑制剂一起施用的方法,肽,疫苗和/或免疫原性组合物具有激活或激发包含多种不同hla ii类等位基因的wt1特异性cd4+ t细胞的优点。在另一个实施方案中,疫苗具有在大部分群体中激活或激发wt1特异性cd4+ t细胞的优点。在另一个实施方案中,所述肽激活10%群体中的wt1特异性cd4+ t细胞。在另一个实施方案中,肽在15%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽激活20%群体中的wt1特异性cd4+ t细胞。在另一个实施方案中,所述肽激活25%群体中的wt1特异性cd4+ t细胞。在另一个实施方案中,肽激活群体中30%的wt1特异性cd4+ t细胞。在另一个实施方案中,肽在35%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽激活40%群体中的wt1特异性cd4+ t细胞。在另一个实施方案中,肽在45%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽激活50%群体中的wt1特异性cd4+t细胞。在另一个实施方案中,所述肽在55%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽在60%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽在70%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽在75%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽在80%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽在85%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽激活90%群体中的wt1特异性cd4+ t细胞。在另一个实施方案中,肽在95%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,肽在大于95%的群体中激活wt1特异性cd4+ t细胞。在另一个实施方案中,疫苗在大部分特定群体(例如美国高加索人)中激活或引发wt1特异性cd4+ t细胞。每种可能性代表本发明的单独实施例。
196、在另一个实施方案中,本发明的方法提供了已经由受试者安装的免疫应答的改善。在另一个实施方案中,本发明的方法包括多于一次或多于两次将肽,组合物或疫苗与至少一种检查点抑制剂一起施用。在另一个实施方案中,肽的组成,浓度或其组合不同。在另一个实施方案中,与至少一种检查点抑制剂一起施用的肽在其中针对感兴趣抗原的免疫应答尚未启动的受试者中提供针对感兴趣抗原的免疫应答的启动。在另一个实施方案中,被诱导的ctl应答于在apc或癌细胞上呈递肽而增殖。在其他实施方案中,提及调节免疫应答涉及分别伴随有th2和th1 t辅助细胞的存在的免疫系统的体液和细胞介导的臂之一或两者,或者在另一个实施方案中各自单独的臂。
197、在其他实施方案中,影响肿瘤生长的方法导致(1)直接抑制肿瘤细胞分裂,或(2)免疫细胞介导的肿瘤细胞溶解或两者,其导致抑制肿瘤细胞网状物的扩张。每种可能性代表本发明的单独实施例。与至少一种检查点抑制剂一起施用的肽或疫苗的使用比没有使用检查点抑制剂更多地直接抑制肿瘤细胞分裂,免疫细胞介导的细胞裂解或两者。
198、本领域普通技术人员基于许多众所周知的方法可以容易地确定通过这两种机制之一抑制肿瘤生长。在另一个实施方案中,通过测量一段时间内的实际肿瘤大小来确定肿瘤抑制。在另一个实施方案中,肿瘤抑制可以通过利用本领域技术人员熟知的方法通过估计肿瘤的大小(在一段时间内)来确定。更具体地说,多种放射成像方法(例如,单光子和正电子发射计算机断层扫描;一般参见“nuclear medicine in clinical oncology”,winkler,c。(编辑)springer-verilog,new york,1986),可以被用来估计肿瘤大小。此类方法还可以利用多种成像剂,包括例如常规成像剂(例如镓-67柠檬酸盐)以及用于代谢物成像,受体成像或免疫成像的专用试剂(例如放射性标记的单克隆抗体特异性肿瘤标记)。另外,也可以使用非放射性方法如超声波(参见“超声鉴别诊断肿瘤”,kossoff和fukuda,(编),igaku-shoin,new york,1984)来估计瘤。
199、除了上述用于确定肿瘤抑制的体内方法之外,可以使用多种体外方法以确定体内肿瘤抑制。代表性实例包括例如通过51cr释放测定肿瘤依赖性淋巴细胞增殖(ioannides等,j.immunol.146(5):1700-1707,1991),肿瘤特异性抗体的体外产生(herlyn,et al.,j.immunol.meth.73:157-167,1984),细胞(例如ctl,辅助t细胞)或体液(例如抗体)介导的体外细胞生长抑制(gazit,et al.,cancer immunol immunother 35:135-144,1992),并且对于这些测定中的任何一个,确定细胞前体频率(vose,int.j.cancer 30:135-142(1982)等。
200、在另一个实施方案中,与未接触或未暴露于本发明的肽连同一起施用的至少一种检查点抑制剂的生长相比,抑制肿瘤生长的方法表明生长状态减少。可通过本领域已知的任何方式评估肿瘤细胞生长,包括但不限于测量肿瘤大小,使用3h-胸苷掺入测定确定肿瘤细胞是否增殖,或计数肿瘤细胞。在其他实施方案中,“抑制”肿瘤细胞生长是指减缓,延迟或停止肿瘤生长或肿瘤收缩。每种可能性代表本发明的单独实施例。
201、在本发明的方法和组合物的另一个实施方案中,在施用治疗之前,施用治疗之后或在治疗施用之前和之后测量wt1表达。在另一个实施方案中,测量wt1转录物表达。在另一个实施方案中,测量肿瘤或癌细胞中的wt1蛋白水平。在另一个实施方案中,测量从癌细胞或肿瘤细胞脱落入循环或其他体液例如但不限于尿中的wt1蛋白或肽。每种可能性代表本发明的单独实施例。
202、在本发明方法和组合物的另一个实施方案中,在施用治疗前(基线),在施用治疗剂之后,或者在施用治疗之前和之后,在肿瘤或癌症细胞,或在全血,血清或血浆中测量(通过转录水平或蛋白水平)由施用于受试者的一种或多种检查点抑制剂靶向的检查点蛋白的表达。在本发明方法和组合物的一个实施方案中,所述一种或多种检查点蛋白选自:ctla-4,pd-l1,pd-l2,pd1,b7-h3,b7-h4,btla,hvem,tim3,gal9,lag3,vista,kir,2b4,cd160,cgen-15049,chk1激酶,chk2激酶,a2ar和b-7家族配体。在本发明的方法和组合物的一个实施方案中,在施用治疗之前,施用治疗之后或在施用前后测量pd1,pd2,ctla4或前述中的两种或更多种的组合的表达治疗。在一个实施方案中,检查点蛋白质表达在原发性肿瘤部位测量。在另一个实施方案中,癌症是转移性的,并且在转移部位或原发性肿瘤部位或两者处测量检查点蛋白质表达。
203、在本发明的方法和组合物的另一个实施方案中,在施用治疗之前(基线),施用治疗之后或施用治疗之前和之后测量一种或多种以下标志物:单核细胞骨髓样(m-mdscs),c-反应蛋白(crp),淋巴细胞绝对值,淋巴细胞绝对值和乳酸脱氢酶(ldh)。在另一个实施例中,在此包括使用一个或多个标记来预测或识别对检查点调制的应答。
204、测定免疫应答的存在和量值的方法是本领域中众所周知的。在另一个实施方案中,淋巴细胞增殖测定法,其中作为细胞增殖的函数测量放射性物质例如3h-胸苷的t细胞吸收。在其他实施方案中,通过测量白介素-2(il-2)产生、ca2+通量或染料吸收例如3-(4,5-二甲基噻唑-2-基)-2,5-二苯基-四唑鎓的增加来实现t细胞增殖的检测。每种可能性代表着本发明的独立实施方案。
205、在另一个实施方案中,通过本领域技术人员已知的方式测定ctl刺激,包括检测细胞增殖、细胞因子产生和其他。在接触配体脉冲靶标后由t细胞分泌的细胞因子的类型和数量的分析可以是功能活性的量度。可通过elisa或elispot测定法测量细胞因子以确定细胞因子产生的速率和总量。(fujihashi k.等,(1993)免疫学方法杂志(j.immunol.meth.)160:181;tanguay s.和killion j.j.(1994)淋巴因子细胞因子研究(lymphokinecytokine res.)13:259)。
206、在另一个实施方案中,通过51cr释放溶解测定法来确定ctl活性。对于用对照肽脉冲的靶细胞,可以比较抗原特异性t细胞对于肽脉冲51cr标记靶标的溶解。在另一个实施方案中,用本发明的肽刺激t细胞,并且可以确定在mhc情形下表达天然肽的靶细胞的溶解。在另一个实施方案中,使用溶解动力学以及固定时间点(例如,4小时)下的总靶标溶解,来评估配体性能。(ware c.f.等,(1983)免疫学杂志(j immunol)131:1312)。
207、测定肽对于hla分子的亲和力的方法是本领域中众所周知的。在另一个实施方案中,通过tap稳定化测定法来测定亲和力。
208、在另一个实施方案中,通过竞争放射免疫测定法来测定亲和力。在另一个实施方案中,利用以下方案:在具有1%牛血清白蛋白(bsa;fisher chemicals,fairlawn,nj)的pbs中洗涤靶细胞两次。将细胞以107/ml再次悬浮在冰上,并且在0℃下使用柠檬酸盐-磷酸盐缓冲液在3mg/mlβ2微球蛋白存在下将天然细胞表面结合肽汽提2分钟。在3mg/mlβ2微球蛋白和30mg/ml脱氧核糖核酸酶存在下将球粒以5×106个细胞/毫升再次悬浮在pbs/1%bsa中,并且将200ml等分试样在存在或不存在hla特异性肽的情况下在20℃下温育10分钟,然后在20℃下与125i标记的肽一起温育30分钟。在用pbs/2%bsa洗涤两次并用pbs洗涤一次后测定总结合125i。通过比较递增浓度的测试肽与已知结合肽来确定相对亲和力。
209、在另一个实施方案中,进行活细胞(例如skly-16细胞)表面上肽与hla的结合的特异性分析以证实与适当hla分子的结合并表征其限制。在另一个实施方案中,这包括与已知结合于相同或不同hla分子的过量未标记肽的竞争和表达相同或不同hla类型的靶细胞的使用。在另一个实施方案中,在活的新鲜或0.25%多聚甲醛固定的人类pbmc、白血病细胞系和特定hla类型的ebv转化t细胞系上进行这种测定法。通过如上文针对对于相关hla分子例如酪氨酸酶或hbv肽序列具有已知高亲和力的125i标记肽所述的竞争测定法来测定发现在特定细胞上结合mhc分子的肽的相对亲合力。
210、在另一个实施方案中,用于本发明的方法和组合物中的wt1肽包含一种或多种非经典氨基酸,例如:1,2,3,4-四氢异喹啉-3-甲酸酯(kazmierski等,(1991)美国化学会志(j.am chem.soc.)113:2275-2283);(2s,3s)-甲基-苯丙氨酸、(2s,3r)-甲基-苯丙氨酸、(2r,3s)-甲基-苯丙氨酸和(2r,3r)-甲基-苯丙氨酸(kazmierski和hruby(1991)四面体通讯(tetrahedron lett.)32(41):5769-5772);2-氨基四氢萘-2-甲酸(landis(1989),博士论文,亚利桑那大学);羟基-1,2,3,4-四氢异喹啉-3-甲酸酯(miyake等,(1984)武田研究实验室杂志(j.takeda res.labs.),43:53-76);组氨酸异喹啉甲酸(zechel等,(1991)国际肽与蛋白质研究杂志(int.j.pep.protein res.),38(2):131-138);和hic(组氨酸环脲)(dharanipragada等,(1993)国际肽与蛋白质研究杂志(int.j.pep.protein res.),42(1):68-77)和((1992)结晶学报:晶体结构通讯(acta.crst.,crystal struc.comm.),48(iv):1239-124)。此非经典氨基酸包含在本发明的修饰的肽中。
211、在另一个实施方案中,本发明的组合物和方法中使用的肽包含一种或多种aa类似物或肽模拟物,其在其他实施方案中诱导或促成特定二级结构。在其他实施方案中,这些肽包含以下:ll-acp(ll-3-氨基-2-二丙烯酮(propenidone)-6-甲酸)、诱导[β]-转角的二肽类似物(kemp等,(1985)有机化学杂志(j.org.chem.)50:5834-5838);诱导[β]-折叠的类似物(kemp等,(1988)四面体通讯(tetrahedron lett.)29:5081-5082);诱导[β]-转角的类似物(kemp等,(1988)四面体通讯(tetrahedron lett.)29:5057-5060);诱导α-螺旋的类似物(kemp等,(1988)四面体通讯(tetrahedron lett.)29:4935-4938);诱导γ-转角的类似物(kemp等,(1989)有机化学杂志(j.org.chem.)54:109:115);由以下参考文献提供的类似物:nagai和sato(1985)四面体通讯(tetrahedron lett.)26:647-650;和dimaio等,(1989)英国化学会志普尔金会刊(j.chem.soc.perkin trans),第1687页;gly-ala转角类似物(kahn等,(1989)四面体通讯(tetrahedron lett.)30:2317);酰胺键等排体(jones等,(1988)四面体通讯(tetrahedron lett.)29(31):3853-3856);四唑(zabrocki等,(1988)美国化学会志(j.am.chem.soc.)110:5875-5880);dtc(samanen等,(1990)国际蛋白质与肽研究杂志(int.j.protein pep.res.)35:501:509);以及olson等,(1990)美国化学科学杂志(j.am.chem.sci.)112:323-333和garvey等,(1990)有机化学杂志(j.org.chem.)55(3):936-940中教导的类似物。β转角和β凸起的构型限制模拟物以及含有其的肽描述于1995年8月8日颁予kahn的美国专利no.5,440,013。
212、在其他实施方案中,本发明方法中所用的肽缀合于如下文所述的各种其他分子之一,所述结合可以经由共价或非共价键(复合),其性质在另一个实施方案中根据特定目的而改变。在另一个实施方案中,所述肽与大分子载体(例如免疫原性载体)共价或非共价复合,所述载体包括但不限于天然和合成聚合物、蛋白质、多糖、多肽(氨基酸)、聚乙烯醇、聚乙烯吡咯烷酮和脂质。在另一个实施方案中,本发明的肽与底物连接。在另一个实施方案中,所述肽结合于脂肪酸,以引入脂质体中(美国专利no.5,837,249)。在另一个实施方案中,本发明的肽与固体支撑物共价或非共价复合,其中多种是本领域中已知的。在另一个实施方案中,肽与载体、底物、脂肪酸或固体支撑物的连接用于增加所引起的免疫应答。
213、在其他实施方案中,载体是甲状腺球蛋白、白蛋白(例如人类血清白蛋白)、破伤风类毒素、聚氨基酸如聚(赖氨酸:谷氨酸)、流感蛋白、乙型肝炎病毒核心蛋白、匙孔血蓝蛋白、白蛋白、或另一种载体蛋白或载体肽;乙型肝炎病毒重组疫苗,或apc。每种可能性代表着本发明的独立实施方案。
214、在另一个实施方案中,术语“氨基酸”是指天然的,或在另一个实施方案中非天然或合成的aa,并且在其他实施方案中可以包括甘氨酸、d或l光学异构体、aa类似物、肽模拟物或其组合。
215、在另一个实施方案中,术语“癌症”、“赘瘤”、“赘生物”或“肿瘤”可互换使用并且是指已经历使其对宿主生物呈病理性的恶性转化的细胞。癌症可以为编号分期系统的任何时期(如0期、1期、2期、3期或4期),和tnm分期系统中的任何时期。原发性癌细胞(即,从接近恶性转化位点处获得的细胞)可以通过充分建立的技术、特别是组织学检查而容易与非癌性细胞区分。如本文所用的癌细胞的定义不仅包括原发性癌细胞,而且包括源自癌细胞祖先的任何细胞。这包括转移的癌细胞,以及源自癌细胞的体外培养物和细胞系。在另一个实施方案中,可基于肿瘤质量检测肿瘤;例如,通过诸如cat扫描、磁共振成像(mri)、x射线、超声或触诊等程序,并且在另一个实施方案中通过生物化学或免疫研究结果鉴定,后者在其他实施方案中也用于鉴定癌细胞。肿瘤可为实体瘤或非实体瘤。
216、用于合成肽的方法是本领域中众所周知的。在另一个实施方案中,使用适当的固态合成程序合成本发明的肽(参见例如steward和young,固相肽合成(solidphase peptidesynthesis),freemantle,san francisco,calif.(1968);merrifield(1967)激素研究中的最新进展(recent progress in hormone res)23:451)。在其他实施方案中,使用如本文所述的测定法来测试这些肽的活性。
217、在另一个实施方案中,通过包括色谱法(例如,离子交换、亲和力和定尺寸柱色谱法)、离心、差异溶解度的标准方法,或通过用于蛋白质纯化的任何其他标准技术来纯化本发明的肽。在另一个实施方案中,使用免疫亲和力色谱法,由此通过使表位与包含针对所述肽或本发明的相关肽而产生的抗体的亲和柱结合来分离所述表位,并且固定至固定支撑物。
218、在另一个实施方案中,亲和标签如六组氨酸(invitrogen)、麦芽糖结合结构域(new england biolabs)、流感涂层序列(kolodziej等,(1991)酶学方法(meth.enzymol.)194:508-509)、谷胱甘肽-s-转移酶或其他连接至本发明的肽以允许通过穿过适当的亲和柱而容易纯化。在其他实施方案中,分离肽也可以使用诸如蛋白水解、核磁共振和x射线晶体学等技术来物理表征。
219、在另一个实施方案中,本发明的肽是经由如本领域技术人员将显而易见的已知技术通过体外翻译产生的。在另一个实施方案中,在翻译期间或之后有差异地修饰肽,例如,通过磷酸化、糖基化、交联、酰化、蛋白水解裂解、连接至抗体分子、膜分子或其他配体(ferguson等,(1988)生物化学年评(ann.rev.biochem.)57:285-320)。
220、在另一个实施方案中,本发明的肽进一步包含可检测标记,其在另一个实施方案中是发荧光的,或在另一个实施方案中是发光的,或在另一个实施方案中具放射性,或在另一个实施方案中是电子密集的。在其他实施方案中,可检测标记包含例如绿色荧光蛋白(gfp)、ds-red(红色荧光蛋白)、分泌型碱性磷酸酶(seap)、β-半乳糖苷酶、荧光素酶、32p、125i、3h和14c、荧光素和其衍生物、若丹明和其衍生物、丹酰基和伞形酮、荧光素或本领域技术人员已知的任何数目的其他此类标记。所用的特定标记将取决于所用免疫测定法的类型。
221、在另一个实施方案中,本发明的肽连接于底物,其在另一个实施方案中充当载体。在另一个实施方案中,肽与底物的连接用于增加所引起的免疫应答。
222、在另一个实施方案中,使用常规交联剂如碳化二亚胺将本发明的肽连接至如本文所述的其他分子。碳化二亚胺的实例是1-环己基-3-(2-吗啉基-(4-乙基)碳化二亚胺(cmc)、1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(edc)和1-乙基-3-(4-氮阳离子-4,4-二甲基戊基)碳化二亚胺。
223、在其他实施方案中,交联剂包含溴化氰、戊二醛和琥珀酸酐。一般来说,可以使用多种同型双功能剂中的任一种,包括同型双功能醛、同型双功能环氧化物、同型双功能亚氨基酯、同型双功能n-羟基琥珀酰亚胺酯、同型双功能马来酰亚胺、同型双功能烷基卤化物、同型双功能吡啶基二硫化物、同型双功能芳基卤化物、同型双功能酰肼、同型双功能重氮鎓衍生物和同型双功能光反应性化合物。在其他实施方案中,也设想异型双功能化合物,例如,具有胺反应性和巯基反应性基团的化合物、具有胺反应性和光反应性基团的化合物以及具有羰基反应性和巯基反应性基团的化合物。
224、在其他实施方案中,同型双功能交联剂分别包括双功能n-羟基琥珀酰亚胺酯二硫代双(琥珀酰亚胺基丙酸酯)、二琥珀酰亚胺基辛二酸酯和二琥珀酰亚胺基酒石酸酯;双功能酰亚胺酯己二亚氨酸二甲酯、庚二亚氨酸二甲酯和辛二亚氨酸二甲酯;双功能巯基反应性交联剂1,4-二-[3'-(2'-吡啶基二硫基)丙酰胺基]丁烷、双马来酰亚氨基己烷和双-n-马来酰亚氨基-1,8-辛烷;双功能芳基卤化物1,5-二氟-2,4-二硝基苯和4,4'-二氟-3,3'-二硝基苯基砜;双功能光反应性剂如双-[b-(4-叠氮基水杨基酰氨基)乙基]二硫化物;双功能醛甲醛、丙二醛、丁二醛、戊二醛和己二醛;双功能环氧化物如1,4-丁二醇二缩水甘油醚;双功能酰肼己二酸二酰肼、碳酰肼和琥珀酸二酰肼;双功能重氮鎓邻联甲苯胺、重氮化和双重氮化联苯胺;双功能烷基卤化物nln'-亚乙基-双(碘乙酰胺)、nln'-六亚甲基-双(碘乙酰胺)、nln'-十一亚甲基-双(碘乙酰胺),以及苄基卤化物和卤基氮芥,如ala'-二碘基-对二甲苯磺酸和三(2-氯乙基)胺。
225、在其他实施方案中,如本文所述,用于将肽连接至其他分子的异型双功能交联剂包括但不限于smcc(琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯)、mbs(间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯)、siab(n-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯)、smpb(琥珀酰亚胺基-4-(对马来酰亚胺基苯基)丁酸酯)、gmbs(n-(γ-马来酰亚胺基丁酰氧基)琥珀酰亚胺酯)、mpbh(4-(4-n-马来酰亚胺基苯基)丁酸酰肼)、m2c2h(4-(n-马来酰亚胺基甲基)环己烷-1-羧基-酰肼)、smpt(琥珀酰亚胺基氧基羰基-a-甲基-a-(2-吡啶基二硫基)甲苯)和spdp(n-琥珀酰亚胺基3-(2-吡啶基二硫基)丙酸酯)。
226、在另一个实施方案中,本发明的肽被配制为通过离子性、吸附性或生物特异性相互作用进行单体的非共价连接。在另一个实施方案中,在低离子强度环境下,例如在去离子水中,通过盐桥形成,可以实现肽与高度带正电荷或带负电荷分子的复合物。在另一个实施方案中,可以使用分别含有众多负电荷和正电荷的带电荷聚合物如聚(l-谷氨酸)或聚(l-赖氨酸)来产生大的复合物。在另一个实施方案中,肽吸附至表面如微粒乳胶珠粒或吸附至其他疏水性聚合物,在其他实施方案中,形成有效模拟交联的或化学聚合的蛋白质的非共价相关肽-超抗原复合物。在另一个实施方案中,经由使用其他分子之间的生物特异性相互作用,使肽非共价连接。例如,生物素对于蛋白质如抗生物素蛋白或抗生蛋白链菌素或其衍生物的强烈亲和力的利用可用于形成肽复合物。根据这个方面并且在另一个实施方案中,使用常见的生物素化试剂如d-生物素的n-羟基琥珀酰亚胺基酯(nhs-生物素)(其与可用的胺基反应),肽可以经修饰以具有生物素基团。
227、在另一个实施方案中,本发明的肽连接至载体。在另一个实施方案中,所述载体是klh。在其他实施方案中,所述载体是本领域中已知的任何其他载体,包括例如甲状腺球蛋白、白蛋白如人类血清白蛋白、破伤风类毒素、聚氨基酸如聚(赖氨酸:谷氨酸)、流感、乙型肝炎病毒核心蛋白、乙型肝炎病毒重组疫苗等。每种可能性代表着本发明的独立实施方案。
228、在另一个实施方案中,本发明的肽结合至脂质,如p3 css。在另一个实施方案中,本发明的肽结合至珠粒。
229、在前述实施方案中,肽、交联肽、结合肽或肽的任何其他形式,连同至少一种检查点抑制剂,用在本发明的方法中。
230、在另一个实施方案中,除了使用至少一种检查点抑制剂,本发明的方法和组合物进一步包含免疫调节化合物。在其他实施方案中,所述免疫调节化合物是细胞因子、趋化因子、或增强免疫系统辅助或粘附分子表达的补体成分、其受体或其组合。在一些实施方案中,免疫调节化合物包括白介素例如白介素1至15、干扰素α、β或γ、肿瘤坏死因子、粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、粒细胞集落刺激因子(g-csf)、趋化因子如嗜中性粒细胞激活蛋白(nap)、巨噬细胞趋化和活化因子(mcaf)、rantes、巨噬细胞炎性肽mip-ia和mip-ib、补体成分,或其组合。在其他实施方案中,免疫调节化合物刺激ox40、ox40l(gp34)、淋巴细胞趋化因子、cd40、cd40l、b7.1、b7.2、trap、icam-1、2或3、细胞因子受体或其组合的表达或增强表达。
231、在另一个实施方案中,免疫调节化合物诱导或增强参与免疫应答的共刺激分子的表达(其包括在一些实施方案中)。
232、在一个实施方案中,根据本发明施用wt1疫苗和检查点抑制剂的患者也在第一次接种疫苗之前或当天或其组合中施用gm-csf。在一个实施方案中,在第一次疫苗施用之前和之后两天向患者皮下施用70mcg gm-csf。
233、在另一个实施方案中,所述组合物包含溶剂,其包括水、分散介质、细胞培养介质、等张剂等。在另一个实施方案中,所述溶剂是具有约7.0的ph的水性等张缓冲溶液。在另一个实施方案中,所述组合物包含稀释剂如水、磷酸盐缓冲盐水或盐水。在另一个实施方案中,所述组合物包含非水性溶剂,例如丙基乙二醇、聚乙二醇和植物油。
234、在另一个实施方案中,所述组合物经配制以通过本领域技术人员已知的许多技术中的任一种施用。例如,本发明提供经肠胃外、经静脉内、经皮下、经皮内、经粘膜内、经局部、经口或通过吸入施用药物组合物。
235、在另一个实施方案中,在包含本发明的肽的疫苗的用途中,疫苗可以进一步包含细胞群体,在另一个实施方案中,其包含淋巴细胞,单核细胞,巨噬细胞,树突细胞,内皮细胞,干细胞或者它们的组合,在另一个实施方案中,它们是相对于彼此的自体的,同基因的或同种异体的。在另一个实施方案中,细胞群包含本发明的肽。在另一个实施方案中,细胞群占据肽。在一个实施方案中,细胞是抗原呈递细胞(apc)。在另一个实施例中,apc是专业的apc。每种可能性代表本发明的单独实施例。
236、在另一个实施方案中,本发明的细胞群体获自体内来源,例如,外周血、白细胞去除血液制品、单采血液制品、外周淋巴结、肠相关淋巴组织、脾脏、胸腺、脐带血、肠系膜淋巴结、肝脏、免疫病变位点,例如滑液、胰腺、脑脊髓液、肿瘤样品、肉芽肿组织或可以获得这些细胞的任何其他来源。在另一个实施方案中,所述细胞群体获自人类来源,其在其他实施方案中获自人类胎儿、新生儿、儿童或成人来源。在另一个实施方案中,本发明的细胞群体获自动物来源,例如猪或猿,或任何其他相关动物。在另一个实施方案中,本发明的细胞群体获自正常的受试者,或在另一个实施方案中患病的受试者,或在另一个实施方案中易患上相关疾病的受试者。
237、在另一个实施方案中,本发明的细胞群体经由基于亲和力的分离方法分离。在其他实施方案中,亲和力分离技术包括使用抗体涂布磁性珠粒的磁性分离、亲和色谱法、结合至单克隆抗体(例如,补体和细胞毒素)或结合单克隆抗体使用的细胞毒性剂,和与连接至固体基质如板的抗体“分区(panning)”,或任何其他适宜技术。在其他实施方案中,分离技术包括使用荧光激活细胞分选机,其可具有不同程度的复杂性,例如多颜色通道、低角度和钝角光散射检测通道、阻抗通道等。在其他实施方案中,可以使用能够分离本发明的细胞群体的任何技术,并且其被视为本发明的一部分。
238、在另一个实施方案中,树突细胞来自如此限定的在多种淋巴和非淋巴组织中存在的形态类似的细胞类型的多种群体(steinman(1991)免疫学年评(ann.rev.immunol.)9:271-296)。在另一个实施方案中,本发明中使用的树突细胞是从骨髓分离的,或在另一个实施方案中源自骨髓祖细胞,或在另一个实施方案中从外周血分离/源自外周血,或在另一个实施方案中源自细胞系或为细胞系。
239、在另一个实施方案中,本文所述的细胞群体是从哺乳动物如鼠类、猿或人类的白血细胞级分分离的(参见例如wo 96/23060)。在另一个实施方案中,白血细胞级分可以从哺乳动物的外周血分离。
240、分离树突细胞的方法是本领域中众所周知的。在另一个实施方案中,经由包括以下步骤的方法分离dc:(a)通过本领域中已知的方法如白细胞去除提供从哺乳动物来源获得的白血细胞级分;(b)通过逆流离心淘析将步骤(a)的白血细胞级分分成四种或更多种子级分;(c)通过使细胞与钙离子载体、gm-csf和il-13或gm-csf和il-4接触来刺激来自步骤(b)的一种或多种级分中的单核细胞转化为树突细胞;(d)鉴定来自步骤(c)的富集树突细胞的级分;和(e)优选在约4℃下,收集步骤(d)的富集级分。
241、在另一个实施方案中,通过荧光激活细胞分选来鉴定富集树突细胞的级分,其鉴定以下标志物hla-dr、hla-dq或b7.2中的至少一种,和以下标志物cd3、cd14、cd16、56、57和cd 19、20的同时不存在。
242、在另一个实施方案中,所述细胞群体包含淋巴细胞,其在另一个实施方案中包含t细胞,或在另一个实施方案中包含b细胞。在其他实施方案中,所述t细胞表征为nk细胞、辅助t细胞、细胞毒性t淋巴细胞(ctl)、tbl、天然t细胞或其组合。应理解,原发性t细胞、或细胞系、克隆等应视为本发明的一部分。在另一个实施方案中,t细胞是ctl、或ctl系、ctl克隆、或从肿瘤、炎性或其他渗透物分离的ctl。
243、在另一个实施方案中,造血干细胞或早期祖细胞包含本发明中使用的细胞群体。在另一个实施方案中,这些群体是通过白细胞去除分离或衍生的。在另一个实施方案中,在细胞因子施用后从骨髓、外周血(pb)或新生儿脐带血去除白细胞。在另一个实施方案中,干细胞或祖细胞的特征为其被称为cd34+的表面抗原标志物的表面表达,和表面谱系抗原标志物lin-的表达的排除。
244、在另一个实施方案中,向受试者施用本发明的肽、组合物或疫苗,以及骨髓细胞。在另一个实施方案中,在受试者的先前辐照后,施用以及骨髓细胞实施方案,作为治疗过程的一部分,以抑止、抑制或治疗受试者中的癌症。
245、在另一个实施方案中,短语“接触细胞”或“接触群体”是指在其他实施方案中可能是直接或间接的暴露方法。在另一个实施方案中,这种接触包括通过本领域中众所周知的任何方式直接注射细胞,例如微注射。在另一个实施方案中,此外设想,向细胞的供应是间接的,例如经由提供于围绕细胞的培养基中,或经由本领域中众所周知并且如本文中所述的任何途径施用至受试者。
246、在另一个实施方案中,本发明方法的ctl生成是在体内实现的,并且通过向受试者中引入在体外与本发明的肽接触的抗原呈递细胞,连同施用至少一种检查点抑制剂来实现(参见例如paglia等,(1996)实验医学杂志(j.exp.med.)183:317-322)。
247、在另一个实施方案中,本发明的方法和组合物的肽被递送至抗原呈递细胞(apc)。
248、在另一个实施方案中,所述肽以编码所述肽的cdna形式递送至apc。在另一个实施方案中,术语“抗原呈递细胞”(apc)是指树突细胞(dc)、单核细胞/巨噬细胞、b淋巴细胞或表达必要的mhc/共刺激分子的其他细胞类型,其有效允许所呈递肽的t细胞识别。在另一个实施方案中,所述apc是癌细胞。每种可能性代表着本发明的独立实施方案。在每个实施方案中,给予患者或受试者的疫苗或apc或任何形式的肽递送与至少一种检查点抑制剂一起施用。如本文所述,至少一种检查点抑制剂的施用不需要在wt1疫苗或其替代形式的相同疫苗,制剂,施用部位或施用时间内。如本文所体现的,与任何其多种形式的wt1疫苗同时施用检查点抑制剂可增强有需要的受试者中wt1特异性ctl的形成。
249、在另一个实施方案中,使ctl与2种或更多种apc群体接触。在另一个实施方案中,所述2种或更多种apc群体呈递不同的肽。每种可能性代表着本发明的独立实施方案。
250、在另一个实施方案中,使用在apc(例如dc)的细胞溶质中导致抗原表达的技术将肽递送至apc。用于表达apc上的抗原的方法是本领域中众所周知的。在另一个实施方案中,所述技术包括(1)将编码本发明的肽的裸dna引入apc中,(2)使apc感染表达本发明的肽的重组载体,和(3)使用脂质体将本发明的肽引入apc的细胞溶质中。(参见boczkowski d.等,(1996)实验医学杂志(j.exp.med.)184:465-472;rouse等,(1994)病毒学杂志(j.virol.)68:5685-5689;和nair等,(1992)实验医学杂志(j.exp.med.)175:609-612)。
251、在另一个实施方案中,如本文所示例,使用培养抗原呈递细胞,例如源自人类细胞系174xcem.t2(被称为t2)的那些,其在限制内源肽与细胞表面mhc i类分子的缔合的抗原加工路径中含有突变(zweerink等,(1993)免疫学杂志(j.immunol.)150:1763-1771)。
252、在另一个实施方案中,使用本文所述的任何方法来引起ctl,其是在体外引起的。在另一个实施方案中,ctl是离体引起的。在另一个实施方案中,ctl是体外引起的。在另一个实施方案中,将所得ctl,连同至少一种检查点抑制剂施用至受试者,从而治疗与肽、包含所述肽的表达产物或其同源物相关的病状。每种可能性代表着本发明的独立实施方案。
253、在另一个实施方案中,所述方法包括引入编码本发明的肽的遗传序列。在另一个实施方案中,所述方法包括向受试者施用包含编码本发明的肽的核苷酸序列的载体(tindle,r.w.等,病毒学(virology)(1994)200:54)。在另一个实施方案中,该方法包括向受试者施用编码肽的裸核酸(dna或rna),或者在另一个实施方案中,施用两种或更多种本发明的肽(nabel等,pnas-usa(1990)90:11307)。在另一个实施方案中,使用多表位,基于类似物的癌症疫苗(fikes等,同上)。每种可能性代表本发明的单独实施例。
254、核酸(dna或rna)可以通过本领域已知的任何方式施用受试者,包括肠胃外或静脉内施用,或者在另一个实施方案中,通过基因枪。在另一个实施方案中,核酸以组合物施用,在其他实施方案中,其对应于本文列出的任何实施方案。dna或rna可作为裸核酸施用于受试者或由载体携带。
255、根据本发明的方法使用的载体在另一个实施方案中可以包含促进或允许本发明的肽(例如wt1肽)在细胞中体外或在受试者中表达的任何载体体内。术语“载体”用于指可用于将编码序列信息(例如,编码wt1肽的核酸序列)转移至细胞或受试者的任何分子(例如,核酸,质粒,病毒,颗粒)。用于几种癌症的核酸疫苗已进入临床试验(wahren b等人,“dna vaccines:recent developments and the future”,vaccines,2014,2:785-796;fioretti d.等人,“dna vaccines:developing new strategies against cancer,journal of biomedicine and biotechnology,2010,2010(938):174378)。已知使用dna疫苗扩增功能性wt1特异性t细胞的策略(chaise c等人,“dna vaccination induces wt1-specific t-cell responses with potential clinical relevance,”blood,2008,112(7):2956-2964)。在一个实施方案中,载体是病毒载体。在另一个实施方案中,载体是非病毒载体。在一个实施方案中,非病毒载体是核酸载体,如质粒dna或mrna载体(参见例如weide b.等,“plasmid dna-and messenger rna-based anti-cancer vaccination,”immunol lett,2008,115(1):33-42);kim h.等,“self-assembled messenger rnananoparticles(mrna-nps)for efficient gene expression,”sci rep,2015,5:12737);ulmer j.b.等人“rna-based vaccines”,vaccine,2012,30:4414-4418)。在另一个实施方案中,“载体”包括减毒病毒,例如痘苗病毒或禽痘病毒,美国专利号4,722,848,通过引用并入本文。在另一个实施方案中,载体是bcg(卡介苗),如stover等人所述(nature 351:456-460(1991))。根据本文的描述,用于本发明肽的治疗性施用或免疫的其它载体,例如伤寒沙门氏菌载体等对本领域技术人员而言将是清楚的。可用于将核酸分子施用给受试者体内和体外细胞的载体的非限制性实例包括腺病毒,腺相关病毒,逆转录病毒,慢病毒,痘病毒,疱疹病毒,病毒样颗粒(vlp),质粒,阳离子脂质,脂质体和纳米颗粒。
256、编码序列”是转录成mrna和/或翻译成多肽的核酸序列。编码序列的边界由5'-末端的翻译起始密码子和3'-末端的翻译终止密码子决定。编码序列可以包括但不限于mrna,cdna和重组多核苷酸序列。可以通过缺失编码序列的一部分,通过插入序列和/或通过取代序列内的一个或多个核苷酸来制备变体或类似物。用于修饰核酸序列的技术,诸如定点诱变,是本领域技术人员熟知的(参见例如sambrook等,molecular cloning:a laboratorymanual,第2版,1989;dna cloning,vols。i和ii,dnglover编,1985)。任选地,利用这种多核苷酸的本发明的核酸序列以及本发明的组合物和方法可以包括非编码序列。
257、术语“可操作地连接的”在本文中用于指侧翼控制序列的排列,其中如此描述的侧翼序列被配置或组装以执行其常规功能。因此,侧翼控制序列可操作地连接至编码序列可以能够在与控制序列相容的条件下实现编码序列的复制,转录和/或翻译。例如,当启动子能够指导编码序列转录时,该编码序列可操作地连接启动子。侧翼序列不必与编码序列邻接,只要其功能正确。因此,例如,介入的非翻译但转录的序列可存在于启动子序列和编码序列之间,并且启动子序列可以仍然被认为与编码序列“可操作地连接”。编码多肽(例如wt1)肽)通常将具有其自己的可操作连接的启动子序列。
258、在另一个实施方案中,载体进一步编码如本文所述的免疫调节化合物。在另一个实施方案中,在向受试者施用编码本发明肽的载体同时,之前或之后,向受试者施用另外的编码它的载体。
259、在另一个实施方案中,将本发明的肽,组合物和疫苗与其他抗癌化合物和化学治疗剂,包括针对替代癌症抗原的单克隆抗体组合施用于受试者,或用于本发明的方法中,或者在另一个实施方案中,由对应于或部分来源于本发明肽的aa序列组成的表位。这是在本发明的各种实施例的实践中使用至少一个检查点抑制剂的补充。
260、在另一个实施方案中,本发明提供了检测受试者中wt1特异性cd4+ t细胞应答的方法,所述方法包括向受试者施用本发明的肽,疫苗或免疫原性组合物。在另一个实施方案中,用于检测wt1特异性cd4+ t细胞应答的迟发型超敏反应测试。在另一个实施方案中,本发明的肽优于其未突变的对应物诱导受试者中的cd4+ t细胞应答。每种可能性代表本发明的单独实施例。
261、如本文所用,术语“患者”,“受试者”和“个体”可互换使用,并且旨在包括人类和非人类动物物种。例如,受试者可以是人类或非人类哺乳动物。在一些实施方案中,受试者是非人类动物模型或兽医患者。受试者可以是任何年龄或性别。
262、在另一个实施方案中,本发明的方法和组合物的免疫原性组合物包含与本发明的肽相关的apc。在另一个实施方案中,免疫原性组合物包含与本发明的肽的混合物相关的apc。在另一个实施方案中,免疫原性组合物由与本发明的肽相关的apc组成。在另一个实施方案中,免疫原性组合物由与本发明的肽的混合物相关的apc组成。每种可能性代表本发明的单独实施例。
263、在另一个实施方案中,本发明的方法和组合物的组合物是免疫原性组合物。在另一个实施方案中,组合物是药物组合物。在另一个实施方案中,组合物是本领域已知的任何其他类型的组合物。每种可能性代表本发明的单独实施例。每种组合物还包含至少一种检查点抑制剂。
264、本发明涵盖剂量范围的各种实施方案。在另一个实施方案中,剂量为20μg/肽/天。在另一个实施方案中,剂量为10μg/肽/天。在另一个实施方案中,剂量为30μg/肽/天。在另一个实施方案中,剂量为40μg/肽/天。在另一个实施方案中,剂量为60μg/肽/天。在另一个实施方案中,剂量为80μg/肽/天。在另一个实施方案中,剂量为100μg/肽/天。在另一个实施方案中,剂量为150μg/肽/天。在另一个实施方案中,剂量为200μg/肽/天。在另一个实施方案中,剂量为300μg/肽/天。在另一个实施方案中,剂量为400μg/肽/天。在另一个实施方案中,剂量为600μg/肽/天。在另一个实施方案中,剂量为800μg/肽/天。在另一个实施方案中,剂量为1000μg/肽/天。
265、在另一个实施方案中,剂量为10μg/肽/剂量。在另一个实施方案中,剂量为30μg/肽/剂量。在另一个实施方案中,剂量是40μg/肽/剂量。在另一个实施方案中,剂量为60μg/肽/剂量。在另一个实施方案中,剂量为80μg/肽/剂量。在另一个实施方案中,剂量为100μg/肽/剂量。在另一个实施方案中,剂量为150μg/肽/剂量。在另一个实施方案中,剂量是200μg/肽/剂量。在另一个实施方案中,剂量为300μg/肽/剂量。在另一个实施方案中,剂量是400μg/肽/剂量。在另一个实施方案中,剂量是600μg/肽/剂量。在另一个实施方案中,剂量为800μg/肽/剂量。在另一个实施方案中,剂量为1000μg/肽/剂量。
266、在另一个实施方案中,剂量为10-20μg/肽/剂量。在另一个实施方案中,剂量为20-30μg/肽/剂量。在另一个实施方案中,剂量为20-40μg/肽/剂量。在另一个实施方案中,剂量为30-60μg/肽/剂量。在另一个实施方案中,剂量为40-80μg/肽/剂量。在另一个实施方案中,剂量为50-100μg/肽/剂量。在另一个实施方案中,剂量为50-150μg/肽/剂量。在另一个实施方案中,剂量为100-200μg/肽/剂量。在另一个实施方案中,剂量为200-300μg/肽/剂量。在另一个实施方案中,剂量为300-400μg/肽/剂量。在另一个实施方案中,剂量为400-600μg/肽/剂量。在另一个实施方案中,剂量为500-800μg/肽/剂量。在另一个实施方案中,剂量为800-1000μg/肽/剂量。
267、在另一个实施方案中,每剂量或每天的肽的总量是上述量之一。在另一个实施方案中,每个剂量的总肽剂量是上述量之一。
268、上述各剂量代表本发明的单独实施方案。
269、在另一个实施方案中,本发明提供了包含本发明的肽,组合物或疫苗以及至少一种检查点抑制剂的试剂盒。在另一个实施方案中,试剂盒还包含标签或包装插页。在另一个实施方案中,该试剂盒用于通过使用迟发型超敏反应测试来检测wt1特异性cd4应答。在另一个实施方案中,该试剂盒用于本文列举的任何其他方法。在另一个实施方案中,该试剂盒用于本领域已知的任何其他方法。每种可能性代表本发明的单独实施例。
270、实施例
271、wt1肽疫苗联合施用nivolumab在治疗卵巢癌患者中的的疗效评估
272、被诊断患有卵巢癌的符合条件的患者将在完成化疗后4个月内开始接种时间表。患者最初在12周内接受6次wt1肽疫苗接种,并且在14周内接受7次输注免疫检查点抑制剂nivolumab。使用每种剂量的疫苗进行毒性评估,并在第15周治疗结束后3周进行毒性评估。治疗后,研究人员将观察患者长达30分钟的时间。没有计划增加剂量。在整个试验过程中常规毒性评估将继续进行。
273、在第15周的评估中没有疾病进展的患者被允许接受大约每8周施用4次另外的疫苗。这个维护疫苗课程将于19周开始。
274、在6个独立的时间点,从40ml肝素化血液样品评估免疫应答:基线(在同意和第一次施用之前,以确定基线变化),在疫苗5和6之前,以及在最后nivolumab输液3周后。如果可行,在3个月的随访中将获得额外的抽血。
275、使用elisa,测量针对疫苗中4种wt1肽产生的抗体水平。抗体通常在完成第四次接种才存在。将对外周血淋巴细胞进行t细胞增殖应答测定,包括:流式细胞术连同用facs进行表型分析,包括白细胞亚群分析,t调节细胞测定(包括cd3,cd4,cd8,foxp3,icos和pd1)和骨髓来源的抑制细胞(mdscs,cd14+hla-drlow细胞),在外周血以及肿瘤中(如果获得任选的活组织检查)。wt1 t细胞特异性cd4和cd8增殖应答将使用多功能细胞内细胞因子染色(ics)和使用meso scale discovery system的基于流式细胞计量的细胞毒性测定来测量,功能通过ifn-γ产生来测量。[29]描述了血样处理,t细胞监测,抗体elisa和多功能t细胞测定的详细程序。
276、基线值和t细胞应答结果将与临床缓解的持续时间相关。
277、如果在第15周之前从研究中移除患者,则将获得用于研究后免疫学研究的血液。将在基线和第15周(或如果认为医学上必要时更早)和此后每3个月,长达1年,直至疾病进展,进行ct扫描。mri腹部和骨盆可以用来代替ct腹部和骨盆。参考放射科医师将使用免疫相关应答标准来确定疾病进展[57]。将在基线,第6周和第15周,然后每3个月,长达1年,直至疾病进展,获得ca125。由于疫苗接种患者炎症混杂的可能性,ca125将不会用于确定疾病进展。患者将继续进行研究直至进展,发展出不可接受的毒性,疫苗顺序用完或患者停药。
278、wt1疫苗:将在本研究中使用的疫苗含有四种独立的wt1肽:
279、·ymfpnapyl(seq id no:124;wt1-a1):具有突变的氨基酸r126y以刺激cd8+应答的hla i类肽。
280、·sgqaymfpnapylpscles(seq id no:125;wt1-122a1长):根据来自临床前和阶段1研究的数据,在更长的肽内包含嵌入的wt1-a1不规则的序列的hla ii类肽以刺激cd4+和cd8+应答。
281、·rsdelvrhhnmhqrnmtkl(seq id no:1;wt1-427长)和pgcnkryfklshlqmhsrkhtg(seq id no:2;wt1-331长):诱导cd4+应答的hla ii类肽,其可为长期持续的cd8+t细胞应答提供帮助。
282、药物产品:在磷酸盐缓冲盐水的无菌溶液中提供四种肽以产生疫苗产品(“wt1vax”)。每个小瓶在总体积为0.7ml(0.4mg/ml的每种肽,40%的过量填充)中含有280mcg的每种肽。在gmp条件下进行瓶装和无菌测试。疫苗乳剂将在使用前单独制备。这将需要肽溶液与免疫佐剂montanide isa 51 vg的混合物。
283、预期剂量:选择每种肽200mcg的剂量,因为它在其他人使用的安全和有效剂量范围内。肽疫苗在广泛的剂量范围内(100-2000mcg注射)产生免疫和临床反应,没有明确的剂量-反应关系证据。较高剂量具有刺激t细胞上较低亲和力tcr并降低反应的理论可能性[30,33,34]。小瓶大小:每个单剂量小瓶含有0.7ml施用途径:皮下。
284、nivolumab:预期剂量:3mg/kg;小瓶大小:10ml;施用途径:静脉注射。nivolumab将以3mg/kg的剂量施用,并且每2周静脉内以60分钟iv输注一次施用。在输注结束时,用足够量的生理盐水冲洗线。如果受试者的体重与用于计算所需剂量的先前体重相差>10%,则应计算所需剂量,校正剂量。不允许增加或减少nivolumab的剂量。第一次nivolumab治疗没有推荐使用的预防药物。
285、受试者可以在nivolumab剂量之间不少于12天施用,并且在预定施用日期之后不超过3天施用。在3天窗口后施用的剂量被认为是剂量延迟。从以前剂量,治疗可能会延迟最多6周。
286、即使施用延迟,ct或mri的肿瘤评估应按照方案继续进行。
287、治疗/干预计划
288、·患者将被视为门诊病人。
289、·wt1疫苗将在第0、2、4、6、8和10周施用。
290、·所有注射剂都将在四肢之间旋转的位置的皮下施用。
291、·所有患者在第0天和第2天接受皮下注射sargramostim(gm-csf)70mcg。如果已经适当指导sq注射施用,患者可以自行施用gm-csf。患者将被告知预期的反应,例如注射部位的刺激。患者将记录日志,注明注射的时间和位置。
292、·患者还将接受1.0ml含montanide的wt1肽乳液。它将由护士在同一解剖部位与gm-csf一起皮下注射(不可自行施用)。
293、·接种疫苗后约30分钟观察患者。
294、·nivolumab将在第0、2、4、6、8、10和12周以60分钟输注静脉内施用。受试者可以在nivolumab剂量之间不少于12天施用,并且在预定施用日期之后不超过3天施用。在3天窗口后施用的剂量被认为是剂量延迟。从以前剂量,治疗可能会延迟最多6周。
295、可预期,与单独的wt1疫苗接种或单独的nivolumab治疗相比,wt1疫苗和nivolumab的组合治疗增加患者中的wt1特异性ctl群体,并提供增加的抗wt1表达肿瘤的活性。
296、参考文献
297、1.siegel,r.,d.naishadham,and a.jemal,cancer statistics,2012.cacancerj clin,2012.62(1):p.10-29.
298、2.hoskins,w.j.,c.a.perez,and r.c.young,principles and practice ofgynecologic oncology.3rd ed.2000,philadelphia:lippincott williams&wilkins.xxi,1268 p.
299、3.barnhill,d.r.,et al.,the second-look surgical reassessment forepithelial ovarian carcinoma.gynecol oncol,1984.19(2):p.148-54.
300、4.rubin,s.c.,et al.,recurrence after negative second-look laparotomyfor ovarian cancer:analysis of risk factors.am j obstet gynecol,1988.159(5):p.1094-8.
301、5.markman,m.,et al.,second-line platinum therapy in patients withovarian cancer previously treated with cisplatin.j clin oncol,1991.9(3):p.389-93.
302、6.zhang,h.,et al.,antibodies against gd2 ganglioside can eradicatesyngeneic cancer micrometastases.cancer res,1998.58(13):p.2844-9.
303、7.zhang,l.,et al.,intratumoral t cells,recurrence,and survival inepithelial ovarian cancer.n engl j med,2003.348(3):p.203-13.
304、8.curiel,t.j.,etal.,specific recruitment of regulatory t cells inovarian carcinoma fosters immune privilege and predicts reduced survival.natmed,2004.10(9):p.942-9.
305、9.iasonos,a.,et al.,identifying clinical improvement in consolidationsingle-arm phase 2 trials in patients with ovarian cancer in second orgreater clinical remission.int j gynecol cancer,2012.22(1):p.63-9.
306、10.berek,j.s.,et al.,randomized,placebo-controlled study oforegovomab for consolidation of clinical remission in patients with advancedovarian cancer.j clin oncol,2004.22(17):p.3507-16.
307、11.reinartz,s.,et al.,vaccination of patients with advanced ovariancarcinoma with the anti-idiotype aca125:immunological response and survival(phase ib/ii).clin cancer res,2004.10(5):p.1580-7.
308、12.bookman,m.a.,et al.,evaluation of monoclonal humanized anti-her2antibody,trastuzumab,in patients with recurrent or refractory ovarian orprimary peritoneal carcinoma with overexpression of her2:a phase ii trial ofthe gynecologic oncology group.j clin oncol,2003.21(2):p.283-90.
309、13.allavena,p.,et al.,intraperitoneal recombinant gamma-interferon inpatients with recurrent ascitic ovarian carcinoma:modulation of cytotoxicityand cytokine production in tumor-associated effectors and of majorhistocompatibility antigen expression on tumor cells.cancer res,1990.50(22):p.7318-23.
310、14.pujade-lauraine,e.,et al.,intraperitoneal recombinant interferongamma in ovarian cancer patients with residual disease at second-looklaparotomy.j clin oncol,1996.14(2):p.343-50.
311、15.recchia,f.,et al.,interleukin-2 and 13-cis retinoic acid asmaintenance therapy in advanced ovarian cancer.int j oncol,2005.27(4):p.1039-46.
312、16.sabbatini,p.j.,et al.,immunization of ovarian cancer patients witha synthetic lewis(y)-protein conjugate vaccine:a phase 1 trial.int j cancer,2000.87(1):p.79-85.
313、17.nicholson,s.,et al.,a phase i trial of idiotypic vaccination withhmfg1 in ovarian cancer.cancer immunol immunother,2004.53(9):p.809-16.
314、18.diefenbach,c.s.,et al.,safety and immunogenicity study of ny-eso-1b peptide and montanide isa-51 vaccination of patients with epithelialovarian cancer in high-risk first remission.clin cancer res,2008.14(9):p.2740-8.
315、19.keilholz,u.,et al.,wilms'tumour gene 1(wt1)in humanneoplasia.leukemia,2005.19(8):p.1318-23.
316、20.oji,y.,et al.,expression of the wilms'tumor gene wt1 in solidtumors and its involvement in tumor cell growth.jpn j cancer res,1999.90(2):p.194-204.
317、21.scharnhorst,v.,et al.,internal translation initiation generatesnovel wt1 protein isoforms with distinct biological properties.j biol chem,1999.274(33):p.23456-62.
318、22.haber,d.a.,et al.,alternative splicing and genomic structure ofthe wilms tumor gene wt1.proc natl acad sci u s a,1991.88(21):p.9618-22.
319、23.mundlos,s.,et al.,nuclear localization of the protein encoded bythe wilms'tumor gene wt1 in embryonic and adult tissues.development,1993.119(4):p.1329-41.
320、24.buckler,a.j.,et al.,isolation,characterization,and expression ofthe murine wilms'tumor gene(wt1)during kidney development.mol cell biol,1991.11(3):p.1707-12.
321、25.fraizer,g.c.,et al.,expression of the tumor suppressor gene wt1 inboth human and mouse bone marrow.blood,1995.86(12):p.4704-6.
322、26.al-hussaini,m.,et al.,wt1 assists in distinguishing ovarian fromuterine serous carcinoma and in distinguishing between serous andendometrioid ovarian carcinoma.histopathology,2004.44(2):p.109-15.
323、27.pinilla-ibarz,j.,et al.,improved human t-cell responses againstsynthetic hla-0201 analog peptides derived from the wt1 oncoprotein.leukemia,2006.20(11):p.2025-33.
324、28.may,r.j.,et al.,peptide epitopes from the wilms'tumor 1oncoprotein stimulate cd4+ and cd8+ t cells that recognize and kill humanmalignant mesothelioma tumor cells.clin cancer res,2007.13(15 pt 1):p.4547-55.
325、29.krug,l.m.,et al.,wt1 peptide vaccinations induce cd4 and cd8 tcell immune responses in patients with mesothelioma and non-small cell lungcancer.cancer immunol immunother,2010.59(10):p.1467-79.
326、30.oka,y.,et al.,induction of wt1(wilms'tumor gene)-specificcytotoxic t lymphocytes by wt1 peptide vaccine and the resultant cancerregression.proc natl acad sci u s a,2004.101(38):p.13885-90.
327、31.letsch,a.,et al.,effect of vaccination of leukemia patients with amhc class i peptide of wilms tumor gene 1(wt1)peptide with unspecific thelper stimulation on wt1-specific igm responses and on igg responses.j clinoncol,2008.26:p.abstr 3054.
328、32.ohno,s.,et al.,wilms'tumor 1(wt1)peptide immunotherapy forgynecological malignancy.anticancer res,2009.29(11):p.4779-84.
329、33.schaed,s.g.,et al.,t-cell responses against tyrosinase 368-376(370d)peptide in hla*a0201+melanoma patients:randomized trial comparingincomplete freund's adjuvant,granulocyte macrophage colony-stimulatingfactor,and qs-21 as immunological adjuvants.clin cancer res,2002.8(5):p.967-72.
330、34.slingluff,c.l.,jr.,et al.,clinical and immunologic results of arandomized phase ii trial of vaccination using four melanoma peptides eitheradministered in granulocyte-macrophage colony-stimulating factor in adjuvantor pulsed on dendritic cells.j clin oncol,2003.21(21):p.4016-26.
331、35.faries,m.b.,et al.,effect of granulocyte/macrophage colony-stimulating factor on vaccination with an allogeneic whole-cell melanomavaccine.clin cancer res,2009.15(22):p.7029-35.
332、36.keilholz,u.,et al.,a clinical and immunologic phase 2 trial ofwilms tumor gene product 1(wt1)peptide vaccination in patients with aml andmds.blood,2009.113(26):p.6541-8.
333、37.weber,j.,et al.,granulocyte-macrophage-colony-stimulating factoradded to a multipeptide vaccine for resected stage ii melanoma.cancer,2003.97(1):p.186-200.
334、38.keir,m.e.,et al.,pd-1 and its ligands in tolerance andimmunity.annu rev immunol,2008.26:p.677-704.
335、39.freeman,g.j.,et al.,engagement of the pd-1 immunoinhibitoryreceptor by a novel b7 family member leads to negative regulation oflymphocyte activation.j exp med,2000.192(7):p.1027-34.
336、40.latchman,y.,et al.,pd-l2 is a second ligand for pd-1 and inhibitst cell activation.nat immunol,2001.2(3):p.261-8.
337、41.hamanishi,j.,et al.,programmed cell death 1 ligand 1 and tumor-infiltrating cd8+ t lymphocytes are prognostic factors of human ovariancancer.proc natl acad sci u s a,2007.104(9):p.3360-5.
338、42.mu,c.y.,et al.,high expression of pd-l1 in lung cancer maycontribute to poor prognosis and tumor cells immune escape throughsuppressing tumor infiltrating dendritic cells maturation.med oncol,2011.28(3):p.682-8.
339、43.pardoll,d.m.,the blockade of immune checkpoints in cancerimmunotherapy.nat rev cancer,2012.12(4):p.252-64.
340、44.nivolumab(bms-936558)investigator brochure,version 12.2013.
341、45.hwang,w.t.,et al.,prognostic significance of tumor-infiltrating tcells in ovarian cancer:a meta-analysis.gynecol oncol,2012.124(2):p.192-8.
342、46.matsuzaki,j.,et al.,tumor-infiltrating ny-eso-1-specific cd8+ tcells are negatively regulated by lag-3 and pd-1 in human ovarian cancer.procnatl acad sci u s a,2010.107(17):p.7875-80.
343、47.brahmer,j.r.,et al.,safety and activity of anti-pd-l1 antibody inpatients with advanced cancer.n engl j med,2012.366(26):p.2455-65.
344、48.page,d.b.,et al.,immune modulation in cancer with antibodies.annurev med,2014.65:p.185-202.
345、49.harrison,m.l.,et al.,duration of second or greater completeclinical remission in ovarian cancer:exploring potential endpoints forclinical trials.gynecol oncol,2007.106(3):p.469-75.
346、50.juretzka,m.,et al.,a phase 2 trial of oral imatinib in patientswith epithelial ovarian,fallopian tube,or peritoneal carcinoma in second orgreater remission.eur j gynaecol oncol,2008.29(6):p.568-72.
347、51.levine,d.,et al.,a phase ii evaluation of goserelin andbicalutamide in patients with ovarian cancer in second or higher completeclinical disease remission.cancer,2007.110(11):p.2448-56.
348、52.walter,s.,et al.,multipeptide immune response to cancer vaccineima901 after single-dose cyclophosphamide associates with longer patientsurvival.nat med,2012.
349、53.wolchok,j.d.,et al.,development of ipilimumab:a novelimmunotherapeutic approach for the treatment of advanced melanoma.ann n yacadsci,2013.1291(1):p.1-13.
350、54.hodi,f.s.,et al.,immunologic and clinical effects of antibodyblockade of cytotoxic t lymphocyte-associated antigen 4 in previouslyvaccinated cancer patients.proc natl acad sci u s a,2008.105(8):p.3005-10.
351、55.quezada,s.a.,et al.,ctla4 blockade and gm-csf combinationimmunotherapy alters the intratumor balance of effector and regulatory tcells.j clin invest,2006.116(7):p.1935-45.
352、56.duraiswamy,j.,et al.,dual blockade of pd-1 and ctla-4 combinedwith tumor vaccine effectively restores t-cell rejection function intumors.cancer res,2013.73(12):p.3591-603.
353、57.wolchok,j.d.,et al.,guidelines for the evaluation of immunetherapy activity in solid tumors:immune-related response criteria.clin cancerres,2009.15(23):p.7412-20.
354、58.dupont,j.,et al.,wilms tumor gene(wt1)and p53 expression inendometrial carcinomas:a study of 130 cases using a tissue microarray.gynecoloncol,2004.94(2):p.449-55.
355、59.eisenhauer,e.a.,et al.,new response evaluation criteria in solidtumours:revised recist guideline(version 1.1).eur j cancer,2009.45(2):p.228-47.
- 还没有人留言评论。精彩留言会获得点赞!