一种基于多组分动态共价化学组装的纳米颗粒及其制备方法和应用与流程
1.本发明属于生物医药材料技术领域,尤其涉及一种基于多组分动态共价化学组装的纳米颗粒及其制备方法和应用。
背景技术:
2.细菌感染威胁着全人类的健康。与日益严峻的细菌耐药性对应的是新型抗生素研发的停滞。因此,新的治疗技术亟待开发和推广,以切实解决日益严峻的细菌耐药性问题,提高细菌感染的治疗效果。
3.造成细菌耐药性问题的一个重要原因是细菌生物被膜的形成。细菌在侵入人体后能在组织或植入体表面粘附并分泌胞外聚合物基质(extracellularpolymeric substances,eps)形成生物被膜。处于生物被膜生长状态的细菌对传统的抗生素治疗有着极高的耐受性,对抗生素的耐受性比其浮游状态生长的同类细菌提高了10-1000倍。因此,在治疗细菌感染的过程中,实现生物膜的解离将会提高抗菌的效果。
4.一氧化氮是一种重要的生物信使分子,在调节生物膜的解离上起到关键的作用。研究表明,皮摩尔到纳摩尔剂量的一氧化氮,可以广泛实现微生物的分散过程,进而恢复细菌对一系列抗菌剂和抗生素的敏感性,增强杀菌效果。因此,使用一氧化氮来调控生物膜解离是一种非常有前景的策略。由于一氧化氮是一种活性的气体分子,容易与很多原子及自由基反应,且在体内的半衰期较短,因此,如何实现一氧化氮的响应性、定点及按需释放比较关键。
5.从另一方面来说,与小分子抗生素相比,抗菌纳米制剂可以通过感染部位的高渗透长滞留(enhancedpenetration and retention,epr)效应被动靶向细菌感染,从而提高感染部位抗生素的局部浓度,提高抗生素抗菌效能,并减少对正常组织和细胞的毒副作用。目前常用的抗菌纳米材料主要是高分子纳米材料、无机纳米材料等,而直接利用小分子组装的纳米材料报道较少,造成这种情况的主要原因是缺少有效的组装方式。与上述材料相比较,直接由小分子组装成的纳米材料具有载药量高、合成简便等优点。因此,如何通过小分子亲疏水性结构的合理设计,实现其自组装过程形成纳米颗粒,是目前所面临的一个难点。
技术实现要素:
6.有鉴于此,本发明旨在提供一种基于多组分动态共价化学组装的纳米颗粒及其制备方法和应用,通过将喹诺酮类抗生素衍生物与一氧化氮供体(nonoates偶氮二醇烯盐类)相结合,合成一类具有两亲性的化合物并组装成纳米颗粒,用于治疗细菌引起的感染。
7.为实现上述目的,本发明提出如下技术方案:
8.一种基于多组分动态共价化学组装的纳米颗粒,将喹诺酮类抗生素衍生物与一氧化氮供体nonoates相结合,通过动态的亚胺键和硼酸酯键制备成具有式(i)所示结构的纳
米颗粒:
[0009][0010]
其中,n为1-5中的任意整数;
[0011]
r1为环丙基、乙基或2,4-二氟苯基;
[0012]
r2为氢或氨基;
[0013]
r3为氢、甲氧基或氟;
[0014]
r4为氟;
[0015]
r5为氢或甲基;
[0016]
r6为氢或甲基。
[0017]
进一步地,所述喹诺酮类抗生素衍生物的制备方法为:将喹诺酮类抗生素、n,n-二甲基甲酰胺和水混合,加入碳酸钾,超声处理,然后加入4-(溴甲基)苯硼酸,搅拌,反应结束后使用稀盐酸溶液调节ph至沉淀析出,抽滤,干燥,得到喹诺酮类抗生素衍生物,即中间体quin-bpa。
[0018]
进一步地,所述n,n-二甲基甲酰胺和水的体积比为4:1~2:1,优选为2:1。
[0019]
进一步地,所述喹诺酮类抗生素的用量为1当量、碳酸钾为2~4当量,优选为3当量,4-(溴甲基)苯硼酸的用量为1~2当量,优选为1.2当量。
[0020]
进一步地,所述喹诺酮类抗生素选自环丙沙星、加替沙星、司帕沙星、诺氟沙星、洛美沙星或替马沙星。
[0021]
进一步地,所述一氧化氮供体nonoates的制备方法为:取有机胺溶解在有机溶剂中,在一氧化氮气氛下,保持反应体系在5~15个标准大气压,搅拌,过滤取固体,即得一氧化氮供体nonoates。
[0022]
进一步地,所述有机胺与有机溶剂的浓度为0.2~0.5m,优选为0.32m。
[0023]
本发明还提供一种基于多组分动态共价化学组装的纳米颗粒的制备方法,包括以下步骤:
[0024]
将一氧化氮供体nonoates的水溶液、喹诺酮类抗生素衍生物和3,4-二羟基苯甲醛溶解于二甲基亚砜中,搅拌后,将得到的溶液分散到ph为7.4的缓冲溶液中,即得基于多组分动态共价化学组装的纳米颗粒。
[0025]
进一步地,步骤2)中,所述一氧化氮供体nonoates、喹诺酮类抗生素衍生物和3,4-二羟基苯甲醛的物质的量之比为1:2:2。
[0026]
本发明还提供一种基于多组分动态共价化学组装的纳米颗粒作为抗菌材料的应
用。
[0027]
本发明提供了一种由两亲性小分子化合物合成及组装的具有抗菌功能的纳米粒子。整个结构由含苯硼酸官能团的喹诺酮类抗生素衍生物与一氧化氮供体nonoates经由连接子3,4-二羟基苯甲醛通过硼酸酯及亚胺等动态共价键结合而成。其中,亲水性部分由一氧化氮供体nonoates提供,疏水性部分由喹诺酮衍生物部分提供。
[0028]
本发明首次实现抗生素与一氧化氮供体组装的小分子纳米颗粒,在功能上具有响应性、定点、按需释放等优点,将一氧化氮解离生物膜与抗生素的抗菌性能相结合,产生协同的抗菌效果。
[0029]
与现有技术相比,本发明的优势为:
[0030]
本发明利用多组分动态共价化学组装,实现了小分子药物自身组装成纳米粒子的目的。与聚合物负载药物的体系相比较,在同一质量浓度下,小分子载药体系具有更高的载药量,且小分子结构确定易于重复便于后期工业化生产。与小分子药物单体相比,纳米药物增加了药物在血液中的循环时间,提高了药物的稳定性。另外,由于动态共价键的引入,纳米颗粒具有活性氧及酸响应性,能够在感染部位实现按需及响应性释放。
[0031]
本发明合成上述小分子的原料便宜、易得且合成及组装方法简便。该方法可以应用于多种喹诺酮类抗生素的组装,实现其纳米级别前药的制备。
[0032]
该材料能发挥一氧化氮解离生物膜的能力及喹诺酮类抗生素的抗菌能力,并产生协同的抗菌效果。体外实验及动物实验表明,该材料在治疗细菌引起的感染上有显著效果。
附图说明
[0033]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0034]
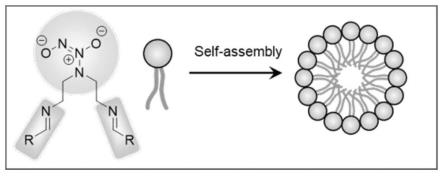
图1为实施例1纳米颗粒的组装示意图;
[0035]
图2为实施例1纳米颗粒及各个单体结构的核磁共振1h-nmr(400mhz,cdcl3)图;
[0036]
图3为实施例1纳米颗粒的红外光谱图(ft-ir);
[0037]
图4为实施例1纳米颗粒的粒径及zeta电位图;
[0038]
图5为实施例1纳米颗粒的扫描电镜(sem)及元素(mapping)图;
[0039]
图6为实施例1纳米颗粒的透射电镜(tem)图;
[0040]
图7为实施例1纳米颗粒的ph及活性氧响应图;
[0041]
图8为实施例1纳米颗粒及各个单体的最小抑菌浓度(mic)及最低杀菌浓度(mbc)对比图;
[0042]
图9为实施例1纳米颗粒治疗小鼠腹腔感染模型图。
具体实施方式
[0043]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
[0044]
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发
明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0045]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
[0046]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
[0047]
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
[0048]
一种基于多组分动态共价化学组装的纳米颗粒,将喹诺酮类抗生素衍生物与一氧化氮供体nonoates相结合,通过动态的亚胺键和硼酸酯键制备成具有式(i)所示结构的纳米颗粒:
[0049][0050]
其中,n为1-5中的任意整数;
[0051]
r1为环丙基、乙基或2,4-二氟苯基;
[0052]
r2为氢或氨基;
[0053]
r3为氢、甲氧基或氟;
[0054]
r4为氟;
[0055]
r5为氢或甲基;
[0056]
r6为氢或甲基。
[0057]
式(i)所示结构的纳米颗粒的合成路线如下所示:
[0058][0059]
所述喹诺酮类抗生素衍生物的制备方法为:将喹诺酮类抗生素、n,n-二甲基甲酰胺(dmf)和水混合,加入碳酸钾,超声处理,然后加入4-(溴甲基)苯硼酸,搅拌12h,薄层色谱法(tlc)监测反应进度,反应结束后,使用酸性溶液调节ph至沉淀析出,抽滤,干燥,得到喹诺酮类抗生素衍生物,即中间体quin-bpa。
[0060]
在一些优选实施例中,所述n,n-二甲基甲酰胺和水的体积比为4:1~2:1,优选为2:1。
[0061]
在一些优选实施例中,所述喹诺酮类抗生素的用量为1当量、碳酸钾为2~4当量,优选为3当量,4-(溴甲基)苯硼酸的用量为1~2当量,优选为1.2当量。
[0062]
在一些优选实施例中,所述喹诺酮类抗生素选自环丙沙星(cip)、加替沙星、司帕沙星、诺氟沙星、洛美沙星或替马沙星。更优选为环丙沙星。具体结构式为:
[0063][0064]
在一些优选实施例中,所述一氧化氮供体nonoates的制备方法为:取有机胺溶解在有机溶剂中,在一氧化氮气氛下,保持反应体系在5~15个标准大气压,搅拌,过滤取固体,即得一氧化氮供体nonoates。更优选为10个标准大气压。所述一氧化氮供体nonoates结构式如下:
[0065]
在一些优选实施例中,所述有机胺与有机溶剂的浓度为0.2~0.5m,优选为0.32m。所示有机溶剂为乙腈或甲醇,优选使用乙腈。
[0066]
有机胺可选自二乙烯三胺、3,3'-二氨基二丙胺、亚精胺,优选为二乙烯三胺。
[0067]
本发明还提供一种基于多组分动态共价化学组装的纳米颗粒的制备方法,包括以下步骤:
[0068]
将一氧化氮供体nonoates的水溶液、喹诺酮类抗生素衍生物和3,4-二羟基苯甲醛溶解于二甲基亚砜中,搅拌后,将得到的溶液分散到ph为7.4的缓冲溶液中,即得基于多组分动态共价化学组装的纳米颗粒。
[0069]
在一些优选实施例中,步骤2)中,所述一氧化氮供体nonoates、喹诺酮类抗生素衍生物和3,4-二羟基苯甲醛的物质的量之比为1:2:2。
[0070]
本发明还提供一种基于多组分动态共价化学组装的纳米颗粒作为抗菌材料的应用。
[0071]
本发明中的“标准大气压”是指101.325kpa。
[0072]
本发明所用原料均为市场上购买。
[0073]
本发明实施例中薄层色谱法(tlc)监测反应进度为本领域常规方法,且并非本发明重点,在此不做赘述。
[0074]
本发明实施例中的“室温”指的是25
±
1℃。
[0075]
实施例1
[0076]
1)一氧化氮供体nonoates的制备方法,步骤如下:
[0077]
将二乙烯三胺(1.0g,9.7mmol)(deta)溶解在乙腈(30ml)中,并转移至高压反应釜。向高压反应釜中通入氮气置换出里面的氧气,再通入一氧化氮气体置换氮气,保持整个反应釜的压力在10个标准大气压。反应搅拌24h后,过滤出1.5g白色固体,即一氧化氮供体nonoates(detanonoate)。产率为95%,产物低温(-80℃)下保存。
[0078]
其核磁数据为:1h nmr(400mhz,d2o)δ4.77
–
4.76(m,4h),3.22
–
3.09(m,4h),2.86
–
2.72(m,4h).
[0079]
2)环丙沙星衍生物的制备方法,步骤如下:
[0080]
将环丙沙星(0.25g,0.76mmol)加入到dmf和水的混合溶液中(分别为4ml与2ml),加入碳酸钾(0.32g,2.28mmol,3.0equiv)超声使其溶解,随后加入4-(溴甲基)苯硼酸(0.2g,0.91mmol,1.2equiv)搅拌过夜,薄层色谱法(tlc)监测反应进度。反应结束后,用1n盐酸溶液调节体系的ph值至中性,使产物沉淀析出,抽滤、干燥得白色固体0.21g,即环丙沙星衍生物(中间体cip-bpa),产率为58%。
[0081]
其核磁数据为:1h nmr(400mhz,dmso-d6)δ15.17(bs,1h),8.66(s,1h),8.01(s,2h),7.89(d,j=13.3hz,1h),7.79(d,j=7.5hz,2h),7.57(d,j=7.4hz,1h),7.33(d,j=7.6hz,2h),3.88
–
3.77(m,1h),3.59(s,2h),3.35
–
3.32(m,4h),2.66
–
2.58(m,4h),1.38
–
1.29(m,2h),1.23
–
1.14(m,2h).
[0082]
3)基于多组分动态共价化学组装的纳米颗粒的制备方法,步骤如下:
[0083]
将一氧化氮供体nonoates(13μl,100mg/ml,具体是直接将一氧化氮供体nonoates溶于去离子水,配制成100mg/ml的溶液)的水溶液、中间体quin-bpa(7.0mg)和3,4-二羟基苯甲醛(2mg)溶解于二甲基亚砜(987μl)中搅拌4h,得到反应液;
[0084]
取6.3μl反应液分散到ph=7.4的1ml磷酸缓冲溶液中得到相应的纳米颗粒aha,即基于多组分动态共价化学组装的纳米颗粒(参见图1)。
[0085]
图2为实施例1及各个单体结构的核磁共振1hnmr(400mhz,cdcl3)图。从图2中可以看出,体系中原料的酚羟基及硼酸羟基峰消失,而在化学位移为8.63ppm处出现了新形成的亚胺氢的特征峰,表明硼酸酯键和亚胺键的形成。
[0086]
图3为实施例1纳米颗粒的红外光谱图(ft-ir)。从图3中可以看出,红外光谱检测到了在1580cm-1
的c=n特征吸收峰及硼酸酯键在1107cm-1
处的特征吸收峰,也进一步证实了上述动态共价键的形成。
[0087]
形貌表征:用纯水将上述组装的纳米颗粒原液稀释10倍后,用纳米粒度仪测定组装体的粒径尺寸,zeta表面电位以及dls。结果如图4所示。从图4中可以看出,该纳米颗粒粒径为68.3nm,分散系数为0.236,表面zeta电位为-27.2mv。
[0088]
图5为实施例1纳米颗粒的扫描电镜(sem)及元素(mapping)图,图6为实施例1纳米颗粒的透射电镜(tem)图。从图5、图6可以看出,纳米粒子形貌接近球形,粒径尺寸接近50nm,且粒子中分别含有硼、碳、氮、氧以及氟等元素。
[0089]
试验例1
[0090]
验证实施例1制备的纳米颗粒酸响应及活性氧响应性释放,方法如下:
[0091]
分别用ph为7.4、6.5、7.4(含100μm h2o2)以及6.5(含100μm h2o2)的溶液将实施例
1制备的纳米颗粒稀释10倍(100μg/ml),得到1mg/ml的组装体。在37℃下孵育2h,测定各组的粒径变化。结果如图7所示。
[0092]
从图7中可以看出,用ph为7.4的溶液稀释后的组装体依旧能够保持粒径约为60nm,在该条件下比较稳定。而在ph为6.5的条件下,组装体的粒径显著增大,推测为亚胺键在酸性条件下断裂,使单体在水相中团聚导致的。在有h2o2存在的条件下,纳米粒子的粒径不再均一,由于硼酸酯键的断裂,体系也有一定程度的聚集,粒径变大。当在ph为6.5及h2o2同时存在的情况下,纳米粒子的粒径更不均一,有多种粒径分布,可能是酸响应和活性氧响应协同的结果。
[0093]
试验例2
[0094]
验证体外抗菌效果,方法如下:
[0095]
分别测量了实施例1中的纳米颗粒aha、deta nonoate、环丙沙星单体cip以及3,4-二羟基苯甲醛(dba)的最小抑菌浓度(mic)及最低杀菌浓度(mbc)。用pbs(磷酸盐缓冲溶液)将各样品稀释成相应的浓度,在96孔板中加入各浓度的样品100μl,再在各个孔中加入100μl 2*105cfu/ml事先准备好的菌液s.aureus xen36(生物发光基因转染的金黄色葡萄球菌)。24h后,通过酶标仪测定600nm的吸光值。其最终结果如图8所示,纳米颗粒aha对于s.aureus xen36的mic与mbc分别为0.13μg/ml和0.25μg/ml,小于环丙沙星单体本身的0.5μg/ml和1.0μg/ml。
[0096]
试验例3
[0097]
为了验证实施例1制备的材料在体内的效果,建立小鼠腹腔感染模型进行验证,方法如下:
[0098]
将所有健康且活泼的小鼠分为4组,分别为组装体组(aha纳米颗粒),环丙沙星组(cip),一氧化氮组(detanonoate)以及对照组(只注射pbs菌液),每组7只小鼠,给每只小鼠的腹腔中注射入300μl 5*108cfu/ml事先准备好的pbs菌液s.aureus xen36,2个小时后拍活体成像(作为每只小鼠生物发光的起点)并且立即给药,给药量根据cip 0.2mg每只的量计算,之后间隔一定的时间拍摄活体成像(ivis),观察小鼠体内生物发光强度的变化,给药24小时后,将老鼠处死,取腹水进行平板计数,统计细菌浓度。结果如图9所示。
[0099]
从图9中可以看出,从活体成像的图片中发现,所有组分中,细菌浓度在小鼠体内都是呈现下降的趋势。环丙沙星组给药一天以后,依旧能检测到细菌的生物发光强度,且经过腹水的平板计数,其中依旧有超过103cfu/ml的细菌存在,说明当前剂量的环丙沙星经过一次治疗并没有能够将细菌全部杀死,而组装体组作用的小鼠,在第8个小时就几乎检测不到细菌,且能够一直维持到第24小时,取腹水进行平板计数后,发现腹水中的菌降到了102cfu/ml以下,说明组装体能够有效杀灭小鼠体内的细菌。
[0100]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1