紫云英苷在制备治疗急性肾损伤药物中的应用
1.本发明涉及紫云英苷在制备治疗急性肾损伤药物中的应用。
背景技术:
2.急性肾损伤(acute kidney injury,aki)是指由于各种因素导致肾功能短期内急剧下降致使机体内代谢产物潴留,水、电解质、酸碱平衡紊乱的临床综合征。近年来,急性肾损伤的发病率呈逐年上升的趋势。
3.顺铂(cisplatin,cddp)是一种临床一线抗肿瘤药物,主要用于头颈部癌、肺癌、卵巢癌等多种实体恶性肿瘤的治疗。顺铂能够阻止dna复制,影响rna和蛋白质的合成,导致肿瘤细胞凋亡。但是顺铂作为一种非特异性抗肿瘤药物,在化疗过程中会出现多种不良反应,包括肾毒性、耳毒性、周围神经病变、过敏反应等,其中肾毒性最常见。顺铂剂量依赖的肾毒性极大的限制了其临床应用。马兜铃酸(aristolochic acids,aa)主要存在于马兜铃酸(aristolochiaceae)马兜铃属(aristolochia)植物中,大剂量马兜铃酸可直接损伤肾小管上皮细胞,尤其近端肾小管上皮细胞,导致细胞坏死或凋亡。体外研究还发现马兜铃酸可抑制肾小管上皮细胞的生长,使细胞周期停滞于g2/m期,且损伤作用与剂量相关。
4.紫云英苷是一种天然存在的黄酮类化合物,广泛存在于菟丝子(cuscuta chinensislam.)和旋花科(convolvulaceae)约60个属和1650种种植物中。有研究报道紫云英苷具有抗炎、抗氧化、抗病毒、镇痛、抗菌、抗过敏和抗肝毒等作用。目前,还未见其用于治疗急性肾损伤的报道。
技术实现要素:
5.发明人在细胞体外模型上使用紫云英苷进行干预治疗,验证紫云英苷改善顺铂/马兜铃酸对肾小管上皮细胞的损伤;在小鼠体内模型上使用紫云英苷进行干预治疗,验证紫云英苷改善顺铂诱导的急性肾损伤。结果表明:在细胞体外模型上使用紫云英苷进行干预治疗,紫云英苷能改善顺铂/马兜铃酸对肾小管上皮细胞的损伤;在小鼠体内模型上使用紫云英苷能改善顺铂诱导的急性肾损伤。说明紫云英苷对顺铂/马兜铃酸诱导急性肾损伤具有保护作用。
6.本发明的目的是提供紫云英苷在制备治疗急性肾损伤药物中的应用。
7.优选的,紫云英苷在制备治疗顺铂和/或马兜铃酸所致的急性肾损伤药物中的应用。
8.进一步优选的,紫云英苷在制备改善肾小管上皮细胞存活率药物的应用
9.进一步优选的,紫云英苷在制备改善肾小管上皮细胞活性氧含量药物的应用。
10.进一步优选的紫云英苷在制备改善急性肾损伤的生化指标血肌酐、尿素氮和白介素-1β药物的应用。
11.进一步优选的,紫云英苷在制备改善急性肾损伤的肾脏组织病理药物的应用。
12.一种用于治疗急性肾损伤的药物,它是以紫云英苷为有效成分,与药学上可接受
的辅料制成的任一药学上可接受的剂型。
13.所述的剂型为片剂、胶囊、粉剂、糖浆、液剂、悬浮剂、冻干粉针或针剂中的任意一种剂型。
14.本发明的有益效果:
15.紫云英苷可以抑制服用顺铂/马兜铃酸产生的肾损伤效果,紫云英苷具有良好的防治顺铂/马兜铃酸诱导急性肾损伤的作用,能为临床上运用紫云英苷防治顺铂诱导急性肾损伤提供较好的实验依据。
16.本发明为紫云英苷的利用及开发出新的用途,扩大了紫云英苷的治疗范围,同时也为顺铂急性肾损伤这一疾病开辟了新的中药治疗方法。
附图说明
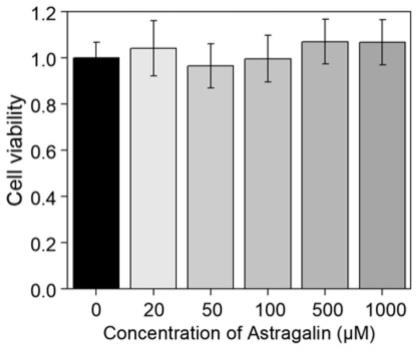
17.图1为紫云英苷对hk-2细胞的细胞毒性结果。
18.图2为顺铂模型在不同药物干预下的细胞活力结果。
19.图3为马兜铃酸模型在不同药物干预下的细胞活力结果。
20.图4为顺铂模型在不同药物干预下的活性氧含量结果。
21.图5为马兜铃酸模型在不同药物干预下的活性氧含量结果。
22.图6为顺铂模型在不同药物干预下的细胞凋亡结果。
23.图7为马兜铃酸模型在不同药物干预下的细胞凋亡结果。
24.图8为急性肾损伤小鼠在不同药物干预下血清肌酐水平。
25.图9为急性肾损伤小鼠在不同药物干预下血清尿素氮水平。
26.图10为急性肾损伤小鼠在不同药物干预下血清白细胞介素-1β水平。
27.图11为急性肾损伤小鼠在不同药物干预下组织切片图。
具体实施方式
28.下面结合实施例对本发明的技术方案作进一步详细描述。以下实施例用于说明本发明,但不应视为对本发明保护范围的限制。
29.实施例1
30.细胞株:人肾小管上皮细胞(hk-2,江苏凯基生物技术股份有限公司)。
31.以下培养基均为dmem培养基:80u/m青霉素和0.08mg/ml链霉素(双抗)、10%的胎牛血清的dmem培养基(江苏凯基生物技术股份有限公司)。
32.顺铂(cddp)标准品购自上海阿拉丁股份有限公司,使用时采用培养基配成合适的浓度,现用现配。
33.马兜铃酸(aa)标准品购自上海阿拉丁股份有限公司,使用时采用培养基配成合适的浓度,现用现配。
34.紫云英苷标准品购自成都麦德生科技有限公司,使用时采用培养基配成合适的浓度,现用现配。
35.n-乙酰半胱氨酸(n-acetyl-l-cysteine,nac)标准品上海阿拉丁股份有限公司,使用时采用培养基配成合适的浓度,现用现配。
36.1 mtt检测紫云英苷对细胞活力的影响
37.1.1实验方法
38.hk-2细胞于含80u/m青霉素和0.08mg/ml链霉素(双抗)、10%的胎牛血清的dmem 培养基中,置于37℃、5%co2培养箱培养;将细胞用胰酶消化后,用血球计数板进行计数,用培养基调整细胞密度为1
×
105个/ml,接种于96孔板上,每孔加入细胞悬液100μl;于37℃、5%的co2培养基中培养12h,小心移除孔内培养基,设置实验组、对照组和空白组,实验组:分别加入不同浓度的紫云英苷药液(20,50,100,500,1μm),每孔180 μl,每个药物浓度设置6个复孔,对照组:加入不含药液的培养基180μl,空白组:向不含细胞的孔内加培养基180μl;所有组于37℃、5%的co2培养基中培养24h,每孔加入 20μl浓度5mg/ml的mtt溶液(用pbs配制,0.22μm滤膜过滤除菌),继续在37℃恒温箱中孵育4h;小心移除孔内培养基上清液,每孔加入150μldmso,37℃震荡10min使紫色结晶物充分溶解,采用酶标仪双波长法(570nm,630nm,双波长,前一个指测量波长,后一个指参考波长,)测定各孔的吸光度(od值),按以下公式计算细胞存活率。
[0039][0040]
od
t
是实验组的吸光度;odb是空白组的吸光度;odc是对照组的吸光度。
[0041]
1.2实验结果
[0042]
如图1所示,紫云英苷对hk-2细胞没有细胞毒作用,与空白组比较无统计学差异 (p》0.05)。
[0043]
2 mtt检测紫云英苷改善顺铂/马兜铃酸诱导急性肾损伤对细胞增殖能力的影响
[0044]
2.1实验方法
[0045]
hk-2细胞密度为1
×
105个/ml,接种于96孔板,每孔加入细胞悬液100μl,于37℃、 5%co2培养箱中培养12h,小心移除孔内培养基,设置给药组、模型组、对照组和空白组,给药组:给药组分别加入50μm n-乙酰半胱氨酸(nac)或不同浓度的紫云英苷药液 (20,40,80μm,分别为低剂量组lc、中剂量组mc、高剂量组hc),每个药物浓度设置 6个复孔,每孔90μl,培养24h;空白组:向不含细胞的孔内加培养基;对照组和模型组:加不含药液培养基90μl,培养24h。模型组和给药组分别加入200μm顺铂(或4mm马兜铃酸),每孔10μl,培养12h,对照组和空白组加不含药液培养基10μl,培养12h。所有组每孔加入12μl浓度为5mg/ml的mtt溶液(用pbs配制,0.22μm滤膜过滤除菌),继续孵育4h,小心移除孔内培养基上清液,每孔加入100μldmso,37℃放置10min使紫色结晶物甲瓒充分溶解,用酶标仪测定各孔的吸光度(od值),计算其细胞存活率。
[0046][0047]
od
t
是给药组和模型组的吸光度;odb是空白组的吸光度;odc是对照组的吸光度。
[0048]
2.2实验结果
[0049]
如图2所示,与空白组比较,模型组顺铂使hk-2细胞的细胞活力明显降低 (p《0.05)。与模型组比较,紫云英苷预处理后的细胞活力明显提高(p《0.05),并且随着紫云英苷剂量的增大,对顺铂诱导损伤的保护作用更加明显。
[0050]
如图3所示,与空白组比较,模型组马兜铃酸使hk-2细胞的细胞活力明显降低 (p《0.05)。与模型组比较,紫云英苷预处理后的细胞活力明显提高(p《0.05),并且随着紫云英
苷剂量的增大,对马兜铃酸诱导损伤的保护作用更加明显。
[0051]
3 dcfh-da染色法检测细胞氧化应激(活性氧含量)情况
[0052]
3.1实验方法
[0053]
将hk-2细胞接种于6孔板中,每孔1
×
104个/ml,每孔加入细胞悬液2ml,于37℃、 5%co2培养箱中培养24h,小心移除孔内培养基。给药组分别加入50μm nac和不同浓度的紫云英苷药液(20,40,80μm,分别为低剂量组lc、中剂量组mc、高剂量组hc),每个药物浓度设置2个复孔,每孔0.9ml,培养12h,空白组和模型组:加不含药液培养基 0.9ml,培养12h;12h后小心移除所有孔内培养基,给药组和模型组分别加入200μm顺铂(或4mm马兜铃酸),每孔1ml,继续培养12h;空白组加不含药液培养基1ml,培养 12h;所有组孵育结束后吸弃上清,使用胰酶消化,2500rpm离心5min收集细胞,加入 1
×
pbs重悬细胞再次离心,再次加入1
×
pbs重悬细胞再次离心,dcfh-da染色液使用无血清培养基进行适当稀释,每组细胞加入1ml染色液,吹悬细胞,放置于37℃恒温箱孵育 20min,染色结束后2500rpm离心5min,使用1
×
pbs重悬细胞再次离心,离心后1
×
pbs重悬细胞,使用荧光酶标仪检测(ex/em=488/525nm)。绿色荧光强度与活性氧的水平成正比。在最大激发波长480nm,最大发射波长525nm处,以空白组荧光信号强度作为对照,设置为基准1,分析实验各组活性氧水平。
[0054]
3.2实验结果
[0055]
如图4所示,与空白组比较,模型组顺铂导致细胞内发生氧化应激(p《0.05)。与模型组比较,紫云英苷预处理后的细胞氧化应激现象减弱(p《0.05),并且随着紫云英苷剂量的增大,对顺铂诱导的氧化应激的保护作用更加明显。
[0056]
如图5所示,与空白组比较,模型组马兜铃酸导致细胞内发生氧化应激(p《0.05)。与模型组比较,紫云英苷预处理后的细胞氧化应激现象减弱(p《0.05),并且随着紫云英苷剂量的增大,对马兜铃酸诱导的氧化应激的保护作用更加明显。
[0057]
4 annexinv-fitc/pi双染法通过流式细胞仪检测细胞凋亡情况
[0058]
4.1实验方法
[0059]
将hk-2细胞接种于6孔板中,每孔1
×
104个/ml,每孔加入细胞悬液2ml,于37℃、 5%co2培养箱中培养24h,小心移除孔内培养基。给药组分别加入50μm nac和不同浓度的紫云英苷药液(20,40,80μm,分别为低剂量组lc、中剂量组mc、高剂量组hc),每个药物浓度设置2个复孔,每孔0.9ml,培养12h,空白组和模型组:加不含药液培养基 0.9ml,培养12h。12h后小心移除所有孔内培养基,给药组和模型组分别加入200μm顺铂(或4mm马兜铃酸),每孔1ml,继续培养12h;空白组加不含药液培养基1ml,培养 12h;所有组孵育结束后吸弃上清,使用不含edta的胰酶消化,2500rpm离心5min,收集细胞,加入1
×
pbs重悬细胞再次离心,再次加入1
×
pbs重悬细胞再次离心,使用100μl binding buffer缓冲液重悬细胞,加入5μlannexinv-fitc染色液和5μlpi染色液,室温避光放置15min,再次加入400μl binding buffer(冰上操作),染色结束后使用流式细胞仪检测。
[0060]
4.2实验结果
[0061]
图6、图7中,a表示空白组,b表示模型组,c表示nac组,d、e、f分别表示紫云英苷低中高剂量组。q2象限内细胞数量越多,损伤越严重。
[0062]
如图6所示,与空白组比较,模型组顺铂导致细胞内发生凋亡(p《0.05)。与模型组比较,紫云英苷预处理后的细胞凋亡现象减弱(p《0.05),并且发现中剂量的紫云英苷对顺
铂诱导凋亡的保护作用更加明显。
[0063]
如图7所示,与空白组比较,模型组马兜铃酸导致细胞内发生凋亡(p《0.05)。与模型组比较,紫云英苷预处理后的细胞凋亡现象减弱(p《0.05),并且随着紫云英苷剂量的增大,对马兜铃酸诱导凋亡的保护作用更加明显。
[0064]
综合以上实验,表明:紫云英苷可以抑制服用顺铂/马兜铃酸产生的肾损伤效果,紫云英苷具有良好的防治顺铂/马兜铃酸诱导急性肾损伤的作用,能为临床上运用紫云英苷防治顺铂/马兜铃酸诱导急性肾损伤提供较好的实验依据。
[0065]
实施例2
[0066]
1材料
[0067]
1.1动物
[0068]
成年健康小鼠48只,雄性,体重(22
±
2g),购自扬州大学比较医学中心,许可证号:syxk(苏)2017-7。
[0069]
1.2药品与试剂
[0070]
顺铂标准品购自上海阿拉丁股份有限公司,采用生理盐水配成合适的浓度,现用现配。
[0071]
紫云英苷标准品购自成都麦德生科技有限公司,采用生理盐水配成合适的浓度,现用现配。
[0072]
n-乙酰半胱氨酸标准品上海阿拉丁股份有限公司,使用时采用生理盐水配成合适的浓度,现用现配。
[0073]
2方法
[0074]
2.1动物分组与实验方案
[0075]
小鼠48只,适应性饲养1周后,随机分为6组,每组8只,分别为:正常对照组 (control)、模型组(model)、n-乙酰半胱氨酸组(nac)、紫云英苷低剂量组(lc)、紫云英苷中剂量组(mc)、紫云英苷高剂量组(hc)。正常对照组(control)每天给予腹腔注射生理盐水;模型组(model)在第七天腹腔注射顺铂注射液20mg/kg;n-乙酰半胱氨酸组 (nac)每天灌胃n-乙酰半胱氨酸100mg/kg,每天1次,连续灌胃10天,在第七天腹腔注射顺铂注射液20mg/kg;紫云英苷低、中、高剂量组每日分别灌胃紫云英苷20mg/kg、40 mg/kg,80mg/kg,每天1次,连续灌胃10天,在第七天腹腔注射顺铂注射液20mg/kg;每天对实验动物进行称重,以调整药物用量。
[0076]
2.2样本采集和数据统计
[0077]
最后一次给药后,禁食12h,摘眼球取血,离心收集血清后置-80℃冰箱冻存。摘取肾脏,部分-80℃保存,4%多聚甲醛固定常温保存。
[0078]
数据统计
[0079]
采用spss 20.0统计软件,实验中各计量参数均以均数
±
标准差形式表示,多组间数据使用单因素方差分析比较。
[0080]
2.3 elisa检测小鼠血清血清肌酐(cr)、尿素氮(bun)和白介素-1β(il-1β)
[0081]
根据试剂盒说明书操作,在酶标仪450nm处读取吸光值并计算标准曲线回归方程式,求得样品浓度。
[0082]
紫云英苷对急性肾损伤小鼠血清肌酐、尿素氮和白细胞介素-1β水平的影响分别
见图 8、图9、图10。与正常对照组比较,模型组小鼠血清肌酐、尿素氮和白细胞介素-1β含量显著升高(p《0.05);与模型组比较,紫云英苷不同剂量组及n-乙酰半胱氨酸组均可不同程度降低小鼠血清肌酐、尿素氮和白细胞介素-1β含量(p《0.05)。说明紫云英苷对顺铂诱导急性肾损伤产生的肌酐、尿素氮和白细胞介素-1β水平升高有一定的抑制作用。
[0083]
2.4he染色观察肾脏组织病理结构变化
[0084]
取肾组织4%多聚甲醛固定、乙醇梯度脱水、石蜡包埋、切片及苏木素-伊红染色,在光学显微镜下观察正常对照组、模型组及给药组之间肾脏病理学变化。
[0085]
紫云英苷对急性肾损伤小鼠肾脏病理学改变的影响如图11所示,正常对照组肾小管清晰可见上皮细胞刷状内缘,上皮细胞排列整齐,肾小球血管网结构清晰。模型组肾小管上皮细胞刷状内缘全部消失,上皮细胞肿胀坏死,空泡变性,近曲小管管腔扩张,不成形,肾小球血管网结构不清晰。紫云英苷组、n-乙酰半胱氨酸组肾脏组织形态较模型组均有一定改善。
[0086]
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,可以根据上述说明加以改进或变换,这些改进和变换应属于本发明所附权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1