多取代吲哚啉-2-硫酮类化合物在制备和治疗非酒精性脂肪肝和糖尿病的药物中的应用的制作方法
1.本发明属于生物医药领域,具体涉及多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐在预防、治疗非酒精性脂肪肝和/或2型糖尿病中的应用。
背景技术:
2.非酒精性脂肪肝目前是全球性慢性肝病,全球发病率高达25%,晚期患者心血管并发症和恶性肿瘤的死亡率增加,但目前临床唯一可靠治疗方式仍然是肝脏移植,由于供体紧缺且代价高昂,目前临床迫切需要药物治疗,但由于脂肪肝发病机制和病理分型复杂以及与全身代谢紧密关联性,目前非酒精性脂肪肝仍无临床靶向药物,全球仍在积极探索有效的临床靶向药物。目前全球仍无靶向脂肪肝的临床治疗药物,原因如下:1.研发药物的靶向性不足,药物具有副作用2.研发药物的用于临床有效性不足。
技术实现要素:
3.本发明首次提出了一种式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物(也可命名为多取代的吲哚啉-2-硫酮3,3-二甲酸酯类化合物及其衍生物)(polysubstituted 2-thioxoindoline-3,3-dicarboxylate acid esters and their derivatives)在制备预防和/或治疗非酒精性脂肪肝疾病、和/或治疗2型糖尿病疾病的药物中的应用。本发明提出的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物可以作为一种先导小分子开发治疗非酒精性脂肪肝的临床药。
4.本发明首先运用自动成像分析的高内涵筛选技术大量筛选药物,发现式(1)所示的小分子化合物可以减少肝脏中脂滴的累积,治疗非酒精性脂肪肝,在体外细胞实验和体内动物实验中使用药物后,通过检测甘油三脂含量和组织切片染色等技术发现非酒精性脂肪肝得到缓解,同时在机制上,通过qpcr和western blot等技术探索小分子发挥作用的机制,即依赖于抑制肝内典型脂合成通路。同时,本发明需要通过计算ic50和cck8等技术找到效力较高且毒性小,可作为有潜力的先导化合物,值得作为治疗非酒精性脂肪肝的先导化合物进行更深的研究。
5.本发明提出了式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐在制备预防和/或治疗非酒精性脂肪肝疾病、和/或治疗2型糖尿病疾病的药物中的应用。
6.其中,所述多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐的结构通式如下式(1)所示:
[0007][0008]
其中,
[0009]
x选自氢、烷基、酯基、酰基、卤素、烷氧基、磺酰胺基;
[0010]
r1选自烷基、苄基、有取代的烷基;
[0011]
r2、r3独自为烷基、苄基。
[0012]
进一步地,所述多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐包括如下式(1a)-(1z)之任一种或多种:
[0013]
[0014][0015]
进一步地,所述多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐包括式(1a)、式(1b)、式(1d)、式(1e)、式(1g)、式(1k)、式(1l)、式(1o)、式(1p)、式(1r)、式(1s)、式(1u)、式(1v)、式(1w)、式(1x)、式(1y)之任一种或多种:
[0016][0017]
进一步地,所述多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐选自式(1a)或式(1k):
[0018][0019]
本发明应用中,所述多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐抑制肝内典型脂合成通路;减少肝脏中脂滴累积,和/或,降低细胞内甘油三酯水平,减少肝脏脂质蓄积,缓解肝脏脂肪变性。
[0020]
本发明应用中,所述多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐增加胰岛素敏感性,改善胰岛素抵抗。
[0021]
本发明应用中,所述应用包括,在制备预测非酒精性脂肪肝耐药和/或复发率和/或生存期的诊断试剂,和/或制备非酒精性脂肪肝预后评价试剂,和/或制备用于非酒精性脂肪肝治疗或降低非酒精性脂肪肝耐药或延长生存期的药物中的应用。
[0022]
本发明应用中,所述应用还包括,在制备预测2型糖尿病耐药和/或复发率和/或生存期的诊断试剂,和/或制备2型糖尿病预后评价试剂,以及在制备用于2型糖尿病或降低2型糖尿病耐药或延长生存期的药物中的应用。
[0023]
本发明还提出了一种调节剂,其包括如上所述的式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐。
[0024]
本发明还提出了一种药物/药物组合物,其包括如上所述的式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐。
[0025]
本发明还提出了一种检测试剂/试剂盒,其包括如上所述的式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐。
[0026]
本发明还提出了所述的调节剂、药物/药物组合物、试剂/试剂盒在制备预测非酒精性脂肪肝耐药和/或复发率和/或生存期的诊断试剂,和/或制备非酒精性脂肪肝预后评价试剂,和/或制备用于非酒精性脂肪肝治疗或降低非酒精性脂肪肝耐药或延长生存期的药物中的应用。
[0027]
本发明还提出了所述的调节剂、药物/药物组合物、试剂/试剂盒在制备预测2型糖尿病耐药和/或复发率和/或生存期的诊断试剂,和/或制备2型糖尿病预后评价试剂,以及在制备用于2型糖尿病或降低2型糖尿病耐药或延长生存期的药物中的应用。
[0028]
本发明所描述的结构式(1)可与无机酸或有机酸反应制得“药学上可接受的盐”。所述无机酸包括盐酸、氢溴酸、硫酸、硝酸、胺基磺酸和磷酸等,所述有机酸包括柠檬酸、酒石酸、乳酸、丙酮酸、乙酸、苯磺酸、对甲苯磺酸、甲磺酸、萘磺酸、乙磺酸、萘二磺酸、马来酸、苹果酸、丙二酸、富马酸、琥珀酸、丙酸、草酸、三氟乙酸、硬酯酸、扑酸、羟基马来酸、苯乙酸、苯甲酸、水杨酸、谷氨酸、抗坏血酸、对胺基苯磺酸、2-乙酰氧基苯甲酸和羟乙磺酸等。
[0029]
本发明提到的衍生物、水合物及其药学上可接受的盐均与式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物的应用效果相当,均可以预防和/或治疗非酒精性脂肪肝疾病、和/或治疗2型糖尿病疾病。
[0030]
本发明还提出了一种对有需要的受试者预防和/或治疗非酒精性脂肪肝的方法,或对患有非酒精性脂肪肝的患者严重程度进行评估的方法,或预测非酒精性脂肪肝复发时间的方法,或对所述患者是否适用式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐的治疗进行预测或预后评估的方法,所述方法包括:确定从所述患者或受试者血液、肝脏组织样品的式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐水平,其中通过所述水平,对所述受试者非酒精性脂肪肝进行预防或治疗,或对患有非酒精性脂肪肝的患者的严重程度进行评估,或预测患者是否发生非酒精性脂肪肝,或对所述患者是否适用靶向式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐的治疗进行预测或预后评估。
[0031]
本发明还提出了一种对有需要的受试者预防和/或治疗2型糖尿病的方法,或对患有2型糖尿病的患者严重程度进行评估的方法,或预测2型糖尿病复发时间的方法,或对所述患者是否适用式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐的治疗进行预测或预后评估的方法,所述方法包括:确定从所述患者或受试者血液样品的式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐水平,其中通过所述水平,对所述受试者2型糖尿病进行预防或治疗,或对患有2型糖尿病的患者的严重程度进行评估,或预测患者是否发生2型糖尿病,或对所述患者是否适用靶向式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐的治疗进行预测或预后评估。
[0032]
其中,所述式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐包括式(1a)所示的toidc:
[0033][0034]
本发明还提出了一种药物筛选方法,在体外诱导肝细胞脂滴蓄积后,用不同药物处理细胞并用尼罗红染色,用高内涵技术同时自动成像分析荧光参数评估药物减少脂滴的效果。
[0035]
本发明的有益效果包括:本发明通过计算ic50和cck8等技术找到效力较高且毒性小的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物、水合物及其药学上可接受的盐,值得作为治疗非酒精性脂肪肝和/或2型糖尿病的先导化合物进行更深的研究。
附图说明
[0036]
图1为高内涵技术筛选药物流程图。
[0037]
图2为小分子化合物toidc在高内涵实验中的筛选结果,发现与对照相比,toidc可以减弱荧光强度,反映toidc可以使肝原代细胞内脂滴减少。
[0038]
图3为小分子化合物toidc在尼罗红染色实验中的结果,发现toidc浓度梯度依赖式减弱肝原代细胞荧光强度,表明随着药物浓度增加细胞中脂滴含量减少更多。
[0039]
图4为小分子化合物toidc在尼罗红染色实验中浓度梯度依赖式减少肝原代细胞荧光强度(图4a),利用image j软件计算后发现toidc抑制细胞脂滴蓄积的半数抑制率为14.17μm(图4b)。
[0040]
图5为小分子化合物toidc在甘油三酯定量实验中浓度梯度依赖式减少肝原代细胞内甘油三酯含量。
[0041]
图6为小分子化合物toidc在尼罗红染色实验中减少hepg2细胞系内荧光强度,左图为只加dmso,中间为加dmso和oa/pa,最右为加入toidc和oa/pa(图6a),利用image j软件计算后发现toidc抑制细胞脂滴蓄积有明显作用(图6b)。
[0042]
图7为小分子化合物toidc在甘油三酯定量实验中减少hepg2细胞系内甘油三酯含
量,左柱为只加dmso,中间为加dmso和oa/pa,最右柱为加入toidc和oa/pa。
[0043]
图8为在qpcr肝原代细胞实验中,验证小分子化合物toidc减少srebp1的基因转录并减少下游脂合成关键酶转录水平,其中每一组的柱状图中,左边为dmso,中间为oa/pa+dmso,右边为oa/pa+toidc。
[0044]
图9为在wb肝原代细胞实验中,验证小分子化合物toidc减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝,其中图9a为wb条带显影蛋白浓度;图9b为通过image j分析wb条带灰度值定量结果,其中每一组的柱状图中,左边为dmso,中间为oa/pa+dmso,右边为oa/pa+toidc。
[0045]
图10为在qpcr肝原代细胞实验中,给予toidc后srebp1及下游脂合成通路基因水平下降,在增加srebp1激活的化合物t0901317后,srebp1及下游之合成通路基因水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝,其中每一组的柱状图中,从左至右依次为dmso、oa/pa+dmso、oa/pa+toidc、oa/pa+toidc+t0901317。
[0046]
图11为在wb肝原代细胞实验中,给予toidc后srebp1及下游脂合成通路蛋白fasn水平下降,在增加srebp1激活的药物后,srebp1及下游之合成通路蛋白fasn水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝,其中图11a为wb条带显影蛋白浓度;图11b为通过image j分析wb条带灰度值定量结果,其中每一组的柱状图中,从左至右依次为dmso、oa/pa+dmso、oa/pa+toidc、oa/pa+toidc+t0901317。
[0047]
图12为在肝原代细胞尼罗红染色实验中,给予toidc后尼罗红荧光减弱,在加入激活srebp1转录化合物t0901317后尼罗红荧光增强,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝。
[0048]
图13在qpcr hepg2细胞实验中,验证小分子化合物toidc减少srebp1的基因转录并减少下游脂合成关键酶转录水平,其中每一组的柱状图中,左边为dmso,中间为oa/pa+dmso,右边为oa/pa+toidc。
[0049]
图14为在qpcr hepg2细胞实验中,给予toidc后srebp1及下游脂合成通路基因水平下降,在增加srebp1激活的化合物t0901317后,srebp1及下游之合成通路基因水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的表达水平而抑制肝脏内脂质合成通路缓解脂肪肝,其中每一组的柱状图中,从左至右依次为dmso、oa/pa+dmso、oa/pa+toidc、oa/pa+toidc+t0901317。
[0050]
图15为在wb hepg2细胞实验中,验证小分子化合物toidc减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝,图15a为wb条带显影蛋白浓度;图15b为通过image j分析wb条带灰度值定量结果,其中每一组的柱状图中,从左至右依次为dmso、oa/pa+dmso、oa/pa+toidc。
[0051]
图16为在wb hepg2细胞实验中,给予toidc后srebp1及下游脂合成通路蛋白fasn水平下降,在增加srebp1激活的药物后,srebp1及下游之合成通路蛋白fasn水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝,其中图16a为wb条带显影蛋白浓度;图16b为通过image j分析wb条带灰度值定量结果,其中每一组的柱状图中,从左至右依次为dmso、oa/pa+dmso、oa/pa+toidc、
oa/pa+toidc+t0901317。
[0052]
图17为在动物实验中,实验三周后,对照组(腹腔注射同浓度dmso)小鼠肝脏平均重量1.78g(图17a左图),给药组(腹腔注射同浓度toidc)小鼠肝脏平均重量1.43g(图17a右图),图17b为对应的柱状图,说明小分子化合物toidc减少高脂喂养小鼠的肝重,反映toidc在体内可以改善脂肪肝。
[0053]
图18为在动物实验中,实验三周后,对照组小鼠肝脏脂质含量平均为506.9umol/g,给药组小鼠肝脏脂质含量平均为354.1umol/g,说明小分子化合物toidc减少高脂喂养小鼠肝中的脂质含量,反映toidc在体内可以改善脂肪肝。
[0054]
图19为组织切片尼罗红染色和h&e染色,与对照组比较,给药组小鼠脂滴荧光参数减少,组织切片脂肪空泡减少,验证小分子化合物toidc可以改善高脂喂养小鼠肝组织的脂肪变性以及减少肝脏脂质蓄积情况,反映toidc在体内可以改善脂肪肝。
[0055]
图20为动物实验中,检测实验三周内两组小鼠的体重,发现给药组小鼠平均体重36.0g明显低于对照组小鼠平均体重40.2g,反映toidc可以减少dio小鼠(c57b6小鼠)体重。
[0056]
图21为动物实验中,实验三周后处死小鼠,大体可见,给药组小鼠体型明显小于对照组小鼠(图21a),取脂肪组织可见,给药组小鼠脂肪组织体积明(图21b右侧)显小于对照组小鼠(图21b左侧),反映toidc可以减少dio小鼠(c57b6小鼠)体重。
[0057]
图22为在动物组织的qpcr实验中,验证小分子化合物toidc减少srebp1的基因转录并减少下游脂合成关键酶转录水平,其中每一组的柱状图中,左边为vehicle,右边为toidc。
[0058]
图23为在动物组织的wb实验中,验证小分子化合物toidc减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝。
[0059]
图24为分别在肝原代细胞(图24a)和hepg2(图24b)测试毒性实验中,用不同浓度的toidc处理肝原代细胞,发现在浓度在60μm前细胞活性无差异,说明小分子toidc在工作浓度时不影响细胞活力。
[0060]
图25为在动物实验中,腹腔注射toidc三周后的高脂小鼠与注射溶剂dmso三周后的高脂小鼠,血清alt转氨酶平均水平分别为172.3u/l和179.1u/l,血清转氨酶ast平均水平分别为33.8u/l和32.7u/l,说明腹腔注射toidc对小鼠没有肝脏损伤毒性。
[0061]
图26为在胰岛素耐量实验,在注射胰岛素后2h后,实验组的小鼠血糖恢复比对照组要慢,反映toidc可以提高高脂小鼠对胰岛素的敏感性,小分子化合物toidc可以改善高脂小鼠胰岛素抵抗,其中图26a为胰岛素耐量实验曲线;图26b为葡萄糖。
[0062]
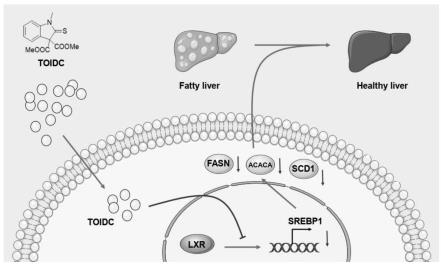
图27为小分子化合物toidc缓解脂肪肝的整体机制图,小分子化合物toidc进入肝脏细胞后通过抑制srebp1的转录从而减少srebp1及下游脂质合成关键酶如fasn的蛋白水平,从而抑制肝脏脂质合成通路缓解脂肪肝。
具体实施方式
[0063]
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,
本发明没有特别限制内容。
[0064]
实施例1化合物1a-1z的制备
[0065][0066]
化合物1a-1z的合成过程为:将如上式1-0所示的n-芳基-n-烷基硫代酰胺(0.2mmol),溴化钴(0.02mmol),dbu(0.4mmol)和na2s2o8(0.4mmol)加入到烧瓶中,再加入无水乙腈ch3cn(4ml),得到的混合物在50℃下(油浴温度)搅拌1-2小时,直到原料式1-0所示n-芳基-n-烷基硫代酰胺用tlc检测反应完全。然后将反应混合物过滤除去固体,滤液在减压下浓缩,残余物采用石油醚/乙酸乙酯的混合溶剂进行柱色谱分离,得到如上式1所示的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物。
[1]
[0067]
[1]zhi yao,zhongliang cai,long zhen,liqin jiang.*org.lett.2020,22,4505-4510.
[0068][0069]
1-甲基-3,3-二甲酸二甲酯基-吲哚啉-2-硫酮(1a):mp:139-140℃.1h nmr(500mhz,cdcl3)δ7.53(d,j=7.4hz,1h),7.44(td,j=7.8,1.0hz,1h),7.22(t,j=7.6hz,1h),7.00(d,j=7.9hz,1h),3.79(s,6h),3.63(s,3h).
13
c nmr(125mhz,cdcl3)δ193.7,165.2,145.9,130.2,128.0,125.7,124.8,109.8,75.1,53.9,31.8.hrms(ei-tof)m/z:[m]+ calculated for c13h13no4s 279.0565,found 279.0567.
[0070][0071]
1-甲基-3,3-二甲酸二甲酯基-5-甲氧基-吲哚啉-2-硫酮(1b):mp:135-136℃.1h nmr(600mhz,cdcl3)δ7.34(s,1h),7.23(d,j=8.0hz,1h),6.90(d,j=8.1hz,1h),3.79(s,6h),3.61(s,3h),2.38(s,3h).
13
c nmr(150mhz,cdcl3)δ193.2,165.4,143.6,134.9,130.7,128.0,126.3,109.6,75.1,53.9,31.9,21.2.hrms(ei-tof)m/z:[m]+ calculated for c14h15no5s 309.0671,found 309.0674.
[0072]
[0073]
1,5-二甲基-3,3-二甲酸二甲酯基-吲哚啉-2-硫酮(1c):mp:134-135℃.1h nmr(600mhz,cdcl3)δ7.34(s,1h),7.23(d,j=8.0hz,1h),6.90(d,j=8.1hz,1h),3.79(s,6h),3.61(s,3h),2.38(s,3h).
13
c nmr(150mhz,cdcl3)δ193.2,165.4,143.6,134.9,130.7,128.0,126.3,109.6,75.1,53.9,31.9,21.2.hrms(ei-tof)m/z:[m]+ calculated for c14h15no4s 293.0722,found 293.0720.
[0074][0075]
1-甲基-3,3-二甲酸二甲酯基-5-(n-甲基-对甲苯磺酰胺基)-吲哚啉-2-硫酮(1d):1h nmr(600mhz,cdcl3)δ7.33(d,j=7.8hz,2h),7.21(d,j=9.8hz,1h),7.18(d,j=7.8hz,2h),7.09(s,1h),6.87(d,j=8.4hz,1h),3.70(s,6h),3.54(s,3h),3.08(s,3h),2.35(s,3h).
13
c nmr(150mhz,cdcl3)δ193.7,164.8,144.8,143.8,138.5,133.0,129.6,129.5,128.1,127.9,123.7,109.7,74.9,54.0,38.2,31.9,21.6.hrms(ei-tof)m/z:[m]+ calculated for c21h22n2o6s2 462.0919,found 462.0915.
[0076][0077]
1-甲基-3,3-二甲酸二甲酯基-5-氟-吲哚啉-2-硫酮(1e):1h nmr(600mhz,cdcl3)δ7.29(dd,j=7.6,2.6hz,1h),7.16(td,j=8.7,2.6hz,1h),6.95(dd,j=8.7,4.0hz,1h),3.81(s,6h),3.62(s,3h).
13
c nmr(151mhz,cdcl3)δ193.11,164.75,161.20,159.58,142.00,129.23(d,j=9.2hz),116.93(d,j=24.0hz),114.01(d,j=26.0hz),110.39(d,j=8.6hz),75.02,54.08,31.96.hrms(ei)m/z calculated for c
13h12
fno4s[m]
+
297.0471,found 297.0469.
[0078][0079]
1-甲基-3,3-二甲酸二甲酯基-5-氯-吲哚啉-2-硫酮(1f):1h nmr(600mhz,cdcl3)δ7.51(d,j=1.8hz,1h),7.41(dd,j=8.4,1.9hz,1h),6.93(d,j=8.4hz,1h),3.82(s,6h),3.61(s,3h).
13
c nmr(151mhz,cdcl3)δ193.22,164.71,144.47,130.50,130.33,129.16,126.20,110.58,74.89,54.12,31.89.
[0080]
[0081]
1-甲基-3,3-二甲酸二甲酯基-5-溴-吲哚啉-2-硫酮(1g):1h nmr(600mhz,cdcl3)δ7.65(d,j=1.8hz,1h),7.56(dd,j=8.4,1.9hz,1h),6.88(d,j=8.4hz,1h),3.81(s,6h),3.60(s,3h).
13
c nmr(151mhz,cdcl3)δ193.16,164.71,144.95,133.22,129.45,128.91,117.85,111.02,74.86,54.13,31.86.hrms(ei)m/z calculated for c
13h12
brno4s[m]
+ 356.9670,found 356.9668.
[0082][0083]
1-甲基-3,3-二甲酸二甲酯基-5-碘-吲哚啉-2-硫酮(1h):1h nmr(600mhz,cdcl3)δ7.74(d,j=1.4hz,1h),7.68(dd,j=8.3,1.5hz,1h),6.69(d,j=8.3hz,1h),3.74(s,6h),3.52(s,3h).
13
c nmr(151mhz,cdcl3)δ193.15,164.72,145.65,139.12,134.41,129.73,111.44,87.87,74.79,54.06,31.74.hrms(ei)m/z calculated for c
13h12
ino4s[m]
+ 404.9532,found 404.9534.
[0084][0085]
1-甲基-3,3-二甲酸二甲酯基-5-甲酸乙酯基-吲哚啉-2-硫酮(1i):1h nmr(600mhz,cdcl3)δ8.10(dd,j=6.0,1.6hz,2h),6.97(d,j=8.8hz,1h),4.31(q,j=7.1hz,2h),3.74(s,6h),3.58(s,3h),1.33(t,j=7.1hz,3h).
13
c nmr(151mhz,cdcl3)δ194.75,165.74,164.80,149.31,132.59,127.83,127.06,126.83,109.39,74.80,61.33,54.09,31.94,14.39.
[0086]
hrms(ei)m/z calculated for c
16h17
no6s[m]
+ 351.0777,found 351.0779.
[0087][0088]
1-甲基-3,3-二甲酸二甲酯基-5-乙酰基-吲哚啉-2-硫酮(1j):1h nmr(600mhz,cdcl3)δ8.04(s,1h),8.02(d,j=8.4hz,1h),7.00(d,j=8.3hz,1h),3.74(s,6h),3.58(s,3h),2.54(s,3h).
13
c nmr(151mhz,cdcl3)δ196.38,194.85,164.77,149.44,133.82,131.60,128.10,125.71,109.49,74.80,54.13,31.95,26.66.hrms(ei)m/z calculated for c
15h15
no5s[m]
+ 321.0671,found 321.0675.
[0089]
[0090]
1-甲基-3,3-二甲酸二甲酯基-7-甲氧基-吲哚啉-2-硫酮(1k):1h nmr(600mhz,cdcl3)δ7.11
–
7.04(m,2h),6.91(d,j=8.0hz,1h),3.87(s,3h),3.84(s,3h),3.71(s,6h).
13
c nmr(151mhz,cdcl3)δ193.18,165.37,145.02,133.86,129.55,125.68,117.97,113.72,75.31,56.08,53.87,35.73.hrms(ei)m/z calculated for c
14h15
no5s[m]
+ 309.0671,found 309.0668.
[0091][0092]
1-7二甲基-3,3-二甲酸二甲酯基-吲哚啉-2-硫酮(1l):1h nmr(600mhz,cdcl3)δ7.29(d,j=7.4hz,1h),7.09(d,j=7.6hz,1h),7.02(t,j=7.5hz,1h),3.88(s,3h),3.71(s,6h),2.58(s,3h).
13
c nmr(151mhz,cdcl3)δ194.46,165.51,143.91,134.26,128.47,124.73,123.59,120.97,74.91,53.86,35.65,19.80.hrms(ei)m/z calculated for c
14h15
no4s[m]
+ 293.0722,found 293.0723.
[0093][0094]
1-甲基-3,3-二甲酸二甲酯基-6-甲氧基-吲哚啉-2-硫酮(1m):1h nmr(600mhz,cdcl3)δ7.34(d,j=8.3hz,1h),6.64(d,j=8.3hz,1h),6.48(s,1h),3.79(s,3h),3.72(s,6h),3.53(s,3h).
13
c nmr(151mhz,cdcl3)δ194.66,165.54,161.70,147.15,126.26,119.71,109.02,97.39,74.52,55.80,53.84,31.83.hrms(ei)m/z calculated for c
14h15
no5s[m]
+ 309.0671,found 309.0674.
[0095][0096]
1-甲基-3,3-二甲酸二甲酯基6-氯-吲哚啉-2-硫酮(1n):1h nmr(500mhz,cdcl3)δ7.37(d,j=8.1hz,1h),7.12(dd,j=8.1,1.7hz,1h),6.93(d,j=1.7hz,1h),3.73(s,6h),3.53(s,3h).
13
c nmr(126mhz,cdcl3)δ194.13,164.85,146.93,136.32,126.54,126.10,124.62,110.47,74.67,54.06,31.85.hrms(ei)m/z calculated for c
13h12
clno4s[m]
+ 313.0176,found 313.0181.
[0097]
[0098]
1-甲基-3,3-二甲酸二甲酯基-4,6-二甲氧基-吲哚啉-2-硫酮(1n):1h nmr(500mhz,cdcl3)δ6.21(d,j=1.8hz,1h),6.15(d,j=1.9hz,1h),3.79(s,3h),3.75(s,3h),3.66(s,6h),3.50(s,3h).
13
c nmr(126mhz,cdcl3)δ195.57,164.56,163.06,156.64,148.18,107.82,94.45,89.63,73.44,55.92,55.82,53.48,32.07.hrms(ei)m/z calculated for c
15h17
no6s[m]
+ 339.0777,found 339.0780.
[0099][0100]
1-甲基-3,3-二甲酸二乙酯基-吲哚啉-2-硫酮(1p):1h nmr(600mhz,cdcl3)δ7.47(d,j=7.5hz,1h),7.35(t,j=7.8hz,1h),7.14(t,j=7.6hz,1h),6.93(d,j=7.9hz,1h),4.19(q,j=7.1hz,4h),3.54(s,3h),1.19(t,j=7.1hz,6h).
13
c nmr(151mhz,cdcl3)δ193.84,164.75,145.86,130.10,128.15,125.69,124.65,109.81,75.22,62.91,31.76,13.89.hrms(ei)m/z calculated for c
15h17
no4s[m]
+ 307.0878,found 307.0875.
[0101][0102]
1-甲基-3,3-二甲酸二异丙酯基-吲哚啉-2-硫酮(1q):1h nmr(600mhz,cdcl3)δ7.55(d,j=7.5hz,1h),7.42(t,j=7.8hz,1h),7.21(t,j=7.6hz,1h),6.99(d,j=7.9hz,1h),5.16
–
5.08(m,2h),3.61(s,3h),1.28(dd,j=14.0,6.3hz,12h).
13
c nmr(151mhz,cdcl3)δ193.94,164.22,145.86,129.97,128.32,125.71,124.49,109.74,75.22,70.65,31.70,21.42,21.40.hrms(ei)m/z calculated for c
17h21
no4s[m]
+ 335.1191,found 335.1189.
[0103][0104]
1-甲基-3,3-二甲酸二苄酯基-吲哚啉-2-硫酮(1r):1h nmr(600mhz,cdcl3)δ7.35(d,j=7.5hz,1h),7.31(t,j=7.8hz,1h),7.23
–
7.19(m,6h),7.18
–
7.14(m,4h),7.06(t,j=7.6hz,1h),6.87(d,j=7.9hz,1h),5.15
–
5.09(m,4h),3.50(s,3h).
13
c nmr(151mhz,cdcl3)δ193.30,164.50,145.94,134.91,130.26,128.51,128.34,128.00,127.75,125.78,124.66,109.88,75.20,68.42,31.79.hrms(ei)m/z calculated for c
25h21
no4s[m]
+ 431.1191,found 431.1193.
[0105][0106]
1-异丙基-3,3-二甲酸二甲酯基-吲哚啉-2-硫酮(1s):1h nmr(600mhz,cdcl3)δ7.45(d,j=7.5hz,1h),7.32(t,j=7.8hz,1h),7.21(d,j=8.0hz,1h),7.12(t,j=7.5hz,1h),5.63(s,1h),3.71(s,6h),1.48(d,j=7.1hz,6h).
13
c nmr(151mhz,cdcl3)δ193.41,165.38,143.96,129.80,128.46,125.77,124.29,111.75,75.25,53.85,48.78,18.51.
[0107][0108]
1-正丁基-3,3-二甲酸二甲酯基-吲哚啉-2-硫酮(1t):1h nmr(600mhz,cdcl3)δ7.45(d,j=7.5hz,1h),7.35(t,j=7.7hz,1h),7.13(t,j=7.5hz,1h),6.93(d,j=7.9hz,1h),4.10(t,j=7.5hz,2h),3.71(s,6h),1.74
–
1.66(m,2h),1.33(dd,j=13.7,6.6hz,2h),1.30
–
1.20(m,4h),0.81(t,j=6.3hz,3h).
13
c nmr(151mhz,cdcl3)δ193.24,165.30,145.39,130.17,128.18,125.66,124.60,110.03,75.23,53.84,44.91,31.45,26.49,26.00,22.54,14.00.hrms(ei)m/z calculated for c
18h23
no4s[m]
+ 349.1348,found 349.1351.
[0109][0110]
1-(3-甲氧丙)基-3,3-二甲酸二甲酯基-吲哚啉-2-硫酮(1u):1h nmr(500mhz,cdcl3)δ7.45(dd,j=7.5,0.5hz,1h),7.36(td,j=7.9,1.1hz,1h),7.13(td,j=7.6,0.7hz,1h),7.04(d,j=8.0hz,1h),4.21(t,j=7.0hz,2h),3.72(s,6h),3.32(t,j=5.8hz,2h),3.25(s,3h),2.04
–
1.97(m,2h).
13
c nmr(126mhz,cdcl3)δ193.36,165.29,145.66,130.23,128.00,125.59,124.65,110.18,75.20,69.19,58.61,53.88,42.04,26.27.hrms(ei)m/z calculated for c
16h19
no5s[m]
+ 337.0984,found 337.0981.
[0111][0112]
1-苄基-3,3-二甲酸二甲酯基-吲哚啉-2-硫酮(1v):1h nmr(600mhz,cdcl3)δ7.53
(d,j=7.5hz,1h),7.33
–
7.24(m,6h),7.17(t,j=7.6hz,1h),6.84(d,j=8.0hz,1h),5.46(s,2h),3.81(s,6h).
13
c nmr(151mhz,cdcl3)δ194.60,165.27,145.15,133.97,130.22,128.95,127.97,127.88,126.91,125.53,124.81,110.79,75.34,53.94,48.15.hrms(ei)m/z calculated for c
19h17
no4s[m]
+ 355.0878,found 355.0876.
[0113][0114]
1-苄基-3,3-二甲酸二甲酯基-5-甲氧基-吲哚啉-2-硫酮(1w):1h nmr(600mhz,cdcl3)δ7.25
–
7.16(m,5h),7.04(d,j=2.5hz,1h),6.73(dd,j=8.7,2.5hz,1h),6.65(d,j=8.7hz,1h),5.35(s,2h),3.74(s,6h),3.69(s,3h).
13
c nmr(151mhz,cdcl3)δ193.41,165.25,157.60,138.65,134.00,129.22,128.93,127.87,126.92,115.08,112.16,111.25,75.37,55.88,53.95,48.27.
[0115][0116]
1-苄基-3,3-二甲酸二甲酯基-5-氯-吲哚啉-2-硫酮(1x):1h nmr(600mhz,cdcl3)δ7.44(d,j=2.0hz,1h),7.23(t,j=7.2hz,2h),7.21
–
7.16(m,4h),6.67(d,j=8.5hz,1h),5.35(s,2h),3.76(s,6h).
13
c nmr(151mhz,cdcl3)δ194.12,164.74,143.72,133.59,130.54,130.29,129.22,129.03,128.04,126.85,126.05,111.50,75.10,54.16,48.20.hrms(ei)m/z calculated for c
13h12
clno4s[m]
+ 313.0176,found 313.0172.
[0117][0118]
1-苄基-3,3-二甲酸二甲酯基-5-溴-吲哚啉-2-硫酮(1y):1h nmr(500mhz,cdcl3)δ7.57(d,j=1.9hz,1h),7.33(dd,j=8.4,1.9hz,1h),7.25
–
7.15(m,5h),6.62(d,j=8.5hz,1h),5.34(s,2h),3.76(s,6h).
13
c nmr(126mhz,cdcl3)δ194.03,164.73,144.18,133.55,133.16,129.50,129.03,128.76,128.03,126.83,117.91,111.93,75.05,54.17,48.15.hrms(ei)m/z calculated for c
19h16
brno4s[m]
+
432.9983,found 432.9980.
[0119][0120]
1-苄基-3,3-二甲酸二甲酯基-5-甲酸乙酯基-吲哚啉-2-硫酮(1z):1h nmr
(600mhz,cdcl3)δ8.11(s,1h),7.96(d,j=8.3hz,1h),7.26
–
7.22(m,2h),7.21
–
7.17(m,3h),6.80(d,j=8.4hz,1h),5.40(s,2h),4.28(q,j=7.1hz,2h),3.77(s,6h),1.30(t,j=7.1hz,3h).
13
c nmr(151mhz,cdcl3)δ195.57,165.70,164.83,148.61,133.58,132.50,129.03,128.04,127.88,127.10,126.82,126.71,110.27,75.01,61.30,54.12,48.19,14.37.hrms(ei)m/z calculated for c
22h21
no6s[m]
+ 427.1090,found 427.1094.
[0121]
实施例2化合物的筛选
[0122]
本发明首先取6-8周龄c57b6小鼠的肝原代细胞,合适密度铺板后用0.3μm的棕榈酸和油酸混合物诱导刺激细胞内出现脂滴聚集。当脂滴聚集后,给细胞分别加上小分子化合物混合的新鲜培养基,培养36小时之后,撤掉培养基。用pbs润洗细胞,固定液固定之后用尼罗红溶液孵育细胞15分钟,接着撤掉尼罗红溶液并用pbs润洗3遍后用dapi溶液孵育5分钟,再撤去溶液,用pbs润洗三遍,细胞表面留有部分pbs覆盖细胞。将细胞孔板放置于高内涵仪器中,调整好合适参数,等待仪器自动对孔连续成像拍照。图2中,高内涵仪器拍照结束后,设置参数,仪器自动分析荧光参数后,筛选出了与对照组相比尼罗红荧光减弱效果较好的如前述式(1)所示的多取代的3,3-二甲酸酯基-吲哚啉-2-硫酮类化合物及其衍生物(如下表1所示),其中,适合于本发明的小分子化合物包括但不限于式(1a)所示的toidc和式(4k)所示的化合物。
[0123]
表1
[0124]
[0125]
[0126]
[0127]
[0128]
[0129][0130]
实施例3体外细胞实验
[0131]
本发明在体外细胞实验中,用混合的棕榈酸和油酸混合物刺激肝细胞蓄积脂滴,接着用本发明实施例2筛选的小分子药物toidc梯度浓度增加处理细胞后运用尼罗红染色发现细胞内蓄积脂滴梯度式减少,见图3。根据图2使用image j软件计算不同浓度toidc处理细胞后尼罗红染色荧光参数,计算发现toidc减少脂滴蓄积的半数抑制率(ic50)为14.17μm,见图4b。本发明同时用甘油三酯检测试剂盒也发现被toidc处理过后的肝原代细胞内蓄积的甘油三酯水平随着浓度增加减少得越多,见图5。
[0132]
接着本发明在体外实验中用另外的细胞系hepg2细胞系重复实验,发现小分子化合物toidc同样在尼罗红染色实验中减少hepg2细胞系内荧光强度,左图为只加dmso,中间为加dmso和oa/pa,最右为加入toidc和oa/pa,并利用image j软件计算后发现toidc抑制细胞脂滴蓄积有明显作用(见图6),同时小分子化合物toidc在甘油三酯定量实验中也显著减少hepg2细胞系内甘油三酯含量,左柱为只加dmso,中间为加dmso和oa/pa,最右柱为加入toidc和oa/pa(见图7)。
[0133]
本发明在qpcr肝原代细胞实验中,验证小分子化合物toidc减少srebp1的基因转录并减少下游脂合成关键酶转录水平,其中每一组的柱状图中,左边为dmso,中间为oa/pa+dmso,右边为oa/pa+toidc(见图8)。
[0134]
本发明在wb肝原代细胞实验中,验证小分子化合物toidc减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝(见图9)。
[0135]
本发明在qpcr肝原代细胞实验中,给予toidc后srebp1及下游脂合成通路基因水平下降,在增加srebp1激活的化合物t0901317后,srebp1及下游之合成通路基因水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝(见图10)。
[0136]
本发明在wb肝原代细胞实验中,给予toidc后srebp1及下游脂合成通路蛋白fasn水平下降,在增加srebp1激活的药物后,srebp1及下游之合成通路蛋白fasn水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝(见图11)。
[0137]
本发明在肝原代细胞尼罗红染色实验中,给予toidc后尼罗红荧光减弱,在加入激活srebp1转录化合物t0901317后尼罗红荧光增强,证明小分子化合物toidc通过减少
srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝(见图12)。
[0138]
同样地,在另外一个细胞系qpcr hepg2细胞实验中,验证小分子化合物toidc减少srebp1的基因转录并减少下游脂合成关键酶转录水平,其中每一组的柱状图中,左边为dmso,中间为oa/pa+dmso,右边为oa/pa+toidc(见图13)。在wb hepg2细胞实验中,验证小分子化合物toidc减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝(见图14)。在qpcr hepg2细胞实验中,给予toidc后srebp1及下游脂合成通路基因水平下降,在增加srebp1激活的化合物t0901317后,srebp1及下游之合成通路基因水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝(见图15)。在wb hepg2细胞实验中,给予toidc后srebp1及下游脂合成通路蛋白fasn水平下降,在增加srebp1激活的药物后,srebp1及下游之合成通路蛋白fasn水平恢复,证明小分子化合物toidc通过减少srebp1及下游脂合成关键酶的蛋白水平而抑制肝脏内脂质合成通路缓解脂肪肝(见图16)。
[0139]
以上实验数据说明,本发明实施例2筛选的小分子药物toidc可以减少肝脏中脂滴蓄积,减少肝脏内甘油三酯的含量,治疗非酒精性脂肪肝。本发明通过体外细胞实验进一步说明了本发明实施例2筛选的小分子化合物具备治疗非酒精性脂肪肝的潜力。
[0140]
实施例4体内动物实验
[0141]
本发明在体内动物实验中,在确定喂养16w高脂的肥胖小鼠有脂肪肝后,将其随机分成两组,一组小鼠每天腹腔注射10mg/kg的本发明实施例2筛选的小分子toidc溶液(给药组),另一组每天腹腔注射相同浓度的dmso溶剂(对照组),进行实验3周后处死小鼠。大体解剖图可见,给药组小鼠肝脏鲜红(如图17a右侧所示),对照组小鼠肝脏偏白较大(如图17a左侧所示)。结果表明,给药组可以减轻脂肪肝(如图17所示)。接着本发明通过tg试剂盒测试肝脏内脂质蓄积,发现给药组肝脏内甘油三酯水平下降(如图18所示)。同时对组织切片进行染色后发现,给药组小鼠脂肪肝得到明显缓解(如图19所示)。同时检测实验三周内两组小鼠的体重,发现给药组小鼠平均体重36.0g明显低于对照组小鼠平均体重40.2g(如图20所示)。同时实验三周后处死小鼠,大体可见,给药组小鼠体型明显小于对照组小鼠(如图21a所示),取脂肪组织可见,给药组小鼠脂肪组织体积(图21b右侧)明显小于对照组小鼠(如图21b左侧所示)。
[0142]
本发明将组织裂解后取上清做qpcr和wb实验同样发现,toidc抑制肝脏内脂合成通路(如图22,图23所示)。
[0143]
接着,本发明在细胞毒性实验中,用不同浓度的toidc处理肝原代细胞,发现浓度小于60μm时细胞活性无差异,说明小分子toidc在工作浓度时不影响细胞活力(如图24所示)。
[0144]
本发明在动物实验中,腹腔注射toidc三周后的高脂小鼠与注射溶剂dmso三周后的高脂小鼠,血清alt转氨酶平均水平分别为172.3u/l和179.1u/l,血清转氨酶ast平均水平分别为33.8u/l和32.7u/l,这说明腹腔注射toidc对小鼠没有肝脏损伤毒性(如图25所示)。
[0145]
以上实验数据说明,本发明实施例2筛选的小分子药物toidc可以抑制肝脏内脂合成通路,降低肝脏内甘油三酯水平减轻并缓解脂肪肝并且小分子药物toidc无毒性。
[0146]
实施例5胰岛素耐量实验
[0147]
分别取5只给药组小鼠(每天腹腔注射本发明实施例2筛选的小分子toidc10mg/kg)和5只对照组小鼠(每天腹腔注射同等量的dmso溶剂),在3周后,首先空腹饥饿两组小鼠4小时,4小时后取两组小鼠尾静脉血用血糖试纸测试小鼠饥饿后血糖,接着用胰岛素1.75iu/kg剂量腹腔注射两组小鼠,分别在注射胰岛素后15分钟,30分钟,1小时,1.5小时,2小时取两组小鼠尾静脉血用血糖试纸及血糖仪测试血糖。最后发现在注射胰岛素后15分钟,1小时,1.5小时两组血糖没有显著差异。但在注射胰岛素2小时后,toidc组小鼠(给药组小鼠)平均血糖为4.80mm,对照组小鼠平均血糖为7.32mm,两组小鼠血糖有明显差异,说明在腹腔注射胰岛素2小时后给药组小鼠血糖恢复比对照组慢,在存在胰岛素抵抗的情况下,腹腔注射toidc可以提高胰岛素敏感性,改善胰岛素抵抗(如图26所示)。
[0148]
本发明通过体内细胞实验进一步说明了本发明实施例2筛选的小分子化合物具备治疗非酒精性脂肪肝和/或2型糖尿病的潜力。
[0149]
本发明的保护内容不局限于以上实施例。在不背离本发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1