一种灌注固定实验动物脑组织的方法与流程
1.本发明属于医疗技术领域,尤其涉及一种灌注固定实验动物脑组织的方法。
背景技术:
2.目前,利用多聚甲醛、boulin固定液、carnoy固定液等组织固定液进行组织的灌注固定可以保持细胞活体时的状态,防止细胞被溶酶体破坏,并减少细胞表面抗原丢失,是保证实验结果准确可信的基础。尤其脑组织中耐氧能力较差,蛋白类抗原更易发生变性。因此,需要对脑组织进行快速有效的灌注固定才能获得满意的组织病理标本,为后续实验奠定良好的基础。常规的动物脑组织灌注固定方法是麻醉实验动物后打开实验动物胸腔,暴露心脏后,经心尖部插管经左心室进入主动脉,将主动脉作为灌注入口,而后注射灌注液对组织进行灌注,灌注出口为右心房。但这种操作方法存在容易造成大量出血,操作视野较差,操作步骤繁琐,一次穿刺成功率低,操作耗时较长的缺点。为此,设计了一种灌注固定实验动物脑组织的方法用于解决上述问题。
3.通过上述分析,现有技术存在的问题及缺陷为:现有技术容易造成大量出血,操作视野较差,操作步骤繁琐,一次穿刺成功率低,操作耗时较长的缺点。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种灌注固定实验动物脑组织的方法。
5.本发明是这样实现的,利用颈总动脉位置较为表浅的解剖学特点,实施经颈总动脉穿刺的方法,建立灌注通路。分离伴行神经后结扎颈总静脉近端,分别于结扎处远端建立灌注入口,于颈静脉建立灌注出口的方式,建立脑循环局部灌注。
6.所述灌注固定实验动物脑组织的方法包括:
7.步骤一,分离出动物尸体的颈总动脉,双侧颈总动脉,游离伴行神经;
8.步骤二,于近心端结扎左侧颈总动脉,迅速于结扎处远端用眼科剪开一浅口后插入灌注针,固定后不能退出;
9.步骤三,在颈静脉上开一浅口作为灌注出口,通过利用与左侧颈总动脉相同的方式,对右侧颈总动脉及颈静脉进行操作;
10.步骤四,通过两侧三通调节阀灌注生理盐水冲洗后,旋转三通改为灌注多聚甲醛,达到灌注脑组织的目的;并对结果进行观察。
11.进一步,所述步骤一中,实验动物具体为:
12.成年健康雄性sd大鼠30只,2月龄,体质量240g~280g,取材前均清洁级饲养。
13.进一步,所述取材前均清洁级饲养具体过程为:
14.每日定时喂食、水,8时至22时规律光照,室温维持在22-24℃。
15.进一步,所述步骤一,具体过程为:
16.通过水合氯醛腹腔注射麻醉sd大鼠满意后,将大鼠仰卧位放置于操作台上,固定牢靠后常规消毒,取颈正中切口,依次逐层切开皮肤、皮下组织,暴露气管后钝性分离颈部
肌肉,充分暴露双侧颈总动脉,游离伴行神经。
17.进一步,所述水合氯醛为10%水合氯醛。
18.进一步,所述步骤二中,灌注针外侧安装有压力传感器,用以检测灌注液输入的速度。
19.进一步,所述步骤四中,多聚甲醛为4%多聚甲醛。
20.进一步,所述步骤四,具体过程为:
21.通过两侧三通调节阀灌注生理盐水,直至大鼠双眼变白,颈静脉流出液体变为清亮后,旋转三通改为灌注4%多聚甲醛,两侧各30ml,共计60ml,先快后慢,待大鼠颈部僵硬后断头取脑,再将脑组织于多聚甲醛中浸泡固定一段时间,待实验用。
22.进一步,所述将脑组织于多聚甲醛中浸泡固定一段时间具体过程为:
23.将脑组织于4%多聚甲醛中浸泡固定24h,待实验用。
24.进一步,所述对结果进行观察具体过程为:
25.根据大鼠脑组织解剖图谱,选取海马组织平面he染色及免疫组化染色后的切片,观察海马组织神经元形态。
26.进一步,在灌注过程中由灌注针外侧压力传感器控制灌注液输入的速度,提高灌注效率,压力传感器将检测到的灌注针外侧的压力发送给plc控制器,plc控制器对压力分析处理后控制伺服电机转动,推动灌注活塞运动,实现灌注液的速度调整。
27.结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
28.第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
29.本发明颈总动脉区解剖位置较浅,解剖结构简单,易于暴露并分离相邻血管、神经,操作不易出现大出血。本发明可以在直视下进行操作,易直接判断灌注针是否进入血管中,操作简便,耗时少。经颈总动脉灌注的方法较全身血管灌注时间短、灌注液消耗少,灌注效率高。灌注液体多为系有毒性化合物,经颈总动脉灌注减少实验人员与其接触时间,有助于保护实验操作人员的身体健康。
30.第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
31.颈总动脉区解剖位置较浅,解剖结构简单,易于暴露并分离相邻血管、神经,操作不易出现大出血,减少了实验操作过程中动物意外死亡。经颈总动脉灌注的方法系脑循环局部灌注,脑组织在相同单位时间内较全身血管灌注耗时短、灌注液消耗少,灌注效率高,灌注效果好。本发明可以在直视下进行操作,易直接判断灌注针是否进入血管中,操作简便,耗时少。灌注液体多为系有毒性化合物,经颈总动脉灌注减少实验人员与其接触时间,有助于保护实验操作人员的身体健康。
32.第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
33.(1)本发明的技术方案转化后的预期收益和商业价值为:
34.本发明减少了实验操作过程中动物意外死亡,节约实验动物成本。在相同单位时间内较全身血管灌注耗时短、灌注液消耗少,灌注效率高,灌注效果好,节约实验试剂和时
间成本。灌注液体多为系有毒性化合物,经颈总动脉灌注减少实验人员与其接触时间,有助于保护实验操作人员的身体健康。
35.(2)本发明的技术方案是否解决了人们一直渴望解决、但始终未能获得成功的技术难题:
36.本发明有效提高了单位时间内脑组织的灌注效果,节约实验试剂和时间成本。
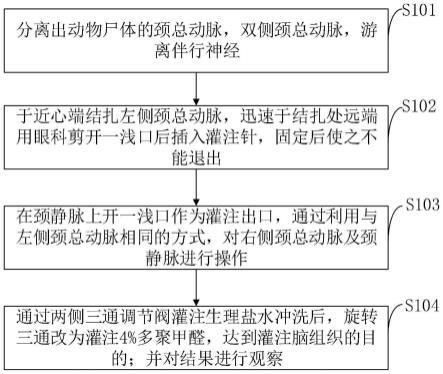
附图说明
37.图1是本发明实施例提供的灌注固定实验动物脑组织的方法流程图。
具体实施方式
38.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
39.一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
40.如图1所示,本发明实施例提供的灌注固定实验动物脑组织的方法包括:
41.s101:分离出动物尸体的颈总动脉,双侧颈总动脉,游离伴行神经。
42.s102:于近心端结扎左侧颈总动脉,迅速于结扎处远端用眼科剪开一浅口后插入灌注针,固定后使之不能退出。
43.s103:在颈静脉上开一浅口作为灌注出口,通过利用与左侧颈总动脉相同的方式,对右侧颈总动脉及颈静脉进行操作。
44.s104:通过两侧三通调节阀灌注生理盐水冲洗后,旋转三通改为灌注4%多聚甲醛,达到灌注脑组织的目的;并对结果进行观察。
45.本发明实施例提供的s101中,实验动物具体为:
46.成年健康雄性sd大鼠30只,2月龄,体质量240g~280g;取材前均清洁级饲养,每日定时喂食、水,8时至22时规律光照,室温维持在22-24℃。
47.本发明实施例提供的s101,具体过程为:
48.10%水合氯醛腹腔注射麻醉sd大鼠满意后,将大鼠仰卧位放置于操作台上,固定牢靠后常规消毒,取颈正中切口,依次逐层切开皮肤、皮下组织,暴露气管后钝性分离颈部肌肉,充分暴露双侧颈总动脉,游离伴行神经。
49.本发明实施例提供的s102中,灌注针外侧安装有压力传感器,用以检测灌注液输入的速度。
50.本发明实施例提供的s104,具体过程为:
51.通过两侧三通调节阀灌注生理盐水,直至大鼠双眼变白,颈静脉流出液体变为清亮后,旋转三通改为灌注4%多聚甲醛,两侧各30ml,共计60ml,先快后慢,待大鼠颈部僵硬后断头取脑,再将脑组织于4%多聚甲醛中浸泡固定24h,待实验用。
52.根据大鼠脑组织解剖图谱,选取海马组织平面he染色及免疫组化染色后的切片,观察海马组织神经元形态。
53.在灌注过程中由灌注针外侧压力传感器控制灌注液输入的速度,提高灌注效率,
压力传感器将检测到的灌注针外侧的压力发送给plc控制器,plc控制器对压力分析处理后控制伺服电机转动,推动灌注活塞运动,实现灌注液的速度调整。
54.二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
55.经颈总动脉灌注固定大鼠海马组织30例验证,大鼠海马组织进行he染色及免疫组化染色后的切片染色效果良好,切片染色清晰,无污染,神经元结构及形态正常。这种操作方法具有灌注时间短、灌注液体量少、灌注效率高等优点,保证脑组织尽可能地接近活体状态,为后续实验提供满意的标本,是一种可以应用于基础研究的脑组织灌注固定方法。
56.三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
57.经颈总动脉灌注固定大鼠海马组织30例体会分析
58.良好的灌注固定是保持组织细胞结构完整及抗原性的关键,提高灌注固定的效果是保证后续实验结果准确可信的基础。经颈总动脉灌注固定大鼠海马组织,具有灌注时间短、灌注液体量少、灌注效率高等优点,是一种可以应用于基础研究的组织灌注固定方法。灌注固定可以最大限度地使组织细胞保持活体时的状态,防止细胞被自身溶酶体破坏,减少抗原丢失,是避免病理假象,保证实验结果准确可信的重要手段。尤其脑组织中的海马组织耐氧能力较差,蛋白类抗原更易发生变性。因此,需要对脑组织进行快速有效的灌注固定才能获得满意的海马组织病理标本,为后续实验奠定良好的基础。现将经颈总动脉灌注固定大鼠海马组织的体会分析如下。
59.1灌注固定的材料与方法
60.1.1材料
61.1.1.1实验动物
62.成年健康雄性sd大鼠30只,2月龄,体质量(240~280)g,购于第二军医大学实验动物中心,动物许可证号:syxk(沪)2012-0003。取材前均清洁级饲养,每日定时喂食、水,8时至22时规律光照,室温维持在22-24℃。
63.1.1.2操作器械及试剂
64.止血钳、镊子、眼科剪、组织剪、手术刀、注射器、灌注针(由12号针头去除针尖后磨圆、磨平)、输液管、三通管、生理盐水、肝素、10%水合氯醛、4%多聚甲醛等。
65.1.2方法
66.10%水合氯醛腹腔注射麻醉sd大鼠满意后,将大鼠仰卧位放置于操作台上,固定牢靠后常规消毒,取颈正中切口,依次逐层切开皮肤、皮下组织,暴露气管后钝性分离颈部肌肉,充分暴露双侧颈总动脉,游离伴行神经。于近心端结扎左侧颈总动脉,迅速于结扎处远端用眼科剪剪开一浅口后插入灌注针,固定后使之不能退出。在颈静脉上剪一浅口作为灌注出口。相同方法对右侧颈总动脉及颈静脉进行操作。打开两侧三通调节阀灌注生理盐水,直至大鼠双眼变白,颈静脉流出液体变为清亮后,旋转三通改为灌注4%多聚甲醛,两侧各30ml,共计60ml,先快后慢,待大鼠颈部僵硬后断头取脑,再将脑组织于4%多聚甲醛中浸泡固定24h,待实验用。
67.2结果
68.根据大鼠脑组织解剖图谱,选取海马组织平面he染色及免疫组化染色后的切片,观察海马组织神经元形态。结果如下:海马组织切片染色效果良好,切片染色清晰,着色佳,无污染;海马组织中的神经元排列紧密有序,形态规则正常,呈圆形或椭圆形,细胞膜及核膜完整,核仁清晰可见,细胞核呈淡蓝色或淡紫色。
69.3分析
70.避免脑组织中抗原丢失,防止组织细胞自溶与腐败,使标本维持在接近活体状态的关键是对脑组织进行快速、均匀、有效的灌注固定。常规的脑组织灌注固定方法主要有以下2种:1)暴露颈总动脉,经颈总动脉灌注固定脑组织,灌注入口为颈总动脉,出口为颈静脉或左心房;2)打开胸腔,经心尖部插管经左心室进入主动脉,灌注入口为主动脉,出口为右心房。经颈总动脉对大鼠脑组织进行灌注,相比较常用的心尖部穿刺置管进行灌注,有以下优点:颈总动脉解剖位置较浅,局部结构简单,易于暴露并分离相邻血管、神经,可以在直视下近心端结扎颈总动脉再置入灌注针,出血较少,操作简洁有效。开胸行心尖部穿刺置管,虽然操作空间较大,但心尖部穿刺点不能准确定位,局部肺动脉、肺静脉等血管多,解剖结构复杂,不易直接判断灌注针是否进入主动脉中,且容易造成穿刺出血,操作视野较差,操作繁琐,耗时较长,穿刺成功率低;心尖部穿刺进行灌注,势必造成灌注液体部分流入降主动脉、腹主动脉、锁骨下动脉,延长灌注时间,浪费灌注液体,而经颈总动脉灌注的方法,可以保证灌注液体全部经颈总动脉流入大脑天然的循环系统,灌注时间短、灌注液体耗费少,灌注效率高、保证脑组织的灌注固定效果;4%多聚甲醛系有毒性化合物,经颈总动脉灌注的方法缩短灌注时间,节约灌注液体,减少实验人员与其接触时间,有助于保护实验人员的健康。通过双侧颈总动脉置入穿刺针对脑组织进行灌注,此法操作步骤简便,但操作难度较大,关键在于眼科剪在颈总动脉上剪开一小口时能否快速顺利地将灌注针置入颈总动脉并固定,操作熟练后可以最大限度地减少脑组织缺血缺氧的时间,保证脑组织尽可能地接近活体状态。经过反复练习,总结相关注意事项主要有:麻醉效果满是迅速置入灌注针的前提和基础,麻醉效果不好,实验动物会因疼痛而挣扎,影响操作顺利进行。操作前可以用止血钳钳夹大鼠四肢,评估麻醉情况;在剪颈总动脉之前一定要做好下一步置入灌注针的准备工作,确保各种器材都在手边,操作时间过长,容易造成血管收缩局部出现血凝块,导致操作失败;用眼科剪剪开颈总动脉的深度要恰到好处,太浅会仅仅剪开血管外膜导致灌注管插入血管假腔,太深则容易剪断血管。一般由45
°
方向剪开血管横截面的1/2~3/4为宜;置入灌注针后即刻固定稳妥,防止灌注针滑脱;灌注针的针头去除针尖后要确实磨平、磨圆,以免刺破血管。综上所述,实验结果证实,通过双侧颈总动脉置入穿刺针对脑组织进行灌注的方法在取材大鼠海马组织进行he染色及免疫组化染色后的切片染色效果良好,切片染色清晰,无污染,神经元结构及形态正常。虽然经颈总动脉灌注固定大鼠海马组织虽然对操作技术的要求较高,但具有灌注时间短、灌注液体量少、灌注效率高等优点,特别是练习熟练后能够最大限度地减少脑组织缺血缺氧的时间,保证脑组织尽可能地接近活体状态,为后续实验提供满意的标本,是一种可以应用于基础研究的脑组织灌注固定方法。
71.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1