对淋巴细胞中抑制途径的中和的制作方法
本发明涉及nkg2a中和剂用于治疗对pd-1中和剂应答不良的癌症的用途,以及nkg2a中和剂和pd-1中和剂用于治疗癌症的联合用途。
背景技术:
1、nk细胞的活性通过一种既涉及活化信号又涉及抑制性信号的复杂机制进行调节。已经鉴定了多种不同的nk特异性受体,这些受体在nk细胞介导的缺乏hla i类的靶细胞的识别和杀灭中起着重要的作用。自然细胞毒性受体(ncr)是指一类活化受体蛋白和表达它们的基因,这些基因在nk细胞中特异性表达。ncr的实例包括nkp30、nkp44和nkp46(参见,例如,lanier(2001)nat immunol[自然免疫学]2:23-27,pende等人(1999)j exp med.[实验医学杂志]190:1505-1516,cantoni等人.(1999)j exp med.[实验医学杂志]189:787-796,sivori等人(1997)j.exp.med.[实验医学杂志]186:1129-1136,pessino等人(1998)j expmed.[实验医学杂志]188(5):953-60;mandelboim等人(2001)nature[自然]409:1055-1060,将其全部披露内容通过引用并入本文)。这些受体是免疫球蛋白超家族的成员,并且他们通过特异性的mab诱导的交联导致强的nk细胞活化以及针对许多类型的靶细胞的nk细胞毒性的活化,该强的nk细胞活化导致细胞内的ca++水平增加,触发细胞毒性和淋巴因子释放。
2、cd94/nkg2a是在淋巴细胞亚群上发现的抑制性受体。cd94/nkg2a限制某些淋巴细胞对表达cd94/nkg2a-配体hla-e的细胞的细胞因子释放和细胞毒性应答(参见,例如,wo99/28748)。还已经发现hla-e通过某些肿瘤细胞(derre等人,j immunol[免疫学杂志]2006;177:3100-7)和活化的内皮细胞以可溶的形式分泌(coupel等人,blood[血液]2007;109:2806-14)。抑制cd94/nkg2a信号传导的抗体可增加淋巴细胞针对hla-e阳性靶细胞的细胞因子释放和细胞溶解活性,例如cd94/nkg2a阳性nk细胞针对表达hla-e的肿瘤细胞或病毒感染细胞的反应。因此,抑制cd94/nkg2a但不引起杀死表达cd94/nkg2a的细胞的治疗性抗体(即,非耗竭性抗体)可诱导对癌症患者中的肿瘤生长的控制。
3、pd-1是cd28家族受体的抑制性成员,该家族还包括cd28、ctla-4、icos和btla。pd-1在活化的b细胞、t细胞和骨髓细胞上表达(okazaki等人(2002)curr.opin.immunol.[免疫学新观点]14:391779-82;bennett等人(2003)j immunol[免疫学杂志]170:711-8)。已经鉴定了pd-1的两种配体(pd-l1和pd-l2),这两种配体已经显示在结合至pd-1后下调t细胞活化(freeman等人(2000)j exp med[实验医学杂志]192:1027-34;latchman等人(2001)natimmunol[自然免疫学]2:261-8;carter等人(2002)eur j immunol[欧洲免疫学杂志]32:634-43)。多种人类癌症中存在丰富的pd-l1(dong等人(2002)nat.med.[自然医学]8:787-9)。pd-1和pd-l1之间的相互作用导致肿瘤浸润性淋巴细胞的减少、t细胞受体介导的增殖的减少和癌性细胞的免疫逃避。通过抑制pd-1与pd-l1的局部相互作用,可以逆转免疫抑制,并且当pd-1与pd-l2的相互作用也被阻断时,该效果是累加的。
4、pd-1阻断已在许多临床试验中产生了令人印象深刻的抗肿瘤反应。然而,在很多癌症中(例如,肺癌)并非所有患者都对抗肿瘤反应的治疗有应答,并且此外一些患者患有在治疗后复发的癌症。因此,在本领域中存在着对于用pd-1轴线抑制剂治疗的患者的改进益处的需要。
技术实现思路
1、在一个方面,本发明提供了在用pd1中和剂(例如抗pd-1或抗pd-l1抗体)治疗的不良应答的个体中引发抗肿瘤免疫应答的改进方法,其中用中和抑制性受体nkg2a的试剂处理个体。pd-1不良应答者中的肿瘤浸润性淋巴细胞在用pd-1中和抗体处理后可表达抑制性受体nkg2a。在pd-1不良应答者中,尽管用pd-1中和剂治疗,肿瘤仍可进展或逃避免疫监视,因为til受抑制性nkg2a受体的限制。pd-1抗性的鼠淋巴瘤模型显示用nkg2a中和剂治疗诱导大多数个体完全缓解。
2、因此,在一个实施例中,提供了一种用中和pd-1的抑制性活性的试剂治疗或预防作为不良应答者或患有不良应答的癌症(例如,被观察为不良应答者或不良应答,或预测为不良应答者或不良应答)的个体的癌症的方法,该方法包含给予个体治疗活性量的抑制人类nkg2a多肽的化合物。在一个实施例中,抑制人类nkg2a多肽的化合物与抑制人类pd-1多肽的化合物联合给予。在另一个实施例中,给予抑制人类nkg2a多肽的化合物,而不与抑制人类pd-1多肽的化合物联合治疗。在一个实施例中,抑制人类nkg2a多肽的化合物在用抑制人类pd-1多肽的化合物的治疗过程结束期间(联合)或治疗过程结束(之后)给予,任选地进一步,其中个体在使用抑制人类pd-1多肽的化合物(例如,在没有用抑制人类nkg2a多肽的化合物治疗的情况下)治疗期间或治疗之后(例如,在第一疗程或治疗周期后)经历不完全应答(或未经历完全应答)、癌症复发或癌症进展,任选地其中该个体在nk细胞和/或cd8 t细胞上具有(例如确定具有)可检测的和/或升高数量的表达nkg2a的nk细胞和/或cd8t细胞和/或升高水平的nkg2a。在一个实施例中,所述癌症是血液肿瘤,任选地是淋巴瘤或白血病。在一个实施例中,所述癌症是恶性肿瘤。在一个实施例中,个体在nk细胞和/或cd8 t细胞上具有可检测的和/或升高数量的表达nkg2a的nk细胞和/或cd8 t细胞和/或升高水平的nkg2a。
3、在一个实施例中,提供了用于在个体中治疗或预防癌症的方法,该方法包括:
4、(a)给予个体中和pd-1抑制性活性的试剂(例如,给予试剂一个周期或疗程);和
5、(b)如果确定步骤(a)中个体的癌症对中和pd-1抑制性活性的试剂应答不良(例如,正在进展,尚未完全应答或消退,则无应答),则给予个体治疗活性量的抑制人类nkg2a多肽的化合物(任选地与中和pd-1的抑制性活性的试剂联合)。
6、在一个实施例中,抑制人类nkg2a多肽的化合物是中和nkg2a的抑制性活性的抗体。在一个实施例中,抑制人类pd-1多肽的化合物是中和pd-1的抑制性活性的抗pd-1或抗pdl-1抗体。该个体可被指定为人类。
7、在一个实施例中,提供了一种活化患有癌症的个体中cd8+肿瘤浸润性t细胞的方法,所述患有癌症的个体对用中和pd-1的抑制性活性的试剂治疗有不良应答(例如,正在进展,尚未完全应答或消退,则无应答),该方法包含给予个体治疗活性量的抑制人类nkg2a多肽的化合物。
8、在本文任何实施例的一个方面,患有对用中和pd-1的抑制性活性的试剂治疗有不良应答的癌症的个体是经历或预测具有高度可能性的个体(例如,基于一种或多种预后因素)在用中和pd-1的抑制性活性的试剂治疗之后(期间或之后)经历不完全应答、缺乏治疗应答、可检测的、复发或残留癌症和/或进行性疾病。在一个实施例中,不良应答的癌症是尽管(例如在期间或之后)用中和pd-1抑制性活性的试剂治疗,但未应答、未完全应答、保持可检测或残留、或已经复发或进展的癌症,或尽管用中和pd-1的抑制性活性试剂治疗,预测(例如基于一种或多种预后因素)具有很高的可能性不应答、不完全应答、保持可检测或残留、或者复发或进展的癌症。在一个实施例中,作为不良应答者或具有不良应答的癌症的个体是用中和pd-1抑制性活性的试剂治疗时(期间或之后)经历不完全应答(例如,未经历完全应答(cr))的个体。在一个实施例中,作为不良应答者或具有不良应答的癌症的个体是用中和pd-1抑制性活性的试剂治疗时(期间或之后)经历至少部分应答(pr),但癌症保持可检测的、已经复发或进展的个体。
9、在一个实施例中,作为不良应答者个体或具有不良应答的癌症的个体是用中和pd-1的抑制性活性的试剂治疗的不良疾病预后的个体(例如,在没有使用中和nkg2a抑制性活性的试剂治疗的情况下;作为单一疗法)。例如,基于一种或多种预测因素,可以确定具有不良疾病预后的个体具有高或更高的癌症进展风险(例如,与具有良好疾病预后的个体相比)。在一个实施例中,预测因素包含在nk细胞和/或cd8 t细胞上存在可检测的和/或升高数量的nkg2a表达的nk细胞和/或cd8 t细胞和/或升高水平的nkg2a。在一个实施例中,预测因素包含在一个或多个基因中存在或不存在突变。在一个实施例中,突变定义由t细胞识别的新表位。在一个实施例中,预测因素包含肿瘤细胞中一种或多种基因或蛋白质的表达水平,例如,pd-l1,肿瘤细胞上pd-l1降低或升高的水平。在一个实施例中,预测因素包含周期中或肿瘤环境中的nk细胞和/或cd8 t细胞中一种或多种基因或蛋白质的表达水平,例如pd-1。在一个实施例中,预测因素包含肿瘤细胞中的突变负荷,例如每个外显子组的非同义突变的数量。
10、在一个实施例中,作为不良应答者个体或具有不良应答的癌症的个体是患有已知对用抑制人类pd-1多肽的化合物治疗有不良应答的癌症的个体,任选地实体瘤、任选地血液恶性病、任选地头颈部鳞状细胞癌。
11、在一个方面,提供了一种组合物,该组合物包含抑制人类nkg2a多肽的抗体,所述抗体用于治疗或预防对用抑制人类pd-1多肽的化合物(例如在用抑制人类pd-1多肽的化合物治疗后已经进展或预测进展),任选地其中癌症是实体癌(例如肺癌)、任选地其中癌症是鳞状细胞癌(例如,hnscc)、任选地其中癌症是血液恶性病(例如淋巴瘤)。
12、在一个方面,提供了中和人类nkg2a的抑制性活性以与中和人类pd-1的抑制性活性的试剂联合使用的试剂,用于治疗对用中和人类pd-1抑制性活性的试剂治疗具有不良应答的癌症。在一个方面,提供了在治疗患有肺癌、黑色素瘤或鳞状细胞癌(例如,hnscc)的个体时中和人类nkg2a的抑制性活性的试剂,该治疗包含给予个体每个有效量的:(a)一种试剂,任选地中和人类nkg2a抑制性活性的抗体,和(b)一种试剂,任选地中和人类pd-1抑制性活性的抗体。
13、在一个方面,提供了一种包含抑制人类nkg2a多肽的抗体的组合物,所述抗体用于治疗或预防已经接受或正在经受抑制人类pd-1多肽的化合物治疗的个体的癌症,其中所述个体在肿瘤环境中具有可检测的,增加的和/或升高数量的表达nkg2a的nk细胞和/或cd8 t细胞,和/或在肿瘤环境中在nk细胞和/或cd8 t细胞上nkg2a的表达水平增加。在一个实施例中,与在用抑制人类pd-1多肽的化合物治疗之前观察到的数量相比,个体在周期中或在肿瘤环境中具有增加的nk细胞和/或cd8 t细胞的数量,和/或与参考值相比增加(例如,细胞数量对应于在抑制人类pd-1多肽的化合物经历不良应答的患者中观察到的值)。在一个实施例中,与用抑制人类pd-1多肽的化合物治疗之前观察到的水平相比和/或与参考值相比,个体在肿瘤环境中在nk细胞和/或cd8 t细胞上具有增加的nkg2a表达水平(例如,水平对应于在抑制人类pd-1多肽的化合物经历不良应答的患者中观察到的值)。在一个实施例中,以导致人类患者(体内)中人类cd94/nkg2a的抑制性活性发生中和的量(例如以导致人类cd94/nkg2a对人类患者中cd8 t细胞和nk细胞的抑制性活性进行中和的量)给予个体该抗nkg2a抗体。在一个实施例中,导致人类患者中人类cd94/nkg2a的抑制性活性发生中和的量为使nkg2a受体在nkg2a+细胞表面上实质上饱和所需的最小浓度(例如,在结合测定中,其中在pbmc上滴定抗体)的至少10倍(例如,10倍-20倍、10倍-50倍、10倍-100倍、20倍-50倍、20倍-100倍、30倍-100倍、50倍-100倍),任选地至少50倍、60倍、80倍或100倍。在一个实施例中,该抗nkg2a抗体与hla-e竞争结合人类nkg2a。
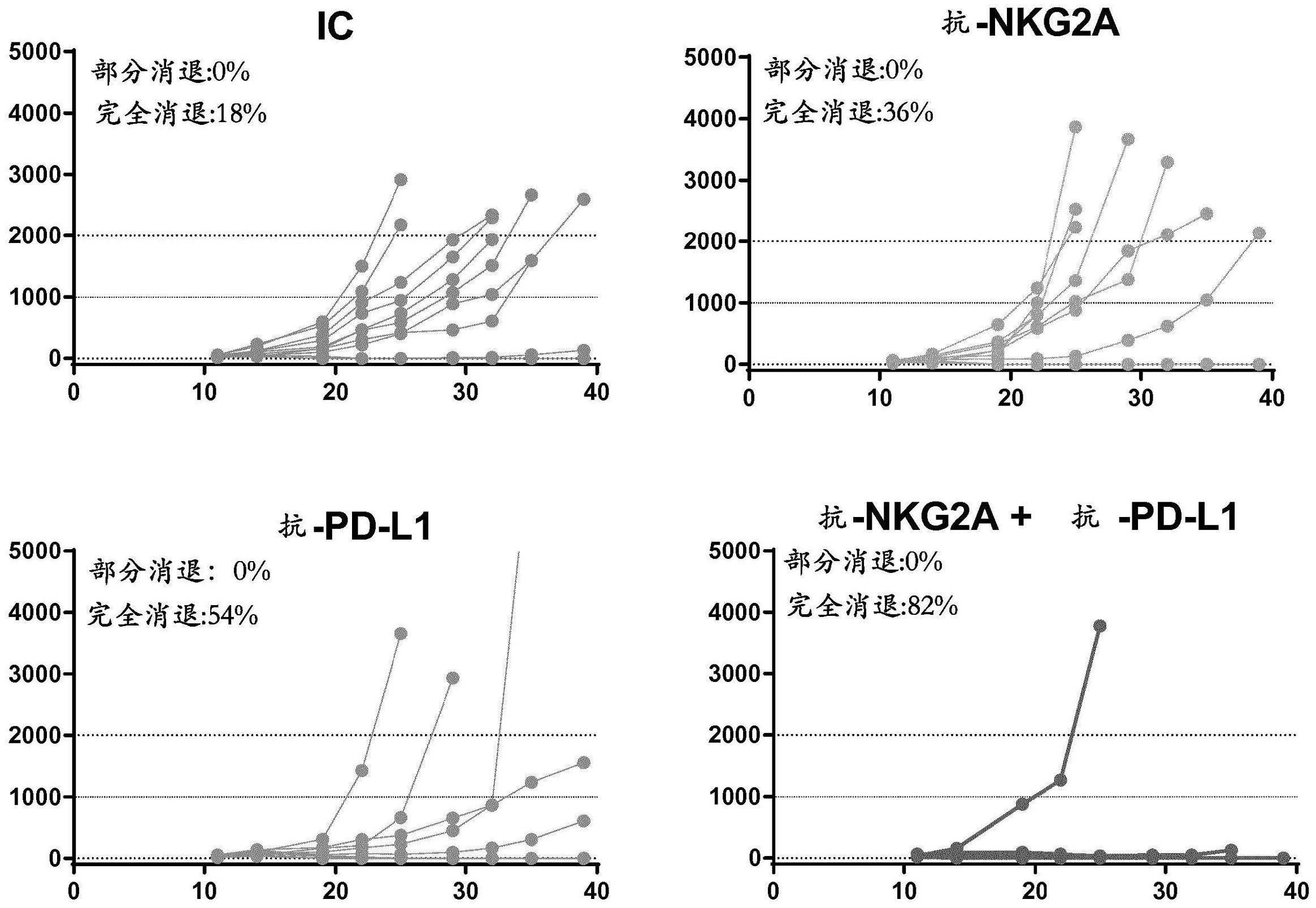
14、在一个方面,本文显示与抗nkga抗体和抗pd-1抗体或与抗nkg2a抗体和抗pd-l1抗体的联合治疗在治疗癌症中特别有效。本文还显示用抗pd1的治疗可以引起肿瘤浸润性淋巴细胞上的nkg2a受体的上调,这样使得nkg2a可以限制阻断pd1轴线的试剂的疗效。由于这些受体都可以限制肿瘤浸润性淋巴细胞的细胞毒性活性,因此这两种受体的抑制性活性的中和通过抗体使得nkg2a+pd1+淋巴细胞有效地消除癌细胞。在一个实施例中,nkg2a+pd1+淋巴细胞是细胞毒性淋巴细胞,任选地是cd8+t细胞或nk细胞。
15、在一个方面,本发明提供了通过抑制性受体nkg2a和pd-1的联合中和(例如,经由使用抗体)来增强抗肿瘤免疫应答的改进方法。不管他们是否对pd-1的抑制性活性有不良应答,联合治疗可用于治疗患有癌症的个体(例如已知对中和pd-1、非小细胞肺癌(nsclc)、肾癌、胃肠癌、胰腺或食道癌、乳腺癌、肾细胞癌(rcc)、黑色素瘤、结肠直肠癌或卵巢癌的试剂有不良应答的癌症),且因此包括例如用中和pd-1的抑制性活性的试剂治疗的应答不良者个体,和用中和pd-1的抑制性活性的试剂治疗的良好应答者个体。
16、因此,在一个实施例中,提供了治疗或预防对用抑制人类pd-1多肽的化合物治疗有不良应答的癌症的方法,该方法包含给予患有癌症的个体:(a)治疗活性量的抑制人类nkg2a多肽的化合物,和(b)治疗活性量的抑制人类pd-1多肽的化合物。在一个实施例中,癌症是实体瘤,任选地包含浸润性nk细胞和/或cd8 t细胞的实体瘤,任选地其中nk细胞和/或cd8 t细胞表达nkg2a,任选地其中至少10%、20%、30%、40%或50%的nk细胞在其表面表达nkg2a。在一个实施例中,抑制人类nkg2a多肽的化合物是中和nkg2a的抑制性活性的抗体。在一个实施例中,抑制人类pd-1多肽的化合物是中和pd-1的抑制性活性的抗pd-1或抗pdl-1抗体。该个体可被指定为人类。
17、在一个实施例中,提供了活化或增强个体中的cd8+肿瘤浸润性t细胞的活性的方法,该方法包含向个体给予:(a)治疗活性量的抑制人类nkg2a多肽的化合物,和(b)治疗活性量的抑制人类pd-1多肽的化合物。在一个实施例中,提供了活化或增强个体中的肿瘤浸润性nk细胞的活性的方法,该方法包含向个体给予:(a)治疗活性量的抑制人类nkg2a多肽的化合物,和(b)治疗活性量的抑制人类pd-1多肽的化合物。在一个实施例中,该癌症是实体瘤。任选地,在任何实施例中,个体患有对用抑制人类pd-1多肽的化合物治疗有不良应答的癌症。
18、在个一方面,本发明提供了治疗,该治疗包括给予中和nkg2a的抑制性活性的抗体与中和pd-1的抑制性活性的抗体的联合。在本文任何实施例的一个方面,提供了包含抑制人类nkg2a多肽的抗体和结合pdl1或pd1并中和人类pd-1多肽的抑制性活性的抗体的组合物。在一个方面,该组合物用于治疗或预防癌症。
19、在一个方面,中和nkg2a的抑制性活性的抗体和中和pd-1的抑制性活性的抗体联合用于治疗或预防已知对用抑制人类pd-1多肽的化合物治疗有不良应答的癌症,任选地是实体瘤,任选地是血液恶性病。在一个实施例中,已知有不良应答的癌症是鳞状细胞癌,任选地是头颈部鳞状细胞癌。
20、在本文的任何实施例中,抑制人类pd-1多肽的化合物或试剂包含防止pd-l1诱导的pd-1信号传导的多肽(例如抗体、与fc结构域融合的多肽、免疫黏附素等),例如通过阻断pd-1与其天然配体pd-l1之间的相互作用(并任选地进一步阻断pd-1和pd-l2之间的相互作用)。在一个方面,多肽是结合pd-1的抗体(抗pd-1抗体);这样的抗体可以阻断pd-1和pd-l1之间和/或pd-1和pd-l2之间的相互作用。在另一方面中,该多肽是结合pd-l1(抗pd-l1抗体)并阻断pd-1和pd-l1之间的相互作用的抗体。在一个实施例中,以导致人类患者(体内)中人类pd-1的抑制性活性发生中和的量(例如以导致人类pd-1对人类患者中cd8 t细胞和nk细胞的抑制性活性进行中和的量)给予/已经给予中和人类pd-1多肽的抗体。在一个方面,根据特定的临床剂量方案,尤其是以特定的剂量并根据具体的给药方案,给予该抗体(或用于给予)。
21、在本文任何实施例的一个方面,中和抑制性受体nkg2a的化合物或试剂是抗体。在一方面中,中和nkg2a的抗体是非耗竭性抗体(例如,不杀死、消除、裂解或诱导这样的杀伤、消除或裂解的抗体),以便负面影响样品或受试者中存在的表达nkg2a的细胞的数量。在个一方面,中和nkg2a的抗体是非耗竭性抗体。非耗竭性抗体可以例如缺少fc结构域或具有对一个或多个fcγ受体(例如cd16)具有最小结合或无结合的fc结构域。实例包括具有来自人类igg4同种型抗体的恒定域的抗体、具有经修饰以降低或消除与一个或多个fcγ受体(例如cd16、cd32a、cd32b和/或cd64)的结合的恒定域的任何同种型(例如igg1、igg2、igg3、igg4)的抗体。
22、在本文任何实施例的一个方面,该抗nkg2a抗体被给予至少一个给予周期,该给予周期包含该抗nkg2a抗体的至少第一次和第二次(和任选地第3次、第4次、第5次、第6次、第7次和/或第8次或更多次)给予,其中在第一次和第二次(和任选地更多次)给予之间以有效实现至少为10μg/ml(或任选地至少20μg/ml、30μg/ml、40μg/ml或50μg/ml)的抗nkg2a抗体的连续(最小)血液浓度的量给予该抗nkg2a抗体。实现或保持指定的连续血液浓度意味着,在指定时间段的持续时间内(例如在抗体的两次给予之间,数周),血液浓度实质上不下降到指定的血液浓度以下,即尽管血液浓度在指定时间段期间可以变化,但指定的血液浓度仍表示最小或“谷”浓度。
23、在一个实施例中,以在给予后(例如在给予的1或2天内)有效实现约或至少约50μg/ml、60μg/ml、70μg/ml或80μg/ml(任选地至少约100μg/ml)的峰血液浓度的量给予该抗nkg2a抗体。
24、在一个实施例中,以有效实现约或至少约10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml、70μg/ml或80μg/ml(任选地至少约100μg/ml)的抗nkg2a抗体的连续(最小)血液浓度的量给予该抗nkg2a抗体持续至少一周或至少两周,随后给予该抗体。
25、在一个实施例中,在两次连续给予之间以有效实现约或至少约50μg/ml、60μg/ml、70μg/ml或80μg/ml(任选地至少约100μg/ml)的抗nkg2a抗体的连续(最小)血液浓度的量给予该抗nkg2a抗体。在一个实施例中,第一次和第二次给予在时间上间隔约两周,任选地约一周。
26、可以任选地以有效的量,并且根据达到如给予周期的整个持续时间中所指定的连续(最小)血液浓度的频率来给予该抗nkg2a抗体。
27、在一个实施例中,抑制人类nkg2a多肽的抗体在治疗过程之后给予(治疗过程可以完全完成或在完成之前停止),或者在治疗过程起始之后(例如,在不完全应答、肿瘤进展等情况下)在包含至少两次给予抗nkg2a抗体的给予周期中,用抗体中和人类pd-1多肽的抗体。在另一个实施例中,抑制人类nkg2a多肽的抗体在给予周期中与中和人类pd-1多肽的抗体联合给予,其中给予周期包含至少两次给予抗nkg2a抗体。在一个实施例中,以有效实现血管外组织(例如,在肿瘤环境中)中为至少4μg/ml(在两个连续给予期间任选地至少10μg/ml)的连续(最小)浓度的量给予该抗nkg2a抗体。任选地,以有效实现血管外组织(例如,在肿瘤环境中)中为至少4μg/ml(任选至少10μg/ml)的连续(最小)浓度的量给予该抗nkg2a抗体,保持给予周期的整个持续时间。在一个实施例中,抗nkg2a抗体以在两次连续给予之间或对于给予周期的持续时间有效实现至少40μg/ml、任选地至少100μg/ml的抗nkg2a抗体的连续(最小)血液浓度的量给予。
28、在一个实施例中,该癌症是血液癌。在一个非限制性实施例中,癌症是淋巴瘤或白血病。在一个实施例中,该癌症是晚期和/或难治性实体瘤。在一个非限制性实施例中,该癌症(例如晚期难治性实体瘤)选自下组,该组由以下组成:非小细胞肺癌(nsclc)、肾癌、胃肠癌、胰腺癌或食管腺癌、乳腺癌、肾细胞癌(rcc)、黑色素瘤、结肠直肠癌、以及卵巢癌。
29、抑制nkg2a多肽的化合物(抗nkg2a试剂)是提高表达nkg2a的nk和/或t细胞引起表达hla-e的细胞死亡的能力的化合物。任选地,该抑制nkg2a多肽的化合物是多肽,任选地是结合nkg2a多肽的抗体(例如单克隆抗体)。
30、在一个实施例中,抗nkg2a试剂通过阻断其配体hla-e的结合来降低nkg2a的抑制性活性,即抗nkg2a试剂干扰hla-e对nkg2a的结合。具有seq id no:4-seq id no:8中任一个的重链和seq id no:9的轻链的抗体是这种抗体的实例。在一个实施例中,抗nkg2a试剂降低nkg2a的抑制性活性而不阻断其配体hla-e的结合,即抗nkg2a试剂是非竞争性拮抗剂,并且不干扰nkg2a与hla-e的结合。具有seq id no:10和seq id no:11的重链和轻链可变区的抗体分别是这种抗体的实例。
31、在一个实施例中,抗nkg2a试剂是以比对一种或多种活化nkg2受体显著更高的亲和力结合nkg2a的抗体。例如,在一个实施例中,该试剂是以比对nkg2c显著更高的亲和力结合nkg2a的抗体。在另外的或可替代的实施例中,该试剂是以比nkg2e显著更高的亲和力结合nkg2a的抗体。在另外的或可替代的实施例中,该试剂是以比nkg2h显著更高的亲和力结合nkg2a的抗体。
32、在一个实施例中,该抗nkg2a试剂与分别具有seq id no:4-8和9的重链和轻链的抗体或分别具有seq id no:10和11的重链和轻链可变区的抗体竞争与cd94/nkg2a的结合。该试剂可以是例如人或人源化抗nkg2a抗体。
33、在一个实施例中,该抗nkg2a抗体是分别具有seq id no:4-8中任一个的任意重链的重链cdr和seq id no:9的轻链的轻链cdr的人源化抗体。在一个实施例中,该抗nkg2a抗体是分别具有seq id no:4-8中任一个的任意重链的重链可变区和seq id no:9的轻链的轻链可变区的人源化抗体。提供了具有改进的性质(如,例如较低的免疫原性、改善的抗原结合或其他功能性质)、和/或改善的物理化学性质(如,例如更好的稳定性)的这类人源化抗体的框架区(fr)中的示例性互补决定区(cdr)残基或序列和/或氨基酸取代位点。
34、在某些任选的方面,提供了一种鉴定患有癌症的个体的方法,所述个体是用中和人类pd-1的抑制性活性的试剂治疗的不良应答者,该方法包含:
35、a)确定已经用中和人类pd-1的抑制性活性(例如,已接受至少一次试剂给予的人)的试剂治疗的个体中nk细胞和/或cd8 t细胞上的nkg2a+(且任选地另外的pd-1)的表达水平和/或nk细胞和/或cd8 t细胞中nkg2a(任选地nkg2a+pd1+)的数量;和
36、b)在确定个体在nk细胞和/或cd8 t细胞(任选地在表达pd-1的nk细胞或t细胞上)上nkg2a表达水平增加和/或nkg2a+(任选地nkg2a+pd1+)nk细胞和/或cd8 t细胞数量增加(例如与参考值相比、与参考值相比增加、与用试剂处理之前观察到的值相比增加)时,将个体鉴定为用中和人类pd-1的抑制性试剂治疗的不良应答者。
37、在某些任选方面中,通过评估nk细胞和/或cd8+ t细胞上nkg2a表达的肿瘤样品(例如,肿瘤组织和/或肿瘤相邻组织)中的存在,可以鉴定患者用抗nkg2a试剂治疗。在本文的任何治疗用途或癌症治疗或预防方法的一个实施例中,个体中癌症的治疗或预防包含:
38、a)确定已经或正在用中和pd-1的抑制性活性的试剂治疗的患有癌症的个体中nk细胞和/或cd8 t细胞上的nkg2a的表达水平和/或表达nkg2a的nk细胞和/或cd8 t细胞的数量,以及
39、b)在确定个体在nk细胞和/或cd8 t细胞上具有增加的nkg2a表达水平和/或增加数量的表达nkg2a的nk细胞和/或cd8 t细胞时,向个体给予中和人类nkg2a多肽的抑制性活性的化合物。
40、在任何方法的一个实施例中,确定nkg2a表达和/或nkg2a+nk细胞和/或cd8 t细胞数量的水平包含确定nkg2a核酸或多肽在nk细胞和/或cd8 t细胞上的表达水平和/或确定生物样品中nkg2a+nk细胞和/或cd8 t细胞的数量,并将该水平与参考水平(例如,值、弱或强细胞表面染色等)进行比较。例如,参考水平可以对应于健康个体、对应于使用抑制人类pd-1多肽的试剂治疗的应答或不良应答的个体、对应于从使用抗nkg2a抗体治疗中获得无/低临床益处的个体、或对应于从使用抗nkg2a抗体(任选地与抑制人类pd-1多肽的试剂联合)治疗获得实质的临床益处的个体。确定生物样品包含增加数量的表达nkg2a的nk细胞和/或cd8 t细胞(例如,与从使用抑制人类pd-1多肽的试剂治疗无法获得足够临床益处的个体相对应的数量,与从使用抗nkg2a抗体治疗获得实质的临床益处的个体相对应的数量)指示患有癌症的个体可以用抗nkg2a抗体进行治疗(例如根据本文所述的治疗方法)。生物样品以增加的水平(例如,高的值、强的表面染色、对应于使用抑制人类pd-1多肽的试剂治疗无法获得足够临床益处的个体的水平、对应于使用抗nkg2a的抗体治疗从个体获得实质的临床益处的水平、比对应于个体从用抗nkg2a抗体的治疗没有获得/获得低的临床益处的水平更高的水平,等等)表达nkg2a核酸或多肽的确定指示该个体患有可用抗nkg2a抗体治疗的癌症,例如根据本文所述的治疗方法。
41、在一个实施例中,cd8 t细胞是肿瘤浸润性cd8 t细胞。在一个实施例中,nk细胞是肿瘤浸润性nk细胞。在一个实施例中,至少15%、20%、25%或30%的nk细胞和/或cd8 t细胞是pd1+nkg2a+。
42、在一个实施例中,所述个体患有包含在其表面表达hla-e多肽的恶性细胞的癌症。在一个实施例中,治疗方法进一步包含确定患有癌症的个体内的恶性细胞(例如肿瘤细胞)的hla-e多肽状态,其中确定恶性细胞表达hla-e核酸或多肽指示该个体患有可用抑制nkg2a的试剂治疗的癌症。
43、在其他实施例中,提供了药物组合物和试剂盒,以及使用他们的方法。在一个实施例中,提供了药物组合物,其包含中和人类nkg2a多肽的抑制性活性的化合物。在一个实施例中,提供了试剂盒,其包含中和人类nkg2a多肽的抑制性活性的化合物和能够检测nk细胞和/或cd8 t细胞表面上nkg2a表达的试剂(例如抗体或其他nkg2a结合剂与可检测部分结合)。
44、这些方面将在本文提供的本发明的描述中更加完全地描述,并且另外的方面、特征和优点将是明显的。
- 还没有人留言评论。精彩留言会获得点赞!