约氏乳杆菌在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用的制作方法
1.本发明涉及微生物应用技术领域,尤其是涉及约氏乳杆菌在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用。
背景技术:
2.在高原地区高海拔的状态下,包括肠道在内的机体结构和功能会出现损伤。高原低氧环境会导致胃肠道应激反应,并伴有肠粘膜损伤,进而导致细菌和内毒素移位,诱发全身炎症反应综合征和多器官功能障碍。肠道粘膜屏障受损的重要原因之一就是缺氧,高原地区氧气含量明显低于低海拔地区,机体为适应高原环境,会出现血红蛋白含量上升、携氧能力上升等生理变化,同时也会出现循环系统阻力增加,免疫系统受损,动脉血氧分压降低的不良反应。郑必海等对20例由平原地区进入高原的个体进行多项检测,结果发现高原急性缺氧可导致急性胃肠道粘膜损伤,其作用机制主要是胃肠道运动紊乱,炎症反应以及自由基的损伤。吴文明等通过建立高原缺氧模型的大鼠,对高原缺氧条件所导致的肠粘膜损伤机制进行了探究,研究显示缺氧诱导了肠粘膜中缺氧诱导因子hif-1α和inos蛋白的表达上调;hif-1α可能参与了肠组织inos蛋白的表达过程和肠粘膜损伤。
3.常用于胃肠道屏障功能治疗的药物可分为以下几类:一是免疫营养物质,例如谷氨酰胺、精氨酸、ω-3脂肪酸以及膳食纤维等,可以提供热量,阻断无氧酵解,有效改善胃肠道的免疫功能;二是重组人生长激素(rhgh),可以降低肠道粘膜通透性,增强肠道免疫力,刺激肠粘膜上皮再生,修复并促进肠道粘膜结构和功能的恢复;三是表皮生长因子(egf),可提高谷氨酰胺对小肠粘膜的营养作用,减轻胃肠道组织的损伤;四是中药,一些中药汤剂具有加强胃粘膜防御机制的作用。
4.但是,上述提到的药物也具有一定的局限性,免疫营养物质、重组人生长激素以及表皮生长因子大多通过皮下注射进行给药,不够方便,并且药物的价格也比较昂贵。而中药的作用机制及其安全性仍有待研究确定。
技术实现要素:
5.有鉴于此,有必要针对上述问题,提供约氏乳杆菌在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用。
6.为了实现上述发明目的,本发明采用以下技术方案:
7.第一个方面,本发明提供mir-122-5p在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用,所述mir-122-5p的序列为:uggagugugacaaugguguuug。
8.第二个方面,本发明提供抑制mir-122-5p表达的试剂在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用。
9.进一步的,所述抑制mir-122-5p表达的试剂包括约氏乳杆菌yh1136。
10.进一步的,所述约氏乳杆菌yh1136保藏于中国典型培养物保藏中心,保藏编号为:
cctcc m 20221116,菌株名称:约氏乳杆菌(lactobacillus johnsonii yh1136),保藏时间:2022年7月15日。
11.第三个方面,本发明提供约氏乳杆菌yh1136在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用。
12.进一步的,所述约氏乳杆菌yh1136的菌液浓度为108cfu/ml。
13.进一步的,所述约氏乳杆菌yh1136的处理过程包括:
14.将约氏乳杆菌yh1136菌种活化后接种于灭菌的mrs液体培养基中37℃培养24h后进行活菌计数,然后将菌液分装,3000r/min,4℃离心15min,弃上清液收集菌体。用ph7.0的pbs缓冲液重悬至初始体积,混匀后再次离心15min,重复两次;最后将菌体重悬在pbs缓冲液中,根据活菌计数结果,将菌液浓度调整至108cfu/ml,4℃保存备用。
15.第四个方面,本发明提供一种治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物,所述药物包括抑制mir-122-5p表达的试剂。
16.进一步的,所述试剂包括约氏乳杆菌yh1136。
17.进一步的,所述药物还包括药学上可接受的载体。
18.进一步的,所述药物的制剂形式为液体剂型。
19.本发明所具有的优点和有益效果是:
20.本发明首次公开了使用约氏乳杆菌yh1136抑制mir-122-5p表达治疗和/或预防高原缺氧环境所导致的肠道屏障损伤,并首次确定了mir-122-5p在其中发挥的作用,与其他现有预防和治疗肠道屏障损伤的药物相比,约氏乳杆菌yh1136具有更安全更稳定的作用效果。
附图说明
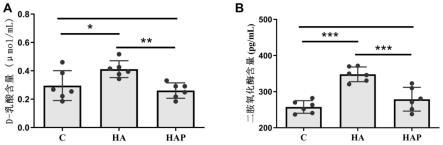
21.图1为肠道屏障功能检测指标,图中*表示,差异显著p<0.05;**表示p<0.01;***表示p<0.001,未标注*即表示差异不显著;
22.图2为差异表达分析结果统计;
23.图3为go富集分析气泡图a.ha vs hap b.c vs ha;
24.图4为kegg通路富集气泡图a.ha vs hap b.c vs ha。
具体实施方式
25.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
26.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
27.实施例1:
28.本实施例提供抑制mir-122-5p表达的试剂在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用。
29.所述抑制mir-122-5p表达的试剂包括约氏乳杆菌yh1136(lactobacillusjohnsonii yh1136),本发明的约氏乳杆菌yh1136由广东益合生物科技有
限公司分离,约氏乳杆菌yh1136(cctcc m20221116)的菌株分离与鉴定方法如下:
30.1.取西藏自治区那曲地区班戈县健康儿童粪便使用0.8%灭菌生理盐水以1∶49的比例混合,然后使用摇床以200r/min的速度震荡30min。取1ml混悬液依次进行等比稀释,稀释至10-8
。取100μl稀释液涂布至mrs平板上,37℃厌氧静置培养36h,然后挑取典型的单菌落进行革兰氏染色,并使用显微镜镜检观察。结合菌落形态以及染色镜检结果挑取单菌落进一步划线纯化培养。纯化培养后再挑取单菌落接种至mrs液体培养基中扩大培养。初步筛选出潜在的乳酸杆菌,进行下一步耐酸耐胆盐实验,其中本发明所提供的乳酸菌暂时命名为乳酸菌yh1136。
31.2.将乳酸菌菌液在mrs液体培养基中活化3代,再以2%的接种量接种于ph=3.0和ph=6.4的mrs液体培养基中,37℃厌氧培养12h;同时按2%的接种量接种于0.3%的牛胆盐mrs液体培养基,37℃厌氧培养12h。检测培养期间活菌数的变化,实验重复3次取平均值。实验结果显示,本发明所提供的乳酸菌yh1136在ph6.4的mrs液体培养基中培养12h后仍然生长优良;且在0.3%胆盐培养基中培养12h后活菌数仍有2.0
×
107cfu/ml,这表明乳酸菌yh1136具有较强的耐酸性和胆盐耐受性,具备在肠道内定植的能力,且定植能达到一定的数量,符合益生菌发挥效果所需106cfu/ml浓度的要求。具体结果如表1所示。
32.菌株ph6.4ph3.00.3%耐胆盐实验(cfu/ml)乳酸菌yh1136+++++2
×
107cfu/ml
33.注:+++为生长优良;++为生长良好。通过与已知浓度的菌体培养液(109、106、103cfu/ml)进行对照以判断生长情况,培养液无浑浊视为无生长,有浑浊度但低于103cfu/ml视为略有生长,浑浊度在103cfu/ml与106cfu/ml之间视为生长一般,浑浊度在高于106cfu/ml低于109cfu/ml视为生长良好,浑浊度近似于109cfu/ml视为生长优良。
34.3.取乳酸菌yh1136菌液活化3代后按2%的接种量接种于mrs-chol培养基(通过超声破碎并使用滤膜过滤的方法,配置胆固醇含量为0.1mg/ml的mrs肉汤培养基)中,37℃厌氧培养24h后用邻苯二甲醛法测定菌液上清液、洗涤液、菌体破碎液中胆固醇的质量分数,以未接种乳酸菌yh1136菌液的mrs-chol培养基作为空白对照,并根据上清液中胆固醇的质量分数计算培养基中胆固醇的脱除率,试验重复3次取平均值。实验结果显示,本发明乳酸菌yh1136的上清液中胆固醇的脱除率最高,为38.75%,洗涤液的脱除率为33.22%,而细胞破碎液的脱除率最低为28.03%(见表2)。说明本发明乳酸菌yh1136具有良好的降解胆固醇的作用。
35.菌株细胞破碎液脱除率(%)洗涤液脱除率(%)上清液脱除率(%)yh113628.0333.2238.75
36.4.使用dna stool mini kit试剂盒提取乳酸菌yh1136的总dna,用2%琼脂糖凝胶电泳检测总dna。使用特异性引物27f和1492r对基因组总dna的16s rdna的全长进行pcr扩增,使用1.0%琼脂糖凝胶电泳对扩增产物进行检测,再使用试剂盒对扩增产物进行纯化。将纯化产物送北京擎科生物科技有限公司进行测序。测序结果如下所示。将该乳酸菌yh1136的16s rdna序列上传至美国生物信息学中心(ncbi)网站,获得登录号(accession)为op049985。在ncbi网站上进行blast比对后,与约氏乳杆菌(lactobacillus johnsonii yh1136)的亲缘性最接近,同源性高达99.79%,因此将目标乳酸菌yh1136鉴定
为约氏乳杆菌(lactobacillus johnsonii yh1136),并于2022年7月15日保藏于中国典型培养物保藏中心,保藏地址为湖北省武汉市武昌区八一路299号武汉大学,保藏编号为cctcc m 20221116。
37.16s rdna测序结果如下:
38.gttggctctgctataatgcaagtcgagcgagcttgcctagatgattttggtgcttgcactaaatgaaactagatacaagcgagcggcggacgggtgagtaacacgtgggtaacctgcccaagagactgggataacacctggaaacagatgctaataccggataacaacactagacgcatgtctagagtttgaaagatggttctgctatcactcttggatggacctgcggtgcattagctagttggtaaggtaacggcttaccaaggcaatgatgcatagccgagttgagagactgatcggccacattgggactgagacacggcccaaactcctacgggaggcagcagtagggaatcttccacaatggacgaaagtctgatggagcaacgccgcgtgagtgaagaagggtttcggctcgtaaagctctgttggtagtgaagaaagatagaggtagtaactggcctttatttgacggtaattacttagaaagtcacggctaactacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggatttattgggcgtaaagcgagtgcaggcggttcaataagtctgatgtgaaagccttcggctcaaccggagaattgcatcagaaactgttgaacttgagtgcagaagaggagagtggaactccatgtgtagcggtggaatgcgtagatatatggaagaacaccagtggcgaaggcggctctctggtctgcaactgacgctgaggctcgaaagcatgggtagcgaacaggattagataccctggtagtccatgccgtaaacgatgagtgctaagtgttgggaggtttccgcctctcagtgctgcagctaacgcattaagcactccgcctggggagtacgaccgcaaggttgaaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaggtcttgacatccagtgcaaacctaagagattaggtgttcccttcggggacgctgagacaggtggtgcatggctgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgtcattagttgccatcattaagttgggcactctaatgagactgccggtgacaaaccggaggaaggtggggatgacgtcaagtcatcatgccccttatgacctgggctacacacgtgctacaatggacggtacaacgagaagcgaacctgcgaaggcaagcggatctcttaaagccgttctcagttcggactgtaggctgcaactcgcctacacgaagctggaatcgctagtaatcgcggatcagcacgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccatgagagtctgtaacacccaaagccggtgggataacctttataggagtcagccgtctaaggtgaca。
39.实施例2:
40.本实施例提供mir-122-5p在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用,所述mir-122-5p的序列为:uggagugugacaaugguguuug。
41.实施例3:
42.本实施例提供约氏乳杆菌yh1136在制备治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物中的应用。所述约氏乳杆菌yh1136的菌液浓度为108cfu/ml。
43.所述约氏乳杆菌yh1136的处理过程包括:
44.将约氏乳杆菌yh1136菌种活化3代,将-80℃保存的菌种从冰箱取出,在37℃条件下迅速溶解,然后将菌液转移至少量mrs液体培养基中进行培养后接种,培养条件是37℃,24h,接种比例为2%。于灭菌的mrs液体培养基中37℃培养24h后进行活菌计数,然后将菌液分装,3000r/min,4℃离心15min,弃上清液收集菌体。用ph7.0的pbs缓冲液重悬至初始体积,混匀后再次离心15min,重复两次;最后将菌体重悬在pbs缓冲液中,根据活菌计数结果,将菌液浓度调整至108cfu/ml,4℃保存备用。
45.实施例4:
46.本实施例提供一种治疗和/或预防高原缺氧环境导致的肠道屏障损伤药物,所述
药物包括抑制mir-122-5p表达的试剂。所述试剂包括约氏乳杆菌yh1136,或者包括其它可以实现抑制mir-122-5p表达的试剂。此外,所述药物还包括药学上可接受的载体。本技术采用的可接受载体是ph=7.0的pbs缓冲液。所述药物的制剂形式为液体剂型。
47.实施例5:
48.1.试验动物与试验设计:
49.将年龄相同,体重相近的36只c57bl/6j小鼠(购买自中国成都市达硕生物研究所)随机分为三组,试验开始前让它们在新环境中进行一周的适应,适应期间使用基础日粮和普通饮用水进行饲喂。三个组的处理如下:第一组小鼠置于低压氧仓内,正常饲喂,作为高原组(ha组);第二组小鼠同样在低压氧仓内饲养,组内小鼠每天灌胃0.2ml约氏乳杆菌yh1136菌液(108cfu/ml),作为高原益生菌组(hap组);最后一组作为对照组(c组),在正常气压状态(约94.5kpa)下进行饲喂。低压氧仓内的低压水平维持在40-45kpa左右以模拟海拔4000m的气压环境,温度和湿度与舱外一致。ha组和hap组在低压氧仓中饲喂14天,每天打开一次氧仓(1h)进行灌胃并补给水和食物。所有动物实验均按照四川农业大学委员会批准的《实验动物饲养和使用指南》(批准号:syxkchuan2019-187)进行。所有动物均在四川农业大学动物微生态研究中心动物房饲养,昼夜循环12个小时。
50.2.菌株的培养以及菌悬液的制备方法:
51.实验菌株为约氏乳杆菌yh1136(lactobacillus johnsonii yh1136)。yh1136已在治疗和预防非酒精性脂肪肝,肉鸡坏死性肠炎等病理过程中被证实具有较好的治疗效果。但目前未关于约氏乳杆菌yh1136治疗高原缺氧环境所致肠道粘膜损伤的研究与应用报道。将菌种活化后接种于灭菌的mrs液体培养基中37℃培养24h后进行活菌计数。然后将菌液分装,3000r/min,4℃离心15min,弃上清液收集菌体。用ph7.0的pbs缓冲液重悬至初始体积,混匀后再次离心15min,重复两次。最后将菌体重悬在pbs缓冲液中,根据活菌计数结果,将菌液浓度调整至108cfu/ml,4℃保存备用。
52.3.样品采集:
53.在第15天随机从每个组中选择6只小鼠脱颈处死。分离肠段并收集0.5cm的回肠片段,用冷的depc清洗后存储在液氮中,-80℃保存备用。
54.4.评价小鼠肠道损伤状况:
55.在处死小鼠之前使用眼眶采血的方法采集0.5-1ml血液。然后将血液放在4℃冰箱30min,取出后使用离心机以2000xg的转速4℃离心20min。离心后用无酶枪头吸出血清-30℃保存。使用elisa试剂盒(上海酶联生物)检测血清中d-乳酸和dao的含量。
56.5.mirna测序及分析:
57.提取样品rna然后送往生物公司进行测序以获得原始数据。然后进行mirna的差异表达分析,并进一步对筛选出来的差异表达mirna进行靶基因预测,go功能分析以及kegg通路分析。通过分析补充益生菌的hap组与高原暴露组ha组之间存在显著差异的mirna所靶向的基因及其功能,以明确益生菌约氏乳杆菌yh1136如何通过调控mirna的表达情况在高原缺氧所致肠道损伤过程中发挥抑制作用。
58.实验结果:
59.1.评价小鼠肠道屏障损伤:
60.我们使用elisa试剂盒检测了小鼠血清中d-乳酸和dao(二胺氧化酶)的水平。血清
中的d-乳酸和dao含量通常被用来评价肠道屏障功能,当肠粘膜受到损伤或通透性升高时,肠道中细菌产生的大量d-乳酸和dao通过受损粘膜进入血液,使血液中d-乳酸和dao的含量升高。因此通过测定血液中d-乳酸和dao的水平,可一定程度反应肠粘膜的损伤情况和通透性的变化。结果如图1所示,图中*表示,差异显著p<0.05;**表示p<0.01;***表示p<0.001,ns即not significant,表示差异不显著。ha组血清中的d-乳酸和dao水平显著高于c组与hap组,并且hap组与c组之间两种物质的水平无显著差异。这提示高原环境可能会提高小鼠肠粘膜通透性或者对肠道屏障产生损伤,而使用约氏乳杆菌yh1136进行防治可以一定程度缓解这些影响。
61.2.已知mirna的差异表达分析:
62.根据各样品中mirna的表达量数据,采用deseq(version 1.18.0,anders s和huber w,2010)对mirna进行差异表达分析,并按照表达量的倍数差异(|log2foldchange|>1)和表达差异显著性(p-value<0.05)筛选出差异表达的mirna。各组两两对比的差异表达mirna结果如图2所示。其中对照组与高原组之间进行比较共筛选到22个差异表达mirna,分别为11个上调表达(即高原组的表达量高于对照组,后面表述相同)和11个下降表达(高原组的表达量低于对照组);对照组与高原益生菌组之间进行共筛选到9个差异表达mirna,其中4个上调表达,5个下降表达;高原组与高原益生菌组之间比较共筛选到13个差异表达mirna,其中8个上调表达,5个下降表达。所有差异表达mirna如表1,表2以及表3所示。结合实验的目标,我们接下来以对照组与高原组和高原组与高原益生菌组的差异表达mirna为重点进行后续的分析。
63.表1高原组与高原益生菌组差异表达mirna(上调表达表示前者高于后者,即该mirna在ha组中的表达量高于hap组的,下降表达则相反,下表同。)
[0064][0065]
表2对照组与高原组差异表达mirna
[0066][0067][0068]
表3对照组与高原益生菌组差异表达mirna
[0069][0070]
3.mirna靶基因预测及功能分析:
[0071]
作为生物过程的重要调节者,mirna利用其靶基因发挥调节作用。mirna主要通过互补配对结合到靶位点,我们使用miranda以小鼠mrna的3’utr序列为目标序列,对差异表达的mirna序列进行靶基因预测。根据go富集的结果,通过富集因子(rich factor)、fdr value以及在该go项上富集的靶基因数量来评价富集程度。富集因子越大,富集程度越高。fdr取值0-1,越接近0表示富集作用越显著。总共有36个mirna比对到靶基因,预测到的靶基因数是14753。然后使用topgo对预测到的基因进行go富集分析,分析时利用go term注释的差异mirna靶基因对每个term的mirna靶基因列表和mirna靶基因数目进行计算,然后通过超几何分布方法计算p-value(显著富集的标准为p-value<0.05),找出与整个基因组背景相比,差异mirna靶基因显著富集的go term,从而确定差异mirna靶基因行使的主要生物学功能(图3)。由图3可以看到高原组与高原益生菌组的go分析显示,差异表达mirna的靶基因主要富集在细胞过程(cell process)、生物调节(biological process)、细胞过程调节(regulation of cell process)、生物过程调节(regulation of biological process)以及细胞对刺激的反应(cellular response to stimulus)。对照组与高原组的差异表达mirna的靶基因主要富集在细胞过程(cell process)、生物调节(biological process)、信号传导(signal transduction)。使用kegg数据库对靶基因在通路上的富集程度进行分析,同样使用富集因子、fdr值以及靶基因数量来评价富集程度。图4为fdr值最小的前20条kegg
通路。结果显示高原组与高原益生菌组的差异表达mirna靶基因主要富集在嗅觉转导(olfactory transduction)、癌症通路(pathways of cancer)、mapk信号通路(mapk signaling pathway)以及ampk信号通路(ampk pathway)中。对照组与高原之间的差异表达mirna靶基因主要富集在癌症通路(pathways of cancer)、mapk信号通路(mapk signaling pathway)、ampk信号通路(ampk signaling pathway)以及wnt信号通路(wnt signaling pathway)。可以看出,以mapk、wnt以及ampk信号通路为主的多个信号通路可能在高原缺氧环境诱导的肠道损伤中发挥作用,而益生菌的介入可能经多个通路进行调控。mapk即丝裂原活化蛋白激酶(mitogen-activated protein kinase)是一类能被不同的细胞外刺激(细胞因子、神经递质、激素、应激等)激活的丝氨酸-苏氨酸蛋白激酶,是信号从细胞表面传导到细胞核内部的重要传递者。wnt信号通路是一个复杂的蛋白质作用网络,多在胚胎和癌症中发挥作用,但也参与细胞的正常生理过程。研究发现,wnt通路是肠道上皮细胞增殖的一个关键调节因子。wnt/β-catenin是肠粘膜中的一个关键调节途径,是一类典型的wnt信号通路,在这项通路中wnt和r-spondin家族配体通过抑制多蛋白破坏复合物诱导转录辅因子β-连环蛋白的稳定。β-连环蛋白与转录因子/淋巴增强子(tcf/lef)型转录因子一起,驱动促进干细胞特性和细胞周期进展的靶基因的表达。mahurkar-joshi等人对肠应激综合征(ibs)以及健康对照(hc)的差异表达mirna进行了分析。结果发现ibs中的mir-219a-5p和mir-338-3p水平降低,抑制mir-219a-5p导致蛋白酶体/屏障功能基因的表达改变,可增强肠上皮细胞的通透性,此外mir-338-3p的抑制可导致mapk信号通路基因的改变。ampk(adenosine 5
‘‑
monophosphate(amp)-activated protein kinase)即amp依赖的蛋白激酶,是生物能量代谢调节的关键分子,负责监管细胞的能力输入与输出,维持细胞生理活动的平稳运转。同时ampk也是作为一个参与多种信号传导通路的关键蛋白。long等人的研究指出mir-122在非酒精性脂肪性肝病(nafld)中上调表达,在进一步的研究中发现敲低mir-122表达可以上调sirt1蛋白的表达并能够激活ampk通路来抑制脂肪生成,在nafld过程中发挥保护作用。
[0072]
我们对高原组与高原益生菌组的差异表达mirna进行了分析,结果显示mmu-mir-122-5p(序列为uggagugugacaaugguguuug)这个mirna在两个组中均有较高的表达量(gy 158.23,gyp 65.77),在高原益生菌组中显著低于高原组。通过对mmu-mir-122-5p这个具体的mirna进行靶基因预测,我们发现其主要的靶基因为slc25a34、aldoa以及vamp3等。其中aldoa是编码果糖二磷酸醛缩酶的基因,在研究中已经发现aldoa可以通过监测糖酵解的通量来控制nlrp3经典激活过程中的ampk激活,从而维持炎症小体的激活,造成线粒体的损伤。图4中高原组与高原益生菌组的kegg分析结果显示,靶基因在ampk通路中也存在富集,这提示两组之间的差异表达mirna即mir-122-5p可能通过ampk通路对缺氧环境所致的肠粘膜损伤,炎症反应等发挥调控作用。
[0073]
由此我们得到结论:益生菌约氏乳杆菌yh1136对高原缺氧所致的肠道屏障损伤具有保护作用;约氏乳杆菌yh1136可抑制mir-122-5p的表达,使其表达量降低,进一步靶向aldoa基因在ampk信号通路在发挥作用。
[0074]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保
护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1