一种多功能核酸纳米组装体及其制备方法
一种多功能核酸纳米组装体及其制备方法
1.本案是针对申请号为“202010916184.1”,申请日为2020/09/03,申请名称为“一种多功能核酸纳米组装体及其制备方法”的中国专利提出的分案申请。
技术领域
2.本发明涉及生物医药领域,特别涉及一种多功能核酸纳米组装体及其制备方法。
背景技术:
3.核酸药物又称核苷酸类药物,是各种具有不同功能的寡聚核糖核苷酸(rna)或寡聚脱氧核糖核苷酸(dna),主要在基因水平上发挥作用。一般认为,核酸药物包括aptamer、抗基因(antigene)、核酶(ribozyme)、反义核酸(antisencenucleic acid)、rna干扰剂。由于其具有特异性针对致病基因,也就是说具有特定的靶点和作用机制,因此,核酸药物,特别是小核酸药物在生物诊断和治疗领域展现出优异的应用前景。功能核酸和功能小分子,特别是一些化疗药的协同使用,正成为目前临床的重要研究方向。
4.然而由于功能核酸多为短的单链核酸,sirna为双链结构,它们很难和功能分子,特别是化疗药物直接组装(比如化疗药盐酸阿霉素,顺铂只能嵌插在核酸中),但是为了实现协同作用又不得不对其协同递送。因此,恰当的载体成为核酸和功能小分子递送的首选。载体通过正负电吸引,亲疏水转换与核酸结合,进一步将功能核酸递送至体内。阳离子聚合物、疏水材料、脂质体、有机介孔硅、酸响应的或谷胱甘肽响应的材料正变成递送载体。但是载体毒性以及低的装载效率也限制了其效果。
5.目前为止有报道的小分子和功能核酸直接组装的现有技术(self-assembled and size-controllable oligonucleotide nanospheres for effectiveantisense gene delivery through an endocytosis independent pathway)有利用硫醇单体和核酸自组装形成纳米颗粒。但是硫醇单体毒性太大,体内应用效果较差。已有报道(a biomimetic coordination nanoplatform for controlled encapsulation and delivery ofdrug
–
gene combinations)利用fe
2+
和核酸组装形成纳米颗粒,但是其稳定性太差,在pbs中10min就发生降解。
6.基于目前核酸药物的制备方法手段单一、方法特定、负载率低和稳定性差的技术问题,严重限制了核酸药物的应用。因此,需要开发一种可扩展性、通用性强的自组装工程系统,实现任意类型的分子,特别是功能性小分子,和功能核酸直接自组装成纳米结构。
技术实现要素:
7.有鉴于此,本发明提供了一种多功能核酸纳米组装体及其制备方法。该多功能核酸纳米组装体的制备方法简单、绿色、温和且成本低廉。
8.为了实现上述发明目的,本发明提供以下技术方案:
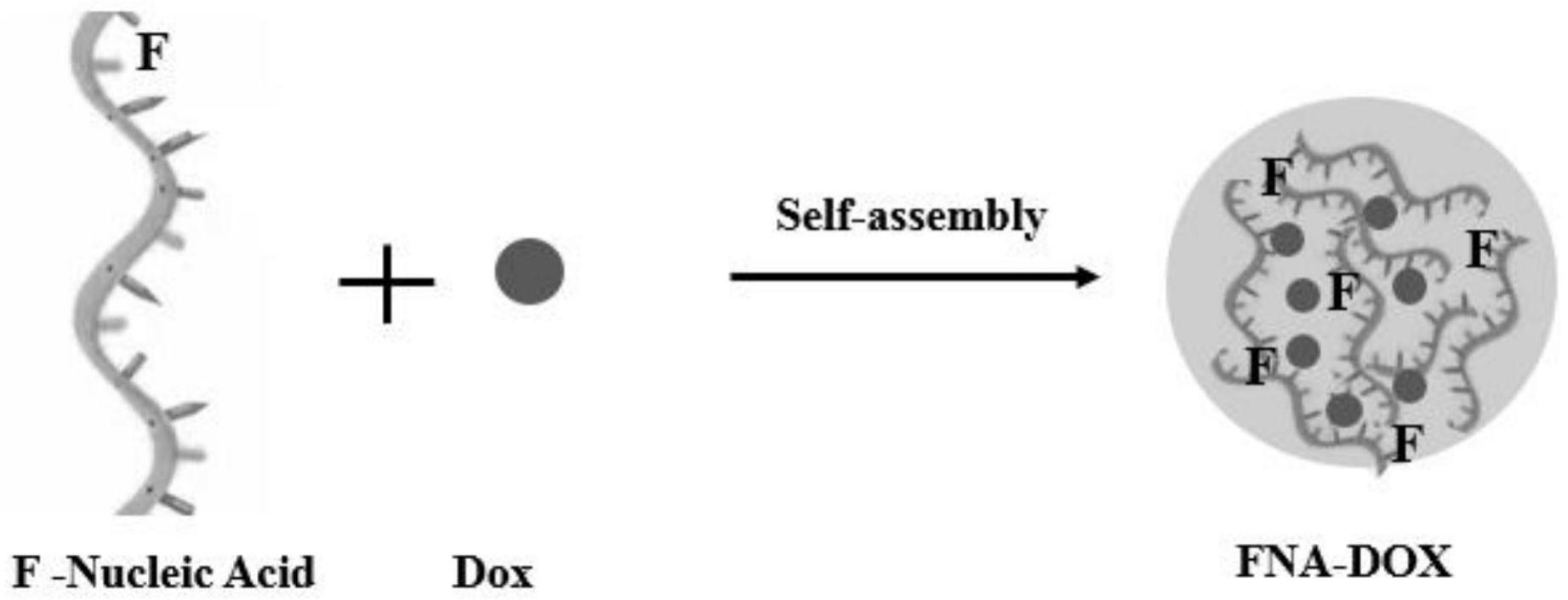
9.本发明提供了一种多功能核酸纳米组装体的制备方法,该制备方法包括:以氟(f)修饰的功能核酸与功能分子为原料,在水溶液中自组装成多功能核酸纳米组装体。
10.氟修饰的核酸由于其可以提高核酸的稳定性,广泛的应用在核酸适配体、g-四链体。氟原子作为极性最强的原子,可以显著的改变核酸的物理化学性质。氟修饰的核酸能够破坏碱基之间的氢键结合,逆转核酸的空间结构,增加核酸的活性位点,从而提高核酸的组装能力。本发明中,以氟修饰的降低细胞耐药性的功能核酸p-gp(fna)为原料,进一步通过分子静电引力、分子堆叠以及水桥的作用,与功能分子自组装形成功能核酸纳米药物,实现了与化疗药、金属离子、稀土离子、多肽、荧光分子和糖类等功能小分子的直接、高装载率组装。本发明克服传统核酸纳米结构制备的限制,展现了一种简单的、通用的实现任意核酸和多功能小分子直接组装,从而对开发制备具有不同功能、新型核酸药物具有重要的科学意义。
11.在本发明中,氟修饰的功能核酸没有限制,所有类型的,随机序列的,任意单链或者双链均核酸满足要求。作为优选,氟修饰的功能核酸中的核酸为sirna、mrna、反义核酸、寡聚核苷酸或dna中的一种或几种。
12.在本发明提供的具体实施例中,氟修饰的功能核酸中的核酸为反义核酸p-gp。
13.在本发明中,本发明氟修饰在碱基中五元糖环的2’位置,但是氟原子在碱基上的修饰位置,以及修饰个数没有限制。任意位置、任意个数以及核酸衍生物修饰f均满足要求。
14.在本发明中,功能分子没有限制,任意类型的化合物、离子、小分子化疗药均可以实现组装。作为优选,功能分子为小分子化疗药、荧光分子、稀土离子、金属离子、糖类、多肽、聚集诱导荧光分子。
15.在本发明提供的具体实施例中,金属离子为铁离子,稀土离子为yb
3+
,小分子化疗药为盐酸阿霉素(dox),荧光分子为光敏剂ce6或光热分子吲哚菁绿(icg),糖类为甘露糖(mannose),多肽为毒蜂素(melittin),聚集诱导荧光分子为tetraphenyl ethylene(aie)。
16.作为优选,氟修饰的功能核酸与功能分子的摩尔质量比为1:25~1:300。
17.作为优选,该制备方法具体包括如下步骤:
18.(1)将氟修饰的功能核酸溶解在水中,得到氟修饰的功能核酸原液;
19.(2)将功能分子溶解在水中,得到功能分子原液;
20.(3)将氟修饰的功能核酸原液与功能分子原液混合均匀,置于金属浴中,90~100℃反应0.1~1.5h;
21.(4)将反应产物离心,水洗,制备得到多功能核酸纳米组装体。
22.作为优选,氟修饰的功能核酸原液的摩尔浓度为50~200μm。
23.在本发明提供的具体实施例中,氟修饰的功能核酸原液的摩尔浓度为100μm。
24.作为优选,功能分子原液的浓度为5~25mm。
25.在本发明提供的具体实施例中,功能分子原液的浓度为10~20mm。
26.作为优选,步骤(3)中反应条件为:95℃反应10min。
27.作为优选,离心转速为5000~10000rpm,时间为4~6min。
28.在本发明提供的具体实施例中,离心转速为8000rpm,时间为5min。
29.本发明还提供了由上述制备方法制得的多功能核酸纳米组装体。
30.本发明提供了一种多功能核酸纳米组装体及其制备方法。该制备方法包括:以氟(f)修饰的功能核酸与功能分子为原料,在水溶液中自组装成多功能核酸纳米组装体。本发明具有的技术效果如下:
31.本发明提供的一种简单通用的氟修饰功能核酸药物的制备方法。由于氟原子的特殊性使得核酸结构活性位点、空间结构发生改变。因此,氟修饰的核酸可以实现与多种类型的分子实现直接组装形成一系列的纳米结构(图1)。该方法简单、原料易得,不添加任何载体,具有广泛的通用性,所得纳米结构具有较高的稳定性和装载效率。作为一种通用方法,本发明为新型核酸药物的制备发展提供了良好的参考;
32.本发明提供的纳米颗粒无毒无害,不涉及任何有机溶剂;
33.本发明提供的纳米颗粒稳定性高,可以在体内良好的循环,富集在目标区域;
34.本发明制备多功能核酸纳米组装体的方法简单、绿色、温和且成本低廉。
附图说明
35.图1为本发明中氟修饰的核酸构建多功能核酸纳米组装体的反应流程图;
36.图2为实施例以氟修饰的反义核酸p-gp(fna)为模型,功能小分子为盐酸阿霉素dox,制备的fna-dox纳米结构的透射电镜图(a)、扫描电镜(b)、电位变化图(c)和粒径分布图(d);
37.图3为实施例制备的一系列核酸/功能分子纳米结构:
38.铁离子/氟修饰核酸(fe
2+-fna),
39.稀土离子/氟修饰核酸(yb
3+-fna),
40.盐酸阿霉素/氟修饰核酸(dox-fna),
41.光敏剂ce6/氟修饰核酸(ce6-fna),
42.光热分子吲哚菁绿icg/氟修饰核酸(icg-fna),
43.糖类甘露糖mannose/氟修饰核酸(mannose-fna),
44.多肽毒蜂素melittin/氟修饰核酸(melittin-fna),
45.聚集诱导荧光aie/氟修饰核酸(aie-fna);
46.图4为实施例制备的fe
2+
和未修饰核酸(fe-dna)以及fe
2+
和氟修饰核酸(fe-fna)形成纳米颗粒的稳定性研究,显示了不同的纳米颗粒在磷酸缓冲溶液中的降解情况;
47.图5示实施例制备的不同纳米颗粒装载效率。
具体实施方式
48.本发明公开了一种多功能核酸纳米组装体及其制备方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
49.本发明提供的多功能核酸纳米组装体及其制备方法中所用核酸药物、功能分子或仪器等均可由市场购得。
50.下面结合实施例,进一步阐述本发明:
51.实施例1
52.原始序列:atccatcccgacctcatccatcccgacctc;
53.f修饰序列(fna):/i2fa/tccatcccgacctcatccatcccgacctc。
54.fna购买于上海生工。
55.实施例2 dox-fna的制备
56.本实施例中核酸药物dox-fna的制备方法如下:
57.(1)向10od的fna中加入527μl的无菌水,避光、室温条件下吹打,使核酸分散均匀,形成100μm的原液,避光-20℃保存。
58.(2)室温避光条件下,将57.9mg的盐酸阿霉素(dox)分散在10ml的二次水中,充分分散均匀,得到10mm的盐酸阿霉素原液,避光保存。
59.(3)将5μl的fna,5μl的dox和20μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
60.(4)将样品取出,8000rpm离心5min,二次水洗两次。
61.图2为本实施例制备的核酸药物dox-fna的透射电镜(a)、扫描电镜图(b)、电位变化图(c)及粒径分布图(d)。从图中可以观察到,fna和dox复合形成的纳米颗粒尺寸均匀,其粒径集中分布在200nm,纳米颗粒的表面电荷为-13.7mv。
62.实施例3 fe
2+-fna的制备
63.(1)将12μl的100μm的fna,2μl的20mm的fecl2和26μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
64.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到fe
2+-fna纳米球。
65.实施例4 yb
3+-fna的制备
66.(1)将5μl的100μm的fna,5μl的20mm的ybcl3和50μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
67.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到yb
3+-fna纳米球。
68.实施例5 dox-fna的制备
69.(1)将5μl的100μm的fna,5μl的10mm的dox和20μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
70.(1)将样品取出,8000rpm离心5min,二次水洗两次。得到dox-fna纳米球。
71.实施例6 ce6-fna的制备
72.(1)将5μl的100μm的fna,5μl的20mm的ce6和15μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
73.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到ce6-fna纳米球。
74.实施例7 icg-fna的制备
75.(1)将5μl的100μm的fna,5μl的20mm的icg和25μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
76.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到icg-fna纳米球。
77.实施例8 mannose-fna的制备
78.(1)将5μl的100μm的fna,15μl的10mm的mannose和50μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
79.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到mannose-fna纳米球。
80.实施例9 melittin-fna的制备
81.(1)将5μl的100μm的fna,10μl的10mm的melittin和30μl的二次水充分混合,然后
置于金属浴,95℃反应10min,冷却至室温。
82.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到melittin-fna纳米球。
83.实施例10 aie-fna的制备
84.(1)将5μl的100μm的fna,10μl的10mm的aie和15μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
85.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到aie-fna纳米球。
86.试验例1
87.图3为实施例3-9制备的一系列的功能分子/核酸纳米结构,得到的纳米粒子形貌均匀。一系列纳米结构的粒径fe
2+-fna为200nm,yb
3+-fna为500nm,dox-fna为500nm,ce6-fna为220nm,icg-fna为150nm,mannose-fna为200nm,melittin-fna为100nm,aie-fna为40nm。
88.试验例2
89.本试验例检测了实施例3制备的fe-fna纳米颗粒及对照fe-dna纳米颗粒在血清中孵育不同时间的稳定性。
90.其中,fe-dna的制备方法为:
91.(1)将12μl的100μm的dna,2μl的20mm的fecl2和26μl的二次水充分混合,然后置于金属浴,95℃反应10min,冷却至室温。
92.(2)将样品取出,8000rpm离心5min,二次水洗两次。得到fe
2+-dna纳米球。
93.图4为实施例3制备的fe-dna和fe-fna纳米颗粒在血清中孵育不同时间的tem图。从图中观察到,24h的孵育时间后,fe-fna仍然保持完整的形貌。可见,f修饰的核酸组装体具有较高的稳定性。
94.试验例3
95.图5为实施例中制备的不同纳米颗粒装载效率的数据,从图中观察到,核酸和小分子的装载量达到80%以上。展现出较高的装载效率。
96.综述所述,本发明提供了一种简单通用的氟修饰功能核酸药物的制备方法。首次在技术上突破了核酸纳米结构组装的限制,实现了任意核酸和任意分子的直接共组装。方法操作简单,所制备的纳米结构装载率高,稳定性好。易于商业和临床的转化。
97.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1