治疗肝癌索拉非尼耐药的联合用药组合物及其用途的制作方法
23,二者联用能够产生更好的抗肿瘤效果,索拉非尼能够逆转索拉非尼耐药性,显著抑制索拉非尼耐药细胞增殖及集落形成,并促进耐药细胞发生凋亡。
10.本发明第二方面提供第一方面所述的药物组合物在制备治疗肝癌的药物中的用途。
11.采用本发明的药物组合物,特别是针对对索拉非尼产生耐药的组织或个体,联合用药能够显著抑制耐药细胞的增殖和克隆形成,促进细胞凋亡。因此,采用本发明的药物组合物能够用于制备治疗肝癌的药物。
12.本发明第三方面提供nf-kb抑制剂在制备索拉非尼耐药性逆转剂中的用途。
13.根据本发明的实施方案,所述nf-kb抑制剂为jsh-23。
14.本发明第四方面提供nf-kb抑制剂在逆转索拉非尼耐药性中的用途。根据本发明的实施方案,所述nf-kb抑制剂为jsh-23。
15.nf-kb抑制剂jsh-23不仅能够逆转索拉非尼耐药性,并且二者联合用药时,可明显降低两者的有效药物浓度,提高抗肿瘤疗效。
16.本发明第五方面提供nf-kb抑制剂在抑制索拉非尼耐药肝癌细胞增殖、细胞集落形成中的用途。
17.根据本发明的实施方案,所述nf-kb抑制剂为jsh-23。
18.本发明第六方面提供nf-kb抑制剂在促进索拉非尼耐药肝癌细胞凋亡中的用途。
19.根据本发明的实施方案,所述nf-kb抑制剂为jsh-23。
20.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
21.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
22.图1显示了hepg2sr细胞筛选过程及形态变化;a图显示了hepg2p细胞经过多轮索拉非尼诱导,获得hepg2sr细胞过程中索拉非尼浓度变化及时间轴;b图显示了hepg2p细胞和hepg2sr细胞的形态差异;
23.图2显示了hepg2p及hepg2sr细胞增殖实验ic
50
检测结果;
24.图3显示了hepg2p及hepg2sr细胞集落形成实验结果,a图显示了hepg2p及hepg2sr细胞应用药物处理48小时后集落形成结果,b图显示了imagej软件进行集落形成定量比较,***p<0.001,****p<0.0001;
25.图4显示了采用流式细胞术检测索拉非尼对hepg2p及hepg2sr细胞凋亡的影响,其中,a图显示了索拉非尼处理hepg2p及hepg2sr细胞,48小时后采用流式细胞术检测的细胞凋亡情况,b图显示了不同组别细胞凋亡统计分析结果,**p<0.01;
26.图5显示了jsh-23与索拉非尼在hepg2sr细胞中的联合作用的细胞增殖实验结果,其中a图显示了基于s型曲线分析不同用药组的ic
50
值,b图显示了不同用药组的细胞活性;
27.图6显示了jsh-23、索拉非尼单独应用和二者联合应用对hepg2sr细胞集落形成的影响,a图显示了不同组别的细胞集落,b图显示了不同组别处理后,细胞集落的统计分析
结果,****p《0.0001;
28.图7显示了采用流式细胞术检测不同药物处理组hepg2 sr细胞凋亡情况,a图显示了流式细胞术检测细胞凋亡结果,早期凋亡细胞位于图中右下象限,晚期凋亡细胞位于图中右上象限;b图显示了不同组别处理后,细胞凋亡统计分析结果,**p《0.01;
29.图8显示了western blot检测不同处理组sox9表达水平。
具体实施方式
30.下面参考具体实施例,对本发明进行描述,需要说明的是,这些实施例仅仅是描述性的,而不以任何方式限制本发明。
31.实施例的实验中所用到的试剂,如无特殊说明,均可通过市售获得。
32.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本公开的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
33.根据本发明一个具体的实施方案,本发明提供一种药物组合物,含有jsh-23和索拉非尼。
34.根据本发明一个具体的实施方案,所述药物组合物中除了包含作为活性成分的jsh-23 和索拉非尼,也可以含有其他的本领域已知的药物中能够加入的辅料。
35.根据本发明一个具体的实施方案,本发明所述的药物组合物包括将jsh-23与索拉非尼混合形成一种混合药物,也包括jsh-23与索拉非尼独立形成两种药物,只是在施用的时候,进行联合用药。
36.本技术的发明人为了解决索拉非尼耐药性的问题,创造性的发现,将nf-kb抑制剂 jsh-23与索拉非尼联合施用,其中的jsh-23能够显著逆转索拉非尼耐药性,主要通过 jsh-23抑制sox9表达,从而逆转索拉非尼耐药性。联合用药可以显著抑制索拉非尼耐药细胞增殖及集落形成,并促进耐药细胞发生凋亡,有效逆转肝癌索拉非尼耐药。发明人发现,
37.根据本发明的实施方案,所述药物组合物中jsh-23和索拉非尼的摩尔比为4:(0.4-4)。
38.根据本发明的实施方案,所述药物组合物中jsh-23和索拉非尼的摩尔比为4:(1-2)。。由此能够进一步抑制索拉非尼耐药细胞增殖及集落形成,促进耐药细胞发生凋亡。
39.根据本发明优选的实施方案,在药物组合物中,例如jsh-23浓度为40μm,索拉非尼浓度为10μm或者20μm。
40.根据本发明一个具体的实施方案,本发明提供所述的药物组合物在制备治疗肝癌的药物中的用途。该药物组合物不仅能够用于治疗肝癌,特别用于针对对索拉非尼产生耐药的组织或个体,能够显著抑制耐药细胞的增殖和克隆形成,促进细胞凋亡。
41.在本发明中,“hepg2 sr细胞是指”hepg2 sorafenib resistance(hepg2 sr),即索拉非尼耐药细胞。
42.下面将结合实施例对本公开的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本公开,而不应视为限定本公开的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪
器未注明生产厂商者,均为可以通过市购获得的常规产品。
43.实施例1制备索拉非尼耐药的稳定肝癌细胞系hepg2 sr
44.1、诱导获取索拉非尼耐药的hepg2 sr肝癌细胞系
45.历经4个月逐渐增加索拉非尼药物剂量的诱导,hepg2索拉非尼耐药(hepg2 sorafenibresistance,hepg2 sr)细胞可耐受的索拉非尼浓度为10μm;随后应用含有索拉非尼(浓度为5μm)的培养基(dmem培养基)维持培养hepg2 sr细胞3个月。hepg2 sr细胞的筛选过程如图1中a图所示。同原始细胞(hepg2 p)相比,hepg2 sr细胞形态发生变化,主要表现为呈现梭形改变,细胞容易聚集,细胞形态如图1中b图所示。
46.2、检测hepg2 sr细胞的抗药性
47.(1)通过细胞增殖实验(mtt)检测上述1中获得的hepg2 sr细胞的抗药性,48 小时mtt检测结果显示,hepg2 p细胞的索拉非尼ic
50
值为10.55
±
1.03μm,而hepg2 sr 细胞的索拉非尼ic
50
值为22.01
±
1.03μm,两者ic
50
差别有统计学意义(p<0.05)(图2)。 ic
50
为半抑制浓度,即(half maximal inhibitory concentration,ic
50
),它是指使细胞活性降至50%时药物浓度。
48.细胞增殖实验过程如下:
49.取处于对数生长期的细胞,应用胰蛋白酶进行消化,终止消化后离心收集细胞,制备成单细胞悬液。应用细胞计数板计数后,将细胞浓度调整成4
×
104个/ml。将上述细胞悬液制备好后混匀,96孔板中每孔加入100μl,即4000个细胞/孔,放置在细胞培养箱中培养过夜(37℃、5%co2)。此过程中,96孔板边缘孔不加细胞,加入pbs,减少液体蒸发对细胞增殖的影响。次日,弃掉上述培养基,分别加入不同浓度梯度的药物后,继续培养48 小时。48小时后,弃上述培养基后,加入mtt工作液(工作终浓度为5mg/ml),继续孵育4小时。4小时后弃掉上述液体,每孔加入100μl dmso,孵育10分钟后,使底部结晶物质充分溶解后,在多功能微孔板检测仪上进行检测,检测波长为490nm测量od值。整个过程中,空白对照组(不加入细胞组)进行同样操作,每个梯度重复孔≥3个。计算细胞活性(%)=(实验组od值-空白对照组od值)/(不加药组od值-空白对照组od值)
×
100%。
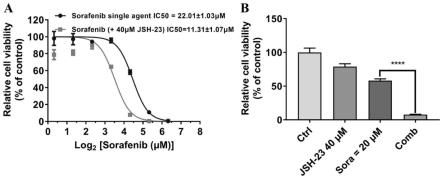
50.(2)评估hepg2 sr细胞的集落形成能力
51.通过集落形成实验评估hepg2 sr细胞的集落形成能力。结果表明,在无药的培养基中hepg2 p细胞集落形成能力较hepg2 sr细胞弱,但是hepg2 p细胞形成单集落面积大; hepg2 p细胞经过索拉非尼药物(5μm,10μm)处理48小时后,其集落形成能力随着药物浓度的增加逐渐减弱,尤其是经过10μm索拉非尼药物处理后,其集落形成能力极低;然而hepg2 sr细胞经过索拉非尼(5μm,10μm)处理48小时后,其集落形成能力几乎不受影响(图3中a和b图)。
52.集落形成实验方法如下:
53.取处于对数生长期细胞,应用胰蛋白酶消化,终止消化后离心收集细胞,制成细胞悬液。应用6孔板,每孔加入3000个细胞,放置在细胞培养箱(37℃、5%co2)中培养过夜。次日弃掉培养基后,更换成含有不同浓度药物的培养基,继续培养72小时。72小时后至2周时间段内,更换为不含药培养基,间隔周期为3天/次。至2周后,肉眼可见集落形成,去掉培养基,pbs清洗2次后,应用甲醇固定20分钟,0.1%结晶紫染色10分钟,相机拍照后,应用image j软件进行集落计数。
54.(3)流式细胞术评估hepg2 sr细胞的抗凋亡能力
55.应用流式细胞术进行细胞抗凋亡能力检测。结果显示:hepg2 p细胞经过索拉非尼10 μm及20μm药物处理48小时后,其凋亡率分别为10.48%和25.57%;而hepg2 sr细胞经过索拉非尼处理48小时后,其凋亡率分别为2.72%和12.35%(图4中a图)。进一步进行统计分析,结果显示两组细胞在索拉非尼10μm及20μm处理48小时后,其凋亡率差异有统计学意义(图4中b图)。
56.流式检测细胞凋亡实验如下:
57.取处于对数生长期的细胞,弃培养基、pbs清洗后,应用胰蛋白酶消化,终止并制备细胞悬液后计数;于6孔板中接种细胞,细胞密度为200,000个/孔,放入细胞培养箱(37℃、 5%co2)中培养过夜。次日,弃前一日培养基后加入含有不同药物浓度的含药培养基,继续孵育48小时。后续步骤如下:
58.①
培养结束后,应用pbs清洗细胞,用不含有edta胰酶消化后收集细胞于流式样品管中,1500g/min,5分钟;应用pbs清洗一次,继续重复离心一次;
59.②
弃上清,加入195μl annexin v-fitc结合液轻轻重悬细胞;
60.③
加入5μl annexin v fitc,轻轻混匀;
61.④
加入10μl碘化丙啶(pi)染色液,轻轻混匀;
62.⑤
室温避光孵育15分钟,进行流式检测。每个样本至少分析50,000个细胞。
63.综上可知,经过长期的索拉非尼药物筛选后,hepg2 sr细胞ic
50
值明显上升,集落形成能力明显增强及抗凋亡能力增强,表明索拉非尼耐药细胞系建立成功。
64.实施例2细胞增殖实验评估jsh-23逆转hepg2 sr细胞的索拉非尼耐药
65.1、细胞增殖实验方法
66.取处于对数生长期的由实施例1获得的hepg2 sr细胞,应用胰蛋白酶进行消化,终止消化后离心收集细胞,制备成单细胞悬液。应用细胞计数板计数后,将细胞浓度调整成 4
×
104个/ml。将上述细胞悬液制备好后混匀,96孔板中每孔加入100μl,即4000个细胞/ 孔,放置在细胞培养箱中培养过夜(37℃、5%co2)。此过程中,96孔板边缘孔不加细胞,加入pbs,减少液体蒸发对细胞增殖的影响。次日,弃掉上述培养基,分别加入不同浓度梯度的药物后,继续培养48小时。48小时后,弃上述培养基后,加入mtt工作液(工作终浓度为5mg/ml),继续孵育4小时。4小时后弃掉上述液体,每孔加入100μl dmso,孵育10分钟后,使底部结晶物质充分溶解后,在多功能微孔板检测仪上进行检测,检测波长为490nm测量od值。整个过程中,空白对照组(不加入细胞组)进行同样操作,每个梯度重复孔≥3个。计算细胞活性(%)=(实验组od值-空白对照组od值)/(不加药组 od值-空白对照组od值)
×
100%。
67.2、实验分组和结果
68.细胞增殖实验分为两组,一组为单独应用索拉非尼(其浓度梯度分别为1.25、2.5、5.0、 10.0、20.0、40.0μm),另一组为索拉非尼基础上加用jsh-23(40μm)。如图5中的a图, 48小时细胞增殖实验结果表明,加用jsh-23后hepg2 sr细胞的ic
50
值由22.01
±
1.03μm 降至11.31
±
1.07μm。同时,图b中单独应用索拉非尼(20μm)时细胞活性为58.27%,单独应用jsh-23(40μm)时细胞活性为79.01%,然而,索拉非尼20μm联合jsh-23 40μm 时(联合用药组以comb表示)细胞活性降至7.87%,进一步进行统计学分析,差别有显著意义(p《0.0001),ctrl为未加入药物的对照组。
69.实施例3集落形成实验检测jsh-23对hepg2 sr细胞集落形成能力的影响
70.1、集落形成实验方法
71.取处于对数生长期hepg2 sr细胞,应用胰蛋白酶消化,终止消化后离心收集细胞,制成细胞悬液。应用6孔板,每孔加入3000个细胞,放置在细胞培养箱(37℃、5%co2) 中培养过夜。次日弃掉培养基后,更换成含有不同浓度药物的培养基,继续培养72小时。 72小时后至2周时间段内,更换为不含药培养基,间隔周期为3天/次。至2周后,肉眼可见集落形成,去掉培养基,pbs清洗2次后,应用甲醇固定20分钟,0.1%结晶紫染色10 分钟,相机拍照后,应用image j软件进行集落计数。
72.2、实验分组和结果
73.研究分为四组:对照组(ctrl)、索拉非尼(10μm)组、jsh-23(40μm)组、索拉非尼(10μm)联合jsh-23(40μm)组(comb)。按照上述分组药物处理方案处理hepg2 sr 细胞48小时,更换为不含药物的全培养基,继续培养至两周。图6中a图和b图结果表明,单独应用索拉非尼或jsh-23对集落形成无明显影响,但是索拉非尼联合jsh-23可显著抑制集落形成,差别有显著意义(p《0.0001)。
74.实施例4检测索拉非尼和jsh-23联合用药对hepg2 sr细胞凋亡的影响
75.1、流式检测细胞凋亡实验设计
76.取处于对数生长期的hepg2 sr细胞,弃培养基、pbs清洗后,应用胰蛋白酶消化,终止并制备细胞悬液后计数;于6孔板中接种细胞,细胞密度为200,000个/孔,放入细胞培养箱(37℃、5%co2)中培养过夜。次日,弃前一日培养基后加入含有不同药物浓度的含药培养基,继续孵育48小时。后续步骤如下:
77.①
培养结束后,应用pbs清洗细胞,用不含有edta胰酶消化后收集细胞于流式样品管中,1500g/min,5分钟;应用pbs清洗一次,继续重复离心一次;
78.②
弃上清,加入195μl annexin v-fitc结合液轻轻重悬细胞;
79.③
加入5μl annexin v fitc,轻轻混匀;
80.④
加入10μl碘化丙啶(pi)染色液,轻轻混匀;
81.⑤
室温避光孵育15分钟,进行流式检测。每个样本至少分析50,000个细胞。
82.2、实验分组和结果
83.本研究分为6组:对照组、jsh-23 40μm组、索拉非尼10μm组、索拉非尼20μm组、索拉非尼10μm联合jsh-23 40μm组(图7中以sora1+jsh-23表示)、以及索拉非尼20μm 联合jsh-23 40μm组(图7中以sora2+jsh-23表示)。处理48小时后,应用流式细胞术进行细胞凋亡检测。结果如图7所示,对照组的细胞凋亡率为0.92%,jsh-23组的细胞凋亡率为2.77%,索拉非尼10μm组细胞凋亡率为3.2%,索拉非尼20μm组细胞凋亡率为 11.76%;但是索拉非尼10μm联合jsh-23 40μm组以及索拉非尼20μm联合jsh-23 40μm 组其细胞凋亡率依次增加至7.44%和25.63%。进一步进行统计学分析,联合用药组与索拉非尼单药相比,凋亡细胞比值有显著差别(p《0.01)。
84.综上所述,本发明通过选取人肝癌细胞株hepg2,构建索拉非尼耐药细胞系,通过细胞增殖实验,观察联合用药对肿瘤细胞增殖的影响,并计算联合指数。结果显示,相比jsh-23 与索拉非尼的单独使用,联合用药可以显著抑制索拉非尼耐药细胞增殖及集落形成,并促进耐药细胞发生凋亡,有效逆转肝癌索拉非尼耐药。
85.实施例5 jsh-23降低sox9表达
86.如上述实施例2实验结果,体外细胞增殖实验(48小时)结果表明:jsh-23(nf-κb p65抑制剂)对hepg2 sr细胞增殖活性具有一定的抑制作用,当jsh-23浓度为40μm时,细胞活性为79.01%,jsh-23浓度为80μm时,细胞活性为59.43%。然后,分别应用不含药的培养基、jsh-23(40μm)和(或)索拉非尼(5μm)处理hepg2 sr细胞,进一步行 western blot检测,结果表明jsh-23与索拉非尼联合应用可以显著降低磷酸化nf-κb p65 水平,同时降低sox9表达。
87.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、“一些实施方案”或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
88.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1