抑制脂氧合酶表达量和/或活性的物质在降低心脏缺血再灌注损伤中的应用
1.本发明属于生物医学领域,具体涉及抑制脂氧合酶表达量和/或活性的物质在降低心脏缺血再灌注损伤中的应用。
背景技术:
2.急性心肌梗死的重要治疗手段是尽快恢复缺血心肌的血流灌注,然而临床研究发现,恢复血液灌注后部分心肌细胞的损伤反而加重,称之为心肌缺血再灌注损伤,在心血管疾病中心脏缺血再灌注损伤是一个预后较差的疾病,再灌注损伤过程中心肌细胞存在多种死亡方式如凋亡、坏死、自噬以及最近被报道的铁死亡。然而何种死亡方式在缺血再灌注的过程中发挥着最为重要的作用还不得而知。
3.铁死亡是一种最近被发现的铁依赖性的细胞程序性死亡方式,与以往发现的死亡方式有着明显的不同。发生铁死亡的细胞呈现出特殊的形态,主要包括细胞线粒体变小,膜密度增高,嵴断裂、减少等特点。造成细胞铁死亡的直接因素是脂质过氧化物的积累,最终导致细胞氧化性死亡。近年来文章报道,铁死亡在多种疾病中都发挥着重要的作用如肿瘤、神经系统、肾脏损伤、血液等。在心血管疾病中gao等人发现谷氨酰胺的分解是铁死亡的诱导因素之一,在离体心脏缺血再灌注损伤模型中,抑制谷氨酰胺分解能够减轻心脏损伤;fang等人发现在小鼠左前降支结扎造成的miri模型中,铁死亡抑制剂fer-1和铁离子螯合剂均可减小心梗面积并降低心脏纤维化程度;在最新的工作中,fang等人进一步发现,铁蛋白重链敲低可造成小鼠铁代谢失衡,在此基础上给予高铁饮食可造成小鼠心肌肥厚表型,该过程也可被铁死亡抑制剂所逆转。上述研究说明铁死亡过程可能成为心肌病的干预靶点。
4.花生四烯酸(aa)是体内最重要的n6多不饱和脂肪酸,是目前研究的热点之一。已有研究表明花生四烯酸的代谢产物在高血压、动脉粥样硬化、急性心梗等心血管疾病中发挥着重要的作用,但在缺血再灌注损伤中发挥关键作用的效应分子还有待研究。
技术实现要素:
5.本发明的目的是降低心脏缺血再灌注损伤。
6.本发明首先保护抑制脂氧合酶表达量和/或活性的物质和/或提高pgc1α表达量的物质在制备降低心脏缺血再灌注损伤的产品中的应用;
7.所述脂氧合酶为alox15和/或alox12。
8.抑制脂氧合酶表达量和/或活性的物质和/或提高pgc1α表达量的物质在制备减轻心肌细胞铁死亡的产品中的应用也属于本发明的保护范围;
9.所述脂氧合酶为alox15和/或alox12。
10.抑制脂氧合酶表达量和/或活性的物质和/或提高pgc1α表达量的物质在制备改善心脏缺血再灌注损伤导致的心脏功能障碍的产品中的应用也属于本发明的保护范围;
11.所述脂氧合酶为alox15和/或alox12。
12.上述应用中,所述改善心脏缺血再灌注损伤导致的心脏功能障碍可表现为降低心脏梗死面积、改善心室射血分数、改善短轴缩短率和/或减少心脏纤维化面积。
13.抑制脂氧合酶表达量和/或活性的物质和/或提高pgc1α表达量的物质在制备降低心肌细胞缺血再灌注损伤后早期和/或晚期存在的心脏功能障碍的产品中的应用也属于本发明的保护范围;
14.所述脂氧合酶为alox15和/或alox12。
15.上述任一所述的应用中,所述抑制脂氧合酶表达量和/或活性的物质可为抑制15-hpete表达的物质或抑制12-hpete表达的物质。
16.上述任一所述的应用中,所述抑制脂氧合酶表达量和/或活性的物质可为脂氧合酶抑制剂。
17.所述脂氧合酶抑制剂可为alox15特异性抑制剂ml351和/或alox12的特异性抑制剂ml355。
18.本发明还保护心肌alox15、心肌15-hpete、心肌alox12、心肌12-hpete和心肌pgc1α中的至少一种在制备降低心脏缺血再灌注损伤的产品中的应用;所述应用是通过心肌中抑制alox15的表达和/或活性、抑制15-hpete的表达、抑制alox12的表达和/或活性、抑制12-hpete的表达和/或心肌中过表达pgc1α实现的。
19.本发明还保护心肌alox15、心肌15-hpete、心肌alox12、心肌12-hpete和心肌pgc1α中的至少一种在制备减轻心肌细胞铁死亡的产品中的应用;所述应用是通过心肌中抑制alox15的表达和/或活性、抑制15-hpete的表达、抑制alox12的表达和/或活性、抑制12-hpete的表达和/或心肌中过表达pgc1α实现的。
20.本发明还保护心肌alox15、心肌15-hpete、心肌alox12、心肌12-hpete和心肌pgc1α中的至少一种在制备改善心脏缺血再灌注损伤导致的心脏功能障碍的产品中的应用;所述应用是通过心肌中抑制alox15的表达和/或活性、抑制15-hpete的表达、抑制alox12的表达和/或活性、抑制12-hpete的表达和/或心肌中过表达pgc1α实现的。
21.上述应用中,所述改善心脏缺血再灌注损伤导致的心脏功能障碍可表现为降低心脏梗死面积、改善心室射血分数、改善短轴缩短率和/或减少心脏纤维化面积。
22.本发明还保护心肌alox15、心肌15-hpete、心肌alox12、心肌12-hpete和心肌pgc1α中的至少一种在制备降低心肌细胞缺血再灌注损伤后早期和/或晚期存在的心脏功能障碍的产品中的应用;所述应用是通过心肌中抑制alox15的表达和/或活性、抑制15-hpete的表达、抑制alox12的表达和/或活性、抑制12-hpete的表达和/或心肌中过表达pgc1α实现的。
23.上述应用中,所述降低心肌细胞缺血再灌注损伤后早期和/或晚期存在的心脏功能障碍可表现为降低心脏梗死面积、改善心室射血分数、改善短轴缩短率和/或减少心脏纤维化面积。
24.上述应用中,所述早期是指缺血再灌注损伤后24小时内。所述晚期是指缺血再灌注损伤后24小时以后。
25.本发明对c57小鼠进行冠状动脉左前降支结扎30min然后解除结扎建成心脏缺血再灌注损伤模型。首先通过腹腔注射凋亡、坏死、自噬以及铁死亡抑制剂治疗模型鼠,发现
在再灌注早期凋亡和坏死抑制剂能够明显改善心脏功能,然而随时间延长铁死亡抑制剂的作用愈发明显。接下来同时检测细胞凋亡相关蛋白caspase3、铁死亡相关蛋白谷胱甘肽过氧化物酶4(gpx4)、长链脂酰辅酶a合成酶4(acsl4)、转铁蛋白(tfr)和半胱氨酸转运蛋白(slc7a11)以确定再灌注过程中细胞的主要死亡方式,发现抑制铁死亡的gpx4和slc7a11的表达随时间依赖而降低,相反促进铁死亡的acsl4和tfr的表达随时间依赖而升高,而caspase3在缺血再灌注后4h时表达最高24h后与假手术组无明显差异,表明在再灌注早期凋亡占据主要作用而随时间延长铁死亡占据主导地位。分别在再灌注30min、4h、12h、24h、7d后取心脏损伤部分进行类二十烷酸代谢组学分析,筛选出差异代谢产物,结果发现15脂氧合酶(alox15)代谢产物15-hete、13-hode、15-hepe的浓度随时间依赖的升高,其中15-hete升高的最显著。运用westernblot检测alox15的表达,发现alox15蛋白的表达水平在心脏中也是时间依赖性升高并且与受损心肌细胞共定位。为了探究alox15以及其代谢产物在缺血再灌注损伤中的作用,将心肌细胞特异性敲除alox15的小鼠(简称敲除alox15的小鼠)和野生型小鼠进行比较,与野生型小鼠相比敲除alox15的小鼠表现出明显的心肌细胞铁死亡降低,心脏功能改善。对小鼠腹腔注射特异性的alox15酶活性抑制剂ml351,然后进行心动超声检测小鼠心脏功能、ttc染色统计梗死面积、masson染色统计心脏纤维化程度,结果发现注射ml351之后小鼠射血分数明显得到改善,梗死面积与纤维化程度也得到明显减轻。此外,花生四烯酸通过alox15产生的初级代谢产物15-hpete发挥着触发心肌细胞铁死亡的作用。在分子机制上发现15-hpete通过促进pgc1α与e3泛素连接酶rnf34的结合从而加速其泛素化降解,导致线粒体形态与功能受损,进而引发铁死亡。通过过表达pgc1α能够有效减轻心肌细胞铁死亡的发生,这提示pgc1α是调控铁死亡的新靶点。由此可见,细胞凋亡与坏死在心脏缺血再灌注损伤早期发挥着主要作用,但随时间推移铁死亡发挥着更为重要的作用,其中alox15的表达持续升高使其代谢产物15-hpete大量积累诱导细胞发生铁死亡从而加重心脏损伤。通过腹腔注射ml351可以有效的降低心脏缺血再灌注损伤。本发明具有重要的应用价值。
附图说明
26.图1为心脏缺血再灌注损伤触发铁死亡。a为小鼠缺血30分钟后在再灌注4小时取小鼠心脏以及在再灌注24小时后取心脏,然后切下心脏左心室损伤区域(结扎线以下位置),利用western blotting检测gpx4和slc7a11以及tfr和acsl4总蛋白的表达水平。b为利用image j统计软件对蛋白进行定量分析(n=5,*p《0.05)。数据显示为means
±
sem,one-wayanova,单因素方差分析。c为小鼠缺血30分钟后在再灌注24小时后取心脏然后进行冰冻切片免疫荧光染色,利用image pro-plμs软件对荧光强度进行实时定量分析。标尺20μm,(n=6)。d为利用prism软件对荧光强度进行定量统计分析(n=6,**p《0.01),数据显示为means
±
sem,未配对双尾t检验。
27.图2为心脏缺血再灌注早期触发心肌细胞凋亡。小鼠缺血30分钟在再灌注4小时以及24小时后取心脏,然后切下心脏左心室损伤区域(结扎线以下位置),利用western blotting检测cleaved-caspase3蛋白水平(n=6,*p《0.05,one-way anova单因素方差分析)。
28.图3为铁死亡在再灌注晚期发挥主导作用。a为手术前24小时腹腔注射多种细胞死
亡抑制剂,在再灌注4小时,24小时,3天,7天时进行实验。b为取小鼠5μl血浆进行ldh检测(n=6,one-way anova单因素方差分析)。c为小鼠缺血30分钟后在再灌注24小时后取心脏然后进行ttc染色(白色为梗死面积,红色为危险区域面积,蓝色为正常心脏组织)。d为ttc染色统计图,梗死面积/危险区域,危险区域/左室面积,标尺1mm(n=6,one-way anova单因素方差分析),数据显示为means
±
sem,未配对双尾t检验。(*p《0.05,**p《0.01)。
29.图4为铁死亡抑制剂在心脏缺血再灌注损伤晚期改善心脏功能。a为手术前24小时腹腔注射多种细胞死亡抑制剂,在再灌注4小时,3天,7天时进行心动超声检测,心动超声图。b为小鼠心脏左室射血分数,短轴缩短率(n=5,two-way anova双因素方差分析)。c为小鼠缺血30分钟后在再灌注7天后取心脏然后进行masson染色,标尺1mm(蓝色为纤维化区域,红色为正常心脏组织)。d为masson染色统计图(纤维化面积/左室面积)。*100(n=6,one-way anova单因素方差分析),数据显示为means
±
sem(*p《0.05,**p《0.01)。
30.图5为心脏缺血再灌注损伤后代谢谱异常。a为假手术小鼠与缺血再灌注小鼠经花生四烯酸代谢组学检测,数据经过标准化处理生成热图,用metaboanalyst5.0(http://www.metaboanalyst.ca/)进行数据处理,图中每个单元格代表一个数据值,颜色的深浅代表值的大小,红色代表浓度高,蓝色代表浓度低(对照组和7小时组n=8,0.5小时组n=10,4小时和24小时组n=9,12小时组n=4)。b为对两组进行多维变量统计分析(pls-da)。c为基于pls-da的变量重要性因子分布图,显示前10种变化最显著的代谢产物。x轴为相关性得分,y轴为代谢产物名称(n=8)。
31.图6为心脏缺血再灌注损伤后代谢谱异常。a为15-hete,13-hode,15-hepe代谢产物在心脏中的含量。b为利用western blotting检测心脏组织中alox15总蛋白的表达水平。c为利用image j统计软件对蛋白进行定量分析(n=6,**p《0.01),数据显示为means
±
sem,one-way anova。
32.图7为心肌细胞过表达alox15加重缺氧复氧后铁死亡。a为大鼠乳鼠心肌细胞腺病毒感染48小时,然后低糖无血清1640培养基在低氧(1%氧气,5%二氧化碳,94%氮气)环境中培养9小时,后恢复高糖dmem培养基,常氧培养24小时收集细胞检测gpx4与alox15蛋白水平。b为利用image j统计软件对alox15和gpx4进行定量分析(n=6,two-way anova双因素方差分析)。数据显示为means
±
sem(**p《0.01)。
33.图8为alox15特异性抑制剂ml351减轻缺氧复氧导致的心肌细胞铁死亡。a为大鼠乳鼠心肌细胞1μmol ml351处理24小时,然后低糖无血清1640培养基在低氧(1%氧气,5%二氧化碳,94%氮气)环境中培养9小时,后恢复高糖dmem培养基,常氧培养24小时收集细胞检测15-hete水平(n=5,one-way anova单因素方差分析)。b为大鼠乳鼠心肌细胞1μmol ml351处理24小时,然后低糖无血清1640培养基在低氧(1%氧气,5%二氧化碳,94%氮气)环境中培养9小时,后恢复高糖dmem培养基,常氧培养24小时收集细胞检测gpx4蛋白水平。c为利用image j统计软件对gpx4进行定量分析(n=6,one-way anova单因素方差分析)。d为1μmol ml351预处理心肌细胞24小时,然后给与0.5μmol rsl36小时后进行cck-8检测(n=6,one-way anova单因素方差分析)。数据显示为means
±
sem(**p《0.01)。
34.图9为alox15的常见代谢产物并不能触发心肌细胞铁死亡。a为大鼠乳鼠心肌细胞1μmol 15-hete、15-hete-pe和12-hete处理24小时,腺病毒过表达alox1548小时,检测细胞培养基中ldh水平(n=6,one-wayanova单因素方差分析)。b为1μmol代谢产物预处理心肌细
胞24小时,然后给与0.5μmol rsl36小时后进行cck-8检测(n=6,one-way anova单因素方差分析)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
35.图10为建立mplc-ms方法检测心脏组织中15-hpete含量。a为花生四烯酸代谢示意图,lc-ms色谱图。b为野生型与敲除alox15的小鼠再灌注7天后心脏危险区域中的15-hpete含量(n=6,two-way anova双因素方差分析)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
36.图11为alox15的直接代谢产物15-hpete触发心肌细胞铁死亡。a为大鼠乳鼠心肌细胞1μmol 15-hpete处理24小时,检测细胞培养基中ldh水平(n=6,未配对双尾t检验)。b为1μmol 15-hpete和12-hpete预处理心肌细胞24小时,然后给与0.5μmol rsl36小时后进行cck-8检测(n=6,one-way anova单因素方差分析)。c为大鼠乳鼠心肌细胞1μmol 15-hpete处理24小时后活细胞脂质过氧化产物荧光探针检测,标尺为20μm。d为大鼠乳鼠心肌细胞1μmol 15-hpete处理24小时后lc-ms技术检测4-hne、4-hhe和mda水平(n=6,未配对双尾t检验)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
37.图12为15-hpete加重心肌细胞损伤并不触发细胞凋亡。a为小鼠心脏缺血再灌注损伤24小时后左心室危险区域提取mrna进行rna-seq得出kegg富集图,点的大小代表基因数目,颜色代表p值大小,红色代表p值小。b为利用热图反应线粒体复合物的变化,红色代表含量高,蓝色代表含量低。c为原代心肌细胞过表达alox1548小时后提取mrna进行rna-seq得出kegg富集图,点的大小代表基因数目,颜色代表p值大小,红色代表p值小。d为利用热图反应线粒体复合物的变化,红色代表含量高,蓝色代表含量低。e为大鼠乳鼠心肌细胞1μmol 15-hpete处理24小时提取mrna进行q-pcr(n=3,未配对双尾t检验)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
38.图13为15-hpete加重心肌细胞损伤并不触发细胞凋亡。a为原代心肌细胞15-hpete处理24小时后,利用试剂盒mitopedpp检测活细胞线粒体脂质过氧化产物绿色荧光为脂质过氧化产物,标尺为10μm,利用prism软件对mitopedpp荧光强度进行定量统计分析(n=6,未配对双尾t检验)。b为原代心肌细胞15-hpete处理24小时后利用jc-1试剂盒检测线粒体膜电位,当线粒体正常、膜电位差保持不变时,jc-1会聚集并发出红色荧光,而当膜电位降低时,jc-1会作为单体存在并发出绿色荧光,标尺为20μm,利用prism软件对jc-1荧光强度进行定量统计分析(n=6,未配对双尾t检验)。c为原代心肌细胞15-hpete处理24小时后,利用电子显微镜拍摄线粒体形态,线粒体形态呈球形,线粒体脊断裂,线粒体数目减少都是铁死亡重要标志,作图标尺为2nm,右图标尺为0.6nm,利用线粒体flameng评分对线粒体进行定量分析(n=10,未配对双尾t检验)。d为原代心肌细胞1μmol 15-hpete处理24小时后取细胞检测atp含量(n=6,未配对双尾t检验)。e为原代心肌细胞过表达alox15或经过缺氧复氧处理在有或者没有ml351预处理24小时条件下atp水平(n=6,one-way anova单因素方差分析)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
39.图14为15-hpete降低过氧化物酶体增殖物激活受体辅激活因子(pgc1α)的蛋白水平。a为小鼠心脏缺血再灌注损伤24小时后取心脏危险区域,利用western blotting检测alox15、atp5a1、atp5f1、cox8a和pgc1α蛋白的表达水平,利用image j统计软件对蛋白进行定量分析(n=6,非配对双尾t检验)。b为原代心肌细胞1μmol 15-hpete处理24小时,western blotting检测pgc1α蛋白的表达水平(n=6,未配对双尾t检验)(*p《0.05,**p《
0.01)。
40.图15为15-hpete降低过氧化物酶体增殖物激活受体辅激活因子(pgc1α)的蛋白水平。a为原代心肌细胞1μmol 15-hpete处理12小时,提取mrna进行q-pcr(n=6,非配对双尾t检验)。b为放线菌酮处理原代心肌细胞2,4,6,8小时在有或者没有15-hpete的条件下,利用western blotting检测pgc1α蛋白的表达水平。c为利用image j统计软件对蛋白进行定量分析(n=6,two-way anova双因素方差分析)。d为293t细胞中转染pgc1α6μg,μb 3μg 48小时后分别给与1μmol 15-hpete,0.5μmol rsl3处理,然后进行ip实验(e和f)293t细胞中转染pgc1α5μg,rnf345μg 48小时后给与1μmol 15-hpete处理,然后进行ip实验。数据显示为means
±
sem(*p《0.05,**p《0.01)。
41.图16为过表达pgc1α能够抑制心肌细胞铁死亡。a为原代心肌细胞感染腺相关病毒48小时过表达pgc1α,然后0.5μmol rsl3处理6小时,去培养基检测ldh水平(n=6,own-way anova单因素方差分析)。b为96孔板中原代心肌细胞感染腺相关病毒48小时过表达pgc1α,然后0.5μmol rsl3处理6小时,利用cck-8试剂盒检测细胞活性(n=6,own-way anova单因素方差分析)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
42.图17为过表达pgc1α能够抑制缺氧复氧诱导的心肌细胞铁死亡。a为原代心肌细胞腺病毒转染48小时过表达pgc1α,进行缺氧复氧处理,提取蛋白进行western blot(n=6,非配对双尾t检验),利用image j统计软件对蛋白进行定量分析(n=6,one-way anova单因素方差分析)。b为原代心肌细胞腺病毒转染48小时过表达pgc1α,给与15-hpete处理,培养基检测ldh水平(n=6,one-way anova单因素方差分析)。c为原代心肌细胞腺病毒转染48小时过表达pgc1α,给与15-hpete处理,利用cck-8检测细胞活性(n=6,one-way anova单因素方差分析)。d为原代心肌细胞腺病毒转染48小时过表达pgc1α,给与15-hpete处理,检测细胞内atp水平(n=6,one-way anova单因素方差分析)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
43.图18为心肌细胞特异性敲除alox15的小鼠再灌注损伤后pgc1α的蛋白水平提高。a为野生型小鼠与心肌细胞特异性敲除alox15的小鼠进行缺血再灌注手术,手术24小时后取心脏危险区域提取蛋白检测pgc1α,gpx4,alox15的表达水平。b为利用image j统计软件对蛋白进行定量分析(n=6,one-way anova单因素方差分析)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
44.图19为ml351抑制心脏缺血再灌注损伤导致的心肌细胞铁死亡。小鼠心脏中15-hete和15-hpete水平(n=6,非配对双尾t检验)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
45.图20为ml351抑制心脏缺血再灌注损伤导致的心肌细胞铁死亡。a为小鼠再灌注24小时后血浆中ldh水平(n=6,one-way anova单因素方差分析)。b为腹腔注射ml351和对照试剂小鼠进行缺血再灌注手术,手术24小时后取心脏危险区域提取蛋白检测pgc1α,gpx4的表达水平,利用image j统计软件对蛋白进行定量分析(n=6,one-way anova单因素方差分析)。c为腹腔注射ml351和对照试剂小鼠进行缺血再灌注手术,心脏中atp水平(n=6,one-way anova单因素方差分析)。d为腹腔注射ml351和对照试剂小鼠进行缺血再灌注手术,手术24小时后取心脏危险区域提取4-hhe,4-hne和mda的水平(n=6,one-way anova单因素方差分析)。数据显示为means
±
sem(*p《0.05,**p《0.01)。
laboratory公司的产品。myh6-cre小鼠为美国cyagen公司的产品。cck-8试剂盒为日本dojindo公司的产品。乳酸脱氢酶(ldh)试剂盒为美国sigma-aldrich公司的产品。alox15特异性抑制剂ml351(简称ml351)为selleck公司的产品,产品目录号为16119。心肌细胞特异性敲除的小鼠(以下简称敲除alox15的小鼠)为the jackson laboratory公司的产品。心肌细胞过表达pgc1α的小鼠为the jackson laboratory公司的产品。
53.2、主要试剂配制
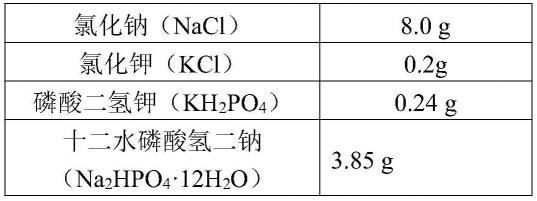
54.(1)磷酸盐缓冲液(1
×
pbs)
[0055][0056]
调ph值至7.2-7.4,超纯水定容至1l,高压高温灭菌,冷却后于4℃储存。
[0057]
(2)d-hanks缓冲液
[0058][0059]
调ph值至7.2-7.4,超纯水定容至1l,高压高温灭菌,冷却后于4℃储存。
[0060]
(3)高糖dmem培养基
[0061]
dmem培养基500ml100
×
青链霉素溶液5mlhyclone优级胎牛血清(北美)50ml
[0062]
(4)低糖1640培养基
[0063]
低糖16401袋nahco33.7g100
×
青链霉素溶液5ml
[0064]
调ph值至7.2-7.4,超纯水定容至1l,高压高温灭菌,冷却后于4℃储存。(5)原代心肌细胞分离消化液
[0065]
胰酶0.1gⅱ型胶原酶0.05gd-hanks缓冲液100ml
[0066]
0.22μm过滤除菌后于4℃储存。
[0067]
(6)tbst缓冲液
[0068]
tris-hcl2.42g
nacl8.775gtween20500μl总体积1l
[0069]
调ph值至7.2-7.4,超纯水定容至1l,室温储存。
[0070]
(7)蛋白裂解液
[0071]
ripa裂解液910μl磷酸酶抑制剂溶于超纯水(20
×
)50μl蛋白酶抑制剂溶于超纯水(25
×
)40μlpmsf(100mm)10μl
[0072]
(8)sds聚丙烯酰胺凝胶
[0073] 分离胶浓缩胶聚丙烯酰胺凝胶预混液7ml3ml10%ap70μl30μltemed3.5μl3μl
[0074]
10%ap:1g过硫酸铵(ap)粉末溶于10ml超纯水,-20℃储存。
[0075]
(9)电泳液
[0076]
tris-base3.02gl-甘氨酸18.8gsds粉末1.0g超纯水定容总体积1.0l
[0077]
(10)转膜液
[0078][0079][0080]
(11)封闭液
[0081]
脱脂奶粉2.5gtbst溶液50ml
[0082]
(12)ip裂解液
[0083]
非变性蛋白裂解液920μl20
×
磷酸酶抑制剂溶于超纯水50μl50
×
蛋白酶抑制剂溶于超纯水20μlpmsf(100mm)10μl
[0084]
(13)ip缓冲液
[0085]
tris-hcl7.9gnacl8.7g
edta0.744gnp401ml超纯水定容总体积1l
[0086]
调节ph至7.2-7.4,4℃储存。
[0087]
(14)la培养基(100ml)
[0088]
nacl1g胰蛋白胨1g酵母提取物0.5gagar1.5g超纯水定容总体积100ml
[0089]
高压蒸汽灭菌30min,待降温至50℃左右将培基取出,按照1:1000的比例加入氨苄青霉素,然后取10ml培养基铺到培养皿中,静置后凝固。
[0090]
(15)lb培养基(100ml)
[0091]
nacl1g胰蛋白胨1g酵母提取物0.5g超纯水定容总体积100ml
[0092]
高压蒸汽灭菌后放置室温待用。
[0093]
(16)1%ttc染液
[0094]
ttc粉末0.1gpbs10ml
[0095]
避光,现配现用。
[0096]
(17)组织细胞透膜液
[0097][0098][0099]
(18)鼠尾裂解液
[0100]
tris-hcl6.057gedta0.731gnacl5.844g10%sds10ml超纯水定容总体积500ml
[0101]
调节ph至8.5
[0102]
(19)花生四烯酸代谢组学内参溶液
[0103]
ltb4-d425μlpge2-d45μl6-keto-pgf1a-d425μl
11,12-dhet-d1125μl20-hete-d625μl8,9-eet-d1125μl5-hete-d825μlara-d825μlepa-d55μldha-d55μl9-hode-d92530%乙腈285μl
[0104]
(20)脂质过氧化产物代谢组学内参溶液
[0105]
4-hne-d310μl60%乙腈100μl
[0106]
3、实验方法
[0107]
(1)建立心脏缺血再灌注小鼠模型方法
[0108]
取大约8周体重20g左右雄性小鼠用脱毛膏脱去胸前毛发。将小鼠固定到恒温37℃鼠板上,用碘伏将心前区进行常规消毒。手术时采用3%异弗烷1l/min吸入式麻醉方式进行气麻。小鼠麻醉后,在心脏跳动幅度最大的位置用剪刀剪开2cm左右的开口。用医用4-0缝合线采用荷包缝合将开口先穿好但不缝合。用弯镊在心脏跳动的上方钝性分离出胸廓(通常开口处为小鼠第四肋间隙)。迅速用左手按压小鼠胸部将心脏从胸腔中挤出,卡在开口处。切记此时应尽可能少的胸腔进气。用6-0医用手术缝合线迅速在冠状动脉左前降支上打上手术活结,同时将缝合线的一头露于胸外。迅速将小鼠心脏放回胸腔内,并排出胸腔中多余的空气,然后将表皮缝合。将做好手术的小鼠继续放回到气麻室中,30分钟后将活结打开进行心脏再灌注放回饲养笼中继续饲养。
[0109]
(2)蛋白的提取与定量
[0110]
(2-1)组织蛋白质的提取
[0111]
将20mg小鼠心脏组织放入装有200μl蛋白裂解液和1颗研磨珠子的2ml离心管中,放入-20℃预冷的组织研磨仪中充分研磨裂解(40hz,90s,2次);组织完全匀浆后取出研磨珠,4℃、12000rpm离心15min;取离心后的上清蛋白样品于新的1.5ml离心管中,取5μl蛋白样品于96孔板中,利用bca法测定蛋白浓度;根据蛋白样品的体积加入不同体积的5
×
sds,充分混匀后,放入金属浴中,100℃,10min。放于冰上降温后于-20℃冰箱保存。
[0112]
(2-2)细胞蛋白质的提取
[0113]
弃去原有细胞培养基,用pbs缓冲液轻轻清洗3次后,将pbs尽可能吸取干净,每孔加入100μl的蛋白裂解液,将孔板置于冰上,用超纯水清洗过的细胞刮刀收集细胞,用移液枪将样品转移至1.5ml离心管中;使用超声细胞组织破碎仪进一步破碎细胞,超声破碎3次,每次3秒,停顿3秒,4℃、12000rpm离心15分钟;取离心后的上清蛋白样品于新的1.5ml离心管中,取5μl蛋白样品于96孔板中,利用bca法测定蛋白浓度;根据蛋白样品的体积加入不同体积的5
×
sds,充分混匀后,放入金属浴中,100度,10分钟。放于冰上降温后于-20度冰箱保存。
[0114]
(2-3)bca法测定蛋白浓度
[0115]
将蛋白标准品用pbs按照一定浓度梯度进行稀释至少8个浓度点,然后用于制作浓度标准曲线;取蛋白标准品与样品各5μl分别依次加入到96孔板中,然后取200μl bca工作液加入每孔中;将已添加样品与工作液的96孔板放入37℃培养箱中孵育30分钟;使用多功能酶标仪读取标准品和蛋白样品在波长562nm处的吸光度。根据蛋白标准品浓度计算出蛋白浓度吸光度标准曲线,带入样品吸光度得出样品蛋白浓度;根据蛋白浓度与上样量计算出所需样品体积。
[0116]
(2-4)蛋白质免疫印迹实验
[0117]
根据目的蛋白分子量大小配制不同浓度的sds聚丙烯酰胺凝胶,根据上样的体积插入不同孔数的上层胶梳子;采用bio-rad mini-protean 3cell系统进行蛋白凝胶电泳,用夹板将凝胶固定保证电泳液不渗漏,根据正负极正确的将夹板放进电泳槽,将电泳液倒至槽中液面规定位置,将上层胶梳子取下,按照蛋白上样顺序加入定量的蛋白样品和5μl的蛋白marker,先用80v将样品跑下浓缩胶,然后调整电压至120v恒压运行,直至样品跑至分离胶下缘;取合适大小的nc膜,将nc膜提前泡在膜平衡液中,电泳结束后,将海绵垫、nc膜、凝胶(切取合适大小)按顺序置于转膜夹上,清除凝胶与nc膜之间产生的气泡,然后将转膜夹夹紧放入转膜仪中,根据目的蛋白大小,选择转膜所需时间,转膜结束将nc膜取出;将nc膜放入配置好的封闭液(5%脱脂奶粉)中,摇床封闭30分钟,按照抗体说明书配置一抗。封闭完成后裁处目的蛋白所在位置的nc膜,然后用tbst清洗掉封闭液,将清洗后的nc膜4度孵育在需要的一抗中12h;一抗孵育12h后用tbst清洗3次,每次10min,然后将nc膜孵育在脱脂奶粉配置好的二抗中常温2h;孵育二抗结束后用tbst清洗3次,每次10min;配置发光液然后进行避光处理,发光液均匀作用于nc膜蛋白面后,将nc膜整齐的放置于全自动化学发光成像系统仪器中进行发光成像;将所得到的图片用image j软件分析出结果。
[0118]
(3)q-pcr
[0119]
将cdna进行q-pcr。
[0120]
小鼠种属q-pcr引物序列如下:
[0121]
[0122][0123]
大鼠种属q-pcr引物序列如下:
[0124][0125]
[0126]
(4)鼠尾dna的鉴定
[0127]
鉴定鼠尾dnaalox15-/-pcr引物序列如下:
[0128][0129]
鉴定鼠尾dnamyh6-cre pcr引物序列如下:
[0130][0131][0132]
(5)免疫共沉淀实验
[0133]
将质粒转染以及药物处理之后的hek293t从培养箱中取出,弃掉原来的培养基,用pbs洗两遍,完全取出多余的pbs,然后向每个皿中加入1ml ip专用裂解液,放于4℃摇床上裂解30分钟;用移液枪吹散细胞团并收集细胞至1.5ml离心管中,4℃、2000rpm离心5分钟,取上清800μl于新的1.5ml管中,剩余200μl于原离心管中;将剩余200μl进行超声破碎细胞,然后4℃、12000rpm,离心15分钟,取上清与800μl混合;取出5μl蛋白样品进行bca法测定蛋白浓度;取出100μl蛋白样品,加入5
×
sds,金属浴100℃10分钟内,作为inpμt;取20μl抗myc或者flag的免疫磁珠于1.5mlep管中,加入1ml ipbμffer颠倒混匀,然后放于磁力架上静置30秒,倾去buffer,如此反复三次清洗磁珠;将剩余的蛋白样品等分为两份,各加入清洗好的20μl的磁珠(根据需要选择抗myc或者flag),放于摇床上4℃结合过夜;取出结合完全的蛋白样品,加入1ml ipbuffer颠倒清洗5分钟,然后放于磁力架上静置30秒,倾去buffer,如此反复五次清洗磁珠;最后一遍弃掉ipbuffer后加入100μl 1
×
sds,金属浴100℃10分钟,取出放于-20℃冰箱保存等待上样。
[0134]
(6)通过小鼠心脏超声检测,得到舒张末期左室内径(lvidd)、收缩末期左室内径(lvids)、舒张末期左室容积(edv)、收缩末期左室容积(esv),并计算出左室射血分数(ef%)、左室短轴缩短率(fs%)。
[0135]
(7)采用ldh检测试剂盒检测小鼠血浆中ldh。
[0136]
(8)采用常规方法进行小鼠心脏ttc染色。
[0137]
(9)采用常规方法进行小鼠心脏masson染色。
[0138]
(10)采用常规方法进行小鼠心脏免疫荧光。
[0139]
(11)采用常规方法进行心脏组织中花生四烯酸检测,其中
[0140]
色谱方法如下:
[0141][0142]
质谱参数如下:
[0143][0144][0145]
(12)采用常规方法进行心脏组织中脂质过氧化产物检测,其中
[0146]
色谱参数如下:
[0147][0148]
质谱参数如下:
[0149]
cmr40psigs130psigs230psiis-4500vcadmediμmtemp500℃
[0150]
(13)采用常规方法进行原代大鼠乳鼠心肌细胞的分离。
[0151]
(14)细胞损伤检测
[0152]
采用ldh检测试剂盒检测血浆中ldh。
[0153]
采用cck-8检测细胞活性。
[0154]
采用tμnel进行细胞凋亡检测。
[0155]
采用liperflμo进行活细胞脂质过氧化产物检测。
[0156]
(15)细胞线粒体相关检测
[0157]
采用mitopedpp进行活细胞线粒体脂质过氧化产物检测。
[0158]
采用jc-1进行细胞线粒体膜电位检测。
[0159]
进行细胞线粒体电镜观察。
[0160]
进行细胞中atp检测。
[0161]
(16)统计方法
[0162]
实验数据采用graphpad prism 7(graphpad software,inc.)软件分析作图,所有实验结果以均值
±
标准差(means
±
sem)表示,每组样本数在图中标明。两组间比较采用学生t检验(t-test),多组间比较采用单因素方差分析(one-way anova)或双因素方差分析(two-way anova),所有实验结果中以p《0.05作为有显著性统计学意义的标准。
[0163]
二、实验结果
[0164]
1、心肌细胞铁死亡在缺血再灌注24小时后发挥主导作用
[0165]
(1)心脏缺血再灌注损伤触发铁死亡
[0166]
对小鼠进行缺血再灌注手术,缺血30分钟,再灌注4或24小时,然后取心脏组织进行western blot检测铁死亡重要指标,结果发现抑制铁死亡的蛋白如gpx4、slc7a11的表达在24小时后明显降低,而4小时时无明显变化,促进铁死亡的蛋白如tfr、acsl4的表达在24小时时明显上调而4小时没有显著性差异(如图1中a和b)。还检测了铁死亡的重要标志物脂质过氧化产物,通过心脏组织免疫荧光,发现心脏缺血再灌注24小时后脂质过氧化产物4-hne的表达明显增加(如图1中c和d)。
[0167]
(2)心脏缺血再灌注早期触发心肌细胞凋亡
[0168]
接下来,检测了凋亡相关蛋白cleaved-caspase3,结果发现与铁死亡蛋白相反在再灌注4小时时凋亡明显增加,而随时间延长在24小时时恢复正常(如图2)。通过以上实验发现在缺血再灌注损伤24小时后心肌细胞发生铁死亡,而在稍短的时间窗口上铁死亡并不明显,上述结果提示铁死亡也许在再灌注晚期时间窗口上发挥着主导作用。
[0169]
(3)铁死亡在心脏缺血再灌注损伤晚期发挥主导作用
[0170]
为了进一步验证铁死亡在缺血再灌注晚期发挥主导作用,设计了如下实验(如图3中a),在手术24小时前腹腔注射细胞凋亡抑制剂emr、细胞坏死抑制剂nec-1、细胞自噬抑制剂3-ma、细胞铁死亡抑制剂fer-1,结果发现4小时后小鼠血浆中ldh水平在再灌注组明显升高,凋亡抑制剂与坏死抑制剂明显降低,然而铁死亡抑制剂与对照组没有明显差异(如图3中b),此结果表明在再灌注早期,凋亡坏死发挥着主导作用,而铁死亡的作用并不明显,这与caspase3蛋白表达水平一致。为了探究细胞死亡方式与心脏梗死面积的影响,取24小时后心脏进行ttc染色,结果发现,凋亡和坏死抑制剂组明显降低了心脏的梗死面积((如图3中c和d),但铁死亡抑制剂发挥着更为明显的作用,铁死亡抑制剂的处理组相较于凋亡抑制剂与坏死抑制剂组白色梗死面积明显减少。结果表明,随着时间的延长,铁死亡发挥着主导作用。
[0171]
(4)铁死亡抑制剂在心脏缺血再灌注损伤晚期改善心脏功能
[0172]
为了进一步探究铁死亡与心脏功能的关系,在手术后4小时、3天、7天时分别对小鼠左心室进行心动超声检测,实验结果发现随着心脏缺血再灌注时间的延长,铁死亡抑制剂fer-1明显提高了射血分数与短轴缩短率,改善了心脏收缩功能(如4中a和b),同时发现在缺血再灌注7天时只有fer-1能够明显改善心脏功能以及心脏纤维化面积(如图4中c和d)。此部分试验结果表明,在缺血再灌注早期时间窗口(4小时)细胞凋亡与坏死发挥着主导作用,此时二者的抑制剂都可以改善心脏功能,但随着时间的延长(24小时及以后)心肌细胞铁死亡逐渐占据主导地位,使用其抑制剂可以有效改善再灌注损伤。
[0173]
综上所述,建立了小鼠心脏缺血再灌注损伤模型,通过检测铁死亡的重要志物gpx4、acsl4、slc7a11、ftr以及脂质过氧化产物4-hne,发现在再灌注早期这些特点并不明显,但随着时间的延长,铁死亡的特征变得清晰。这不仅确定铁死亡在再灌注过程中确实发生,还提示它的发生需要时间的积累。采用多种细胞死亡的抑制剂进行动物实验,结果发现,在再灌注的最初几个小时内(4小时)发现凋亡与坏死占据主导作用,而随着再灌注时间延长(24小时)铁死亡发挥主导作用,使用其抑制剂可以明显改善再灌注损伤,为临床更加精准用药提供了新的思路。
[0174]
2、心脏缺血再灌注损伤后alox15及其代谢产物表达升高
[0175]
(1)心脏缺血再灌注损伤后花生四烯酸代谢谱异常
[0176]
脂质代谢异常是造成细胞铁死亡的关键因素,花生四烯酸代谢异常在心血管疾病中发挥着重要作用,因此探究在心脏缺血再灌注整个时间窗口中花生四烯酸代谢谱的变化至关重要。取小鼠再灌注0.5小时、4小时、12小时、24小时或7天的心脏危险区域(左心室结扎线以下区域)进行花生四烯酸代谢组学检测。通过代谢谱热图发现loxs家族的代谢产物(如5,12,15,17,18-hete,13-hode,15-hepe,ltb4等)都随再灌注时间的延长明显升高,在第7天的时候升高的最为明显(见图5中a)。为进一步筛选出在再灌注过程中最为重要的代谢产物,选取对照组与手术后第7天的数据进行偏最小二乘法-判别分析法(partial least sqμares-discriminant analysis,pls-da)分析,对化合物进行聚类分析以将重要的化合物筛选出来,可以发现假手术组与缺血再灌注组7天的代谢产物之间具有显著性差异(见图5中b)。同时对代谢数据进行深入处理来发掘出在缺血再灌注中发挥重要作用的代谢物,做出关于化合物对缺血再灌注损伤的vip得分图(见图5中c),筛选出得分大于1的代谢产物,发现alox15的代谢产物12,15-hete,13-hdohe,15-hepe得分排在前面,这提示alox15及其代谢产物在缺血再灌注损伤中发挥着重要作用。将研究重点确定为alox15以及其代谢产物。
[0177]
(2)心脏缺血再灌注损伤后alox15表达升高
[0178]
分析alox15及其代谢产物的具体变化。结果发现,在心脏组织中,15-hete随心脏缺血再灌注损伤时间的延长升高的最为明显,在第7天时大约为假手术组的15倍(如图6中a),同时还发现alox15的蛋白水平也持续升高(如图6中b和c)。此结果说明了在心脏缺血再灌注损伤过程中,心脏组织中alox15的蛋白水平持续升高导致其下游花生四烯酸的代谢产物15-hete升高,进而引起代谢异常。
[0179]
3、15-hpete触发心肌细胞铁死亡
[0180]
(1)心肌细胞过表达alox15加重缺氧复氧后铁死亡
[0181]
为了进一步探究alox15促进心肌细胞铁死亡的分子机制,分离大鼠乳鼠的心肌细胞,用腺相关病毒感染心肌细胞从而过表达alox15,在感染病毒48小时后,更换低糖无血清1640培养基,将细胞放入缺氧箱中(由1%氧气、5%二氧化碳和94%氮气组成)培养9小时,然后取出细胞,更换高糖dmem培养基,放入常氧培养箱中培养24小时,然后收集细胞。结果发现与心脏组织一致,细胞缺氧复氧能够明显增加alox15的表达、降低gpx4的表达,同时过表达alox15相比缺氧复氧处理能够进一步降低gpx4的表达(见图7)。
[0182]
(2)alox15特异性抑制剂ml351减轻缺氧复氧导致的心肌细胞铁死亡
[0183]
为了进一步探究是alox15本身还是其下游代谢产物触发铁死亡,使用alox15的特异性酶活性抑制剂ml351处理心肌细胞。在心肌细胞缺氧复氧处理前24小时用1μmol ml351处理细胞。处理后的细胞提取15-hete,结果发现ml351的处理相比对照组明显降低了15-hete的水平,同时也明显降低了缺氧复氧导致的15-hete的升高(如图8中a)。上述结果验证了ml351能够抑制alox15的酶活性,降低15-hete的水平。检测ml351处理之后gpx4的蛋白水平,结果发现ml351能够明显提高缺氧复氧导致的gpx4的降低(如图8中b和c)。用0.5μmol rsl3处理心肌细胞6小时诱导心肌细胞铁死亡,同时给予细胞1μmol ml351处理。结果发现ml351的处理能够明显改善rsl3导致的细胞活性降低(如图8中d)。结果表明,alox15通过其下游代谢产物促进心肌细胞铁死亡。
[0184]
(3)alox15的常见代谢产物并不能触发心肌细胞铁死亡
[0185]
花生四烯酸通过alox15代谢产生的主要小分子包括15-hete、12-hete、15-hete-pe、12-hete-pe。为了探究是哪种代谢产物能够诱导心肌细胞铁死亡,分别给与心肌细胞1μmol代谢产物处理24小时,通过检测培养基中ldh水平来确定细胞损伤程度,结果发现只有过表达alox15能够诱导细胞损伤,而其代谢产物的处理却没有明显变化(见图9中a)。为了进一步验证实验结果,给予细胞处理代谢产物24小时,同时给予rsl3处理细胞6小时后利用cck-8检测细胞活性,结果与之前一致,alox15的常见代谢产物的处理并不能降低细胞活性(见图9中b)。
[0186]
(4)mplc-ms方法检测心脏组织中15-hpete含量
[0187]
已有研究表明花生四烯酸通过alox15直接产生15-hpete,而其极不稳定迅速被还原为15-hete。为了确定是否15-hpete发挥着更为主要的作用,利用高效液相色谱串联质谱(lc-ms)技术开发了高效快速检测15-hpete的方法(如图10中a),首先利用该方法检测了小鼠手术后心脏中15-hpete的水平,结果发现再灌注7天后其水平明显升高,而在敲除alox15的小鼠中显著降低(如图10中b),这与15-hete的变化相一致。
[0188]
(5)alox15的直接代谢产物15-hpete触发心肌细胞铁死亡
[0189]
为了探究15-hpete能否触发铁死亡,给与心肌细胞1μmol 15-hpete处理24小时,结果发现培养基中ldh水平明显升高(如图11中a),同时细胞活性显著降低,并且能够进一步加重rsl3导致的铁死亡(如图11中b)。接下来利用活细胞脂质过氧化产物荧光探针检测脂质过氧化产物,结果发现15-hpete处理明显增加了活细胞内脂质过氧化产物的积累(如图1中c),同时利用lc-ms技术检测了脂质过氧化产物发现用15-hpete处理细胞后4-hne、4-hhe和mda水平明显升高(如图11中d)。通过以上实验确定了花生四烯酸通过alox15的直接代谢产物15-hpete触发心肌细胞铁死亡加重缺氧复氧损伤。
[0190]
4、15-hpete诱导线粒体损伤
[0191]
(1)15-hpete造成线粒体复合物的合成减少
[0192]
为了进一步探究心脏缺血再灌注损伤中心肌细胞发生铁死亡的机制,首先取小鼠手术后心脏左心室危险区域提取rna做rna-seq,结果发现手术组keeg代谢通路主要富集在生热作用与氧化磷酸化作用(如图12中a),而这两条信号通路与线粒体功能密不可分,并且发现再灌注24小时后线粒体复合物ⅰ、ⅳ、
ⅴ
的mrna水平明显降低(如图12中b),这些结果提示再灌注损伤后线粒体功能受损。为了验证alox15是否参与了线粒体损伤,在心肌细胞中过表达alox15并且提取rna做rna-seq,结果与再灌注小鼠心脏的结果一致,同样keeg代谢通路主要富集在生热作用与氧化磷酸化作用(如图12中c),过表达细胞中线粒体复合物ⅰ、ⅳ、
ⅴ
的mrna水平明显降低(如图12中d)。为了进一步探究15-hpete的作用,给予心肌细胞1μmol 15-hpete处理24小时,结果发现线粒体复合物ⅰ、ⅳ、
ⅴ
的mrna水平显著降低(如图12中e)。通过以上结果,发现15-hpete能够通过降低线粒体复合物ⅰ、ⅳ、
ⅴ
的mrna水平从而造成线粒体损伤。
[0193]
(2)15-hpete造成心肌细胞线粒体铁死亡
[0194]
为了探究15-hpete造成线粒体损伤与铁死亡之间的关系,首先检测线粒体脂质过氧化产物,结果发现15-hpete处理组线粒体脂质过氧化产物明显增加(如图13中a和b)。利用jc-1试剂盒检测线粒体膜电位,结果发现15-hpete的处理能够明显造成膜电位紊乱(如图13中c和d)。线粒体形态的改变也是铁死亡的重要标志,通过电镜拍照得到心肌细胞线粒体形态,结果我们发现15-hpete处理后线粒体脊的断裂增加、形态呈球形、线粒体数量减少(如图13中e和f),这些形态特征都是细胞发生铁死亡的重要标志。最后检测了心肌细胞中atp的水平,15-hpete处理能够明显降低atp的水平(如图13中g),同时还发现ml351能够改善缺氧复氧或者过表达alox15导致的atp的降低。以上结果表明(如图13中h),15-hpete通过造成线粒体损伤从而触发心肌细胞铁死亡。
[0195]
5、15-hpete促进pgc1α泛素化降解诱导线粒体损伤
[0196]
(1)15-hpete降低过氧化物酶体增殖物激活受体辅激活因子(pgc1α)的蛋白水平
[0197]
为了探究15-hpete造成线粒体损伤是否与pgc1α有关,首先,在小鼠缺血再灌注损伤24小时后心脏中检测线粒体复合物以及pgc1α,结果显示线粒体复合物在手术组心脏中明显降低,同时pgc1α的蛋白水平也是显著降低(如图14中a和b)。为了探究pgc1α的降低是否与alox15代谢产物的升高有关,首先给与原代心肌细胞ml351预处理24小时,然后进行缺氧复氧处理,结果发现ml351的预处理能够明显恢复缺氧复氧导致的pgc1α降低(如图14中c和d)。为了进一步明确15-hpete是否能够调控pgc1α的蛋白水平,给予原代心肌细胞1μmol 15-hpete 24小时,结果发现15-hpete的处理明显降低了pgc1α的蛋白水平(如图14中e和f)。通过以上结果发现15-hpete通过降低了pgc1α的蛋白水平从而损伤线粒体形态与功能。
[0198]
(2)15-hpete通过增加pgc1α与rnf34结合从而增加其泛素化降解
[0199]
实验结果表明,15-hpete能够降低pgc1α的蛋白水平,但其分子机制还不明确,为了进一步探究15-hpete降低pgc1α的分子机制,首先从转录水平检测了15-hpete处理能否改变pgc1αmrna水平,结果发现15-hpete处理24小时后pgc1αmrna水平并没有明显变化(如图15中a),该结果提示15-hpete可能影响了蛋白的稳定性,因此给予细胞放线菌酮(chx)处理,放线菌酮能够抑制蛋白的合成,同时给与15-hpete处理,western blotting结果发现用放线菌酮抑制蛋白合成之后,再给予15-hpete处理加速了蛋白的降解(如图15中b和c)。合
成了带有flag标签的pgc1α质粒,带有ha标签的ub,并将两种质粒同时转染进293t细胞系中,48小时后分别给与15-hpete,rsl3以及dmso处理,收集细胞进行ip实验,结果发现15-hpete能够明显增加pgc1α的泛素化水平然而rsl3处理却没有明显变化(如图15中d),此部分结果表明15-hpete能够促进泛素化的降解从而导致线粒体损伤,细胞触发铁死亡,而不是细胞发生铁死亡进而导致pgc1α的泛素化降解。接下来合成了带有myc标签的rnf34质粒,同时将其与带有flag标签的pgc1α质粒共转染进293t细胞中48小时后给与15-hpete处理,随后收集细胞进行ip实验,结果发现15-hpete处理能够增加pgc1α与rnf34的结合(如图15中e和f)。通过此部分结果,证实了15-hpete通过增加pgc1α与rnf34的结合从而促进pgc1α的泛素化降解。
[0200]
(3)过表达pgc1α能够抑制rsl3诱导的心肌细胞铁死亡
[0201]
以上实验结果表明15-hpete通过增加pgc1α与rnf34的结合从而促进pgc1α的泛素化降解。为了进一步探究pgc1α在心肌细胞铁死亡中的作用,接下来在原代心肌细胞中用腺相关病毒过表达pgc1α48小时后给与0.5μmol rsl3处理6小时,通过检测培养基中ldh水平来评价心肌细胞损伤程度,利用cck-8检测心肌细胞活性。通过结果发现,过表达pgc1α能够明显提高rsl3导致的ldh水平的降低(如图16中a),同样,过表达pgc1α能够提高rsl3导致的细胞活性的降低(如图16中b)。以上结果表明,过表达pgc1α能够抑制rsl3诱导的心肌细胞铁死亡。
[0202]
(4)过表达pgc1α能够抑制缺氧复氧诱导的心肌细胞铁死亡
[0203]
通过以上结果证实了pgc1α能够抑制心肌细胞铁死亡,为了进一步探究过表达pgc1α是否可以改善心肌细胞缺氧复氧导致的铁死亡,首先在心肌细胞中过表达pgc1α48小时后将细胞进行缺氧复氧处理,western blotting结果显示,过表达pgc1α能够提高缺氧复氧导致的gpx4的降低(如图17中a和b),接下来同样检测了15-hpete处理的心肌细胞培养中ldh水平,细胞活性以及atp的水平,结果与rsl3诱导的铁死亡一致,过表达pgc1α同样能够抑制缺氧复氧导致的铁死亡(如图17中c、d和e)。
[0204]
(5)心肌细胞特异性敲除alox15提高再灌注损伤后pgc1α的蛋白水平
[0205]
为了进一步在动物实验中验证这一结果,对心肌细胞特异性敲除alox15的小鼠进行缺血再灌注手术,取心脏危险区域提取蛋白,western blotting结果显示在缺血再灌注7天后与野生型小鼠相比,alox15的敲除增加了pgc1α的表达,同样gpx4的表达也在敲除alox15的小鼠中明显增加(如图18中a和b)。以上结果表明,过表达pgc1α能够抑制心肌细胞铁死亡。
[0206]
6、ml351减轻再灌注损伤后心肌细胞铁死亡改善心脏功能
[0207]
(1)ml351抑制心脏缺血再灌注损伤导致的15-hpete升高
[0208]
通过以上实验结果猜想是否可以给予小鼠alox15的特异性酶活性抑制剂ml351从而有效地降低再灌注损伤后的心肌细胞铁死亡。在小鼠再灌注损伤手术前24小时开始给与腹腔注射10mg
·
kg-1
·
day-1
ml351,手术后24小时取心脏检测15-hete、15-hpete的水平,结果显示注射ml351之后明显降低了再灌注损伤导致的15-hete和15-hpete水平的升高(见图19)。
[0209]
(2)ml351抑制心脏缺血再灌注损伤导致的心肌细胞铁死亡
[0210]
检测血浆中ldh水平,给与ml351改善了再灌注导致的心脏损伤(如图20中a)。接下
来检测了铁死亡的重要指标,发现ml351的处理使得心脏组织中gpx4与atp的水平明显升高,脂质过氧化产物的含量显著降低相比于再灌注小鼠(如图20中b-e)。通过以上实验证实了ml351能够抑制心脏缺血再灌注损伤导致的心肌细胞铁死亡。
[0211]
(3)ml351改善心脏缺血再灌注损伤导致的心脏功能障碍
[0212]
为了进一步探究其是否能够改善再灌注损伤后的心脏功能。首先在手术后24小时取材进行ttc染色,结果发现给予ml351能够明显降低心脏梗死面积(如图21中a),同样腹腔注射ml351能够改善左心室射血分数和短轴缩短率(如图21中b),减少心脏纤维化面积(如图21中c)。以上结果表明,小鼠腹腔注射ml351可以改善心脏缺血再灌注损伤导致的心脏功能障碍。
[0213]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1