一种可吸收防粘连材料及其制备方法与流程
1.本发明涉及生物医药材料技术领域,具体涉及一种可吸收防粘连材料、制备方法。
背景技术:
2.术后粘连是外科手术领域普遍存在的问题,也是临床中长期未能解决的医学难题之一。临床上几乎所有手术都涉及组织之间防粘连和局部抗炎症问题,在人体腹部、心血管、脊柱、骨关节、腿部、妇科盆腔等外科手术后发生的组织粘连不但给患者带来极大的痛苦,而且造成巨大的经济损失;手术后的粘连也可能会引起严重的并发症,如肠梗阻、慢性疼痛、女性的异位妊娠、不孕不育等,增加了二次手术的几率,严重的甚至会导致死亡。
3.感染是导致术后粘连的诸多因素之一,之前的研究大都忽略了细菌感染对粘连形成的影响,尤其是对于腹腔粘连,由于创面暴露于富含大量腹腔液的潮湿环境中,极大地提高了细菌感染的几率,从而增加了术后粘连的发生率。例如大肠杆菌感染所导致的渗出液中含有大量的纤维蛋白及白细胞,因而会导致密性粘连的形成。
4.到目前为止,防粘连材料大体可划分为三代。第一代是人体不可降解吸收的机械材料,如金属、丝绸、橡胶等;第二代材料为人体难以吸收的屏障材料,如矿物油等;第三代材料为人体可降解吸收的生物材料,如玻尿酸、聚乳酸、多糖类物质等。其中,第三代生物材料在临床上的应用较为普遍。
5.胶原是具有支撑器官、保护机体功能的重要结构蛋白,同时胶原是真皮中结缔组织的主要成分,占皮肤真皮层的75%以上,构成人体最外层的保护网。胶原在皮肤创面修复中早有应用,但是胶原作为人工皮肤的缺点是物理机械性能差,在富含酶和微环境的人体环境中,胶原膜材料易于酶解,最终导致手术的失败,因此,限制了其在临床的应用。胶原类敷料生物相容性好,具有止血促凝、促进细胞分裂分化作用,但稳定性比较弱、弹性差、质脆、不耐水,且来源于动物,存在感染的风险。
6.几丁糖又称壳聚糖,其具有明显的促进伤口收缩和愈合的效果,是一种生物学性状优良、极具发展潜力的植入材料。但是几丁糖的粘附性和降解速度控制以及植入前期的炎症和异物反应问题,其研究大多停留在试验及小范围的临床应用。
7.透明质酸是人体结缔组织的天然成分,具有良好的生物相容性。但是因透明质酸在体内存留时间短,不能较长时间在创面上维持较高的药物浓度,影响抗粘连效果,所以很多研究都着眼于将其与其他高分子聚合物联合使用。
8.羧甲基纤维素是纤维素醚的一种,作为新型有机抗粘连材料,它可明显减少腹腔粘连的形成,还具有一定的止血效果。羧甲基纤维素可制成溶液、凝胶等多种形式,具有吸收性良好、无毒、无免疫原性及生物相容性良好等特点。单一的羧甲基纤维素成膜性优良,但极易溶于水,在水中一段时间后,不能保持较好的膜结构,力学性能较差,拉伸强度较低,且降解速度过快。
9.中国专利201811112155.9公开了一种防粘连止血敷料及其制备方法,包括吸附的纱布基材和防粘连止血组合物,该防粘连止血组合物中包含羟甲基壳聚糖和透明质酸,其
降解周期可调空间小,防粘连效果有待改进。
10.综上所述,当前临床上缺少一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料。
技术实现要素:
11.鉴于上述现有技术存在的不足,本发明的目的在于提供一种可吸收防粘连材料及其制备方法。
12.为实现上述目的,本发明采用的技术方案为:
13.一种可吸收防粘连材料,所述可吸收防粘连材料包括:
14.抗菌消炎层a,其活性成分包括人体可降解吸收的高分子材料、增塑剂、生物活性矿物质材料、抗菌消炎成分和微量元素原液;
15.和/或防粘连层b,其活性成分包括人体可降解吸收的高分子材料、增塑剂、生物活性矿物质材料和微量元素原液。
16.在上述可吸收防粘连材料中,作为一种优选实施方式,所述抗菌消炎层a的活性成分质量比为,人体可降解吸收的高分子材料:增塑剂:生物活性矿物质材料:抗菌消炎成分:微量元素原液=1:(0.1-10):(0.01-10):(0.9-15):(0-10)(例如1:3:1:1:1、1:1:3:1:3、1:1:3:1:5、1:1:1:3:9、1:3:1:1:1、1:5:1:1:1、1:1:5:1:3、1:1:5:1:5、1:1:1:5:9、1:7:1:1:1、1:1:7:1:3、1:1:7:1:5、1:1:1:7:9、1:1:1:13:9);所述防粘连层b的活性成分质量比为,人体可降解吸收的高分子材料:增塑剂:生物活性矿物质材料:微量元素原液=1:(0.1-10):(0.01-10):(0-10)(例如1:1:1:1、1:1:1:3、1:1:1:5、1:1:1:7、1:1:1:9、1:3:1:1、1:1:3:3、1:5:1:5、1:1:5:7、1:9:3:9)。
17.在上述可吸收防粘连材料中,作为一种优选实施方式,所述人体可降解吸收的高分子材料包括:透明质酸及其衍生物、纤维素醚及其衍生物、壳聚糖及其衍生物和淀粉及其衍生物中的一种或几种;优选地,所述人体可降解吸收的高分子材料包括:透明质酸、透明质酸钠、羧甲基纤维素、羧甲基纤维素钠、壳聚糖和淀粉中的一种或几种。
18.在上述可吸收防粘连材料中,作为一种优选实施方式,所述微量元素原液包括硼(b)、铁(fe)、钾(k)、镁(mg)、锰(mn)、钠(na)、磷(p)、钛(ti)、硅(si)、铝(al)、锂(li)、铍(be)、钪(sc)、钒(v)、铬(cr)、钴(co)、镍(ni)、铜(cu)、锌(zn)、镓(ga)、锗(ge)、砷(as)、硒(se)、鉫(rb)、锶(sr)、钇(y)、锆(zr)、铌(nb)、钼(mo)、银(ag)、镉(cd)和铟(in)。
19.本发明中,所述微量元素原液是指具有微磁矩的高能态、多功能的含水络合离子群浓缩液,具有较强的杀菌消毒功效;所述微量元素原液含有20多种生命相关元素和生命动力元素的含水络合阳离子群,其中的许多过渡元素的电子转移自由基反应,能自动生成羟基自由基[
·
oh],具有强烈氧化作用,其氧化电势远高于其它氧化剂,比氯高一倍,它能够打破各种化学键,特别是对那些有毒结构的活性键,有氧化裂解的功能,有很强的杀菌消毒功能。另外有机微量元素通过皮肤渗透,可以参与细胞代谢,促进皮肤生长。本发明使用的微量元素原液是北京金山生态动力素制造有限公司生产的微量元素原液,它的商品名为生命动力素,学术名称为金属离子线性凝聚态磁化矿溶液。
[0020]
在上述可吸收防粘连材料中,所述生物活性矿物质材料是指含有硅、磷、氧的无机化合物;作为一种优选实施方式,所述生物活性矿物质材料包括生物活性玻璃、regesi再生
硅、羟基磷灰石、磷硅酸盐及其衍生物、硅酸盐及其衍生物和磷酸盐及其衍生物中的一种或几种。
[0021]
本发明中提到的regesi再生硅是按照申请公布号为:cn111017934a的中国专利中的方法进行制备得到的。上述regesi再生硅包括:纳米级的二氧化硅粒子堆积而成的具有多孔结构的支架,以及均匀分布于所述支架中的钙和磷元素,是具有生物活性的磷硅酸钙化合物;所述再生硅的比表面积为200-350
㎡
/g;其对应的市售产品为幸福益生再生医学科技有限公司生产的再生硅。
[0022]
在上述可吸收防粘连材料中,作为一种优选实施方式,当所述可吸收防粘连材料包括抗菌消炎层a和防粘连层b时,抗菌消炎层a附着于防粘连层b的单面或双面上;或者防粘连层b附着于抗菌消炎层a的单面或双面上。
[0023]
在上述可吸收防粘连材料中,作为一种优选实施方式,当抗菌消炎层a附着于防粘连层b的单面或双面上时,抗菌消炎层a中生物活性矿物质材料的质量含量低于防粘连层b中生物活性矿物质材料的质量含量。
[0024]
本发明中,抗菌消炎层里面的抗菌消炎成分起主要作用,生物活性矿物质材料添加量小,起辅助作用;本发明优选ab或aba双层结构中的防粘连层b中生物活性矿物质材料的添加量较多,其促修复作用层层递进,逐层加强,避免生物活性矿物质材料一次性添加量太多,出现机体不耐受的情况。若将所述防粘连材料制备为凝胶状,凝胶状的防粘连材料吸收渗透液的作用减弱(吸水性变差),效果不具有逐级递进的作用。
[0025]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述可吸收防粘连材料中各层的排列结构型为:a、b、ab、aba或bab。
[0026]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述的抗菌消炎层a的平均孔径为20~500μm(例如50μm、100μm、150μm、200μm、250μm、300μm、350μm、400μm、450μm)。
[0027]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述的抗菌消炎层a的厚度为0-10mm(例如1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm),抗拉强度为10~300n/cm(例如30n/cm、60n/cm、90n/cm、150n/cm、200n/cm、250n/cm)。
[0028]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述的抗菌消炎层a的抗菌消炎成分包括:抗生素类消炎成分、中药提取物和季铵盐类抗菌成分中一种或几种。
[0029]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述抗生素类消炎成分为β-内酰胺类抗生素、氨基糖苷类抗生素、喹诺酮类抗生素和大环内酯类抗生素中的一种或几种。
[0030]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述中药提取物为黄连、牛黄、黄芩、黄柏、金银花和连翘提取物中的一种或几种。
[0031]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述季铵盐类抗菌成分为氨基多糖季铵盐和/或壳聚糖季铵盐。
[0032]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述的防粘连层b的平均孔径范围20~500μm(例如50μm、100μm、150μm、200μm、250μm、300μm、350μm、400μm、450μm)。
[0033]
本发明中的平均孔径指的是冻干海绵上形成的各个空隙的平均孔径。孔径越小,结构越致密,吸水率较高,可用于高渗出液的伤口;反之,适用于低渗出液的伤口。孔径的大小主要取决于人体可降解吸收的高分子材料的种类和添加量。
[0034]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述的防粘连层b的厚度为0-10mm(例如1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm),抗拉强度为10~300n/cm(例如30n/cm、60n/cm、90n/cm、150n/cm、200n/cm、250n/cm)。
[0035]
本发明所述的抗菌消炎层a和能够促进伤口愈合的防粘连层b中人体可降解吸收的高分子材料可通过高分子材料的种类和分子量不同来调节产品在人体内的降解时间,根据不同创伤部位的要求来调整降解时间。
[0036]
本发明所述的能够促进伤口愈合的抗菌消炎层a和防粘连层b中的生物活性矿物质材料可通过高温烧结予以调节生物活性矿物质材料在生物体内的保留时间。
[0037]
在上述可吸收防粘连材料中,作为一种优选实施方式,所述可吸收防粘连材料在生物体内降解的周期为3天至2年(例如5天、10天、1个月、3个月、6个月、9个月、12个月、18个月)。
[0038]
上述可吸收防粘连材料的制备方法,包括以下步骤:
[0039]
(a)按照上述可吸收防粘连材料中防粘连层b中活性成分的用量配比,用水溶解人体可降解吸收的高分子材料,然后加入增塑剂、生物活性矿物质材料和微量元素原液,制备成第一溶液组;
[0040]
(b)按照上述可吸收防粘连材料中抗菌消炎层a中活性成分的用量配比,用水溶解人体可降解吸收的高分子材料,然后加入增塑剂、生物活性矿物质材料、微量元素原液和抗菌消炎成分,制备成第二溶液组;
[0041]
(c)可吸收防粘连材料的制备:
[0042]
a型:将所述第二溶液组倒入模具中,冷冻凝结至固态,之后抽真空,冷冻干燥至海绵状,得到a型可吸收防粘连材料;
[0043]
b型:将所述第一溶液组倒入模具中,冷冻凝结至固态,之后抽真空,冷冻干燥至海绵状,得到b型可吸收防粘连材料;
[0044]
ab和aba型:将所述第一溶液组倒入模具中,冷冻凝结至固态,之后抽真空,冷冻干燥至海绵状,得到防粘连层b,使用喷涂装置将所述第二溶液组喷涂至所述防粘连层b的两面或其中一面上,得到aba型或ab型可吸收防粘连材料;
[0045]
bab型:将所述第二溶液组倒入模具中,冷冻凝结至固态,之后抽真空,冷冻干燥至海绵状,得到抗菌消炎层a;使用喷涂装置将所述第一溶液组喷涂在所述抗菌消炎层a的两面,得到bab型可吸收防粘连材料。
[0046]
在上述制备方法中,作为一种优选实施方式,步骤(a)中所述水为注射用水或灭菌注射用水。
[0047]
在上述制备方法中,作为一种优选实施方式,步骤(a)中所述第一溶液组的含水量为40wt%-90wt%(例如50wt%、60wt%、70wt%、80wt%),优选为52wt%-88.89wt%(例如55wt%、58wt%、62.5wt%、67.5wt%、72.5wt%、77.5wt%、82.5wt%、85wt%)。
[0048]
在上述制备方法中,作为一种优选实施方式,步骤(b)中所述第二溶液组的含水量为32wt%-88wt%(例如35wt%、40wt%、50wt%、60wt%、70wt%、80wt%)。
[0049]
在上述制备方法中,作为一种优选实施方式,步骤(c)中制备得到的可吸收防粘连材料的含水量≤10%(例如1%、2%、3%、4%、5%、6%、7%、8%、9%)。
[0050]
本发明采用了注射用水作为溶剂,一方面避免了有机溶剂对人体的危害,另一方
面可以根据伤口位置的不同,选择对应级别的水,当所述防粘连材料用于体内时,选择注射用水或灭菌注射用水。
[0051]
在上述制备方法中,作为一种优选实施方式,还包括:(d)将步骤(c)中得到的可吸收防粘连材料,冷冻凝结至固态,之后抽真空冷冻干燥至海绵状,根据不同的伤口部位和伤口形状,裁剪成不同的形状,装入包装中,密封。
[0052]
在上述制备方法中,作为一种优选实施方式,还包括:步骤(e),对步骤(d)中得到的密封后的可吸收防粘连材料进行灭菌;优选地,灭菌的方式为环氧乙烷灭菌、伽马射线灭菌、电子束灭菌、干热灭菌和臭氧灭菌中的一种。
[0053]
在上述制备方法中,作为一种优选实施方式,所述搅拌的速度为50rpm/min~500rpm/min(例如100rpm/min、150rpm/min、200rpm/min、250rpm/min、300rpm/min、350rpm/min、400rpm/min、450rpm/min)。
[0054]
在上述制备方法中,作为一种优选实施方式,所述冷冻的温度为-10℃~-100℃(例如-20℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃);优选地,所述真空度为-0.05mpa~-0.1mpa(例如-0.06mpa、-0.07mpa、-0.08mpa、-0.09mpa)。
[0055]
本发明中所用冷冻温度优选为-10℃以下,冷冻温度太高或时间太短会导致冷冻干燥时产品鼓泡,影响产品最终的产品形态。
[0056]
在上述制备方法中,作为一种优选实施方式,所述增塑剂为多元醇;优选地,所述多元醇为甘油和/或聚乙二醇。
[0057]
在上述制备方法中,作为一种优选实施方式,所述可吸收防粘连材料的多层结构形式为ab型时,抗菌消炎层a与防粘连层b的质量比为1:(0.01-100)(例如1:1、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90),优选为1:(0.02-50)(例如1:0.05、1:0.1、1:0.5、1:1.5、1:3、1:6、1:9、1:15、1:25、1:35、1:45)。
[0058]
在上述制备方法中,作为一种优选实施方式,所述可吸收防粘连材料的多层结构形式为aba型时,抗菌消炎层a总质量与防粘连层b的质量比为1:(0.01-100)(例如1:1、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90),优选为1:(0.02-50)(例如1:0.05、1:0.1、1:0.5、1:1.5、1:3、1:6、1:9、1:15、1:25、1:35、1:45)。
[0059]
本发明所用的生物活性矿物质材料,同时对软组织与骨组织具有修复和键合作用的,具有良好的生物相容性和骨传导性;生物活性矿物质材料对成纤维细胞增殖、胶原基质的再生具有促进作用,且在体内的保留时间可通过高温烧结予以调节,弥补了其他材料(如透明质酸等)注射周期短的问题。
[0060]
本发明与现有技术相比,其优点在于:
[0061]
(1)本发明通过生物活性矿物质材料的特有属性和其在生物体内的保留时间,将其复配制成一种可吸收防粘连材料。生物活性矿物质材料与体液接触后形成三维网状结构,有利于细胞的增殖和攀爬,引导细胞分化,使组织之间紧密结合,加快伤口愈合,有效防止创面修复后的组织粘连。
[0062]
(2)本发明所制备的一种可吸收防粘连材料,降解周期可控,通过人体可降解吸收高分子材料的种类和分子量,以及生物活性矿物质材料的烧结温度来调整产品在人体内的降解时间,根据不同创伤部位的要求来调整降解时间。
[0063]
另外,本发明的防粘连材料在生物体内经水解、酶解等过程,逐渐降解成低分子量
化合物或单体,降解产物能被排出体外或能参加体内正常新陈代谢而消失的材料;避免进行二次取出手术,减少了病人的痛苦,同时又不会在人体内形成长期存在的异物。
[0064]
(3)本发明通过探索微量元素对人体结构和器官的重要价值,将其与人体组织有利的20多种微量元素添加到防粘连材料中,促进组织细胞的新陈代谢,增强细胞活力,提高其免疫力,抗击细菌和病毒的侵入,防治各种炎症。
[0065]
(4)本发明所制备的一种可吸收防粘连材料为多孔结构(真空冷冻干燥过程中升华形成的空隙以及生物活性矿物质材料本身具备的多孔结构),具有较大的比表面积,与体液接触后形成三维网状结构,有利于细胞的增殖和攀爬,引导细胞分化,使组织之间紧密结合,加快伤口愈合,有效防止创面修复后的组织粘连。
[0066]
(5)本发明所制备的一种可吸收防粘连材料,集抗菌消炎、加快伤口愈合、降解可控、安全无刺激等优势于一体,为患者提供了集多功能性和便利性为一体的防粘连材料。
[0067]
(6)本发明制备的一种可吸收防粘连材料,适用于体内和体外创面,如肝脏/肺部损伤、宫腔粘连、心脏手术损伤、剖腹产手术损伤、以及体外的急性和慢性创面,可以加快伤口愈合,并根据不同创面部位,调节所述防粘连材料的降解周期。
[0068]
(7)本发明所制备的一种可吸收防粘连材料是由人体可降解吸收的高分子材料组成,溶剂为水,避免了使用有机溶剂带来的危害。
[0069]
(8)本发明采用单层或多层结构形式的防粘连材料,使其适用于不同的伤口部位;并且根据伤口的形状的不同,可以定制出与伤口相适应的圆形、矩形、心形、多边形以及立体结构。
[0070]
(9)本发明所制备的一种可吸收防粘连材料质地柔软,具有一定的抗拉强度,更有利于组织之间的紧密结合,能够提高病人的舒适感。
附图说明
[0071]
图1为生物活性玻璃edx能谱图,其中,生物活性玻璃中的钙离子含量为23.5wt%;
[0072]
图2为regesi再生硅的edx能谱图,其中,regesi再生硅中的钙离子含量为34.3wt%。
具体实施方式
[0073]
为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例和对比例对本发明制备的能够抗菌消炎、加快伤口愈合、降解周期可控的可吸收防粘连材料作进一步的说明,但本发明不受这些具体实施例和对比例的限制。
[0074]
本发明实施例中所用的生物活性玻璃为肖特/诺邦的45s5,其edx能谱图如附图1所示,所述生物活性玻璃中的钙离子含量为23.5wt%;本发明实施例中所用的regesi再生硅是按照申请公布号为:cn111017934a的中国专利中的方法进行制备得到的。上述regesi再生硅包括:纳米级的二氧化硅粒子堆积而成的具有多孔结构的支架,以及均匀分布于所述支架中的钙和磷元素,是具有生物活性的磷硅酸钙化合物;所述再生硅的比表面积为200-350
㎡
/g;其对应的市售产品为幸福益生再生医学科技有限公司生产的再生硅,所述再生硅的edx能谱图如附图2所示,所述regesi再生硅中的钙离子含量为34.3wt%。
[0075]
实施例1
[0076]
以制备透明质酸酸钠-生物活性玻璃-甘油-β内酰胺-微量元素原液防粘连材料为例。
[0077]
将1克透明质酸钠溶于87.89克注射用水中,加热至60~80℃,搅拌溶解得到透明质酸钠水溶液,加入0.1克甘油、0.01克的生物活性玻璃和10克微量元素原液,搅拌均匀,分成两组,其中一组质量为10克,向其中加入1克的β内酰胺消炎成分,搅拌均匀,即得用来制备抗菌消炎层的第二溶液组,静置待用;另一组质量为89克,为用来制备防粘连层的第一溶液组,将其注入模具后放入冷冻箱内,温度为-10℃,冷冻24小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b。将用来制备抗菌消炎层的第二溶液组喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将用来制备抗菌消炎层的第二溶液组全部喷涂至防粘连层b的表面,即得到一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料(透明质酸酸钠-生物活性玻璃-甘油-β内酰胺-微量元素原液)。
[0078]
实施例2
[0079]
以制备透明质酸钠/羧甲基纤维素钠-regesi再生硅-甘油-β内酰胺-微量元素原液防粘连材料为例。
[0080]
将1克透明质酸钠和1克羧甲基纤维素钠溶于72克注射用水中,加热至60~80℃,搅拌溶解得到透明质酸钠/羧甲基纤维素钠水溶液,加入6克甘油、5克regesi再生硅和10克微量元素原液,搅拌均匀,分成两组,其中一组的质量为20克,向其中加入5克的β内酰胺消炎成分,搅拌均匀,即得用来制备抗菌消炎层的第二溶液组,静置待用;另一组的质量为75克,为用来制备防粘连层的第一溶液组,将其注入模具后放入冷冻箱内,温度为-20℃,冷冻10小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b。将用来制备抗菌消炎层的第二溶液组喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将用来制备抗菌消炎层的第二溶液组全部喷涂至防粘连层b的表面,即得到一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料(透明质酸钠/羧甲基纤维素钠-regesi再生硅-甘油-β内酰胺-微量元素原液防粘连材料)。
[0081]
实施例3
[0082]
以制备羧甲基纤维素钠-regesi再生硅-聚乙二醇-β内酰胺-微量元素原液防粘连材料为例。
[0083]
将2克羧甲基纤维素钠溶于75.98克注射用水中,加热至60~80℃,搅拌溶解得到羧甲基纤维素钠水溶液,加入10克聚乙二醇、10克regesi再生硅和2克微量元素原液,搅拌均匀,分成两组,其中一组的质量为1克,向其中加入0.02克的β内酰胺消炎成分,搅拌均匀,即得用来制备抗菌消炎层的第二溶液组,静置待用;另一组的质量为98.98克,为用来制备防粘连层的第一溶液组,将其注入模具后放入冷冻箱内,温度为-50℃,冷冻4小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b。将用来制备抗菌消炎层的第二溶液组喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将用来制备抗菌消炎层的第二溶液组全部喷涂至防粘连层b的表面,即得到一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料(羧甲基纤维素钠-regesi再生硅-聚乙二醇-β内酰胺-微量元素原液防粘连材料)。
[0084]
实施例4
[0085]
以制备壳聚糖/透明质酸钠-regesi再生硅-聚乙二醇-β内酰胺-微量元素原液防粘连材料为例。
[0086]
将1克壳聚糖和1克透明质酸钠溶于75.98克注射用水中,加热至60~80℃,搅拌溶解得到壳聚糖/透明质酸钠水溶液,加入10克聚乙二醇、10克regesi再生硅和2克微量元素原液,搅拌均匀,分成两组,其中一组的质量为1克,向其中加入0.02克的β内酰胺消炎成分,搅拌均匀,即得用来制备抗菌消炎层的第二溶液组,静置待用;另一组的质量为98.98克,为用来制备防粘连层的第一溶液组,将其注入模具后放入冷冻箱内,温度为-50℃,冷冻4小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b。将用来制备抗菌消炎层的第二溶液组,喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将用来制备抗菌消炎层的第二溶液组,全部喷涂至防粘连层b的表面,即得到一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料(壳聚糖/透明质酸钠-regesi再生硅-聚乙二醇-β内酰胺-微量元素原液防粘连材料)。
[0087]
实施例5
[0088]
以制备壳聚糖/透明质酸钠-羟基磷灰石-聚乙二醇-黄连提取物-微量元素原液防粘连材料为例。
[0089]
将1克壳聚糖和1克透明质酸钠溶于36克注射用水中,加热至60~80℃,搅拌溶解得到壳聚糖/透明质酸钠水溶液,加入20克聚乙二醇、20克羟基磷灰石和6克微量元素原液,搅拌均匀,分成两组,其中一组的质量为50克,向其中加入16克的黄连提取物,搅拌均匀,即得用来制备抗菌消炎层的第二溶液组,静置待用;另一组的质量为34克,为用来制备防粘连层的第一溶液组,将其注入模具后放入冷冻箱内,温度为-80℃,冷冻3小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b。将用来制备抗菌消炎层的第二溶液组喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将用来制备抗菌消炎层的第二溶液组全部喷涂至防粘连层b的表面,即得到一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料(壳聚糖/透明质酸钠-羟基磷灰石-聚乙二醇-黄连提取物-微量元素原液防粘连材料)。
[0090]
实施例6
[0091]
以制备淀粉/壳聚糖-生物活性玻璃(肖特/诺邦的45s5)-甘油-氨基多糖季铵盐-微量元素原液防粘连材料为例。
[0092]
将1克淀粉和2克壳聚糖溶于60克注射用水中,加热至60~80℃,搅拌溶解得到淀粉/壳聚糖水溶液,加入12克甘油、15克生物活性玻璃和2克微量元素原液,搅拌均匀,分成两组,其中一组的质量为20克,向其中加入9克的氨基多糖季铵盐,搅拌均匀,即得用来制备抗菌消炎层的第二溶液组,静置待用;另一组的质量为71克,为用来制备防粘连层的第一溶液组,将其注入模具后放入冷冻箱内,温度为-100℃,冷冻2小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b。将用来制备抗菌消炎层的第二溶液组喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将即得用来制备抗菌消炎层的第二溶液组全部喷涂至防粘连层b的表面,即得到一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料(淀粉/壳聚糖-生物活性玻璃-甘油-氨基多糖季铵盐-微量元素原液防粘连材料)。
[0093]
实施例7
[0094]
以制备淀粉/壳聚糖-生物活性玻璃(肖特/诺邦的45s5)-甘油-氨基多糖季铵盐防粘连材料为例。
[0095]
将1克淀粉和2克壳聚糖溶于62克注射用水中,加热至60~80℃,搅拌溶解得到淀粉/壳聚糖水溶液,加入12克甘油和15克生物活性玻璃,搅拌均匀,分成两组,其中一组的质量为20克,向其中加入9克的氨基多糖季铵盐,搅拌均匀,即得用来制备抗菌消炎层的第二溶液组,静置待用;另一组的质量为71克,为用来制备防粘连层第一溶液组,将其注入模具后放入冷冻箱内,温度为-100℃,冷冻2小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b。将用来制备抗菌消炎层的第二溶液组喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将用来制备抗菌消炎层的第二溶液组全部喷涂至防粘连层b的表面,即得到一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料(淀粉/壳聚糖-生物活性玻璃-甘油-氨基多糖季铵盐防粘连材料)。
[0096]
对比例1
[0097]
以制备透明质酸钠-甘油-微量元素原液防粘连材料为例。
[0098]
将1克透明质酸钠溶于88.9克注射用水中,加热至60~80℃,搅拌溶解得到透明质酸钠水溶液,加入0.1克甘油和10克的微量元素原液,搅拌均匀,将其注入模具后放入冷冻箱内,温度为-10℃,冷冻24小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到一种可吸收防粘连材料(透明质酸酸钠-甘油-微量元素原液)。
[0099]
对比例2
[0100]
以制备透明质酸钠/羧甲基纤维素钠-甘油-β内酰胺-微量元素原液防粘连材料为例。
[0101]
将1克透明质酸钠和1克羧甲基纤维素钠溶于77克注射用水中,加热至60~80℃,搅拌溶解得到透明质酸钠/羧甲基纤维素钠水溶液,加入6克甘油和10克微量元素原液,搅拌均匀,分成两组(组1和组2),组1的质量为75克,用来制备防粘连层,将其注入模具后放入冷冻箱内,温度为-20℃,冷冻10小时后取出,放入真空冷冻干燥机内,真空干燥20小时后取出,得到防粘连层b;组2的质量为20克,用来制备抗菌消炎层,加入5克的β内酰胺消炎成分,搅拌均匀,即得抗菌消炎溶液组3静置待用。将抗菌消炎溶液组3喷涂在防粘连层b的正反两面,喷完后,将其放入真空冷冻干燥机内,干燥5小时后取出,反复喷涂干燥3个循环,将抗菌消炎溶液组3全部喷涂至防粘连层b的表面,即得到一种可吸收防粘连材料(透明质酸钠/羧甲基纤维素钠-甘油-β内酰胺-微量元素原液防粘连材料)。
[0102]
对实施例1-7中制备的一种抗菌消炎、加快伤口愈合、降解可控的可吸收防粘连材料和对比例1-2中制备的一种可吸收防粘连材料进行基本性能评价,具体包括以下几项内容:
[0103]
(1)吸水率
[0104]
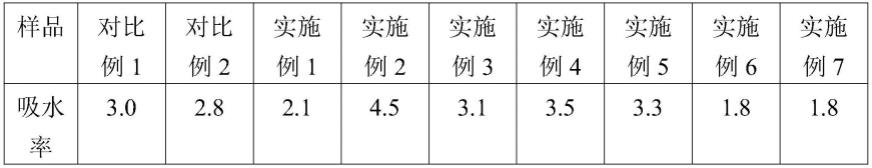
将对比例1-2和实施例1-7中各个防粘连材料裁剪成3cm*3cm,称重得m1,放入37℃无菌模拟体液中,12小时后称重得m2,然后计算吸水率。吸水率=(m2-m1)/m1,吸水率得测试结果如下:
[0105][0106]
由以上结果可知,实施例2的吸水率最高,实施例6和7的吸水率最低。
[0107]
(2)力学性能
[0108]
将对比例1-2和实施例1-7中各个防粘连材料裁剪成3cm*3cm,使用万能试验机进行防粘连材料的力学性能试验,拉力强度测试结果如下:
[0109][0110]
由以上结果可知,对比例2和实施例2的力学性能最好,实施例5的力学性能最差,原因可能是由于生物活性矿物质材料和中药提取物等粉末的添加量过高导致的。
[0111]
(3)止血性能
[0112]
准备spf级sd大鼠30只,随机分组,每组3只。以sd大鼠的肝脏损伤出血为模型,将大鼠麻醉并剃去腹部毛发,用手术刀将腹部打开,露出肝脏。用手术刀在肝脏上开一个长度1cm,深度1cm的伤口。用对比例1-2和实施例1-7制备的样品覆盖在出血肝脏的顶部,盖上纱布垫,同时实施常规的按压操作。每隔5s抬起纱布,观察出血情况直到止血,统计出血时间和出血量。
[0113]
分别取对比例1-2和实施例1-7制备的防粘连材料和对照组(纱布),做以下肝脏止血试验。试验结果记录如下:
[0114][0115][0116]
由以上结果可知,对比例1-2和实施例1-7制备的防粘连材料相对于对照组,具有一定的止血效果,对比例1和实施例1-7制备的防粘连材料材料的止血效果优劣顺序为:实施例4》实施例3》实施例2》实施例6》实施例7》实施例5》对比例2》实施例1》对比例1》对照组。
其中实施例4和实施例3制备的防粘连材料止血效果最好,其原因可能是实施例4和实施例3的配方中添加的regesi再生硅含量较高。其中含有5%regesi再生硅实施例2和含有15%生物活性玻璃实施例6的止血效果相差不大,其原因可能是regesi再生硅中的钙离子含量高于生物活性玻璃导致的,因为适量钙离子的引入,不仅能控制最终所制备的防粘连材料的降解速率,又可以为血液凝固提供必要的钙离子,与防粘连材料产生协同作用,加快止血速度。
[0117]
(4)表面粘附力
[0118]
准备spf级sd大鼠27只,随机分组,每组3只。将sd大鼠背部皮肤切开一个1cm*1cm的创面,然后将对比例1-2和实施例1-7中的防粘连材料样品贴附于创面区域,按压10min后,从材料侧面进行剥离,测定出的拉力值即为创面表面粘附力强度,每个样品测试3次取平均值。测出的表面粘附力结果如下:
[0119][0120]
通过以上结果可知,对比例1-2和实施例1-7所制备的防粘连材料的表面粘附力从大到小排序为:对比例2》实施例2》实施例1》实施例4》对比例1》实施例4》实施例5》实施例6=实施例7。其中粘附力最大的是对比例2制备的防粘连材料,可能的原因是配方中采用的人体可降解吸收高分子材料的粘附力较强;实施例6和实施例7的粘附力最小,其原因可能是配方中的生物活性玻璃与淀粉/壳聚糖的协同降低了所述材料的表面粘附力。
[0121]
(5)体外降解
[0122]
将对比例1-2和实施例1-7中所制备的料各个防粘连材料样品裁剪成2cm*2cm,称重得a0,然后将防粘连材料装入20ml的人体模拟体液中,置于37℃恒温摇床中模拟降解,每天更换模拟体液,观察样品在模拟体液中得变化情况。72小时后将防粘连材料取出,干燥后称重得an。
[0123]
计算降解率(降解率=(a0-an)/a0)并将测试结果记录如下:
[0124][0125]
由以上结果可知,对比例1-2和实施例1-7制备的样品在体外降解试验中降解率从大到小的排列顺序为:对比例1》对比例2》实施例1》实施例2》实施例3=实施例4》实施例5》实施例6=实施例7,生物活性矿物质材料的加入大大降低了本发明防粘连材料的降解速率。
[0126]
(6)生物相容性
[0127]
试验组:选取sd大鼠108只,将上述对比例1-2和实施例1-7制备的防粘连材料置于大鼠背部皮下组织内,分别在3天、7天、14天,21天处死(3只/次),观察局部反应,取出材料
及周围组织,做he染色切片观察,并进一步观察防粘连材料组织周围的炎症反应,评价防粘连材料的生物相容性。
[0128]
对照组:选取sd大鼠12只,采用手术缝合线直接缝合背部伤口,分别在3天、7天、14天,21天处死(3只/次)并观察局部反应。
[0129]
伤口愈合的标准:伤口愈合面积大于原始伤口面积的95%或者伤口面积小于原始伤口面积的5%,即为完全愈合。
[0130]
试验结果:试验组和对照组sd大鼠全部成活,伤口完全愈合,放置防粘连材料部位组织均无化脓、水肿、充血、坏死,说明对比例1-2和实施例1-7制备的防粘连材料对大鼠无害且生物相容性较好。
[0131]
(7)抑菌试验
[0132]
试验细菌选用金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌、黑曲霉。取制备好的防粘连材料与水按照质量比1:20进行配置得到供试品,取供试品(5ml/支)4份,直接接种试验菌;取1ml供试品分别转移至4个无菌容器中,每一容器接种一种试验菌(接种108cfu/ml的菌液0.05ml),1ml供试品中接种菌量为105~106cfu,接种菌液的体积不得超过供试品体积的1%,充分混合,使供试品中的试验菌均匀分布。金黄色葡萄球菌、铜绿假单胞菌接种在胰酪大豆胨琼脂培养基,培养温度在30℃~35℃,培养时间18-24小时;白色念珠菌接种在沙氏葡萄糖琼脂培养基,培养温度在20℃~25℃,培养时间2-3天;黑曲霉接种在沙氏葡萄糖琼脂培养基,培养温度在20℃~25℃,培养时间5-7天。
[0133]
试验样品选取对比例1-2和实施例1-7制备的防粘连材料,对照组为培养基的空白对照。
[0134]
试验结果表明,对比例1-2制备防粘连材料具有抑制菌落生长的现象,说明微量元素原液具有杀菌消炎的效果;实施例1-7的样品均具有良好的抑制菌落生长的现象,其中实施例2的抑菌效果最好(培养基中菌落数最少)。
[0135]
(8)防粘连效果测试
[0136]
试验组:选取sd大鼠27只,随机分为9组,每组3只。适应性饲养一周后,在大鼠小肠部位制作肠粘连创面模型,用手术刷轻刮盲肠前浆膜面,造成轻度渗血,将试验组材料(对比例1-2和实施例1-7中制备的防粘连材料)直接包裹在创面上,3周后观察创口表面的粘连情况和组织学形态。
[0137]
对照组:选取sd大鼠3只,适应性饲养一周后,在大鼠小肠部位制作肠粘连创面模型,用手术刷轻刮盲肠前浆膜面,造成轻度渗血,不做处理,直接缝合伤口,3周后观察创口表面的粘连情况和组织学形态。
[0138]
实验结果:对照组的大鼠创口表面与周围肠系膜间发生大面积粘连,难以分离,属于iii级粘连;实验组对比例1-2的防粘连材料在作用部位与周围的肠系膜间发生轻度粘连;实验组实施例1-7的防粘连材料在作用部位并未与腹腔壁和周围的肠系膜间发生粘连,创口表面仍有部分试验材料剩余。
[0139]
由此可见,实施例1-7的材料与创口粘附性好,对术后粘连的发生起到抑制作用。
[0140]
(9)创面愈合疗效测试
[0141]
准备30只spf级sd大鼠,适应性饲养一周后,随机分为10组,包括试验组和对照组,每组3只大鼠。大鼠经麻醉后,背部剪去毛发,皮肤消毒,在脊柱两侧相同位置各建立一个直
径1.6cm的全层皮肤创面模型,造模后单笼饲养。每隔2天拿无菌尺测量伤口直径,拍照记录和观察伤口的愈合情况,计算14天内创面愈合率。
[0142]
试验组采用对比例1-2和实施例1-7中制备的防粘连材料对大鼠皮肤创面进行治疗;
[0143]
对照组伤口暴露,日常对其进行止血和渗液清洁。
[0144]
创面愈合率的计算公式如下:愈合率=(原始伤口面积-未愈合伤口面积)/原始伤口面积*100%。
[0145]
伤口愈合的标准:伤口愈合面积大于原始伤口面积的95%或者伤口面积小于原始伤口面积的5%,即为完全愈合。
[0146]
创面愈合率的记录结果如下:
[0147][0148]
由以上结果可知,对比例1-2和实施例1-7制备的样品对大鼠皮肤伤口愈合效果优于对照组。对比例1-2的样品对大鼠皮肤伤口愈合效果优于对照组,其原因可能是因为微量元素对伤口具有促进愈合的效果;实施例1-7样品对伤口皮肤愈合效果的优劣排序顺序为:实施例3=实施例4》实施例2》实施例6》实施例7》实施例5》实施例1,其伤口愈合效果可能与生物活性矿物质材料的种类和添加量有关。根据以上结果,以regesi再生硅为生物活性矿物质材料进行制备防粘连材料对大鼠创面的促愈合效果优于使用生物活性玻璃和羟基磷灰石。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1