一种颗粒凝胶复合支架及其制备方法和应用
一种颗粒凝胶复合支架及其制备方法和应用
1.本发明是申请日为2021年11月18日,申请号为202111367445.x,发明名称为一种用于组织工程皮肤的颗粒凝胶复合支架及其制备方法的分案申请。
技术领域
2.本发明属于生物材料及组织工程学技术领域,具体涉及一种用于组织工程皮肤的颗粒凝胶复合支架及其制备方法。
背景技术:
3.组织工程皮肤是指将培养的功能细胞与细胞外基质及支架材料互相作用制成的一种具有生物活性的人工皮肤。将不同类型的细胞组成的皮肤细胞系统,可以模拟真实皮肤对外界环境的反应,从而预测这种敏感器官的感应行为。近年来,随着动物实验的替代(replacement)、减少(reduction)、优化(refinement)原则即3r原则的提出以及全球相关法规的推进,与皮肤相关的动物实验逐渐被组织工程皮肤所替代。为突破由此造成的相关专利壁垒,迫切需要发展组织工程皮肤的相关技术。
4.构建组织工程皮肤一般需要支架、细胞与生长因子等。其中,支架材料是构建组织工程皮肤的关键,其既要能有效地支撑细胞,又要能促进细胞外基质(ecm)的分泌以形成皮肤组织。由于人体皮肤ecm中含有丰富的i型胶原和iii胶原,因此,胶原蛋白一直是组织工程皮肤支架构建的主要材料。但是,胶原支架的一个主要缺点是在培养过程中易受成纤维细胞介导而收缩,导致无法塑形、表皮层脱附等严重问题,妨碍了组织工程皮肤的批量化构建;此外,支架的收缩还会对其作为皮肤移植物时的功效和植入成功率造成不良影响。基于此,研究者开发了一些物理和化学交联的方法以降低胶原支架的收缩率。然而,由于大多数交联剂(如戊二醛、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐等)细胞毒性较大,故需要在接种细胞之前对支架材料进行交联。这些方法还需要额外的清洗步骤,无法保证细胞在支架材料中的均一分布;更为重要的是,这些交联剂的使用会干扰胶原纤维的组装过程,对胶原支架的生理活性造成影响。例如专利cn102836462a即公开了将胶原蛋白与壳聚糖复配后,加入戊二醛进行交联,制备组织工程皮肤,该皮肤机械强度不高,且会收缩,不利于功能细胞的充分生长和分化。
5.颗粒凝胶是指由高体积分数水凝胶颗粒构成的一类新型黏弹性材料,它不仅具备常规水凝胶含水量高、生物相容性好的特点,还具有剪切稀化、自愈合、可打印等特征。最近,以颗粒凝胶为细胞载体,实现了软骨和心肌梗塞的修复,骨关节炎的治疗等。但是,颗粒凝胶在组织工程皮肤构建中的应用尚未见报道。将颗粒凝胶与传统胶原基质结合,有望获得一种兼具生物相容性、抗收缩性和打印性等诸多优势的新型复合支架材料,可以作为现有组织工程皮肤构建技术的重要补充。
技术实现要素:
6.本发明的目的是制备一种可用于组织工程皮肤构建的颗粒凝胶复合支架,具有抗
收缩、生物相容性好、打印性好、有足够强度的特点。
7.为达到上述目的,本发明采用的技术方案是:
8.一种用于组织工程皮肤的颗粒凝胶复合支架的制备方法,包括以下步骤:
9.1)将一定体积分数的水凝胶颗粒加入至胶原蛋白溶液中,得到颗粒凝胶;
10.2)将颗粒凝胶ph值调节至生理条件,并加入功能细胞,得到共混物;
11.3)将上述共混物转移至模板中或3d打印得到颗粒凝胶复合支架。
12.本发明用于组织工程皮肤应用的复合支架材料是以一定体积分数的水凝胶颗粒和胶原蛋白预凝胶为主要基质,包埋功能细胞,在37℃下胶原发生自交联而形成。其中水凝胶颗粒选用天然生物相容性材料,无明显细胞毒性,结合胶原蛋白可适用于不同功能细胞的共培养,保证了细胞在三维空间的动态变化过程,更有利于细胞在体外进行长期、高效、稳定的培养。此外,通过水凝胶颗粒的嵌入提高了整体支架的机械性能,其中支架强度可以通过水凝胶颗粒的大小和体积分数来进行调节。同时,由于水凝胶颗粒体积分数占比大,水凝胶颗粒之间会形成阻塞(jamming)效应,形成颗粒凝胶;因此,该支架材料兼具颗粒凝胶的特性,如剪切稀化、自愈合、可打印等优点。
13.该支架的制备过程简单,不干扰胶原纤维的组装过程,最大程度地保留了胶原水凝胶的理化特性和生物活性;并且,该支架材料还具有独特的抗收缩特性,适用于组织工程皮肤的批量化构建。
14.虽然现有技术中存在将胶原蛋白和透明质酸、胶原蛋白、纤维蛋白、纤连蛋白、弹性蛋白、明胶、壳聚糖、海藻酸钠、聚乙二醇、聚乙烯醇和聚丙烯酰胺等水凝胶原料一起混合,再交联固化形成支架材料,但是这类支架材料中为分子级别直接共混,并不含有水凝胶颗粒成分,也未涉及颗粒凝胶的构建。本发明通过将高体积分数的水凝胶颗粒加入到胶原蛋白溶液中,得到颗粒凝胶,调整混合液至中性后,胶原会发生原位交联,最终形成水凝胶颗粒为支撑体、胶原纤维为连接网格的类似于“钢筋-混凝土”结构,如此可以增加复合支架的强度,并且能够实现抗收缩性。另外,水凝胶颗粒之间有空隙,可以通过调节水凝胶颗粒的尺寸或加入量来形成不同空隙量的复合支架,有利于复杂的生物结构的体外构建。同时,该复合支架中不含有传统的用于胶原蛋白交联的交联剂例如戊二醛、京尼平等,水凝胶颗粒也是生物相容性材料,所以复合支架的生物相容性优异。
15.进一步地,所述胶原蛋白选自胶原i型、胶原ii型、胶原iii型和胶原iv型中的一种或多种;所述共混物中胶原蛋白的浓度为0.1-10mg/ml。
16.进一步地,所述颗粒凝胶中水凝胶颗粒的体积分数占比为50%-74%。
17.进一步地,所述水凝胶颗粒的制备原料选自透明质酸、胶原蛋白、纤维蛋白、纤连蛋白、弹性蛋白、明胶、壳聚糖、海藻酸钠、聚乙二醇、聚乙烯醇和聚丙烯酰胺中的一种或多种;所述水凝胶颗粒的制备原料经化学或物理交联后,由微流控法、机械破碎法或乳化法制备得到所述水凝胶颗粒。
18.进一步地,所述水凝胶颗粒的制备原料占共混物质量的0.1%-10%,粒径为1μm-1000μm,为无规则块状颗粒或微球型颗粒。
19.进一步地,所述功能细胞选自角质形成细胞、间质干细胞、血管内皮细胞、周细胞、黑色素细胞、朗格汉式细胞、纤维细胞和成纤维细胞中的一种或多种。
20.进一步地,步骤3)中所述模板为transwell嵌套,将其转移至37℃培养箱中孵育,
胶原发生原位交联形成颗粒凝胶复合支架后,加入完全培养基进行三维细胞培养,并定时更换新鲜培养基。
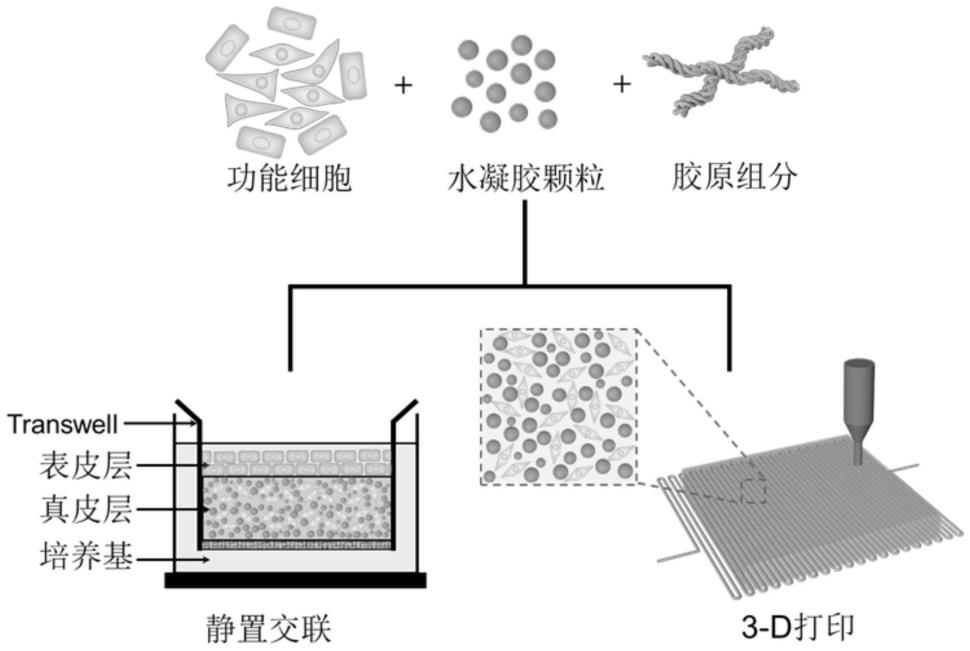
21.进一步地,所述3d打印为生物打印,打印温度为37℃,打印的真皮模型再转移至无菌培养皿中,加入完全培养基进行三维细胞培养,并定时更换新鲜培养基。
22.本发明还提供了上述制备方法制备得到的用于组织工程皮肤的颗粒凝胶复合支架,其能抗收缩,生物相容性好,不影响细胞生长和分化的,打印性好,机械强度高。
23.由于上述技术方案的运用,本发明与现有技术相比具有下列优点:
24.(1)本发明的复合支架采用的原料均为生物相容材料,具有可注射、模量可调、可打印等优势;并且可以通过对水凝胶颗粒的结构和组分进行定制设计,以满足特定细胞或组织构建所需的个性化要求;
25.(2)本发明的复合支架有效地解决了细胞生长所导致的支架收缩的问题,可实现细胞在三维环境中稳定的生长和结构稳定,有利于提高体外模型构建和测试评价时的一致性。
26.(3)本发明的复合支架亦可应用于构建其他人造器官模型,取代动物实验,进行长期毒理、药理作用研究。
附图说明
27.附图1为用于组织工程皮肤的复合支架的制备方法的示意图。
28.附图2为实施例1制备得到的复合支架第1、10、20天的收缩实物图。
29.附图3为实施例1制备得到的复合支架的凝胶收缩百分比图。
30.附图4为实施例1制备得到的复合支架第5天的细胞活死染色图。
31.附图5为实施例2制备得到的复合支架用于培养nih/3t3和hacat细胞的mtt图。
32.附图6为实施例2制备得到的复合支架第1、3、7天的细胞生长实物图。
33.附图7为实施例1制备得到的复合支架第1、3、7天的细胞骨架染色数据。
34.附图8为实施例1制备得到的复合支架的人造皮肤模型的he染色数据。
35.附图9为实施例1制备得到的复合支架的流变数据。
36.附图10为实施例2制备得到的复合支架的流变数据。
具体实施方式
37.本发明的用于组织工程皮肤的复合支架的制备方法的示意图如附图1所示。
38.下面结合具体实施例详细说明本发明的技术方案,以便本领域技术人员更好理解和实施本发明的技术方案,但并不因此将本发明限制在所述的实例范围之中。
39.实施例1
40.采用如下方法制备本发明的用于组织工程皮肤的复合支架:
41.1)水凝胶颗粒的制备
42.1.1)丁二醇二缩水甘油醚bdde交联ha水凝胶的制备
43.首先将50μl的丁二醇二缩水甘油醚bdde与3ml的0.25m naoh混合,制备1,4-丁醇二缩水甘油醚的水溶液。然后将400mg透明质酸ha粉(分子量=106da)加入上述溶液中,充分搅拌3h形成13.3%(w/v)ha浓度的溶液。其中反应在50℃下进行,ph维持在13.0
±
0.5。用
0.1m hcl将溶液调至中性,待反应完成后,将水凝胶溶液转移到透析袋中,用蒸馏水透析2天,透析袋分子量规格为14000。
44.1.2)bdde交联ha水凝胶颗粒的制备
45.将上述透析好的ha凝胶块取出在100目(0.15mm)的筛网上进行研磨,筛网下方放置装有适量纯水培养皿,用于收集ha水凝胶颗粒。研磨完后,将培养皿中的液体转移至离心管,在8000rpm下离心3分钟,去除上清液。再次加入纯水离心去除上清液,重复3次。
46.2)水凝胶颗粒、功能细胞与胶原蛋白的共混培育
47.2.1)首先将ha水凝胶颗粒进行紫外灭菌处理,并浸入pbs或培养基中进行3-5次置换;准备细胞数为1x10
6-2x10
6 cells/ml小鼠成纤维细胞悬液;
48.2.2)提前将用到的ep管在冰浴下遇冷2min。
49.2.3)在冰浴条件下,混合0.1m 0.05ml naoh溶液,0.55ml胶原醋酸溶液。胶原的最终浓度为2.5mg/ml。
50.2.4)缓慢加入ha水凝胶颗粒和0.1ml 10x pbs缓冲液,吹打混匀后调节溶液为中性。ha水凝胶颗粒占总溶液体积的70%。
51.2.5)向上述溶液中加入0.09ml 10x培养基,充分混匀后加入0.1ml血清和0.01ml双抗(青霉素/链霉素)。
52.2.6)加入0.1ml带有培养基的小鼠成纤维细胞悬液,吹打混匀。
53.2.7)取0.3ml上述混合溶液转移至12孔板transwell中进行培养,做三组平行样。
54.上述混合溶液中,以ha原料计算,ha原料占上述混合溶液质量的0.5%。
55.3)全皮层的构建:
56.将上述混合溶液转移至37℃培养箱中孵育30min。待形成凝胶后在transwell内室加入0.5ml含有人永化角质形成细胞的完全培养基,外室加入1ml完全培养基进行三维细胞培养,每24h更换一次新鲜培养基,连续培养3天。吸出transwell中所有培养基,在外室中加入350μl皮肤分化培养基,保证其液面高度与transwell底部齐平,在气液界面处连续培养11天。
57.对照组的制备方法基本同实施例1,区别仅在于:不加入相应的水凝胶颗粒。
58.测试实施例1的真皮层的收缩性能,其第1、10、20天的收缩实物图如附图2所示,可见该真皮层具有优异的抗收缩性能。计算实施例1以及对照组的真皮层在不同培养天数的收缩百分比,结果如附图3所示,可见相比于对照组,实施例1的真皮层的抗收缩性能显著。
59.采用哈克流变仪测试实施例1和对照组真皮层的机械性能,结果如附图9所示。在相同的应变条件下,加入颗粒胶后胶原凝胶的模量与胶原对照组相比增加了10倍,并且在较大的应变条件下可以持续保持固体行为。
60.实施例1和对照组的真皮层第5天的细胞活死染色图如附图4所示,可见实施例1的真皮层细胞活死情况基本同对照组,说明实施例1的真皮层同样具有良好的生物相容性。
61.附图7为实施例1和对照组制备得到的复合支架第1,3,7天的细胞骨架染色图。可见第七天时,实施例1中的真皮层中功能细胞在三维结构中均舒展,生长和分化,生长情况明显优于对照组。
62.附图8为实施例1制备得到的复合支架的人造皮肤模型he染色数据。可见,所构建的皮肤模型其表皮层和真皮层分明,并且构建的表皮层的厚度与正常人的相近,能够正常
模拟人皮肤组织的形态结构。
63.实施例2
64.制备用于组织工程皮肤的复合支架的工艺基本同实施例1,区别仅在于:未加入表皮细胞构建表皮层,改变ha水凝胶颗粒的用量,使得以ha粉原料计算,ha粉原料占步骤2.7)的混合溶液质量的0.12%。加入的ha水凝胶颗粒占总溶液体积的50%。
65.采用哈克流变仪测试实施例2的真皮层的机械性能,结果如附图10所示。在线性黏弹区内,加入0.12%ha颗粒胶的胶原凝胶模量提升至200pa。
66.附图5为实施例2和对照组制备得到的复合支架分别用于培养nih/3t3和hacat细胞的mtt图。可见实施例2的真皮层明显更利于两种细胞的生长和分化,尤其是hacat细胞。
67.附图6为实施例2和对照组制备得到的复合支架第1,3,7天的细胞生长实物图。可见,第七天时,实施例2的真皮层上生长和分化的细胞明显多于对照组。
68.实施例3
69.1)水凝胶颗粒的制备
70.1.1)京尼平改性胶原水凝胶预聚体的制备
71.京尼平改性胶原水凝胶预聚体制备过程与实施例1中2.2)-2.4)步骤基本相同,区别仅在于:步骤2.4)改为,缓慢加入溶解0.01%(w/v)京尼平的胶原混合溶液。
72.1.2)京尼平改性胶原水凝胶颗粒的制备
73.使用pdms芯片,将含2%(w/w)乳化剂fe-surf的氟油(7500)为连续相,上述胶原混合溶液为分散相,在低温条件下调节两相流速制备1μm-1000μm范围的微球,然后在37℃下进行固化交联。
74.2)水凝胶颗粒、功能细胞与胶原组分的共混培育
75.2.1)首先将京尼平改性胶原水凝胶颗粒进行紫外灭菌处理60min,并浸入pbs或培养基中进行多次置换;准备细胞数为1x10
6-2x10
6 cells/ml小鼠成纤维细胞悬液;
76.2.2)提前将用到的ep管在冰浴下遇冷2min。
77.2.3)在冰浴条件下,混合0.1m 0.05ml naoh溶液,0.55ml胶原醋酸溶液。胶原的最终浓度为0.1mg/ml。
78.2.4)缓慢加入京尼平改性胶原水凝胶颗粒和0.1ml 10x pbs缓冲液,吹打混匀后调节溶液为中性。京尼平改性胶原水凝胶颗粒占总溶液体积的50%。
79.2.5)向上述溶液中加入0.09ml 10x培养基,充分混匀后加入0.1ml血清和0.01ml双抗(青霉素/链霉素)。
80.2.6)加入0.1ml带有培养基的成纤维细胞悬液,吹打混匀后制备成3d打印前驱体。
81.以步骤1.1)中胶原原料计算,胶原原料占步骤2.6)的3d打印前驱体质量的0.12%。
82.3)真皮层的构建
83.将上述3d打印前驱体作为打印墨水装配于生物3d打印机上,通过程序控制打印喷头,调节打印平台的温度为37℃后进行生物打印,最后将打印的特定外观的真皮模型转移至无菌培养皿中,加入完全培养基进行三维细胞培养,每24h更换一次新鲜培养基。
84.实施例4
85.1)水凝胶颗粒的制备
86.1.1)sh-ha/hb-peg水凝胶预聚体的制备
87.将100mg超支化聚乙二醇二丙烯酸酯(hb-pegda)溶于ph=7.4的1ml 1
×
pbs中,配置成浓度为10%(w/v)溶液a;将30mg巯基化透明质酸(sh-ha)溶于ph=7.4的2ml 1
×
pbs中,配置成浓度为1.5%(w/v)溶液b;
88.1.2)sh-ha/hb-peg水凝胶颗粒的制备
89.将上述a、b溶液快速混合,迅速转移到含2%(w/w)乳化剂fe-surf的氟油(7500)中,使用玻璃棒快速搅拌,通过乳化的方式形成不同大小微球,在常温下静置2min后形成水凝胶。
90.2)水凝胶颗粒、细胞与胶原组分的共混培育
91.2.1)首先将sh-ha/hb-peg水凝胶颗粒进行紫外灭菌处理60min,并浸入pbs或培养基中进行3-5次置换;准备细胞数为1x10
6-2x10
6 cells/ml人源成纤维细胞悬液;
92.2.2)提前将用到的ep管在冰浴下遇冷2min。
93.2.3)在冰浴条件下,混合0.1m 0.05ml naoh溶液,0.55ml胶原醋酸溶液。胶原的最终浓度为5mg/ml。
94.2.4)缓慢加入sh-ha/hb-peg水凝胶颗粒和0.1ml 10x pbs缓冲液,吹打混匀后调节溶液为中性。sh-ha/hb-peg水凝胶颗粒占总溶液体积的70%。
95.2.5)向上述溶液中加入0.09ml 10x培养基,充分混匀后加入0.1ml血清和0.01ml双抗(青霉素/链霉素)。
96.2.6)加入0.1ml带有培养基的人源成纤维细胞悬液,吹打混匀。
97.2.7)取0.3ml上述混合溶液转移至12孔板transwell中进行培养,做三组平行样。
98.上述混合溶液中,以sh-ha粉原料计算,sh-ha粉原料占上述混合溶液质量的0.5%。
99.3)真皮层的构建:
100.将上述混合溶液转移至37℃培养箱中孵育30min。待形成凝胶后在transwell内室加入0.5ml完全培养基,外室加入1ml完全培养基进行三维细胞培养,每24h更换一次新鲜培养基。
101.上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1