一种基因洗脱球囊及其制备方法和应用与流程
1.本发明涉及基因洗脱球囊技术领域,尤其涉及一种基因洗脱球囊及其制备方法和应用。
背景技术:
2.心血管疾病目前仍然是全球最常见的死亡原因,约占所有死亡的30%。动脉粥样硬化导致血流受限病变的发展,导致组织供氧受损,并出现心绞痛或间歇性跛行等临床症状。此外,斑块破裂和血栓形成的不稳定病变导致心肌梗死(mi),导致显著的发病率和死亡率。尽管药物洗脱支架(des)的广泛应用可以在一定程度上环节心血管疾病,但是支架内再狭窄(isr)、动脉延迟愈合和血栓形成仍然是重要的临床并发症。
3.新内膜的生长是经皮冠状动脉介入治疗(pci)时机械血管损伤的多因素反应。扩张球囊导管和放置支架所需的径向力会导致动脉粥样硬化斑块、内皮细胞以及动脉壁内膜和内侧层的破裂或撕裂。这导致了细胞因子和生长因子的级联释放、粘附分子的表达、巨噬细胞和其他炎症细胞的募集和浸润、vsmc的增殖和迁移以及ecm的沉积。新生内膜发育导致管腔狭再次窄,冠状动脉血流减少导致复发性症状,需要再次血管重建,在某些情况下血栓闭塞导致心肌梗死。
4.cn109966564a公开了一种载药球囊,其公开的载药球囊包括球囊及依次层叠于所述球囊的外表面的载药层和保护层,所述载药层中含有基因,所述保护层覆盖所述载药层,且所述保护层的材料选自聚乙烯醇、聚乙烯吡咯烷酮、壳聚糖、羟丙基-β-环糊精、羟乙基纤维素、羧甲纤维素钠、葡聚糖、阿拉伯胶、海藻酸钠、胶原蛋白、大豆蛋白及聚乙二醇硬脂酸酯中的至少一种。保护层能够较好地保护载药层,能够避免在输送过程基因过多损失,并且保护层的材料选自上述物质中的至少一种,使得该载药球囊到达病变部位后,载药球囊扩张时,保护层能够快速地溶解或脱落,以快速释放基因。
5.基因洗脱球囊(geb)是一种通过载体将治疗性基因从球囊表面传递到血管壁来预防isr的有效策略。geb的大生物分子输送可以解决目前存在的支架平台或导管为基础的输送系统的缺点:如活性药物在病变部位的浓度不足、化合物远端扩散到其他器官以及对参与血栓形成的细胞特异性靶向不足、血管损伤后炎症及内膜增生等问题,可根据基因产物作用方式和细胞靶点进行分类,有针对性地进行治疗。
6.综上所述,开发一种高效安全的基因洗脱球囊是至关重要的。
技术实现要素:
7.针对现有技术的不足,本发明的目的在于提供一种基因洗脱球囊及其制备方法和应用,所述基因洗脱球囊的粒径小而均匀,可在球囊扩张后快速穿过细胞膜被吸收,大幅提高药物的生物利用度,所述基因洗脱球囊涉及的原料均可生物降解,不会对人体产生周身毒性。
8.为达此目的,本发明采用以下技术方案:
9.第一方面,本发明提供一种基因洗脱球囊,所述基因洗脱球囊包括球囊本体以及依次设置于所述球囊本体表面的亲水涂层和包覆治疗基因的纳米涂层;
10.所述纳米涂层包括阳离子脂质体和治疗基因。
11.本发明中,所用载体为阳离子脂质体,其组成成分、结构和细胞膜高度相似,有良好的生物相容性,可帮助治疗基因顺利穿过细胞膜,提高治疗基因的生物利用度;阳离子脂质体在体内可生物降解,产物可被人体吸收或代谢排出,不会产生周身毒性;而且阳离子脂质体可起到一定的缓释作用,延长有效浓度的时间;相对于活性药物,治疗性基因的生物相容性更好,对人体的副作用更小;相对于药物,基因的靶向性更强,对靶标部位的治疗更有针对性,治疗过程更加可控;因此,本发明所述基因洗脱球囊兼具高效性和安全性的特点。
12.本发明中,通过geb输送,以阳离子脂质体作为治疗性基因的载体介导进入靶点,能防止治疗基因被体内的核酸酶过快消解。此外,以阳离子脂质体作为载体,能促进在靶点更好的渗透,同时以载体作为治疗基因的临时储库,实现基因的长效、匀速释放,改进释放的动力学,并更好地控制不利的系统性副作用。而且所述基因洗脱球囊涉及的原料均可生物降解,不会对人体产生周身毒性。
13.优选地,所述亲水涂层的厚度为10-500μm,例如50μm、100μm、150μm、200μm、250μm、300μm、350μm、400μm、450μm等。
14.优选地,所述纳米涂层的厚度为200-300μm,例如220μm、240μm、260μm、280μm等。
15.所述阳离子脂质体的原料包括阳离子脂质。
16.阳离子脂质分子由四个部分组成:头部、连接链、连接键和疏水尾烃,极性头部起着脂质体与dna、脂质体-dna复合物与细胞膜或细胞内其他组分相互结合的作用,带有多价极性头基团或具有多个正电荷极性头的阳离子脂质体转染效率较高,这可能是因为它与dna的结合较牢固。连接链的长度能影响阳离子纳米脂质体与粘膜表面的相互作用,从而影响转染活力。一般来说,带有长连接链的阳离子纳米脂质体能明显增强与粘膜表面的相互作用,转染效率高。连接键是类脂分子很重要的组成部分,它决定了阳离子纳米脂质体的化学稳定性和生物可降解性。
17.使用阳离子脂质体作为载体能保证球囊扩张后纳米粒子被快速释放并进入靶细胞,并防止治疗基因被体内核酸酶过快消解,提高治疗基因在血管内膜的转染率,而且阳离子脂质作为载体属于对人体无毒的可生物降解材料,对于预防心脑血管再狭窄、动脉延迟愈合及血栓形成都具有重要意义。
18.优选地,所述阳离子脂质包括氯化三甲基-2,3-二油烯氧基丙基铵(dotma)、溴化三甲基-2,3-二油酰氧基丙基铵(dotap)、三氟乙酸二甲基-2,3-二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵(dospa)、溴化三甲基十二烷基铵(dtab)、溴化三甲基十四烷基铵(ttab)、溴化三甲基十六烷基铵(ctab)、溴化二甲基十八烷基铵(ddab)、溴化二甲基-2-羟乙基-2,3-二油酰氧基丙基铵(dori)、溴化二甲基-2-羟乙基-2,3-二油烯氧基丙基铵(dorie)、溴化二甲基-3-羟丙基-2,3-二油烯氧基丙基铵(dorie-hp)、溴化二甲基-4-羟丁基-2,3-二油烯氧基丙基铵(dorie-hb)、溴化二甲基-5-羟戊基-2,3-二油烯氧基丙基铵(dorie-hpc)、溴化二甲基-2-羟乙基-2,3-双十六烷氧基丙基铵(dprie)、溴化二甲基-2-羟乙基-2,3-双十八烷氧基丙基铵(dsrie)、溴化二甲基-2-羟乙基-2,3-双十四烷氧基丙基铵(dmrie)、n-(2-精胺甲酰氨基)-n’,n
’‑
双十八烷基甘氨酰胺(dogs)、1,2-二油酰-3-琥珀
酰-sn-甘油胆碱酯(dosc)、3β-[n-(n',n'-二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol)、脂质多聚-l-赖氨酸(lpll)、硬脂胺(sa)中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:dotap和dotma的组合,dotma和dc-chol的组合,dotap、dotma和dc-chol的组合等。
[0019]
本发明中,所述阳离子脂质体优选上述种类的原因在于:其一,其大小、形状、电荷和靶分子的可调性意味着可靠的运输能力;其二,所有阳离子脂质体均可与dna形成复合物,极大压缩dna分子体积,从而有效进入细胞进行转染,同时可避免病毒载体可能带来的免疫毒性。
[0020]
优选地,所述治疗基因包括血管内皮生长因子(vegf)、一氧化氮合酶(enos)、反义寡核苷酸、前列环素(pgis)、7nd或组织因子(tf)中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:vegf和enos的组合,反义寡核苷酸、pgis和7nd的组合,反义寡核苷酸、pgis、7nd和tf的组合等。
[0021]
优选地,以所述阳离子脂质体的总质量为100%计,所述治疗基因的质量百分数为0.1%-10%,例如0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%等。
[0022]
本发明中,所述基因洗脱球囊的粒径小而均匀,足够大的比表面积确保了足够的负载治疗基因的量,而常规基因洗脱球囊,治疗基因的负载量最多能达到0.5%,本技术中的治疗基因可以达到远超于现有技术的水平。
[0023]
第二方面,本发明提供一种第一方面所述的基因洗脱球囊的制备方法,所述制备方法包括如下步骤:
[0024]
(1)将阳离子脂质在有机溶剂中溶解形成溶液,去除溶剂形成阳离子脂质薄膜,加入水与阳离子脂质薄膜混合,然后在超声作用下形成阳离子脂质体悬液;
[0025]
(2)将所述阳离子脂质体悬液与治疗基因混合并孵育;
[0026]
(3)将悬液采用微孔膜过滤,加入添加剂,形成涂覆悬液;
[0027]
(4)在含有亲水涂层的球囊本体设置涂覆悬液,固化,形成包覆治疗基因的纳米涂层,得到所述基因洗脱球囊。
[0028]
优选地,步骤(1)中,所述有机溶剂包括氯仿。
[0029]
优选地,所述溶液的质量浓度为1-100mg/ml,例如5mg/ml、10mg/ml、20mg/ml、40mg/ml、60mg/ml、80mg/ml等。
[0030]
优选地,所述去除有机溶剂的方式包括旋蒸。
[0031]
示例性地,所述旋蒸在旋蒸仪中进行。
[0032]
优选地,所述旋蒸的压力为10-70kpa,例如15kpa、20kpa、30kpa、40kpa、50kpa、60kpa等。
[0033]
优选地,所述旋蒸的温度为45-70℃,例如50℃、55℃、60℃、65℃等。
[0034]
优选地,所述旋蒸的时间为10-100min,例如20min、40min、60min、80min等。
[0035]
优选地,所述超声的时间为10-60min,例如15min、20min、25min、30min、35min、40min、45min、50min、55min等。
[0036]
示例性地,所述超声在探针超声仪中进行。
[0037]
优选地,以所述阳离子脂质薄膜的总质量为100份计,所述水的质量为50-500份,例如100份、150份、200份、250份、300份、350份、400份、450份等。
[0038]
优选地,步骤(2)中,所述混合后,还包括孵育。
[0039]
本发明中,将阳离子脂质通过经超声-复乳化方法制备成纳米粒子,与治疗基因经过孵育形成复合物纳米粒子,再通过微孔滤膜过滤使纳米粒子粒径小而均匀。纳米载体由于自身的高比表面积和微小粒径,可以有效提高被负载药物的负载量,极大促进药物的渗透能力,同时纳米颗粒可以通过血液和组织被有效地消除,能降低药物对细胞的特定破坏作用程度。
[0040]
优选地,所述孵育的时间为20-80min,例如30min、40min、50min、60min、70min等。
[0041]
优选地,步骤(3)中,所述微孔膜的孔径为0.4-1μm,例如0.45μm、0.8μm等。
[0042]
优选地,所述微孔膜过滤后,还包括将过滤后的悬液与添加剂混合。
[0043]
优选地,所述添加剂包括果糖、葡萄糖、蔗糖、乳糖、麦芽糖、赤藓醇,苏糖醇,阿拉伯糖醇,核糖醇、甘露醇、半乳糖醇,岩藻糖醇,艾杜醇,肌醇,庚七醇,异麦芽酮糖醇,麦芽糖醇,乳糖醇,麦芽三糖醇,伏格列波糖,木糖醇,山梨糖醇或聚乙二醇中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:果糖、葡萄糖、蔗糖和乳糖的组合,阿拉伯糖醇,核糖醇、甘露醇、半乳糖醇,岩藻糖醇和艾杜醇的组合,乳糖醇,麦芽三糖醇,伏格列波糖,木糖醇,山梨糖醇和聚乙二醇的组合等。
[0044]
优选地,步骤(4)中,所述亲水涂层的设置方式包括:将亲水涂层的原料设置于球囊表面,完成亲水涂层的设置。
[0045]
优选地,所述亲水涂层的原料包括聚丙烯酰胺。
[0046]
优选地,所述设置的方式包括喷涂和干燥。
[0047]
示例性地,所述亲水涂层的设置方式包括:将质量浓度为0.5%~2%(例如0.6%、0.8%、1%、1.2%、1.4%、1.6%、1.8%等)的聚丙烯酰胺通过喷涂设备均匀喷涂于球囊表面,喷涂量为15~25μg/mm2(例如16μg/mm2、18μg/mm2、20μg/mm2、22μg/mm2、24μg/mm2等),喷涂完成后置于真空干燥箱中在0.1~1atm(例如0.2atm、0.4atm、0.6atm、0.8atm等)、40-70℃(例如45℃、50℃、55℃、60℃、65℃等)条件下干燥20h以上(例如22h、24h、26h、28h、30h等)。
[0048]
优选地,所述固化的温度为40-70℃,例如45℃、50℃、55℃、60℃、65℃等。
[0049]
作为优选的技术方案,所述制备方法包括如下步骤:
[0050]
(1)将阳离子脂质与有机溶剂混合,形成质量浓度为1-100mg/ml的溶液;
[0051]
再将所述溶液在压力为10-70kpa和温度为45-70℃的条件下旋蒸10-100min,去除有机溶剂,形成阳离子脂质薄膜;
[0052]
然后将所述阳离子脂质薄膜与水超声10-60min,混合分散,形成所述悬液;
[0053]
(2)将所述悬液与治疗基因混合,孵育20-80min,形成含治疗基因的悬液;
[0054]
(3)将含治疗基因的悬液采用孔径为0.4-1μm的微孔膜过滤,形成涂覆悬液;
[0055]
(4)在含有亲水涂层的球囊本体设置涂覆悬液,在40-70℃下固化,形成包覆治疗基因的纳米涂层,得到所述基因洗脱球囊。
[0056]
第三方面,本发明提供一种医疗器械,所述医疗器械包括第一方面所述的基因洗脱球囊。
[0057]
相对于现有技术,本发明具有以下有益效果:
[0058]
(1)本发明所述基因洗脱球囊粒径小而均匀,一方面可在球囊扩张后快速穿过细
胞膜被吸收,大幅提高药物的生物利用度,另一方面确保了能够尽可能多的负载治疗基因。
[0059]
(2)本发明所述基因洗脱球囊涉及的原料均可生物降解,不会对人体产生周身毒性,所述基因洗脱球囊生物相容性好,对人体副作用小,靶向性强,治疗过程可控,而且由于阳离子载体的缓释作用,能够延长有效浓度的时间。
[0060]
(3)本发明所述基因洗脱球囊兼具高效和安全的特点,对于预防心脑血管再狭窄、动脉延迟愈合及血栓形成都具有重要意义。
[0061]
(4)本发明的制备工艺简单、高效、稳定,操作便捷。
[0062]
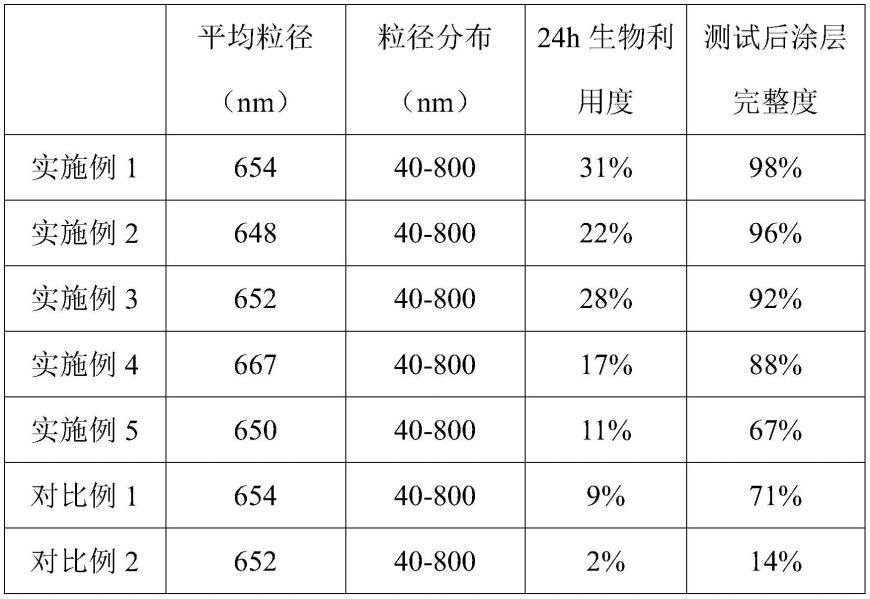
(5)本发明所述基因洗脱球囊的平均粒径在667nm以内,粒径分布在40-800nm之间,24h生物利用度在11%以上,测试后涂层完整度在67%以上。
具体实施方式
[0063]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0064]
本发明中,各实施方式中涉及的部分原料的购置信息如下:
[0065]
球囊本体:生产于中天医疗,材质为pebax;
[0066]
dotap:购于sigma-aldrich,牌号为≥98%(tlc),powder;
[0067]
dotma:购于sigma-aldrich;
[0068]
dc-chol:购于sigma-aldrich;
[0069]
vegf:购于sigma-aldrich;
[0070]
enos:购于sigma-aldrich;
[0071]
pgis:购于sigma-aldrich。
[0072]
实施例1
[0073]
本实施例提供一种基因洗脱球囊,所述基因洗脱球囊包括球囊本体以及依次设置于所述球囊本体表面的亲水涂层和包覆治疗基因的纳米涂层;
[0074]
所述纳米涂层包括阳离子脂质体和治疗基因。
[0075]
所述亲水涂层的厚度为100μm。
[0076]
所述纳米涂层的厚度为300μm。
[0077]
所述基因洗脱球囊由如下方法制备,所述方法包括如下步骤:
[0078]
(1)将dotap溶于氯仿配制成浓度为30mg/ml的溶液;
[0079]
将所述步骤一中溶液转移至旋转蒸发仪,在50kpa压力、50℃条件下旋蒸90min,去除氯仿,形成脂膜;
[0080]
加入40ml去离子水将所述步骤二中脂膜分散,使用探针超声仪将脂质体均匀分散形成悬液;
[0081]
(2)将10μg的vegf加入到所述的悬液中,37℃下孵育60min,形成含治疗基因的悬液;
[0082]
(3)将所述的悬液以0.8μm微孔滤膜过滤,去除粒径过大的粒子,然后加入1.6g山梨糖醇,形成喷涂悬液;
[0083]
(4)将所述喷涂悬液通过超声喷涂设备均匀喷涂于球囊外表面,所述球囊外表面预先经过亲水处理,亲水处理的过程为:将质量浓度为1%的聚丙烯酰胺通过喷涂设备均匀
喷涂于球囊表面,喷涂量为20μg/mm2,喷涂完成后置于真空干燥箱中在0.5atm、60℃条件下干燥24h;
[0084]
然后在55℃下固化处理喷涂完的所述球囊后,得到所述基因洗脱球囊。
[0085]
实施例2
[0086]
本实施例提供一种基因洗脱球囊,所述基因洗脱球囊包括球囊本体以及依次设置于所述球囊本体表面的亲水涂层和包覆治疗基因的纳米涂层;
[0087]
所述纳米涂层包括阳离子脂质体和治疗基因。
[0088]
所述亲水涂层的厚度为100μm。
[0089]
所述纳米涂层的厚度为300μm。
[0090]
所述基因洗脱球囊由如下方法制备,所述方法包括如下步骤:
[0091]
(1)将dotma溶于二氯甲烷配制成浓度为40mg/ml的溶液;
[0092]
将所述溶液转移至旋转蒸发仪,在60kpa压力、50℃条件下旋蒸100min,去除二氯甲烷,形成脂膜;
[0093]
加入40ml去离子水将所述步骤二中脂膜分散,使用探针超声仪将脂质体均匀分散形成悬液;
[0094]
(2)将10μg的enos加入到所述的乳液中,37℃下孵育60min,形成含治疗基因的悬液;
[0095]
(3)将所述的悬液以0.8μm微孔滤膜过滤,去除粒径过大的粒子,然后加入1.6g聚乙二醇,形成喷涂悬液;
[0096]
(4)将所述喷涂悬液通过超声喷涂设备均匀喷涂于球囊外表面,所述球囊外表面预先经过亲水处理,亲水处理的过程为:将质量浓度为0.5%的聚丙烯酰胺通过喷涂设备均匀喷涂于球囊表面,喷涂量为25μg/mm2,喷涂完成后置于真空干燥箱中在0.1atm、4℃条件下干燥30h;
[0097]
然后在55℃下固化处理喷涂完的所述球囊后,得到所述基因洗脱球囊。
[0098]
实施例3
[0099]
本实施例提供一种基因洗脱球囊,所述基因洗脱球囊包括球囊本体以及依次设置于所述球囊本体表面的亲水涂层和包覆治疗基因的纳米涂层;
[0100]
所述纳米涂层包括阳离子脂质体和治疗基因。
[0101]
所述亲水涂层的厚度为100μm。
[0102]
所述纳米涂层的厚度为300μm。
[0103]
所述基因洗脱球囊由如下方法制备,所述方法包括如下步骤:
[0104]
(1)将dc-chol溶于氯仿配制成浓度为30mg/ml的溶液;
[0105]
然后将所述的溶液转移至旋转蒸发仪,在50kpa压力、50℃条件下旋蒸90min,去除氯仿,形成脂膜;
[0106]
再加入40ml去离子水将所述的脂膜分散,使用探针超声仪将脂质体均匀分散形成悬液;
[0107]
(2)将10μg的pgis加入到所述的乳液中,37℃下孵育60min,形成含治疗基因的悬液;
[0108]
(3)将所述的悬液以0.8μm微孔滤膜过滤,去除粒径过大的粒子,加入0.8g蔗糖及
0.8g聚乙二醇,形成喷涂悬液;
[0109]
(4)将所述的喷涂悬液通过超声喷涂设备均匀喷涂于球囊外表面,所述球囊外表面预先经过亲水处理,亲水处理的过程为:将质量浓度为2%的聚丙烯酰胺通过喷涂设备均匀喷涂于球囊表面,喷涂量为15μg/mm2,喷涂完成后置于真空干燥箱中在1atm、70℃条件下干燥22h;
[0110]
然后在55℃下固化处理喷涂完的所述球囊后,得到所述基因洗脱球囊。
[0111]
实施例4
[0112]
本实施例与实施例1的区别在于将dotap替换为等质量的lpll,其余均与实施例1相同。
[0113]
实施例5
[0114]
本实施例与实施例1的区别在于步骤(1)中,将dotap直接在去离子水中分散,其余均与实施例1相同。
[0115]
对比例1
[0116]
本对比例与实施例1的区别在于将dotma替换为等质量的月桂醇聚醚-23,其余均与实施例1相同。
[0117]
对比例2
[0118]
本对比例与实施例1的区别在于:将dotap、vegf、氯仿和水直接混合分散后,37℃下孵育60min,形成喷涂悬液,其余均与实施例1相同。
[0119]
性能测试
[0120]
将实施例1-5和对比例1-2所述的基因洗脱球囊进行如下测试:
[0121]
(1)粒径分布及平均粒径测定:使用masterriser 2000e+zs90激光粒度仪测定纳米粒子粒度分布及平均粒径。
[0122]
(2)治疗基因的生物利用度:动物实验,将本发明基因涂层球囊与对照空白球囊在兔腹主动脉中模拟人体内球囊手术过程,基因涂层支架与对照组样本容量均为10。分别于术后12h、24h、2d、4d、7d处死2只,取出病变部位血管,生理盐水冲洗,在球囊扩张部位取1mg血管组织,提取rna进行rt-pcr扩增,1.5%琼脂糖凝胶电泳观察结果。
[0123]
(3)图层牢固度:通过导引鞘、远端通路导管及导丝将基因涂层球囊送入体外模拟血管冲刷装置中,模拟药物球囊进入体内并输送至靶部位的输送过程。采用pbs模拟血液,流速为35ml/min,37℃水浴,控制模拟冲刷时间为3min,3min后立即从靶部位将药物涂层球囊取出,通过电子显微镜观察球囊表面涂层完整度。
[0124]
测试结果汇总于表1中。
[0125]
表1
[0126][0127]
分析表1数据可知,本发明所述基因洗脱球囊的平均粒径在667nm以内,粒径分布在40-800nm之间,24h生物利用度在11%以上,测试后涂层完整度在67%以上;本发明所述基因洗脱球囊粒径小而均匀,可在球囊扩张后快速穿过细胞膜被吸收,大幅提高药物的生物利用度,同时,此方法中所有材料均可生物降解,不会对人体产生周身毒性。除此之外,本发明的制备工艺简单、高效、稳定,操作便捷。
[0128]
分析对比例1与实施例1可知,对比例1性能不如实施例1,证明以阳离子脂质体和治疗基因配合形成的基因洗脱球囊性能更佳。
[0129]
分析对比例2与实施例1可知,对比例2性能不如实施例1,证明在制备中,将阳离子脂质体和治疗基因依次形成乳液和悬液,即采用超声-复乳化方法形成的基因洗脱球囊性能更佳。
[0130]
分析实施例4与实施例1可知,实施例4性能不如实施例1,证明优选本发明所述的阳离子脂质体形成的基因洗脱球囊性能更佳。
[0131]
分析实施例5与实施例1可知,实施例5性能不如实施例1,证明在阳离子脂质体先形成溶液再形成乳液,得到的基因洗脱球囊性能更佳。
[0132]
本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1