去乙酰化酶自牺牲系统及其应用
1.本发明涉及分子生物学技术领域,尤其涉及一种去乙酰化酶自牺牲系统及其应用。
背景技术:
2.组蛋白和dna组装成的核小体是真核染色质的基本组成部分。组蛋白氨基末端的动态修饰在控制染色质的结构组织及其转录状态方面起着至关重要的调节作用。组蛋白去乙酰化酶(hdac)是一类调节各种细胞过程的关键酶。具体来说,hdac催化去除组蛋白赖氨酸残基上的乙酰基,与带负电荷的dna紧密结合,染色质致密卷曲从而抑制基因的转录表达。它们还会去除非组蛋白的蛋白上的乙酰基,如微管蛋白、皮质肌动蛋白和转录因子,以改变细胞的流动性、迁移和增殖。hdac活性水平异常化与癌症等各种疾病有关,这使它们成为癌症表观遗传学治疗的靶点。hdac抑制剂的发现是一个长期的追求,已有多种抑制剂被批准用于临床或临床试验。因此,用于hdac靶向成像和治疗的分子工具对于其功能注释、癌症诊断和药物开发起着至关重要的作用。
3.已报道的几例激活型hdac探针其设计策略主要是通过分子内的亲核加成、亲核取代反应,利用hdac催化底物去乙酰化后产生的氨基基团与亲电部分(如碳酸二甲酯、硝基苯并恶二唑和醛基)发生分子内亲核反应,从而点亮荧光信号。然而,这些探针仅适用于体外实验,限制了其在生物成像中的应用。
4.为此,需要寻求一种高度特异性的去乙酰化酶自牺牲系统,能够在体内响应hdac激活近红外荧光(nirf)和光声(pa)成像,并释放前药。
技术实现要素:
5.本发明为了解决上述技术问题,本发明公开了一种高度特异性的去乙酰化酶自牺牲系统并用于构建hdac激活型的探针和前药,实现在体内响应hdac的近红外荧光(nirf)和光声(pa)成像,并释放前药。
6.为了实现上述目的,本发明提供了一种去乙酰化酶自牺牲系统,
7.包括苯酚酯连接物、hdac底物和荧光团;
8.所述苯酚酯连接物为苯酚酯连接物i至vii中的一种,
9.所述苯酚酯连接物i的结构式为:
10.所述苯酚酯连接物ii的结构式为:
11.所述苯酚酯连接物iii的结构式为:
12.所述苯酚酯连接物iv的结构式为:
13.所述苯酚酯连接物v的结构式为:
14.所述苯酚酯连接物vi的结构式为:
15.所述苯酚酯连接物vii的结构式为:
16.上述的去乙酰化酶自牺牲系统,进一步的,所述hdac底物为6-乙酰氨基己酸或2,2-二甲基-6-乙酰氨基己酸。
17.上述的去乙酰化酶自牺牲系统,进一步的,所述荧光团为带有羧酸的荧光团bix-ca或带有羟甲基基团的荧光团bix-hm。
18.上述的去乙酰化酶自牺牲系统,进一步的,作为离去部分的荧光团为bix-hm-so
3-。
19.所述去乙酰化酶自牺牲系统为hdac探针,所述hdac探针具有以下式i、ii、iii、iv的结构式:
20.[0021][0022]
其中r1为h或f,r2为h、f或no2。
[0023]
基于一个总的技术构思,本发明还提供了一种所述的去乙酰化酶自牺牲系统在去乙酰化酶进行体内激活成像中的应用。
[0024]
上述的应用,进一步的,所述应用中体内激活成像为共聚焦细胞荧光成像,具体步骤为:将细胞与含有hdac探针的新鲜培养基孵育,用尼康a1+共焦显微镜进行成像,激发波长为640nm,发射区域为663nm至738nm。
[0025]
上述的应用,进一步的,所述应用中体内激活成像为细胞的光声成像,具体步骤为:将mda-mb-231细胞与hdac探针培养,用胰蛋白酶收集细胞,用微管离心收集细胞悬浮液;将带有细胞颗粒的试管插入试管架,并用msot成像系统成像。
[0026]
上述的应用,进一步的,所述应用具体为:通过尾静脉注射hdac探针,对活体进行体内hdac活性的nirf/pa成像。
[0027]
基于一个总的技术构思,本发明还提供了所述的去乙酰化酶自牺牲系统在前药释
放中的应用。
[0028]
基于一个总的技术构思,本发明还提供了所述的去乙酰化酶自牺牲系统在评估hdac抑制剂疗效中的应用。
[0029]
与现有技术相比,本发明的优点在于:
[0030]
(1)本发明提供了一种去乙酰化酶自牺牲系统,通过调控苯酚酯连接物的反应性和空间位阻,获得了自牺牲体系。设计了一种具有开环特性的新型螺环氧杂蒽染料,为高信倍比nirf/pa双模成像提供了分子基础。研究结果表明,苯酚酯连接物邻位拉电子取代效应对于促进释放动力学和效率至关重要,通过引入偕二甲基识别底物和增加酯键邻位的空间位阻为消除羧酸酯酶的干扰提供了可行的策略。结合新的染料和去乙酰化酶自牺牲系统,我们开发了一种hdac激活的nirf/pa探针,用于hdac活性的体外和体内检测。
[0031]
(2)本发明提供了一种去乙酰化酶自牺牲系统在组蛋白去乙酰化酶体内激活成像中的应用,使用硝基取代自牺牲连接物的nirf/pa探针在活细胞和活体中提供了具有理想的动力学和高对比度的hdac灵敏成像。相对与常见羧酸酯酶,如人羧酸酯酶(ces1、ces2)和猪肝酯酶(ple),它对hdac表现出极好的特异性,显示了检测肿瘤细胞中hdac活性的潜力。
[0032]
(3)本发明提供了一种去乙酰化酶自牺牲系统在前药释放中的应用,通过将sn-38的酚羟基与我们的去乙酰化酶自牺牲系统进行醚化,在去笼闭后,sn-38的发射峰从425nm移动到550nm,这允许通过荧光光谱监测其释放。随时间变化的荧光光谱显示,sn-38逐渐被激活,并在与hdac6孵育~3h后达到最大值。前药由hdac6特异性释放,对ces1、ces2和ple具有理想的抗性,为hdac高表达的肿瘤小鼠提供有效治疗。我们的通用去乙酰化酶自牺牲系统将为开发hdac激活型探针和前体药物打开一个新的范例,突出其治疗应用的潜力。
附图说明
[0033]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述。
[0034]
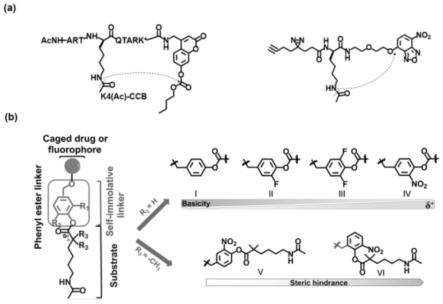
图1为本发明去乙酰化酶自牺牲系统的结构以及原理;(a)先前报道的hdac探针的分子结构。(b)响应hdac的去乙酰化酶自牺牲系统的设计和结构。
[0035]
图2为本发明去乙酰化酶自牺牲系统的hdac介导的去笼闭反应机理示意图。
[0036]
图3为本发明去乙酰化酶自牺牲系统hdac激活nirf/pa成像示意图。
[0037]
图4为本发明去乙酰化酶自牺牲系统hdac介导的前药释放示意图。
[0038]
图5为带有羟甲基基团的荧光团bix-hm的结构及理化性质,(a)bix-hm-me于不同的ph值下的主要结构。(b)bix-hm和bix-hm-me的ph依赖性吸光度。
[0039]
图6为实施例1至4中p1~p4对hdac的反应性结果。
[0040]
图7为p4-p6对200nm hdac6、ces1、ces2和ple的荧光响应。
[0041]
图8为p7对hdac6的荧光响应情况。(a)p7对不同浓度hdac6(0-500nm)的荧光响应情况,插图:荧光强度和hdac6从0到100nm浓度的线性拟合曲线。(b)p7(20μm)、p7(20μm)和hdac6(200nm)在无tsa或有tsa(10μm)时,在37℃pbs中响应后的紫外-可见吸收光谱。(c)p4和p7对不同hdac酶的荧光响应。(d)p7(20μm)、p7(20μm)和hdac6(400nm)在无tsa或有tsa(10μm)时,于37℃pbs中的pa光谱和成像。
[0042]
图9为p7对活细胞中的hdac活性进行nirf/pa成像结果。(a)mda-mb-231细胞与不
含tsa或含有tsa(10μm)的p7(20μm)孵育共聚焦荧光成像。(b)用流式细胞术分析mda-mb-231细胞与不含或含有tsa(10μm)的p7(20μm)孵育。(c)在37℃pbs中,未添加或添加tsa(10μm)的p7(20μm)、p7(20μm)和mda-mb-231细胞裂解物(5μl)的pa光谱和成像。
[0043]
图10为mda-mb-231荷瘤小鼠体内hdac活性的nirf/pa成像。(a)体内hdac活性的nirf/pa成像示意图。在不同时间点尾静脉注射p7(1.85mg/kg)、瘤内注射tsa或不注射tsa的mda-mb-231荷瘤小鼠的代表性nirf(b)和pa(c)成像,生理盐水作为对照。白色点圈表示肿瘤区域。接受不同处理的mda-mb-231荷瘤小鼠在不同时间点的时间依赖性荧光(d)和pa强度(e)(n=5)。(f)注射5h后,从小鼠解剖的主要器官和肿瘤组织的荧光强度。比例尺=2mm。**p《0.01,***p《0.001,****p《0.0001。
[0044]
图11为mda-mb-231荷瘤小鼠体内hdac活性的nirf成像。(a)hdac抑制剂和实时nirf成像治疗时间表的示意图。(b)hdac抑制剂的化学结构。(c)在不同时间点静脉注射p7(1.85mg/kg)后,用不同抑制剂预处理的mda-mb-231荷瘤小鼠的代表性nirf成像(n=5)。白色点圈表示肿瘤区域。(d)肿瘤部位nirf信号的量化(n=5)。测试1:注射p7(1.85mg/kg)5h后nirf信号的量化。测试2:使用商用hdac试剂盒分析用不同抑制剂治疗的均质肿瘤中的hdac活性。数据以平均值
±
标准差表示。
[0045]
图12为前药对mda-mb-231荷瘤小鼠的体内治疗效果。(a)肿瘤模型建立和癌症治疗时间表的示意图。(b)hdac激活前药释放的机理的示意图。(c)每隔一天静脉注射一次生理盐水、sn-38(4.0mg kg-1
)或前体药物(7.5mg kg-1
)五次后,mda-mb-231肿瘤的生长曲线。(d)不同治疗后mda-mb-231荷瘤小鼠的体重。(e)第30天解剖肿瘤的照片。(f)不同治疗后的最终肿瘤重量。(g)第30天接受不同治疗的mda-mb-231荷瘤小鼠肿瘤切片的h&e和tunel染色。绿色荧光为tunel染色信号,蓝色荧光为细胞核染色信号。标尺=50μm。在所有数据集中,所有组n=5只小鼠。*p《0.05,**p《0.01,***p《0.001,***p《0.0001。
具体实施方式
[0046]
以下结合具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。
[0047]
除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
[0048]
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
[0049]
实施例
[0050]
以下实施例中所采用的材料和仪器均为市售。
[0051]
本发明公开了一种新型去乙酰化酶自牺牲系统,该系统能够以高效和良好的动力学实现特定于hdac活性的体内激活成像和前药释放。以前的hdac探针在生理条件下与游离胺基的反应性较弱,仅适用于特定的荧光团(图1中a为以前的hdac探针分子结构图)。为了解决这些局限性,我们使用微调苯酯连接物的反应性和空间位阻,设计了一种新型的去乙酰化酶自牺牲系统。我们设想,苯基酯连接体中的吸电子基团(ewg)可以促进与游离胺的亲
核加成-消除反应,为hdac靶向激活成像和前药释放提供有效的去乙酰化酶自牺牲系统。基于这一假设,我们设计了包括三个模块的去乙酰化酶自牺牲系统,分别为苯基酯连接物、hdac底物和作为离去部分的荧光团或药物。
[0052]
图1中b为响应hdac的去乙酰化酶自牺牲系统的设计和结构。本发明通过在邻位引入不同的拉电子基团(ewg),设计了具有反应性可调的苯基酯连接物。ewg的引入有两个好处:一个是增加酯部分的亲电性,增强亲核加成动力学,另一个是削弱酚酸盐的碱度,这赋予了更高的离去效率。为了提高对羧酸酯酶的特异性,我们通过在常见的hdac底物6-乙酰氨基己酸的α碳上引入-二甲基基团,并选择一个带有邻位取代物的大位阻自牺牲连接物。
[0053]
图2为hdac介导的激活反应机理示意图,从图中看出:底物脱乙酰化产生了一个游离胺基,触发了与苯基酯连接物的分子内亲核加成消除,随后发生自牺牲反应,释放保护基团。这种去乙酰化酶自牺牲系统普遍适用于开发hdac激活型的探针和前药。
[0054]
基于这种去乙酰化酶自牺牲系统,我们使用新型螺环氧杂蒽染料开发了一种可激活的探针,用于对hdac进行近红外荧光(nirf)和光声(pa)双模成像。图3为hdac可激活nirf/pa成像示意图,从图中看出:在hdac介导的离去反应中,这种染料表现出从无色螺环“封闭”形式到有色氧杂蒽“开环”结构的转变。
[0055]
本发明使用硝基取代自牺牲连接物的nirf/pa探针在活细胞和活体中提供了具有理想的动力学和高对比度的hdac灵敏成像。相较于常见羧酸酯酶,如人羧酸酯酶(ces1、ces2)和猪肝酯酶(ple),它对hdac表现出极好的特异性。由于pa成像提供了高空间分辨率和组织穿透深度,同时nirf成像提供了极好的灵敏度,这种双模能力扩大了我们的探针在体内应用的潜力。
[0056]
本发明进一步开发了一种新的前药系统,图4为hdac介导的前药释放示意图,从图中看出:前药系统能够在体内靶向治疗,例如hdac过度表达的三阴性乳腺癌(tnbc)。我们的研究创造了第一个用于体内hdac特异性nirf/pa成像和前药释放的通用去乙酰化酶自牺牲系统,突出了其治疗应用的前景。
[0057]
为开发一种在体内激活的hdac活性nirf/pa探针,我们设计了一种新的螺环氧杂蒽染料(bix),因为螺环氧杂蒽结构可以在具有不同的吸收和发射曲线的氧杂蒽“开环”形式和螺环“闭环”形式之间表现出可调节的平衡。我们最初试验了一种带有羧酸的荧光团bix-ca。该荧光团在730nm处显示出一个主要的nir吸收峰,但由于羧酸的弱亲核性,即使在酚羟基乙酰化后仍保留开环形式。为了将其改造成具有开环反应的近红外染料,我们设计了一种新的带有羟甲基基团的荧光团bix-hm。
[0058]
图5的a为考察bix-hm-me于不同的ph值下的主要结构,在酸性条件下趋于开环状态,碱性条件下趋于闭环转态。
[0059]
图5的b为bix-hm和bix-hm-me的ph依赖性吸光度。荧光团bix-hm在ph值为7.4时于730nm处显示出强烈的吸收峰,而在醚化后在约650nm处呈现出宽蓝移吸收带。同时,醚化后荧光峰变得可以忽略。笼闭的bix-hm(bix-hm-me)的pk
cycl
值(吸光度因螺环化而降低至最大吸光度一半时的ph值)为6.6,表明在ph值为7.4时,醚化的bix-hm主要为闭合螺环形式。
[0060]
此外,在2.5至10的ph值范围内,bix-hm在nir区域显示出强吸收带,表明其主要为开环结构。这种光谱变化归因于酚盐形式和酚羟基形式之间的平衡。bix-hm的pka~5.8,这意味着在ph值为7.4时荧光团主要为酚形式。此外,bix-hm的摩尔吸收系数为3.74
×
105,荧
光量子产率为11.4%,同时具有良好的光稳定性。总之,这些结果表明,bix-hm在生理条件下可以为高信倍比和灵敏度nirf/pa监测hdac奠定基础
[0061]
实施例1
[0062]
本实施例的一种自牺牲hdac探针p1,其结构式为:
[0063][0064]
其中r1=h,r2=h。
[0065]
本实施例的自牺牲hdac探针p1包括三个模块,分别为苯酚酯连接物i、hdac底物和作为离去部分的荧光团。
[0066]
其中苯基酯连接物i的结构式为:
[0067]
hdac底物为6-乙酰氨基己酸。
[0068]
作为离去部分的荧光团为带有羟甲基基团的荧光团bix-hm。
[0069]
实施例2:
[0070]
本实施例的一种自牺牲hdac探针p2,其结构式为:
[0071][0072]
其中r1=h,r2=f。
[0073]
本实施例的自牺牲hdac探针p2包括三个模块,分别为苯基酯连接物ⅱ、hdac底物和作为离去部分的荧光团。
[0074]
其中苯基酯连接物ⅱ的结构式为:
[0075]
hdac底物为6-乙酰氨基己酸;
[0076]
作为离去部分的荧光团为带有羟甲基基团的荧光团bix-hm。。
[0077]
实施例3:
[0078]
本实施例的一种自牺牲hdac探针p3,其结构式为:
[0079][0080]
其中r1=f,r2=f。
[0081]
本实施例的自牺牲hdac探针p3包括三个模块,分别为苯基酯连接物iii、hdac底物
和作为离去部分的笼闭荧光团。
[0082]
其中苯基酯连接物iii的结构式为:
[0083]
hdac底物为6-乙酰氨基己酸;
[0084]
作为离去部分的荧光团为带有羟甲基基团的荧光团bix-hm。
[0085]
实施例4:
[0086]
本实施例的一种自牺牲hdac探针p4,其结构式为:
[0087][0088]
其中r1=h,r2=no2。
[0089]
本实施例的自牺牲hdac探针p4包括三个模块,分别为苯基酯连接物iv、hdac底物和作为离去部分的荧光团。
[0090]
其中苯基酯连接物iv的结构式为:
[0091]
hdac底物为6-乙酰氨基己酸;
[0092]
作为离去部分的荧光团为带有羟甲基基团的荧光团bix-hm。
[0093]
实验一:测试实施例1至4中p1~p4对hdac的反应性:
[0094]
使用了hdac6,一种广泛参与许多生物和病理过程的hdac。考察p1-p4(20μm),与hdac6(200nm)在37℃条件下反应3h后的荧光响应情况,。
[0095]
图6为探针与hdac6共存与否的情况下,p1~p4在745nm处的荧光强度结果,从图中可以看出:这些探针荧光背景低。在hdac6存在时,氟取代、二氟取代和硝基取代的苯基酯连接物ii-iv的荧光显著增强(分别为15倍、60倍和90倍),而未取代的连接物i仅显示出轻微的荧光增强。吸收光谱分析的结果类似。荧光动力学分析显示,硝基取代探针的反应速率最快。这些结果证实,苯酚酯连接物的拉电子取代效应对于促进hdac激活的自牺牲反应的动力学和效率至关重要。
[0096]
考虑到hdac作用于远离酯键的远端位点,我们设想酯附近的大位阻基团可以抑制羧酸酯酶的干扰,而对hdac反应的影响最小,偕二甲基效应可以通过空间位阻屏蔽酯键,并提高其抗水解的稳定性。我们首先设计并合成了以2,2-二甲基-6-乙酰氨基己酸为hdac底物的探针。
[0097]
实施例5:
[0098]
本实施例的一种自牺牲hdac探针p5,其结构式为:
[0099]
其中r1=h,r2=no2。
[0100]
本实施例的自牺牲hdac探针p5包括三个模块,分别为苯基酯连接物、hdac底物和作为离去部分的荧光团或药物。
[0101]
其中苯基酯连接物的结构式为:
[0102]
hdac底物为2,2-二甲基-6-乙酰氨基己酸;
[0103]
作为离去部分的荧光团为带有羟甲基基团的荧光团bix-hm。
[0104]
通过将近红外荧光团从对位改为邻位,我们得到了另一个拥有大位阻自牺牲连接物的探针p6。
[0105]
实施例6:
[0106]
本实施例的一种自牺牲hdac探针p6,其结构式为:
[0107]
其中r1=h,r2=no2。
[0108]
本实施例的自牺牲hdac探针p1包括三个模块,分别为苯基酯连接物、hdac底物和作为离去部分的笼闭荧光团或药物。
[0109]
其中苯基酯连接物的结构式为:
[0110]
hdac底物为2,2-二甲基-6-乙酰氨基己酸;
[0111]
作为离去部分的荧光团为带有羟甲基基团的荧光团bix-hm。
[0112]
实验二:研究探针p4~p6对三种羧酸酯酶的特异性,如ces1、ces2和ple。
[0113]
将探针p4~p6(20μm)分别与ces1、ces2和ple(100nm)共同孵育3h后测试荧光光谱。
[0114]
图7为p4~p6对200nm hdac6、ces1、ces2和ple的荧光响应结果。
[0115]
从图中看出:探针p4与这些羧酸酯酶反应很好探针p5对hdac6表现出良好的荧光增强响应(30倍),对ces1表现出更好的抗性(2倍),这表明2,2-二甲基-6-乙酰氨基己酸是hdac6的合适底物。然而,它仍然容易受到来自ces2(15倍)和ple(18倍)的非特异性干扰。
[0116]
通过将近红外荧光团从对位改为邻位,我们得到了另一个拥有大位阻自牺牲连接
物的探针p6。有趣的是,在ces1、ces2和ple的存在下,探针p6的荧光增强可忽略,但在hdac6作用下表现出显著的荧光激活(30倍)。
[0117]
这一结果表明,在酯键附近引入大位阻基团为消除羧酸酯酶干扰提供了一种策略。此外,我们发现探针p6对其他细胞内小分子、活性氧物种和酶具有理想的抗性。该探针对hdac活性具有特异性,因为当加入hdac抑制剂曲古菌a(tsa)孵育后,其荧光强度显著降低。在tsa处理下使用hela细胞裂解物进行的进一步测试显示,荧光增强可忽略不计。总之,这些结果表明,我们成功地开发了一种用于构建hdac探针的高效去乙酰化酶自牺牲系统。
[0118]
为了提高探针的溶解性,使用铜(i)催化的叠氮炔环加成反应,将磺酸根基团修饰到探针p6上,获得另一个探针p7。
[0119]
实施例7:
[0120]
本实施例的一种自牺牲hdac探针p7,其结构式为:
[0121]
其中r1=h,r2=no2。
[0122]
本实施例的自牺牲hdac探针p7包括三个模块,分别为苯酚酯连接物、hdac底物和作为离去部分的荧光团。
[0123]
其中苯酚酯连接物的结构式为:
[0124]
hdac底物为2,2-二甲基-6-乙酰氨基己酸;
[0125]
作为离去部分的荧光团为bix-hm-so
3-。
[0126]
实验三:考察p7对不同浓度hdac6的荧光响应:
[0127]
将p7(20μm)与不同浓度的hdac6共同孵育3h后,测试其荧光光谱。
[0128]
图8为p7对hdac6的荧光响应情况。图中a为考察p7对不同浓度hdac6(0~500nm)的荧光响应。插图:荧光强度和hdac6从0到100nm浓度的线性拟合曲线。从图中看出:随着hdac6浓度在7.0nm至500nm范围内的增加,该探针在745nm处显示出逐渐增加的荧光峰。
[0129]
图中b为p7(20μm)、p7(20μm)和hdac6(200nm)反应后的紫外-可见吸收光谱。类似地,当hdac6(400nm)存在时,该探针在730nm处的吸收峰增强了约20倍。相比之下,探针p7在hdac6和抑制剂tsa的混合物中或在tsa存在的情况下显示出可忽略的吸收光谱变化,从而验证了其对hdac活性的特异性反应。
[0130]
使用不同的脱乙酰基酶(包括hdac1、hdac2、hdac3、hdac10、hdac11、sirt1和sirt2)进行的进一步选择性研究表明,图中c表明探针p7对hdac6具有高度选择性,而p4对不同的hdac具有不同的荧光响应。这一结果表明2,2-二甲基-6-乙酰氨基己酸可以作为
hdac6的选择性底物。
[0131]
图中d研究了探针p7对hdac活性进行pa检测的可能性。将p7(20μm)、p7(20μm)和hdac6(400nm)的混合物或在混合物中加入tsa(10μm)时,于37℃反应后的pa光谱和成像。探针在680-850nm范围内发出非常微弱的pa信号。相比之下,在hdac6存在的情况下,它显示出强烈的pa信号,在730nm处的信倍比约为8倍。在tsa存在的情况下对hdac6进行的分析也证明,pa信号对hdac活性具有特异性。
[0132]
我们证明,使用硝基取代自牺牲连接物的nirf/pa探针在活细胞和活体中提供了具有理想的动力学和高对比度的hdac灵敏成像。相对与常见羧酸酯酶,如人羧酸酯酶(ces1、ces2)和猪肝酯酶(ple),它对hdac表现出极好的特异性。由于pa成像提供了高空间分辨率和组织穿透深度,同时nirf成像提供了极好的灵敏度,这种双模能力扩大了我们的探针在体内应用的潜力。
[0133]
基于这种去乙酰化酶自牺牲系统,我们使用新型螺环氧杂蒽染料开发了一种可激活的探针,用于对hdac进行近红外荧光(nirf)和光声(pa)双模成像。
[0134]
实施例8:
[0135]
一种去乙酰化酶自牺牲系统在组蛋白去乙酰化酶进行体内激活成像中的应用,利用设计的探针p7对活细胞中的hdac活性进行nirf/pa成像。选择hdac活性上调的tnbc细胞系mda-mb-231细胞作为模型。
[0136]
共聚焦细胞荧光成像实验操作如下:所有细胞在37℃下与含有探针p7(20μm)的1ml新鲜培养基孵育3h。在成像之前,用冷pbs洗涤细胞三次。为了进行抑制研究,在使用探针(20μm)孵育之前,用tsa(10μm)预处理细胞1小时。荧光图像由尼康a1+共焦显微镜获得,激发波长为640nm,发射区域为663nm至738nm。
[0137]
细胞的光声成像操作如下:将mda-mb-231细胞(在75cm2的细胞培养瓶中培养约7
×
106个细胞)与p7(20μm)在37℃下培养3小时。用10ml pbs洗涤细胞三次。用0.25%胰蛋白酶收集细胞,用tc20计数
tm
自动细胞计数器(美国bio-rad)。用微管(200μl)离心收集细胞悬浮液。将带有细胞颗粒的试管插入试管架,并用msot成像系统成像。为了进行抑制研究,在与p7(20μm)孵育之前,用tsa(10μm)预处理mda-mb-231细胞1小时。
[0138]
图9为p7对活细胞中的hdac活性进行nirf/pa成像结果。
[0139]
图中a为mda-mb-231细胞与不含tsa或含有tsa(10μm)的p7(20μm)孵育的共聚焦荧光成像。从图中,我们观察到p7在mda-mb-231细胞中显示出明亮的荧光(图3a)。相比之下,用hdac抑制剂tsa预处理的细胞显示的荧光信号可以忽略不计。
[0140]
图中b为用流式细胞术分析mda-mb-231细胞与不含或含有tsa(10μm)的p7(20μm)孵育响应情况。从图中看出:流式细胞术分析显示,与受抑制的细胞群相比,hdac活性高的细胞群中该探针的荧光显著增强。
[0141]
图中c为在37℃pbs中,未添加或添加tsa(10μm)的p7(20μm)、p7(5μm)和mda-mb-231细胞裂解物(5μl)的pa响应光谱和成像。从图中看出:使用商业试剂盒对细胞裂解物进行的进一步分析验证了mda-mb-231细胞中的高hdac活性,而tsa预处理细胞中检测不到hdac活性。这些结果表明,p7能够对活细胞中的hdac活性进行特异性荧光检测。此外,我们利用该探针,通过多光谱光声层析成像(msot)系统对活细胞中的hdac活性进行pa成像。正如预期的那样,mda-mb-231细胞在730nm处显示出强烈的pa信号,但在tsa抑制后显示出非
常弱的pa响应。总之,这些结果证明了我们成功开发了一种用于活细胞分析的可激活hdac活性探针。据我们所知,这是第一个用于hdac活性nirf/pa双模成像的可激活探针。
[0142]
实施例10:一种用于活体hdac成像的自牺牲nirf/pa探针。
[0143]
通过尾静脉注射测试了探针p7在mda-mb-231荷瘤小鼠中成像hdac活性的能力。图10为mda-mb-231荷瘤小鼠体内hdac活性的nirf/pa成像。从图中可以看出:与瘤内注射相比,系统输送探针会产生延迟的nirf和pa反应。
[0144]
图b和c为在不同时间点尾静脉注射p7(1.85mg/kg)、瘤内注射tsa或不注射tsa的mda-mb-231荷瘤小鼠的代表性nirf和pa成像,生理盐水作为对照。白色点圈表示肿瘤区域。
[0145]
图中d和e为接受不同处理的mda-mb-231荷瘤小鼠在不同时间点的时间依赖性荧光(d)和pa强度(e)(n=5)。图中f为注射5h后,从小鼠解剖的主要器官和肿瘤组织的荧光强度。**p《0.01,***p《0.001,****p《0.0001。
[0146]
从图中发现,在注射3h后在肿瘤部位观察到明显的nirf和pa反应,在注射5h后出现最大信号,随后逐渐减少,直到注射24h后。总之,这些结果表明我们的探针能够在体内对hdac活性进行nirf/pa双模成像。
[0147]
实施例11:一种去乙酰化酶自牺牲系统在评估hdac抑制剂疗效中的应用。
[0148]
实验组:根据推荐的用药方案,向mda-mb-231荷瘤小鼠施用了四种hdac抑制剂,包括三种批准的药物伏立诺他(saha)、hdac抑制剂(quisinostat)和帕比司他(panobinostat),以及一种正在进行临床试验的药物阿贝司他(abexinostat)(图8b),然后在连续三天(每天给药一次)注射后系统性地输送p7进行nirf成像。利用探针p7评估mda-mb-231荷瘤小鼠中hdac活性的能力。
[0149]
对照组:生理盐水代替p7;
[0150]
图11为mda-mb-231荷瘤小鼠体内hdac活性的nirf成像。(a)hdac抑制剂和实时nirf成像治疗时间表的示意图。(b)hdac抑制剂的化学结构。(c)在不同时间点静脉注射p7(1.85mg/kg)后,用不同抑制剂预处理的mda-mb-231荷瘤小鼠的代表性nirf成像(n=5)。白色点圈表示肿瘤区域。(d)肿瘤部位nirf信号的量化(n=5)。测试1:注射p7(1.85mg/kg)5h后nirf信号的量化。测试2:使用商用hdac试剂盒分析用不同抑制剂治疗的均质肿瘤中的hdac活性。数据以平均值
±
标准差表示。
[0151]
从图中可以看出:注射不同的抑制剂,荧光成像的强度还是会有较大的差异。与生理盐水处理的对照小鼠相比,服用抑制剂的小鼠的nirf信号均降低(图8c)。用quisinostat治疗的小鼠的nirf信号减少最大,这表明它是体内hdac活性最有效的抑制剂。这一发现表明,我们的探针具有在体内评估hdac抑制剂的能力。
[0152]
实施例12:
[0153]
一种去乙酰化酶自牺牲系统在前药释放中的应用,其原理参见图1e,使其能够在体内靶向治疗hdac过度表达的三阴性乳腺癌(tnbc)。我们的研究创造了第一个用于体内hdac特异性nirf/pa成像和前药释放的通用去乙酰化酶自牺牲系统,突出了其治疗应用的前景。
[0154]
这种去乙酰化酶自牺牲系统普遍适用于开发hdac靶向探针和疗法的荧光团和药物。
[0155]
考虑到hdac在癌细胞中,尤其是在侵袭性肿瘤中的高活性,我们有动机开发一种
hdac特异性前体药物释放系统。我们选择拓扑异构酶i抑制剂sn-38,一种常用于治疗各种癌症的活性喜树碱成分。据报道,封闭其酚羟基可显著降低其功效和毒性。hdac介导的前药系统是通过将sn-38的酚羟基与我们的去乙酰化酶自牺牲系统进行醚化来设计的。1hnmr、
13
c nmr和esi-ms证实了前药的成功合成。在去笼闭后,sn-38的发射峰从425nm移动到550nm,这允许通过荧光光谱监测其释放。随时间变化的荧光光谱显示,sn-38逐渐被激活,并在与hdac6孵育~3h后达到最大值。进一步的时间依赖性hplc分析也证实了前药能与hdac6响应释放。此外,前药由hdac6特异性释放,对ces1、ces2和ple具有理想的抗性。总之,这些结果表明,我们的设计为hdac提供了一个高效、特异的前药系统。
[0156]
此外,使用钙黄绿素乙酰甲酯(calcein am)和碘化丙啶(pi)对经前药处理的mcf-10a和mda-mb-231细胞系进行荧光染色,证实对tnbc mda-mb-231细胞具有选择性细胞毒性。总之,这些结果证实了我们的前药系统可以在hdac上调细胞系中被高度特异性激活,对tnbc细胞产生特异性细胞毒性。
[0157]
进一步评估了前药系统在mda-mb-231荷瘤小鼠体内的疗效,将荷瘤小鼠随机分为三组,并通过尾静脉注射前药,与未笼闭药物sn-38和生理盐水对照组进行比较。
[0158]
图12为前药对mda-mb-231荷瘤小鼠的体内治疗效果。
[0159]
a为肿瘤模型建立和癌症治疗时间表的示意图。b为hdac激活前药释放的机理的示意图。c为每隔一天静脉注射一次生理盐水、sn-38(4.0mg kg-1
)或前体药物(7.5mg kg-1
)五次后,mda-mb-231肿瘤的生长曲线。d为不同治疗后mda-mb-231荷瘤小鼠的体重。e为第30天解剖肿瘤的照片。f为不同治疗后的最终肿瘤重量。g为第30天接受不同治疗的mda-mb-231荷瘤小鼠肿瘤切片的h&e和tunel染色。绿色荧光为tunel染色信号,蓝色荧光为细胞核染色信号。标尺=50μm。在所有数据集中,所有组n=5只小鼠。*p《0.05,**p《0.01,***p《0.001,***p《0.0001。
[0160]
从图中可以看出:与生理盐水组相比,前药组小鼠的肿瘤体积显著减少。肿瘤抑制率约为70%(图c和d)。有趣的是,给予sn-38的小鼠显示出肿瘤生长抑制,但程度较低(图e和f)。我们观察到,与使用sn-38治疗的荷瘤小鼠相比,使用我们的前药治疗的荷瘤小鼠显示出更大程度的肿瘤细胞凋亡。用前药治疗的小鼠的解剖肿瘤和主要器官的体外荧光成像证实了肿瘤中sn-38的释放。总之,这些结果表明,我们的前药系统为hdac上调的侵袭性癌症提供了一种有效的治疗范式,允许肿瘤特异性激活前药,且副作用可以忽略不计。
[0161]
综上,我们设计了一个通用去乙酰化酶自牺牲系统,用于体内hdac激活成像和前药释放。通过微调苯酚酯连接物的反应性和空间位阻,获得了自牺牲体系。我们设计了一种具有开环特性的新型螺环氧杂蒽染料,为nirf/pa检测提供了高信倍比。我们证明,苯基酯连接物的拉电子取代对于促进释放动力学和效率至关重要,并且酯键附近带有偕二甲基取代的底物和邻位取代物的巨大空间位阻为消除羧酸酯酶的干扰提供了可行的策略。结合新的染料和去乙酰化酶自牺牲系统,我们开发了一种具有良好的动力学、高对比度和良好的特异性可激活的nirf/pa探针,用于hdac活性的体外和体内检测。nirf/pa探针显示了检测肿瘤细胞中hdac上调的潜力。一种新的hdac特异性前药系统被进一步创造出来,为携带hdac上调肿瘤的小鼠提供有效治疗。我们的通用去乙酰化酶自牺牲系统将为开发hdac特异性探针和前体药物打开一个新的范例,突出其治疗应用的潜力。
[0162]
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制。虽
然本发明已以较佳实施例揭示如上,然而并非用以限定本发明。任何熟悉本领域的技术人员,在不脱离本发明的精神实质和技术方案的情况下,都可利用上述揭示的方法和技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同替换、等效变化及修饰,均仍属于本发明技术方案保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1