MEFLC细胞培养上清的应用的制作方法
meflc细胞培养上清的应用
技术领域
1.本发明涉及细胞培养产物技术领域,特别涉及meflc细胞培养上清的应用。
背景技术:
2.目前,ipsc技术在心血管疾病方面的研究和应用体现在两个方面,一是将心血管病病人的体细胞编程为ipsc后在体外建立疾病模型,可以在细胞水平研究发病机制及有效药物,二是将ipsc或ipsc分化的心肌细胞移植到病人体内,来治疗心肌梗死、心力衰竭等疾病。
3.已有体内实验证实未分化的ipsc细胞可以在体内分化成为心肌细胞,但这类细胞由于具有胚胎干细胞特征而具有致瘤风险。因此,在体外诱导ipsc细胞分化为心肌谱系细胞,然后再移植注入心脏可能是规避这一风险更佳的选择。已有研究证实,在mi小鼠心梗区注射ipsc-cm能够明显改善心梗小鼠的心功能,在mi大鼠心梗部位移植ipsc-cm和内皮细胞共培养的细胞薄片也能改善心脏功能,但移植到局部的细胞存活率低一直是细胞移植疗法共同存在的问题,优化体内生存时间是临床转化的关键问题。
4.转录因子基因myog编码肌细胞生成素(myogenin)蛋白,是生肌调节因子(mrfs)基因家族的成员之一。mrfs转录因子家族(包括myod、myf5、mrf4和myog)在骨骼肌发生的每一个阶段都起着关键作用。该家族所有成员共同含有一个保守的螺旋-环-螺旋(bhlh)基序,可以与下游基因的e盒结合,从而激活下游肌肉特异性基因的表达。研究表明,myog通过控制、启动成肌细胞的融合和肌纤维的形成,而在肌肉分化过程中起关键作用。在小鼠中的研究显示,myog基因缺失会导致严重的肌肉分化缺陷,从而造成围产期死亡。因此,myog是骨骼肌发育过程中必需的调控因子,并且是不可替代的。目前,已有研究证实,myog基因在小鼠、鸭、草鱼、京海黄鸡等动物的心脏中都有表达,可能与心肌的生长发育相关。但myog基因在人心脏组织中的表达及在心脏发育中的作用尚未见报道。
5.发明人对获得的meflc细胞培养上清进行功能性研究,以开发其在疾病中的应用。
技术实现要素:
6.本发明要解决的技术问题,就是对meflc细胞培养上清进行功能性研究,以进一步开发其在疾病中的应用。
7.本发明的meflc细胞,为人心肌成纤维样细胞,该细胞株于2022年4月23日保藏于广东省微生物菌种保藏中心,保藏编号为gdmccno.62409。相关信息可参见于专利申请号为2022109079687的专利申请。
8.通过对meflc培养上清的功能研究,发现meflc培养上清对hipsc-cm在缺氧(cocl2)、活性氧(h2o2)、抗肿瘤药物(阿霉素)处理下具有保护作用。而meflc培养上清中含量较高而hcfc中没有的蛋白,这些蛋白可能与meflc上清液对hipsc-cm在缺氧、活性氧、抗肿瘤药物处理下的保护作用有关。
附图说明
9.图1为不同培养条件和药物处理下细胞的活力图。
具体实施方式
10.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合具体实施例进行详细描述。
11.1.meflc构建
12.构建步骤:
13.1.1构建pcw-myog-t2a-puro慢病毒载体:用常规分子克隆方法将myog cdna和一个嘌呤霉素抗性基因亚克隆到pcw-cas9-blast载体中(addgene,83481),取代原载体中的cas9和blast基因,得到pcw-myog。
14.1.2慢病毒包装:
15.1.2.1接种hek293t细胞到6孔板中,用d10培养液(dmem培养液+体积含量10%的胎牛血清)进行培养,待细胞汇合度达到70%-80%时准备进行转染;
16.1.2.2在转染前1h,弃去原来培养液,加入2ml/孔预热的无血清optimem培养液;
17.1.2.3按照产品说明书用lipofectamine 2000试剂进行转染。将pcw-myog(20μg)、pvsvg(10μg)(addgene)、pspax2(15μg)(addgene)共转染hek293t细胞;
18.1.2.4在6h后,将培养液更换成dmem培养液+体积含量10%的胎牛血清+体积含量1%的bsa(牛血清白蛋白);
19.1.2.5继续培养约60h后,取培养液于3000rpm、4℃离心10min,去除细胞残渣。
20.1.2.6用0.45μm低蛋白结合滤膜(millipore steriflip hv/pvdf)过滤上清液,去除细胞残渣。
21.1.2.7将含病毒的培养液按照体积比4:1与质量百分含量10%的蔗糖缓冲液混合(50mm tris-hcl,ph 7.4,100mm nacl,0.5mm edta)混合,10000g、4℃离心4h。小心弃去上清液,离心管在吸水纸上沥干3min,加入pbs缓冲液重悬,-80℃保存。
22.1.3pcw-myog-t2a-puro慢病毒感染人ipsc细胞株(dyr0100):
23.1.3.1hipsc培养:将人诱导多能干细胞(hipsc)dyr0100(atcc)接种于matrigel基质(康宁,354277)包被的平板上,然后用stemup(nissan chemical corporation)进行培养。stemup培养基每两天更换一次。ipsc每隔3天传代一次,或在细胞培养达到80-90%汇合度时传代。传代过程中用1
×
dpbs(gibco,14040133)冲洗1次,然后在室温下用使用1
×
dpbs(gibco,14190144)稀释的0.5mm edta(invitrogen,15575020)处理10min。传代比为1:3-1:6。
24.1.3.2转染:待hipsc细胞汇合度达到70%-80%时进行转染。感染复数(moi)约为0.3-0.5。转染24h后,将培养液更换成新鲜stemup(含终浓度为2μg/ml的盐酸多四环素(dox))。2天后,将培养液更换成stemup(含dox 2μg/ml+嘌呤霉素(puromycin)(invivogen))进行筛选。筛选2-3天后,能够得到约30%的转化效率。挑取单个的克隆接种到不同的皿中培养,即得hipsc-myog细胞株。24小时后加入dox开始诱导myog表达,48小时后加入puromycin(终浓度2μg/ml)进行筛选。筛选过程持续48-72小时,挑取存活的单克隆进行扩大培养。
25.1.4利用实时定量pcr技术鉴定单克隆是否表达myog,将阳性的单克隆扩大培养(命名为hipsc-myog),同时在培养液中加入dox持续诱导myog的表达,将此时定为第1天。培养液:stemup培养液。此时的培养条件为:
①
stemup培养液+dox(终浓度2μg/ml)。
26.1.5使用培养条件
①
培养hipsc-myog15-20天后,换培养条件
②
持续培养hipsc-myog。培养条件
②
的组成为:高糖dmem培养液+体积含量10%的fbs+体积含量1%的neaa+体积含量1%的ps+dox(终浓度2μg/ml)。每10-14天使用puromycin(终浓度2μg/ml)筛选3-4天,保证myog阳性细胞的纯度。在30-40天,细胞形态明显发生变化,呈成纤维细胞状,我们将这种细胞命名为meflc(myogenin-expressingfibroblast-likecells)。
27.1.6meflc使用培养条件
②
进行培养。
28.2.meflc培养上清的功能研究
29.2.1meflc的培养上清对hipsc-cm在缺氧(cocl2)、活性氧(h2o2)、抗肿瘤药物(阿霉素)处理下具有保护作用
30.2.11实验材料准备:
31.hcfc(人心脏成纤维细胞系)条件培养液制备:hcfc使用培养条件
③
培养至汇合度约80%,使用丝裂霉素(mitomycin,20μg/ml)处理5h,之后按照5
×
105cell/孔接种到6孔板中,继续用培养条件
③
培养,48h后收集细胞培养液,1000g离心5min,再用0.45μm滤膜过滤,去除细胞残渣,所得培养上清液即hcfc条件培养液。
32.meflc条件培养液制备:meflc使用培养条件
②
培养至汇合度约80%,使用丝裂霉素(mitomycin,20μg/ml)处理5h,之后按照5
×
105cell/孔接种到6孔板中,继续用培养条件
③
培养,48h后收集细胞培养液,1000g离心5min,再用0.45μm滤膜过滤,去除细胞残渣,所得培养上清液即meflc条件培养液。hipsc-cm使用培养液培养条件
④
进行培养。
33.培养条件
③
的组成为:高糖dmem培养液+体积含量10%的fbs+体积含量1%的neaa+体积含量1%的ps。培养条件
④
的组成为:高糖dmem培养液+体积含量3%的kosr+体积含量1%的neaa+体积含量1%的ps。
34.2.1.2细胞接种与培养:
35.hipsc-cm使用胰蛋白酶溶液(0.05%)消化,于200g离心5min收集细胞,按照10000cell/孔接种细胞至96孔板,用培养条件
③
培养24h后,更换条件培养液进行培养。具体分组如表1所示。
36.2.1.3药物处理:
37.条件培养48h后,加入不同的药物处理。其中doxo浓度为1μm,处理时间24h。cocl2浓度为1mm,处理时间为24h。h2o2浓度为1mm,处理时间为4h。每组设3-4个生物学重复。对照组与条件培养组处理条件相同。同时设置一组无任何药物处理的空白对照组。
38.表1实验分组情况
[0039][0040]
2.1.4细胞活性检测:
[0041]
用prestoblue细胞活性检测试剂(invitrogen,a13261)检测细胞活性。
[0042]
2.1.5实验结果与分析:
[0043]
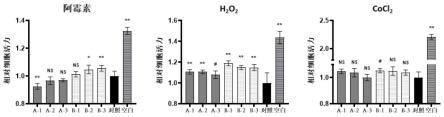
结果如图1所示,doxo处理24h后,meflc(75%、50%)组的细胞活性显著高于对照组,而hcfc条件培养液只有100%与对照组有显著差异。h2o2处理4h,meflc(100%、75%、50%)、hcfc(100%、75%、50%)组细胞活性均显著高于对照组。cocl2处理24h后,meflc(100%)组细胞活性显著高于对照组,而hcfc条件培养液与对照组无显著差异。因此,meflc条件培养液对hipsc-cm在缺氧(cocl2)、活性氧(h2o2)、抗肿瘤药物(阿霉素)处理下具有保护作用,作用效果优于常用的人成纤维细胞系(hcfc)。
[0044]
3.meflc的培养上清的质谱检测:
[0045]
3.1实验材料准备:
[0046]
meflc使用培养条件
②
进行培养至汇合度约80%,使用丝裂霉素(mitomycin,20μg/ml)处理5h,之后继续使用培养条件
②
培养,标记为meflc-mito-c;
[0047]
hcfc用培养条件
③
培养至汇合度约80%,同样使用丝裂霉素(mitomycin,20μg/ml)处理5h,之后继续使用培养条件
③
培养,标记为hcfc-mito-c。
[0048]
3.2细胞培养及上清收集:
[0049]
meflc-mito-c、hcfc-mito-c使用0.05%胰蛋白酶消化,于200g离心5min收集细胞,按照2
×
106cell/孔接种细胞至10cm培养皿中。meflc-mito-c、hcfc-mito-c分别用培养条件
②
和培养条件
③
培养2天后,弃去原培养液,用pbs清洗细胞3次,换无血清培养液(高糖dmem培养液+体积含量1%的neaa+体积含量1%的ps)进行培养(每皿12ml)。无血清培养2天后,收集细胞培养上清,用于质谱检测。(每种细胞做3个生物学重复)。
[0050]
3.3质谱检测:
[0051]
质谱法检测meflc-mito-c、hcfc-mito-c培养上清中的主要蛋白成分。
[0052]
3.4实验结果与分析:
[0053]
如表1所示,通过质谱法,我们分析找到了50个在meflc上清中含量较高而hcfc中没有的蛋白,这些蛋白可能与meflc上清液对hipsc-cm在缺氧、活性氧、抗肿瘤药物处理下
的保护作用有关。
[0054]
表1 meflc与hcfc上清差异蛋白分析
[0055][0056][0057]
4.meflc培养上清中外泌体提取与质谱检测
[0058]
4.1实验材料准备:
[0059]
meflc使用培养条件
②
培养至汇合度约80%,弃去原培养液,用pbs洗3次,更换无外泌体培养液(高糖dmem培养液+体积含量10%的无外泌体血清+体积含量1%的neaa+体积
含量1%的ps),培养2天后,收集培养上清液,于-80℃暂存。
[0060]
4.2超速离心法提取外泌体:
[0061]
在37℃中速融样本。
[0062]
将样本移动至一个新的离心管内,2000
×
g,4℃,30min离心。
[0063]
小心的将上清液移至新的离心管中,10,000
×
g,4℃,45min再次离心,以去除较大的囊泡。
[0064]
取上清,经0.45μm滤膜过滤,收集过滤液。
[0065]
将过滤液移至新的离心管中,选择超速转子,4℃,100,000
×
g离心70min。
[0066]
去除上清,用10ml预冷的1
×
pbs重悬后,选择超速转子,再次4℃,100,000
×
g,超速离心70min。
[0067]
去除上清,用100μl预冷的1
×
pbs重悬,取20μl电镜,10μl粒径,40μl提蛋白,剩余外泌体于-80℃保存。
[0068]
4.3用质谱法对外泌体中的蛋白进行鉴定。
[0069]
4.4实验结果与分析:
[0070]
meflc外泌体中的蛋白种类及丰度如表2所示。
[0071]
表2外泌体中蛋白种类及丰度
[0072]
[0073][0074]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1