一种具有骨质疏松微环境调节功能的关节假体界面及其制备方法与应用
1.本发明属于医用假体植入物技术领域,具体涉及一种具有骨质疏松微环境调节功能的关节假体界面及其制备方法与应用,尤其涉及该关节假体界面在制备用于骨质疏松患者行关节置换手术时使用的关节假体中的应用。
背景技术:
2.骨质疏松(osteoporosis,op)是一种以骨量减低、骨组织微结构损坏,导致骨脆性增加、易发生骨折为特征的全身性骨病。针对op导致的髓关节骨折,人工关节置换可以快速恢复患者的肢体运动功能,避免长期卧床引起的多种并发症。然而,临床病例回顾分析表明:生物型人工关节假体在op人群中的临床治疗效果不佳,关节置换术后并发症较非op人群多发。主要原因为以下两点:首先,op侵蚀导致骨量丢失,假体与患者骨髓腔无法精准匹配,与骨质结合面积大幅减少易产生应力遮挡致假体移位、松动,甚至假体周围骨折;其次,op特异的病理性破骨活化使生物型假体界面与松质骨骨床无法形成有效骨整合,长期的力学负荷最终导致生物固定型假体下沉。
3.人类在衰老过程中其骨重建平衡发生明显改变,绝经后雌激素分泌量减少以及多种“破骨细胞刺激因子”的过度表达,可以促进成骨或相关基质细胞表面“核因子kb受体活化因子配体”c receptor activator of nuclear factor-kbligand,rankl)的表达,而竞争性结合rankl的骨保护素(osteoprotegerin,opg)分泌减少。过度表达的rankl特异性识别并结合破骨前体细胞或破骨细胞表面的rank受体,促进破骨细胞的分化和激活,并抑制其凋亡。有文献证实:上述opg/rankl/rank途径的激活和过度活化可以介导骨质侵蚀过程,影响松质骨的骨小梁厚度、间距等微观结构。在关节假体移植区域的骨形成作用明显低于骨吸收,受累关节严重的骨质流失,脆弱的骨质条件无法产生长期支撑假体的力学负荷,从而导致生物固定型假体移位、松动、下沉和假体周围骨折等严重术后并发症。因此,亟需研发一种可修饰于假体表面的功能化仿生界面,可以精准地调控由opg/rankl/rank途径介导的成骨-破骨平衡状态,并促进假体界面与周围骨质的整合,从而降低op患者关节置换术后并发症的发生几率,以保证假体的长期稳定性。
4.近年来,数字化设计和3d打印等先进技术的融合革新促进了个体化定制假体在骨科领域的长足发展,从而解决了假体无法精准匹配患者骨缺损和髓腔的临床难题。此外,以松质骨骨小梁的微观形态为参照而仿生设计的钛合金微孔可以于假体表面原位3d熔融打印,增强了界面与骨床的初始稳定性。但是,上述微孔界面不具备op微环境调节功能,且钛合金材料具有较高的生物惰性且表面光滑,无法高效地发挥其微孔内成骨作用。仿生矿化胶原是由胶原、钙盐和磷酸盐等有机和无机化学物质通过生物矿化过程合成,具有与人体骨骼组成成分和微观结构相似的一类功能化仿生材料。它具有无免疫原性、优异的骨组织生物相容性、粘结性、流动性以及良好的生物可降解性能等多种优势,能够有效地促进成骨相关细胞的粘附、增殖以及成骨分化。而双膦酸盐(bisphosphonates,bps)作为临床一线抗
op药物,可以有效调控机体破骨活化的途径,从而具备逆转破骨-成骨微环境失平衡的功能。同时,bps可以提供合成仿生矿化胶原步骤中的磷酸根,预期能够构建一类具有促成骨和op微环境调控双重功能的功能化仿生矿化胶原(functionalized biomineralized collagen,fbc)。其主要机制为:bps可以抑制成骨细胞和骨髓间充质干细胞(bone mesenchymal stem cells,bmscs)表面表达rankl,同时促进opg的分泌与破骨细胞及其前体细胞表面上的rank受体激活剂结合,以阻止rankl和rank之间的相互作用,从而抑制破骨前体细胞的活化和破骨分化,反馈性抑制局部骨质的过度吸收。此外,研究证实bps可诱导假体周围的成纤维细胞凋亡,从而防止植入物孔隙中的纤维组织长入以提高假体的长期稳定性。然而,长期口服用药bps的全身副作用较大,无法在假体植入区域持续精准调控成骨-破骨平衡,局部应用bps则可显著提高其生物利用度,并在破骨活化区域维持适当的浓度和活性,而不会影响健康的骨组织。但是,如何保证bps在局部应用时持续低浓度缓释,并保持高效的生物活性是的目前的关键难点。
技术实现要素:
5.本发明针对op患者进行关节置换术后易发生假体移位、松动甚至假体周围骨折等严重的术后并发症这一亟需解决的难题,提供一种具有骨质疏松微环境调节功能的关节假体界面及其制备方法与应用。
6.为实现上述目的,采用以下技术方案:
7.本发明提供一种具有骨质疏松微环境调节功能的关节假体界面,包括3d打印仿生骨小梁金属微孔结构支架和填充在3d打印仿生骨小梁金属微孔结构支架的微孔结构中的海藻酸钠-仿生矿化胶原;
8.所述海藻酸钠-仿生矿化胶原通过以下方法制备:
9.先向cac12水溶液中加入无机磷酸盐,搅拌混合均匀后,加入i型胶原蛋白,搅拌得到仿生矿化胶原,向仿生矿化胶原中加入海藻酸钠粉末,得到海藻酸钠-仿生矿化胶原。
10.进一步的,所述i型胶原胶原蛋白、cac12、无机磷酸盐的配比为2mg:0.17mol:0.1mol。
11.进一步的,加入海藻酸钠粉末后,海藻酸钠的终浓度为30mg/ml。
12.进一步的,所述无机磷酸盐为na2hpo4,或者为na2hpo4与双膦酸盐的混合物。
13.进一步的,所述双膦酸盐为唑来膦酸盐、阿仑膦酸盐、氯膦酸盐、依替膦酸盐、替鲁膦酸盐或利塞膦酸盐。
14.进一步的,所述na2hpo4与双膦酸盐的摩尔比为1:(0.25-4)。
15.更进一步的,所述na2hpo4与双膦酸盐的摩尔比为1:4、1:2、1:1、2:1或4:1。
16.进一步的,所述3d打印仿生骨小梁金属微孔结构支架的厚度为300-400μm,孔径为500-700μm。
17.进一步的,所述3d打印仿生骨小梁金属微孔结构支架的材料为钛合金。
18.进一步的,在4℃,向cac12水溶液中加入无机磷酸盐,1500r/min的搅拌速度下搅拌10min,混合均匀。
19.本发明还提供上述具有骨质疏松微环境调节功能的关节假体界面的制备方法,包括以下步骤:
20.步骤一、解析松质骨骨小梁微结构,构建仿生骨小梁金属微孔结构支架模型;
21.步骤二、3d打印仿生骨小梁金属微孔结构支架模型,得到3d打印仿生骨小梁金属微孔结构支架;
22.步骤三、制备海藻酸钠-仿生矿化胶原;
23.步骤四、将海藻酸钠-仿生矿化胶原填充于3d打印仿生骨小梁金属微孔结构支架,得到具有骨质疏松微环境调节功能的关节假体界面。
24.进一步的,所述步骤一的过程为:
25.采用micro-ct扫描松质骨部位,并应用mimics三维重建软件,截取松质骨均匀分布区域,测定松质骨中骨小梁的宽度、间隙和松质骨的孔隙率,进而获得3d打印仿生骨小梁金属微孔结构支架的柱径、孔隙大小和孔隙率,构建3d打印仿生骨小梁金属微孔结构支架的三维图像。
26.进一步的,所述步骤二的过程为:
27.通过ebm技术打印3d打印仿生骨小梁金属微孔结构支架三维图像,得到3d打印仿生骨小梁金属微孔结构支架。
28.进一步的,所述步骤四的过程为:
29.将3d打印仿生骨小梁金属微孔结构支架浸没在海藻酸钠-仿生矿化胶原中,使用真空泵将海藻酸钠-仿生矿化胶原吸入3d打印仿生骨小梁金属微孔结构支架的微孔结构中,调节ph至7.35-7.45,得到具有骨质疏松微环境调节功能的关节假体界面。
30.本发明还提供上述关节假体界面在制备用于骨质疏松患者行关节置换手术时使用的关节假体中的应用。
31.与现有技术相比,本发明的有益效果为:
32.本发明的具有骨质疏松微环境调节功能的关节假体界面,先以bps与无机磷酸盐为原料制备仿生矿化胶原,然后将具备粘结性、流动性以及良好的生物可降解性等优异特征的海藻酸钠-仿生矿化胶原填充于3d打印仿生骨小梁金属微孔结构支架的微孔结构中,改善了3d打印仿生骨小梁金属微孔结构支架的生物惰性。一方面,海藻酸钠-仿生矿化胶原在发挥促成骨作用,另一方面,海藻酸钠-仿生矿化胶原不断降解并持续释放bps至界面周围骨质,从而在局部高效地发挥调控opg/rankl/rank途径介导的op微环境的作用。
33.本发明的具有骨质疏松微环境调节功能的关节假体界面,通过改变3d打印仿生骨小梁金属微孔结构支架的空间结构能够调控fbc的降解速率,以匹配微孔结构支架内部骨长入的时间节点,并实现bps的长期低浓度缓释,赋予具有骨质疏松微环境调节功能的关节假体界面优异的促成骨和靶向调控op微环境的双重功能,以达到改善破骨-成骨失衡状态下的假体界面周围骨质条件和促进界面骨整合的临床目标,从根本上解决op患者关节置换术后并发症高发的关键难题。
附图说明
34.本发明的附图说明为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
35.图1为本发明实施例1的3d打印仿生骨小梁金属微孔结构支架的照片;
36.图2为本发明实施例1的海藻酸钠-仿生矿化胶原及其制备原料的照片;
37.图3为本发明实施例3的3d打印仿生骨小梁金属微孔结构支架、海藻酸钠-仿生矿化胶原和关节假体界面的扫描电镜图;
38.图4为本发明实施例3的活死染色结果;
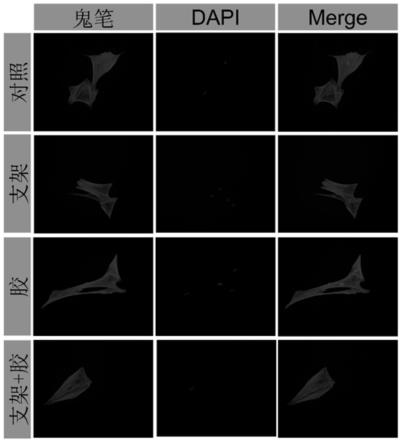
39.图5为本发明实施例3的鬼笔环肽染色结果;
40.图6为本发明实施例3的海藻酸钠-仿生矿化胶原的降解速率结果;
41.图7为本发明实施例3的cck-8检测bmscs的增值速率结果;
42.图8为本发明实施例4的各组trap活性定量检测结果;
43.图9为本发明实施例4的各组trap染色结果;
44.图10为本发明实施例4的trap染色结果;
45.图11为本发明实施例4的trap活性检测统计结果;
46.图12为本发明实施例5的各组茜素红染色结果;
47.图13为本发明实施例5的各组茜素红染色定量分析;
48.图14为本发明实施例5的各组alp染色结果。
具体实施方式
49.为了进一步理解本发明,下面对本发明优选实施方案进行描述,但是应当理解,这些描述只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。
50.本发明的具有骨质疏松微环境调节功能的关节假体界面,包括3d打印仿生骨小梁金属微孔结构支架和填充在3d打印仿生骨小梁金属微孔结构支架的微孔结构中的海藻酸钠-仿生矿化胶原(水凝胶);
51.其中,海藻酸钠-仿生矿化胶原通过以下方法制备:先向cac12水溶液中加入无机磷酸盐,搅拌混合均匀后,加入i型胶原蛋白,搅拌得到仿生矿化胶原,向仿生矿化胶原中加入海藻酸钠粉末,得到海藻酸钠-仿生矿化胶原。
52.上述技术方案中,i型胶原胶原蛋白、cac12、无机磷酸盐的配比为2mg:0.17mol:0.1mol,加入海藻酸钠粉末后,海藻酸钠的终浓度为30mg/ml。使用cacl2交联,最终制备成稳定的海藻酸钠-仿生矿化胶原(水凝胶)。
53.上述技术方案中,无机磷酸盐为na2hpo4,或者为na2hpo4与双膦酸盐的混合物,双膦酸盐为唑来膦酸盐、阿仑膦酸盐、氯膦酸盐、依替膦酸盐、替鲁膦酸盐或利塞膦酸盐。na2hpo4与双膦酸盐的摩尔比优选为1:(0.25-4),更优选为摩尔比为1:4、1:2、1:1、2:1或4:1。
54.上述技术方案中,3d打印仿生骨小梁金属微孔结构支架的厚度为300-400μm,孔径为500-700μm;3d打印仿生骨小梁金属微孔结构支架的材料优选为钛合金。
55.上述技术方案中,优选在4℃,向cac12水溶液中加入无机磷酸盐,1500r/min的搅拌速度下搅拌10min。
56.本发明的具有骨质疏松微环境调节功能的关节假体界面的制备方法,包括以下步骤:
57.步骤一、采用micro-ct扫描家兔股骨松质骨部位,并应用mimics三维重建软件,截
取松质骨均匀分布区域,重建三维图像输出为stl文件并导入rhino软件,测量骨小梁的总体积,得到松质骨中骨小梁宽度、间距,和松质骨孔隙率,根据测得的数据,得到3d打印仿生骨小梁金属微孔结构支架模型。
58.步骤二、通过ebm技术打印3d打印仿生骨小梁金属微孔结构支架三维图像,得到3d打印仿生骨小梁金属微孔结构支架。
59.步骤三、制备海藻酸钠-仿生矿化胶原。
60.步骤四、将3d打印仿生骨小梁金属微孔结构支架浸没在海藻酸钠-仿生矿化胶原中,使用真空泵将海藻酸钠-仿生矿化胶原吸入3d打印仿生骨小梁金属微孔结构支架的微孔结构中,调节ph至7.35-7.45,得到具有骨质疏松微环境调节功能的关节假体界面。
61.本发明的具有骨质疏松微环境调节功能的关节假体界面在制备用于骨质疏松患者行关节置换手术时使用的关节假体中的应用。
62.在本发明中所使用的术语,一般具有本领域普通技术人员通常理解的含义,除非另有说明。
63.为了使本领域的技术人员更好地理解本发明的技术方案,下面将结合实施例对本发明作进一步的详细介绍。在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
64.下述实施例中所用的材料、试剂、装置、仪器、设备等,如无特殊说明,均可从商业途径获得。以下结合实施例进一步说明本发明。
65.实施例1
66.步骤一、仿生骨小梁金属微孔结构支架
67.采用micro-ct扫描家兔股骨松质骨部位,并应用mimics三维重建软件,截取松质骨均匀分布区域,重建三维图像输出为stl文件并导入rhino软件,测量骨小梁的总体积,得到松质骨中骨小梁宽度、间距,和松质骨孔隙率。根据测得的数据,得到3d打印仿生骨小梁金属微孔结构支架模型。
68.步骤二、制备3d打印仿生骨小梁金属微孔结构支架
69.以钛合金为材料,通过ebm技术打印3d打印仿生骨小梁金属微孔结构支架模型(为了检测方便,打印成圆盘状(直径为10mm,高度3mm),用于细胞实验和理化性能测试,在实际应用中,可以根据需要,3d打印成任意形状,骨科中,就打印成假体形,动物支架所需的柱状3d打印仿生金属微孔的参数,依据实验动物髓腔的实际ct扫描数据设定和打印),得到3d打印仿生骨小梁金属微孔结构支架。
70.步骤三、制备海藻酸钠-仿生矿化胶原
71.在4℃,向cac12溶液中添加无机磷酸盐,在速度1500r/min下搅拌10min,然后将i型胶原蛋白溶于上述溶液,得到仿生矿化胶原,加入终浓度为30mg/ml的海藻酸钠粉末,得到海藻酸钠-仿生矿化胶原;
72.其中,na2hpo4混合物为na2hpo4与bps按摩尔比1:4、1:2、1:1、2:1或4:1的混合物;bps为唑来膦酸盐。
73.步骤四、将3d打印仿生骨小梁金属微孔结构支架浸没在海藻酸钠-仿生矿化胶原中,使用真空泵将海藻酸钠-仿生矿化胶原吸入3d打印仿生骨小梁金属微孔结构支架的微孔结构中,通过naoh溶液(0.1m)调节ph至7.35-7.45,得到具有骨质疏松微环境调节功能的
关节假体界面。
74.实施例2
75.结构检测(海藻酸钠-搭载唑来膦酸3d打印仿生骨小梁金属微孔结构支架)
76.观察实施例1的3d打印仿生骨小梁金属微孔结构支架和海藻酸钠-仿生矿化胶原,结果如图1-3所示。图1为3d打印仿生骨小梁金属微孔结构支架的照片,图2为海藻酸钠-仿生矿化胶原及其制备原料的照片,图3为3d打印仿生骨小梁金属微孔结构支架、海藻酸钠-仿生矿化胶原和关节假体界面的扫描电镜图。从图1-3可以看出,制备的海藻酸钠-仿生矿化胶原外观呈米白色,该海藻酸钠-仿生矿化胶原性质稳定,常温下即可稳定存在,加入磷酸氢二钠或者唑来膦酸药物后,对于海藻酸钠-仿生矿化胶原状态和性质未见明显影响。3d打印仿生骨小梁金属微孔结构支架(动物支架)呈多孔状,孔隙形状规整,柱大小均匀一致,计算可得孔径为631.0
±
21.65μm,柱径为349.0
±
14.15μm,与预期相符。此外,电镜下可以看出,所制备的海藻酸钠-仿生矿化胶原具有一定的孔隙结构,测量可得,海藻酸钠-仿生矿化胶原的孔隙大小为111.6
±
9.31μm。正常细胞大小约为10-100μm,所以该孔隙允许细胞正常迁移和粘附,有利于细胞进行营养物质交换。
77.实施例3
78.对该复合体系的生物相容性进行检测(海藻酸钠-搭载唑来膦酸3d打印仿生骨小梁金属微孔结构支架)
79.首先,在12孔板中,每孔种植4万bmscs检测支架的细胞毒性。24h之后,通过活死染色,在荧光显微镜下,观察各组细胞的存活情况。结果如图4所示,与对照组(无支架也无海藻酸钠-仿生矿化胶原)相比,支架组、海藻酸钠-仿生矿化胶原、支架+海藻酸钠-仿生矿化胶原组未见明显差别,证实该复合体系对于bmscs无细胞毒性。由于海藻酸钠-仿生矿化胶原存在时,细胞位于海藻酸钠-仿生矿化胶原里面,所以细胞未呈现出长梭形的贴壁形态,而是表现出类似于悬浮状态的圆形。
80.为进一步验证该复合体系对细胞粘附、细胞形态的影响,进行细胞骨架微丝进行染色,结果如图5所示。从图5中可以看出,与对照组相比,其他三组的细胞形态未见明显改变,微孔结构正常。实验结果表明,该复合体系对于bmscs骨架微丝无明显影响。
81.为验证该海藻酸钠-仿生矿化胶原的降解速率。在体外条件下,将实施例1制备的海藻酸钠-仿生矿化胶原放置在5ml的pbs中浸泡,按照设定好的时间进行取样,冻干和称量,最终计算出海藻酸钠-仿生矿化胶原的降解速率如图6所示。结果显示,到第30天,海藻酸钠-仿生矿化胶原降解了85%,到第60天左右,该海藻酸钠-仿生矿化胶原基本降解完全,考虑到正常骨修复过程需要3个月,所以该海藻酸钠-仿生矿化胶原降解的时间正好能够与骨长入时间相匹配。既能达到药物缓释的目的,也避免了在骨再生中海藻酸钠-仿生矿化胶原的占位作用。
82.为验证该复合体系对bmscs增值的影响,实验采取cck-8法检测细胞增殖速率。在24孔板中,每孔种植2万bmscs,每两天换一次培养液,分别在第1、4、7天对细胞数量进行检测,检测结果如图7所示。从图7中可以看出,不同na2hpo4:bps比例下,对于bmscs的增值有一定的影响。与不加bps相比,当bps含量过高(大于1:4时),导致药物浓度过大,会对细胞的增值起到明显的抑制作用,细胞数量不断减少。而当比值为2:1时,对于bmscs的增值具有一定的促进作用,且促进增值的效果比不含药物的不含bps组的海藻酸钠-仿生矿化胶原效果更
好,差异具有显著统计学差异(p《0.01)。
83.实施例4
84.抑制破骨相关实验检测(海藻酸钠-搭载唑来膦酸3d打印仿生骨小梁金属微孔结构支架)
85.在6孔板中,每孔种植2万破骨前体细胞raw264.7,先使用不含双抗的α-mem培养基培养一天,第二天使用含有破骨诱导因子m-csf(50ng/ml)和rankl(100ng/ml)的培养基,诱导ranw264.7细胞定向分化为破骨细胞,诱导培养四天后使用抗酒石酸酸性磷酸酶(trap)定量检测试剂盒和trap染色试剂盒,进行定量和定性检测破骨细胞活性。如图8所示,当na2hpo4:bps比例中,双膦酸盐浓度逐渐增加时,trap活性逐渐降低,提示当bps含量较高时,抑制效果更显著,约在1:1左右时达到最佳,图9的trap染色结果中,也可以看到随着bps含量的增加,破骨细胞数量逐渐降低,体积也在逐渐减小。为了更精确的确定最佳比例,选取更小的范围进行trap定量和定性检测,如图10所示,从染色结果可以看出,当比例为1:1和1:2时,破骨细胞明显变小,数量降低。图11中trap活性检测,也可以看出在这两个比例下,破骨细胞活性抑制效果最佳,且随着bps浓度的升高,抑制效果不再增强。提示1:1或者1:2比例下的bps浓度,即可达到最佳的抑制破骨细胞活性的作用。
86.实施例5
87.促成骨作用(海藻酸钠-搭载唑来膦酸3d打印仿生骨小梁金属微孔结构支架)
88.在体外条件下,在12孔板中,每孔种植4万bmscs,先使用低糖培养基进行增值培养,待细胞覆盖板低60%后,换成骨诱导培养基(主要成分为10%胎牛血清,1%青链霉素双抗,12.8mg/l维生素c,2.16g/lβ-甘油磷酸钠,5mmol/l地塞米松)进行诱导培养,分别在第7天、第14天,分别使用茜素红试剂盒与碱性磷酸酶(alp)染色试剂盒,进行茜素红染色和alp染色。并对茜素红染色结果进行定量分析,使用10%的氯化十六烷吡啶溶解钙结节,对茜素红结果进行定量检测。
89.促成骨相关茜素红检测实验结果如图12所示,从图12支架染色结果以及图13的定量分析结果中,可以看出,不含bps组的海藻酸钠-仿生矿化胶原具有一定的促成骨作用,随着时间的增长,促成骨效果逐渐增强。而含有bps的实验组,起初随着bps含量的增加,促成骨效果逐渐增强,但是当含量超过1:1之后,继续增加bps含量促进成骨的效果开始降低,效果明显不如无bps组。从图14的alp染色结果可以看出,第7天时,与na2hpo4:bps比例为1:0、1:2和1:4相比,在1:1比例下,alp染色深度最深,促成骨效果最强。而随着bps比例增加,在1:2、1:4以及1:0组中alp染色结果显示促成骨效果较差。在第14天时,不含bps组的海藻酸钠-仿生矿化胶原以及低bps组,促成骨效果逐渐增强,其中2:1比例下促成骨效果相比于1:1比例更好。而高bps含量时,染色结果显示促成骨效果依然较差,且细胞出现萎缩变形,有凋亡趋势。
90.对于本领域的普通技术人员而言,可以根据实际使用情况更换功能相同的不同型号用电器,对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。显然,上述实施方式仅仅是为清楚地说明所作的举例,而并非对实施例的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有实施例予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1