约氏乳杆菌在制备防治高尿酸血症药物上的应用及制备方法与流程
1.本发明涉及微生物技术领域,尤其是涉及约氏乳杆菌在制备防治高尿酸血症药物上的应用及制备方法。
背景技术:
2.高尿酸血症(hyperuricemia,hua)主要指正常嘌呤饮食状态下,空腹血尿酸水平高于正常水平的一种病症,即男性血清中的尿酸浓度高于416.4μmol/l(7.0mg/dl),女性血清中的尿酸浓度高于356.9μmol/l(6.0mg/dl)。我国高尿酸血症的患病率高达13.3%,虽然其不会威胁患者的生命安全,但它与痛风、高血压、心血管疾病、糖尿病、恶性肿瘤等多种重大疾病的发生密切相关,也与多个重要靶器官损害密切相关。高尿酸血症可分为原发性高尿酸血症及继发性高尿酸血症。原发性高尿酸血症主要由先天性嘌呤代谢紊乱和/或尿酸排泄障碍所引起。继发性高尿酸血症通常由某些系统疾病或者长期使用药物所引起。目前高尿酸血症的治疗方式主要有两类,一是生活干预,二是药物治疗。临床应用的降尿酸药物主要有三类,分别是抑制尿酸生成药,由于尿酸是嘌呤的代谢的终产物,该类药物通过抑制嘌呤的从头合成而降低尿酸生成,包括别嘌呤醇、非布司他等。肾脏的排泄问题也是诱发hua的一大重要原因,通过抑制近端肾小管对尿酸的重吸收,有助于尿酸排泄,常用促尿酸排泄药药物有苯溴马隆、丙磺舒和苯磺唑酮等,尿酸酶制剂是促进尿酸降解的药物,通过分解尿酸为溶解度更高便于排出体外的尿素囊而发挥作用,包括拉布立酶、培戈洛替酶和聚乙二醇尿酸氧化酶。目前用于研究高尿酸血症的动物主要是小鼠和大鼠,动物模型又可分为两大类,一类是遗传修饰,另一类是化学诱导造模。前者通过基因修饰技术模拟发病机制,后者通过药物诱发病症。二者各有优缺点。
3.目前用于治疗高尿酸血症的药物具有毒副作用强,患者耐受力低等问题,尤其对肾脏和胃肠道的损害作用突出。例如抑制尿酸合成的药物非布司他,在临床使用中相继报道出增加心血管风险,损害肝功能等副作用,并且价格昂贵。促进尿酸排泄的苯溴马隆也有报道提出其具有肝功能异常、氨基转移酶升高等肝损伤不良反应。拉布立酶等促尿酸分解的药物也是具有免疫原性、发热、恶心、头痛、心血管事件以及便秘等不良反应。因此研究人员开始寻求健康、高效的防治高尿酸血症的途径。
技术实现要素:
4.有鉴于此,有必要针对上述问题,提供约氏乳杆菌在制备防治高尿酸血症药物上的应用及制备方法。
5.第一个方面,本发明提供约氏乳杆菌yh1136在制备防治高尿酸血症药物上的应用。
6.第二个方面,本发明提供一种防治高尿酸血症的药物组合物,所述药物组合物包括约氏乳杆菌yh1136。
7.进一步地,所述药物组合物还包括药学上可接受的载体。
8.进一步地,所述药物组合物的制剂形式为液体剂型。
9.第三个方面,本发明提供一种防治高尿酸血症的药物,包括:将所述约氏乳杆菌yh1136制备成菌悬液,再将菌悬液进一步制备成药物。
10.进一步地,所述菌悬液浓度为108cfu/ml。
11.进一步地,将所述约氏乳杆菌yh1136配制成菌悬液的方法为:
12.将-80℃保存的约氏乳杆菌yh1136菌株取出,转移至灭菌mrs液体培养基中进行活化培养,培养条件为37℃,24h;然后将菌液以2%的比例接种于灭菌mrs液体培养基中37℃扩大培养24h后进行活菌计数,然后将菌液分装,3000r/min,4℃离心15min,弃上清液收集菌体;用ph7.0的pbs缓冲液重悬至初始体积,混匀后再次离心15min,重复两次;将菌体重悬在生理盐水中,根据活菌计数结果,将菌悬液浓度调整至108cfu/ml,4℃保存备用,得到约氏乳杆菌yh1136菌悬液。
13.进一步地,所述活化培养为培养3代。
14.进一步地,所述药物还包括:将所述约氏乳杆菌yh1136菌悬液进一步灭活得到灭活菌悬液,再将灭活菌悬液进一步制备成药物。
15.进一步地,将所述约氏乳杆菌yh1136菌悬液灭活的方法,包括:
16.将所述约氏乳杆菌yh1136菌悬液在70℃水浴2h,得到灭活约氏乳杆菌yh1136菌悬液。
17.与现有技术相比,本发明所具有的优点和有益效果是:
18.本发明的约氏乳杆菌yh1136在中国典型培养物保藏中心的保藏号是cctcc m 20221116,已经在申请号为2022109236103的中国专利申请中首次记载,本发明将其首次用于降解尿酸的相关研究,并且初显成效。动物实验表明,约氏乳杆菌yh1136和灭活约氏乳杆菌yh1136可通过有效降低血清中尿酸含量从而达到防治高尿酸血症的目的。并通过其和植物乳杆菌在降尿酸效果上的对比,结果发现,植物乳杆菌在防治大鼠高尿酸血症上远不如本发明的约氏乳杆菌yh1136,该菌株有望进一步开发成防治高尿酸血症的相关药物。
附图说明
19.图1是实验进程示意图;
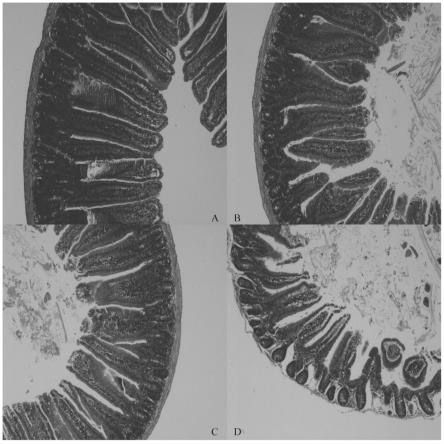
20.图2是第(1)-(4)组处理组回肠病理切片,图中:a对照组;b灭活yh1136组;c yh1136组;d氧嗪酸钾造模组;
21.图3是第(1)-(4)组处理组肝脏病理切片,图中:a对照组;b灭活yh1136组;c yh1136组;d氧嗪酸钾造模组;
22.图4是第(1)-(4)组处理组肾脏病理切片,图中:a对照组;b灭活yh1136组;c yh1136组;d氧嗪酸钾造模组;
23.图5是第(1)-(4)组处理组血清中尿酸含量:图中:a为第0周血尿素含量;b为第4周血尿素含量;c为第8周血尿素含量;d为第12周血尿素含量;
24.图6是第(1)-(4)组处理组大鼠双侧肾脏重量对比分析;
25.图7是第(1)-(4)组处理组大鼠体重变化分析;
26.图8是第(1)-(4)组处理组回肠alpha物种多样性差异图;
27.图9是第(1)-(4)组处理组回肠菌群的主坐标分析(pcoa);
28.图10是yh1136和g83及其对应的肠道滤液在体外的黄嘌呤氧化酶抑制能力测定。
具体实施方式
29.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
30.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
31.实施例1:
32.本实施例提供约氏乳杆菌yh1136菌悬液的制备方法:
33.本实施例所述约氏乳杆菌yh1136保藏于中国典型培养物保藏中心,保藏编号为:cctcc m 20221116,菌株名称:约式乳杆菌(lactobacillus johnsonii),已经在申请号为2022109236103的中国专利申请中首次记载。
34.将1ml-80℃保存的约氏乳杆菌yh1136菌株取出,该菌株已经在申请号为2022109236103的中国专利申请中首次记载,转移至少量的灭菌mrs液体培养基中进行活化培养3代,其中少量是指灭菌mrs液体培养基的体积为5-10ml,在本实施例中灭菌mrs液体培养基为10ml,培养条件为37℃,24h;然后将菌液以2%的比例接种于大量的灭菌mrs液体培养基中37℃扩大培养24h后进行活菌计数,本实施例中大量是指灭菌mrs液体培养基的体积为200ml,然后将菌液分装,3000r/min,4℃离心15min,弃上清液收集菌体;用ph7.0的pbs缓冲液重悬至初始体积,混匀后再次离心15min,重复两次;最后将菌体重悬在生理盐水中,根据活菌计数结果,将菌悬液浓度调整至108cfu/ml,4℃保存备用,得到约氏乳杆菌yh1136菌悬液。每周重新制备一次。
35.实施例2:
36.本实施例提供灭活约氏乳杆菌yh1136菌悬液的制备方法:
37.将实施例1制备好的约氏乳杆菌yh1136菌悬液在70℃水浴2h,得到灭活约氏乳杆菌yh1136菌悬液。采用本方法制备的灭活约氏乳杆菌yh1136菌悬液,灭活益生菌的表面吸附位点暴露,更容易粘附在肠道上皮细胞,发挥拮抗病原菌的作用,不受环境温度影响更容易保存运输,具有更高的安全性。
38.实施例3:
39.本实施例提供约氏乳杆菌yh1136在制备防治高尿酸血症药物上的应用。
40.实施例4:
41.本实施例提供一种防治高尿酸血症的药物组合物,所述药物组合物包括约氏乳杆菌yh1136和药学上可接受的载体。本实施例采用的可接受载体是ph=7.0的pbs缓冲液。所述药物组合物的制剂形式为液体剂型。
42.实施例5:
43.本实施例提供一种防治高尿酸血症的药物,该药物是由实施例1制备的约氏乳杆菌yh1136菌悬液制备而成。
44.实施例6:
45.本实施例提供一种防治高尿酸血症的药物,该药物是由实施例2制备的灭活约氏
乳杆菌yh1136菌悬液制备而成。
46.对比例1:
47.本对比例提供植物乳杆菌g83菌液的制备方法,本对比例与实施例1的区别仅仅在于采用的菌株为植物乳杆菌g83(由四川农业大学动物微生态研究中心提供,可以市售获得),其余与实施例1同。
48.对比例2:
49.本对比例提供灭活植物乳杆菌g83菌液的制备方法,本对比例与实施例2的区别仅仅在于采用的菌株为植物乳杆菌g83(由四川农业大学动物微生态研究中心提供,可以市售获得),其余与实施例2同。
50.实验例:
51.1.动物分组及给药:
52.将体重为280
±
5g的健康雄性3周龄大鼠,随机分成六组,每组分为两笼,每笼有6个重复。大鼠购买自斯贝福(北京)生物技术有限公司、型号为sd大鼠。第一组为空白对照组、第二组为氧嗪酸钾造模组、第三组为约氏乳杆菌干预组(益生菌组)、第四组为灭活约氏乳杆菌干预组(灭活益生菌组)、第五组为植物乳杆菌g83干预组、第六组为灭活植物乳杆菌g83干预组。
53.(1)空白对照组:灌胃0.5ml/100g 0.5%cmc溶液,造模1h后给予等体积生理盐水,每日一次。
54.(2)氧嗪酸钾造模组:灌胃氧嗪酸钾,氧嗪酸钾的使用剂量为100mg/100g体重,将氧嗪酸钾按200mg/ml的比例溶解于0.5%的羧甲基纤维素钠溶液中,灌胃时的液体剂量是0.5ml/100g体重。约氏乳杆菌干预组、灭活约氏乳杆菌干预组、植物乳杆菌g83干预组和灭活植物乳杆菌g83干预组的配置方法相同,造模1h后给予等体积生理盐水,每日一次。
55.(3)约氏乳杆菌干预组:灌胃氧嗪酸钾,造模1h后给予实施例1制备的约氏乳杆菌yh1136菌悬液灌胃,每日一次。
56.(4)灭活约氏乳杆菌干预组:灌胃氧嗪酸钾,造模1h后给予实施例2制备的灭活约氏乳杆菌yh1136菌悬液灌胃,每日一次。
57.(5)植物乳杆菌g83干预组:灌胃氧嗪酸钾,造模1h后给予对比例1制备的植物乳杆菌g83菌液灌胃,每日一次。
58.(6)灭活植物乳杆菌g83干预组:灌胃氧嗪酸钾,造模1h后给予对比例2制备的植物乳杆菌g83菌液灌胃,每日一次。
59.2.样品采集:
60.(1)实验开始第0、28、56、84天使用内眦采血法采集血液样品,收集血清用于测定尿酸含量;
61.(2)实验期间每周对所有大鼠进行称重,记录体重变化情况。
62.(3)第85d,处死大鼠取血,收集血清样本;
63.(4)取大鼠肝脏、双侧肾脏、小肠组织;
64.实验的具体进程如图1所示。
65.3.观察项目及检测内容:
66.(1)第(1)-(4)组肠道、肝脏以及肾脏病理变化对比:
67.检测方法:取部分小肠,肝脏以及右侧肾脏组织在4℃下,用4%的多聚甲醛溶液固定24h以上,用石蜡包埋后做he染色,光镜下观察组织病理变化;
68.(2)血清中尿酸水平的检测:
69.检测方法:使用尿酸(ua)含量(微量法)检测试剂盒(solarbio,中国北京)对第(1)-(4)组血清的尿酸水平进行检测。
70.(3)第(1)-(4)组肠道菌群结构测序分析对比:
71.检测方法:取第(1)-(4)组回肠组织,使用试剂盒提取菌体dna,进行高通量测序,对比各组肠道菌群结构的变化。该试剂盒为stool dna kit,型号为d4015-02 200preps(购买omega bio-tek公司,美国佐治亚州诺克罗斯市)。
72.(4)黄嘌呤氧化酶体外抑制实验:
73.采用hplc(高效液相色谱)法测定酶促反应中底物黄嘌呤的含量,根据反应前后底物含量的变化情况来评价生理盐水、yh1136菌悬液、灭活的yh1136菌悬液、灌胃约氏乳杆菌yh1136大鼠肠道滤液、灌胃灭活约氏乳杆菌yh1136大鼠肠道滤液、植物乳杆菌g83、灭活植物乳杆菌g83对黄嘌呤氧化酶的抑制作用。其中灌胃约氏乳杆菌yh1136大鼠肠道滤液是指取0.1g灌胃了约氏乳杆菌yh1136菌悬液的大鼠回肠肠道内容物,加入灭菌后的ph=7.0的pbs缓冲液,进行匀浆化处理,然后在3000r/min的条件下离心10min中,取0.5ml上清液作为灌胃约氏乳杆菌yh1136大鼠肠道滤液。灌胃灭活约氏乳杆菌yh1136大鼠肠道滤液是指取0.1g灌胃了灭活约氏乳杆菌yh1136菌悬液的大鼠回肠肠道内容物,加入灭菌后的ph=7.0的pbs缓冲液,进行匀浆化处理,然后在3000r/min的条件下离心10min中,取0.5ml上清液作为灌胃灭活约氏乳杆菌yh1136大鼠肠道滤液。
74.(5)肌苷体外降解实验:
75.取yh1136菌悬液、灭活yh1136菌悬液、灌胃约氏乳杆菌yh1136大鼠肠道滤液、灌胃灭活约氏乳杆菌yh1136大鼠肠道滤液、植物乳杆菌g83菌液、灭活植物乳杆菌g83菌液各0.5ml,分别加入5ml 10mg/ml的肌苷溶液中,混匀后37摄氏度培养12h,4000r/min离心10min,取上清10μl进行层析,然后测定吸光值,根据标注曲线测定肌苷降解率。
76.(6)鸟苷体外降解实验:
77.测定方法与肌苷相同,取yh1136菌悬液、灭活yh1136菌悬液、灌胃约氏乳杆菌yh1136大鼠肠道滤液、灌胃灭活约氏乳杆菌yh1136大鼠肠道滤液、植物乳杆菌g83菌液、灭活植物乳杆菌g83菌液、各0.5ml,分别加入5ml 10mg/ml的鸟苷溶液中,37摄氏度培养12h,4 000r/min离心10min,取上清10μl过滤后使用hplc法测定鸟苷含量,根据反应前后鸟苷含量测定鸟苷体外降解率。
78.4.实验结果:
79.(1)第(1)-(4)组处理组肠道病理变化分析:
80.图2展示了肠道的病理切片结果。如图2可知,造模组的肠道绒毛形态与对照组相比,出现了明显的改变,肠道绒毛高度减少,隐窝深度增加。而使用灭活约氏乳杆菌yh1136和约氏乳杆菌yh1136进行灌胃处理的两个组,小肠绒毛形态均得到了有效的改善,肠道绒毛高度增加,隐窝深度降低,其中灭活约氏乳杆菌yh1136组的效果略好于yh1136组。这提示约氏乳杆菌yh1136对于小肠绒毛的损伤具有保护作用,这一点在我们的其他研究中也得到了证实。
81.(2)第(1)-(4)组处理组肝脏病理变化分析:
82.如图3所示,对照组可见清晰完整的肝小叶结构,肝细胞以中央静脉为中心向周围呈放射状整齐排列,造模组以及另外两组yh1136处理组也未见明显肝脏组织损伤。
83.(3)第(1)-(4)组处理组肾脏病理变化分析:
84.如图4所示,对照组病理切片未见明显的病变。造模组与对照组相比,出现了明显的充血症状,肾小管上皮细胞出现颗粒变性,肾小囊发生了扩张。约氏乳杆菌yh1136处理组仍有少量轻度的充血现象,而灭活约氏乳杆菌yh1136处理组表现基本正常。这表明灭活约氏乳杆菌yh1136的防治效果更好。
85.(4)第(1)-(4)组处理组血清中尿酸含量的检测:
86.如图5所示。实验开始前第0周时,四个组大鼠的血清尿酸含量比较接近,且没有显著性差异。第4周时,造模组与对照组相比,血清尿酸含量大幅提升。约氏乳杆菌yh1136组和灭活约氏乳杆菌yh1136组尿酸含量较对照组相比也有所升高,但也都显著低于造模组的尿酸水平。第8和第12周各处理组的尿酸水平趋势与第4周相同,即造模组尿酸水平最高,约氏乳杆菌yh1136和灭活约氏乳杆菌yh1136组次之,对照组最低。说明采用氧嗪酸钾灌胃造模的方法是可行的,约氏乳杆菌yh1136组和灭活约氏乳杆菌yh1136灌胃组的尿酸水平较造模组有所下降,但仍高于对照组,其中灭活约氏乳杆菌yh1136组的尿酸水平降低最多,基本与对照组持平,这说明灭活约氏乳杆菌yh1136比正常状态下的约氏乳杆菌yh1136具有更好的降低血清尿酸含量的效果。
87.(5)第(1)-(4)组处理组双侧肾脏重量以及体重的变化:
88.如图6、图7所示。最终实验结束时,造模组的双侧肾脏重量高于对照组,这是因为尿酸含量升高可能会导致高尿酸血症肾病,痛风石以及肾结石等病症,加大肾脏的负担,使肾脏的重量提高。体重的结果显示,实验结束时,造模组的体重最高,对照组的体重次之,灭活约氏乳杆菌yh1136组再次,约氏乳杆菌yh1136组的体重为最低。
89.(6)第(1)-(4)组处理组肠道菌群分析:
90.使用16s rrna高通量测序对各处理组大鼠的回肠菌群结构进行分析。香农多样性通常被用于分析群落多样性的高低,是alpha多样性分析的一种。香农多样性的结果如图8所示,可以看出,与对照组相比,造模组的回肠香农多样性在高原缺氧环境的作用下显著减少,约氏乳杆菌yh1136组和灭活约氏乳杆菌yh1136组在约氏乳杆菌yh1136的作用下,香农多样性显著增加,呈现恢复的趋势。beta多样性分析常被用来比较不同生态系统之间的多样性,也就是样品间的差异。pcoa是较为常用的beta多样性分析方法。如图9所示,造模组与灭活约氏乳杆菌yh1136组的样本距离最接近,表示这两个组的物种组成结构相似度最高。造模组与对照组的样本距离最远,表示二者之间的物种组成差异较大。
91.(7)黄嘌呤氧化酶体外抑制能力测定:
92.由图10可知,在体外处理100min后,灌胃灭活约氏乳杆菌的大鼠肠道滤液,灌胃约氏乳杆菌的大鼠肠道滤液以及yh1136菌悬液的体外抑制黄嘌呤氧化酶的能力最强,酶活均降低到40%以下。灭活yh1136菌悬液和植物乳杆菌g83菌液的黄嘌呤氧化酶体外抑制能力较弱,其活性降低至80%左右。而生理盐水以及灭活植物乳杆菌g83菌液则几乎没有抑制黄嘌呤氧化酶的能力,其活性在经过100min的处理后仍有95%以上。这项结果表明,灭活约氏乳杆菌yh1136菌悬液具有较强的体外抑制黄嘌呤氧化酶的能力,其抑制能力强于植物乳杆
菌g83菌液。
93.(8)肌苷体外降解效率测定:
94.由表1可知灌胃灭活约氏乳杆菌yh1136的大鼠肠道滤液具有最高的肌苷降解率,可达88.46%,灌胃约氏乳杆菌yh1136大鼠肠道滤液的降解率为72.44%,约氏乳杆菌yh1136的直接降解率也达68.47%。而与之相比的植物乳杆菌g83菌液则只有28.22%的降解率,灭活处理后降解率则只有2.35%。这表明灭活处理并非对所有的乳酸杆菌都适用。同样,约氏乳杆菌yh1136菌悬液在灭活后其肌苷降解率也大幅降低为22.92%,但取其灌胃后的大鼠肠道滤液用于降解肌苷具有最佳的效果,这表明灭活的约氏乳杆菌yh1136菌悬液降解尿酸的能力可能与其在肠道中与其他细菌或者物质发挥互作有关。
95.表1肌苷的体外降解效率
[0096][0097]
(9)鸟苷的体外降解效率测定:
[0098]
由表2可知,鸟苷的体外降解效率与肌苷降解效率的结果类似,即灌胃灭活约氏乳杆菌yh1136的大鼠肠道滤液具有最佳的体外鸟苷降解率,高达92.15%。其次是灌胃约氏乳杆菌yh1136大鼠肠道滤液,达到77.21%,接下来是yh1136菌悬液为73.89%,而灭活yh1136菌悬液则大幅下降,仅为25.43%,植物乳杆菌g83菌液为23.78,虽然有一定的鸟苷降解率,但其效率远不如约氏乳杆菌yh1136。而灭活植物乳杆菌g83菌液的降解率才2.33%。
[0099]
表2鸟苷的体外降解效率
[0100][0101]
我们使用药物造模的方式建立了大鼠高尿酸血症模型,并通过益生菌灌胃给药的方式进行治疗,结果表明,约氏乳杆菌yh1136和灭活约氏乳杆菌yh1136可通过降低血清中尿酸含量有效治疗和预防大鼠高尿酸血症。
[0102]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1