马醉木苷元在制备脾酪氨酸激酶抑制剂中的应用
1.本发明涉及生物医药技术领域,尤其涉及马醉木苷元在制备脾酪氨酸激酶抑制剂中的应用。
背景技术:
2.马醉木苷元(asebogenin)是从杜鹃花科马醉木属(piper)植物叶得到的二氢查耳酮(dihydrochalcone)类化合物,研究发现马醉木苷元能通过化学方法高效人工合成,具有广泛应用和推广的潜力。但对于该物质具体的作用研究不够深入,以及相关作用机制也不是很清楚。
3.脾酪氨酸激酶(spleen tyrosine kinase,syk)是一种非受体蛋白酪氨酸激酶,催化底物蛋白酪氨酸残基磷酸化。主要存在于脾脏、胸腺和肺部的器官,在造血细胞、免疫细胞等多种细胞中广泛表达。syk是重要的信号转导分子,其活性受自身磷酸化调控。当syk被磷酸化激活后,进一步磷酸化多个下游相关信号分子参与调控b细胞成熟、破骨细胞生成、血小板活化、细胞的增殖分化等多种生理功能,是免疫和炎症反应信号通路中的关键蛋白。syk信号通路的过度活化在类风湿性关节炎、系统性红斑狼疮、特发性血小板减少性紫癜等自身免疫性疾病和肿瘤的发生发展中扮演重要角色。鉴于此,syk是全球创新药研发企业重点聚焦的几种酪氨酸激酶之一。
4.部分syk小分子抑制剂如fostamatinib、cerdulatinib等已进入临床试验阶段用于治疗关节炎、特发性血小板减少性紫癜等疾病。但是这类传统的小分子抑制剂通过竞争结合atp结合位点,进而直接抑制syk的酶活性位点发挥作用,由于atp的结合位点在不同激酶之间具有结构保守性和相似性,故这类传统小分子激酶抑制剂往往特异性不强,其脱靶效应限制了其应用。其中,如fostamatinib是syk和flt3双重抑制剂(syk ic
50
=41nm),还可抑制jak2、vegfr2等多种激酶活性,其低选择性导致的毒性问题难以克服。
5.第二代高选择性的syk抑制剂包括目前处于临床试验阶段的cerdulatinib、ans002和entospletinib等,虽然表现出良好的治疗前景,但也能不同程度地抑制其它激酶的活性,如cerdulatinib和ans002是syk和jak双重抑制剂(cerdulatinib对syk的ic
50
=32nm,对jak的ic
50
=6~12nm;ans002对syk的ic
50
=5nm,对jak的ic
50
=4~46nm),tak-659是syk和flt3双重抑制剂(ic
50
分别为3.2nm和4.6nm)。因此,开发作用模式新颖、药理学特性良好、选择性高、特异性强的syk抑制剂是非常需要的。
技术实现要素:
6.本发明的目的在于提供马醉木苷元在制备syk抑制剂中的应用,通过本发明可以看出马醉木苷元能够直接结合syk蛋白,抑制血小板和中性粒细胞内的syk激酶的磷酸化和活化,对其它酪氨酸激酶无显著抑制作用,特异性强,而且药理学特性良好、选择性高,能够更好的用于治疗或预防类风湿性关节炎、系统性红斑狼疮、特发性血小板减少性紫癜等自身免疫性疾病和肿瘤的发生、发展。
7.为了实现上述发明目的,本发明提供以下技术方案:
8.本发明提供了马醉木苷元在制备脾酪氨酸激酶抑制剂中的应用。
9.作为优选,所述马醉木苷元干扰脾酪氨酸激酶中的tyr525磷酸化。
10.本发明还提供了马醉木苷元在制备治疗与脾酪氨酸激酶信号通路活性相关疾病的药物中的应用。
11.作为优选,所述与脾酪氨酸激酶信号通路活性相关疾病包括自身免疫性疾病和肿瘤。
12.作为优选,所述自身免疫性疾病包括类风湿性关节炎、系统性红斑狼疮和特发性血小板减少性紫癜。
13.通过采用上述技术方案,本发明具有如下有益效果:
14.1.本发明中的马醉木苷元作用模式不同于传统的syk激酶抑制剂,并非通过阻止atp结合而抑制syk激酶固有活性,而是通过干扰syk残基tyr525的磷酸化影响syk激酶的诱导激活。
15.2.本发明中的马醉木苷元能直接结合syk蛋白,抑制血小板、中性粒细胞以及其它多种细胞内的syk激酶的磷酸化和活化,发挥syk抑制剂的作用,作用稳定性高。
16.3.本发明中的马醉木苷元抑制gpvi信号通路中的syk激活,对其它酪氨酸激酶无显著抑制作用,作用选择性高、特异性强,且药理学效果良好。
17.4.本发明中的马醉木苷元可通过对syk激酶的磷酸化和活化的抑制作用,更好的应用于类风湿性关节炎、系统性红斑狼疮、特发性血小板减少性紫癜等自身免疫性疾病和肿瘤的治疗或预防。
附图说明
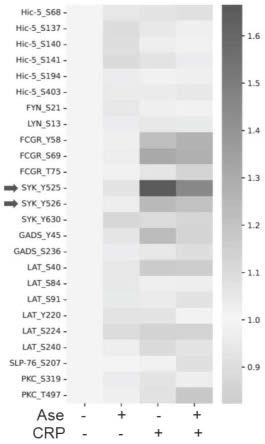
18.图1为定量蛋白质组学热图;
19.图2为马醉木苷元对gpvi/syk通路上游重要蛋白质磷酸化水平的影响(其中,(a)为对fcrγ-s69磷酸化水平的影响,(b)为对fcrγ-t75磷酸化水平的影响,(c)为对fcrγ-y58磷酸化水平的影响,(d)为对fyn-s21磷酸化水平的影响,(e)为对lyn-s13磷酸化水平的影响);
20.图3为马醉木苷元对常见76种酪氨酸激酶的活性抑制筛选实验结果(其中,(a)为马醉木苷元对76种酪氨酸激酶活性抑制情况的树形图,(b)为马醉木苷元对76种酪氨酸激酶活性抑制情况的热图);
21.图4为r406和马醉木苷元与syk结合的mst实验结果(其中,(a)为syk与r406或马醉木苷元形成复合物之后的荧光值随时间变化的曲线,(b)为r406和马醉木苷元与syk相互作用的结合参数的拟合量效曲线);
22.图5为马醉木苷元与syk复合物的分子动力学模拟结果(其中,(a)为syk-马醉木苷元的水溶状态复合物的分子动力学模拟,(b)为模拟体系中的α-c原子的均方根偏差情况,(c)为模拟体系中的α-c原子的均方根波动情况,(d)为模拟体系总势能的变化情况);
23.图6为马醉木苷元与syk的分子对接情况(其中,(a)为马醉木苷元的低能量构象与syk(pdb id:4puz)的分子对接分析示意图,(b)为2d图像形式呈现的两者之间可能的结合位点,(c)为3d图像形式呈现的两者之间可能的结合位点);
24.图7为r406和cerdulatinib与syk的分子对接情况(其中,(a)为r406的低能量构象与syk的分子对接分析示意图,(b)为r406的化学结构,(c)为r406以2d图像形式呈现的与syk可能的结合位点,(d)为r406以3d图像形式呈现的与syk可能的结合位点,(e)为cerdulatinib的低能量构象与syk的分子对接分析示意图,(f)为cerdulatinib以2d图像形式呈现的与syk可能的结合位点,(g)为cerdulatinib以3d图像形式呈现的与syk可能的结合位点);
25.图8为马醉木苷元与cerdulatinib对syk激酶活性的作用情况(其中,(a)为马醉木苷元对syk激酶固有活性的影响,(b)为cerdulatinib对syk激酶固有活性的影响);
26.图9为马醉木苷元对血小板syk tyr525磷酸化及下游信号分子磷酸化水平的抑制情况(其中,(a)为syk tyr525磷酸化水平,(b)为syk下游信号分子plcγ2磷酸化水平,(c)为syk下游信号分子erk1/2磷酸化水平);
27.图10为马醉木苷元和r406单独使用或联合使用对胶原诱导的血小板聚集的影响;
28.图11为马醉木苷元对中性粒细胞活化过程中syk tyr525的磷酸化水平及nets形成的抑制情况(其中,(a)为syk tyr525磷酸化水平,(b)为不同浓度马醉木苷元对fmlp诱导nets形成的影响)。
具体实施方式
29.本发明提供了马醉木苷元在制备脾酪氨酸激酶抑制剂中的应用。
30.在本发明中,所述马醉木苷元干扰脾酪氨酸激酶中的tyr525磷酸化。
31.本发明还提供了马醉木苷元在制备治疗与脾酪氨酸激酶信号通路活性相关疾病的药物中的应用。
32.在本发明中,所述与脾酪氨酸激酶信号通路活性相关疾病包括自身免疫性疾病和肿瘤。
33.在本发明中,所述自身免疫性疾病包括类风湿性关节炎、系统性红斑狼疮和特发性血小板减少性紫癜。
34.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
35.实施例1 asebogenin分子靶标的筛选研究
36.syk在血小板中位于glycoprotein vi(gpvi)的下游,gpvi是胶原蛋白在血小板上的特异性受体。胶原蛋白接触血小板gpvi受体后,促进syk磷酸化和活化,以磷酸化信号转导驱动的方式,促进血小板活化。因而gpvi/syk信号通路在血栓形成过程中,尤其是胶原蛋白诱导的血小板活化过程中起重要作用。
37.发明人前期已发现,asebogenin显著抑制胶原蛋白及gpvi激动剂—胶原相关肽collagen-related peptide(crp)诱导的血小板的聚集、粘附和扩展,并能抑制crp诱导的血小板的活化及细胞内钙离子浓度增加;asebogenin能显著抑制体内动脉血栓和静脉血栓形成,且在抗血栓时不增加出血风险。结果表明asebogenin能够靶向gpvi信号通路。
38.在上述基础上,采用定量磷酸化蛋白质组学、体外激酶谱活性筛选方法,分析asebogenin对gpvi信号通路下游重要信号分子磷酸化水平的变化,分析asebogenin对血小板活化相关酪氨酸激酶活性的影响,从而筛选asebogenin作用的分子靶标。
39.(一)定量磷酸化蛋白质组学分析asebogenin对gpvi受体介导的血小板激活过程中蛋白质磷酸化水平的影响
40.(1)制备洗涤人血小板:
41.a.使用含3.8%柠檬酸钠抗凝剂的真空采血管采集志愿者的静脉血(其中柠檬酸钠与血液的体积比为1:9),采集结束后轻柔摇晃采血管,使全血与柠檬酸钠溶液充分混合以防止血液凝固;
42.b.使用巴氏吸管轻柔地将全血从抗凝采血管中吸出,转入10ml离心管中,8ml/管,配平后在室温下使用医用离心机离心,120
×
g,20min;
43.c.离心结束后,小心吸取上层的富血小板血浆(platelet-rich plasma,prp),转入洁净的10ml离心管中,并放置于37℃水浴锅中静置20min;
44.d.水浴结束后,往每管prp中加入其自身1/5体积的acd溶液(表1),再加入相应量的pge1使其终浓度达0.2μm,随即将离心管温和地上下颠倒混匀各组分;
45.表1人acd溶液配方1[0046][0047]
(注:人acd溶液配方1为将溶液ph调至6.5;d-glucose2为临用现加成分。)
[0048]
e.配平各管prp后放置离心机进行常温离心,620
×
g,10min;
[0049]
f.离心结束后,弃上清,得到血小板团块,随后往离心管中先加入1ml经37℃预热的htg溶液(表2)吹散血小板团块,再继续往血小板悬液中加htg,使其终体积达到步骤c中prp体积的3/4,并放置于37℃水浴锅中静置20min;
[0050]
表2 htg溶液配方1[0051][0052]
(注:htg溶液配方1将溶液ph调至7.4;d-glucose2为临用现加成分。)
[0053]
j.水浴结束后,往每管血小板悬液中加入其自身1/5体积的acd溶液,再加入相应量的pge1(0.2μm),随即将离心管温和地上下颠倒混匀各组分;
[0054]
h.配平各管血小板悬液后放置离心机进行常温离心,620
×
g,10min;
[0055]
i.离心结束后,弃上清,得到血小板团块,随即往离心管中先加入1ml经37℃预热的htg溶液吹散重悬血小板,再继续往血小板悬液中加适量htg,以期得到的血小板浓度为3
×
108/ml,并放置于37℃水浴锅中静置20min;
[0056]
g.水浴结束后,使用自动血细胞分析仪对洗涤血小板计数,并使用htg溶液调整血小板浓度至3
×
108/ml。
[0057]
(2)将制备的洗涤人血小板分成4组:对照组血小板不作处理,实验1组为向血小板中加入asebogenin(20μm)预孵育5min,实验2组为将血小板先直接加入crp(0.1μg/ml)活化5min,实验3组为先向血小板中加入asebogenin(20μm)预孵育5min,然后加入crp(0.1μg/ml)活化5min。4组操作完成后,加入1/4体积5%sds裂解缓冲液(表3),并加入cocktail蛋白酶抑制剂(1
×
,购自medchemexpress公司),cocktail磷酸酶抑制剂(1
×
,购自medchemexpress公司)以及navo3(0.5mm,ph 7.8),混匀后,在冰上裂解5min。
[0058]
表3 5%sds裂解缓冲液配方
[0059][0060]
待血小板裂解后,将提取的蛋白质经胰蛋白酶分解,获得的肽段用tmt6-plex试剂定量标记,tio2富集磷酸化肽段,采用orbitrap exploris 480质谱仪进行液相色谱-质谱/质谱分析,鉴定各组所有蛋白(包括fcrγ-s69、fcrγ-t75、fcrγ-y58、fyn-s21以及lyn-s13)的磷酸化的丰度。
[0061]
根据蛋白质组学热图结果显示(图1),asebogenin显著抑制血小板gpvi受体诱导的syk磷酸化,与crp(0.1μg/ml)刺激的血小板组相比,asebogenin(20μm)显著降低syk tyr525/526磷酸化水平以及syk下游蛋白lattyr220磷酸化水平。进一步分析asebogenin对gpvi/syk信号通路上游信号分子lyn、fyn及fcrγ磷酸化水平的影响,蛋白质组学分析结果显示(图2),asebogenin对gpvi受体诱导的fcrγ-s69、fcrγ-t75、fcrγ-y58、fyn-s21以及lyn-s13的磷酸化水平无显著影响。这些结果表明,asebogenin可能直接作用于syk抑制其磷酸化活化而发挥作用。
[0062]
(二)激酶谱分析
[0063]
为研究asebogenin靶向syk激酶的特异性,进一步检测asebogenin对常见76种酪氨酸激酶活性的抑制作用。
[0064]
采用htrf kinease-tk商品试剂盒(购自perkinelmer公司的cisbio品牌)以及adp-glo激酶活性检测试剂盒(购自promega公司)检测激酶活性,激酶工作液中加入asebogenin(500nm),加入试剂盒中的底物触发反应,随后加入试剂盒中的检测液后,采用荧光酶标仪检测吸光值,计算激酶活性,检测asebogenin对76种酪氨酸激酶活性的影响。
[0065]
表4 asebogenin对常见76种酪氨酸激酶的活性抑制百分率
[0066]
[0067]
[0068][0069]
结果显示,同溶剂对照组(和处理组含有相同浓度的溶媒二甲基亚砜dmso,1
‰
)相比,asebogenin(500nm)虽然对flt3、csf1r、alk、epha8、pdgfrβ、epha4、abl2、musk、pdgfrα、fak和epha1这11种酪氨酸激酶的活性的抑制率超过20%,但这11种激酶并不参与gpvi激活的信号转导过程,说明asebogenin对gpvi受体介导的信号转导通路中的多种激酶活性无明显影响。如图3,通过不同颜色区分抑制程度,抑制程度从绿到红依次升高,其中(b)中的红色下划线标识的11种激酶的活性抑制超过20%。
[0070]
综合以上结果表明,asebogenin抑制gpvi信号通路中的syk激活,而对其它血小板活化相关激酶活性无明显影响。
[0071]
实施例2 asebogenin抑制syk活化的作用模式研究
[0072]
根据鉴定到的syk是asebogenin的作用靶点,为进一步研究asebogenin抑制syk的作用模式,我们采用分子对接实验分析asebogenin与syk的潜在结合位点,采用微量热泳动(microscale thermophoresis,mst)实验分析asebogenin与syk的结合能力,采用分子动力学模拟手段评价asebogenin与syk结合的稳定性。
[0073]
(一)微量热泳动实验
[0074]
alexa-488荧光标记的重组人syk蛋白(0.22μm)与2
×
浓度梯度稀释的asebogenin(总共16个浓度:64mm、32mm、16mm、8mm、4mm、2mm、1mm、500μm、250μm、125μm、62.5μm、31.25μm、15.63μm、7.812μm、3.906μm、1.954μm)等体积混合后,加入monolith标准毛细管中,并载入nanotemper monolith系列微量热泳动仪中进行488nm的荧光测量,根据测定的结合参数,计算asebogenin结合syk的解离常数kd,分析asebogenin结合syk的能力。该实验以现有的传统syk小分子抑制r406作为标准品和阳性对照。
[0075]
根据拟合结合曲线显示(图4中的(b)),asebogenin与syk结合的解离常数kd值约为r406与syk的kd值的10倍,根据已有的研究r406的kd值为12nm,asebogenin与syk结合的解离常数kd约为120nm,结果表明asebogenin同syk之间存在直接结合,且相互作用较强。
[0076]
(二)分子动力学模拟实验
[0077]
进一步对asebogenin与syk形成的化合物的稳定性进行分析。采用discovery studio 2019 client软件(biovia,san diego,ca),对syk(pdb id:4puz)和asebogenin模拟化合物进行四步标准化动力学级联操作,包括体系能量最小化(minimization)、系统升温(heating)、体系平衡(equilibration)、动力学模拟采样(production),分析计算均方根偏差rmsd和均方根波动rmsf,评价asebogenin与syk结合的稳定性。
[0078]
从图5的结果中可以看出,asebogenin与syk形成的化合物的多种构象在模拟级联过程中均无显著性变化:其中,反应模拟过程中体系稳定性的变量(图5中的(b));通过计算每个原子相对于其平均位置的波动,用来考察模拟结果是否与晶体结构相符合的(图5中的(c));体系的总势能变化曲线显示总势能随时间的波动范围也较小(图5中的(d))。这些参数表明,asebogenin与syk形成的化合物具有高度的稳定性。
[0079]
(三)分子对接实验
[0080]
从rcsb蛋白质数据库(www.rcsb.org)中下载syk蛋白的x射线晶体结构,使用chemoffice 2014软件绘制asebogenin三维结构,采用discovery studio 2019软件(biovia,san diego,ca)中的libdock模块进行全局分子对接,分析asebogenin与syk相互作用的位点,并分析asebogenin与现有的传统syk抑制剂结合位点的区别。
[0081]
结果显示,asebogenin能够嵌合入syk(pdb id:4puz)蛋白中,并以氢键、π-σ、π-π、π-阴离子和π-烷基相互作用力进行结合(图6中的(a))。asebogenin的a-苄基环与syk氨基酸残基asn489、asn524和ser551以氢键结合,与ser551以π-σ相互作用结合,与gln486以π-阴离子相互作用结合;asebogenin的酮羰基能与syk氨基酸残基asn524和lys552形成氢键;另外,asebogenin的b-苯环分别以π-π、π-阴离子和π-烷基的方式与syk氨基酸残基tyr525、glu614及val613相互作用(图6中的(b)和(c))。
[0082]
(三)体外激酶活性检测实验
[0083]
本实验采用htrf kinease-tk商品试剂盒(购自perkinelmer公司的cisbio品牌)进行,syk激酶工作液(0.1μg/ml),加入不同浓度的asebogenin预孵育,混合体系中加入tk底物工作液以触发反应,加入检测液终止反应,利用荧光酶标仪分别检测波长620nm以及665nm处的吸光值,分析asebogenin对syk激酶活性的影响。该实验以现有传统syk小分子抑制剂赛度替尼(cerdulatinib)作为阳性对照。
[0084]
与现有的常用syk激酶小分子抑制剂r406和cerdulatinib比较发现,r406(图7中的(a)-(d))和cerdulatinib(图7中的(e)-(g))都是结合到syk的atp结合位点,通过阻断atp结合发挥激酶抑制作用;但是asebogenin并非嵌合到atp结合口袋中,而是与syk的关键位点tyr525相互作用,干扰其磷酸化,从而抑制syk的诱导活化。
[0085]
在asebogenin与syk的潜在结合位点中,tyr525位于syk激酶结构域的活化环中,tyr525磷酸化对于上游受体诱导的syk活化至关重要,但是不影响syk的固有活性。使用重组蛋白进行的体外激酶活性检测实验显示,asebogenin并不影响syk激酶固有活性(图8中的(a)),相反,传统syk抑制剂cerdulatinib明显抑制syk激酶固有活性(图8中的(b))。综合上述分子对接结果表明,asebogenin作用模式不同于传统的syk激酶抑制剂,并非通过阻止atp结合而抑制syk激酶固有活性,而是通过干扰syk残基tyr525的磷酸化影响syk激酶的诱导激活。
[0086]
实施例3 asebogenin抑制血小板和中性细胞活化过程中的syk磷酸化水平
[0087]
采用免疫印迹实验,进一步检测asebogenin对血小板和pmn活化过程中syk磷酸化水平的影响,并检测asebogenin对血小板syk下游信号分子磷酸化水平的影响,明确asebogenin对syk活化的作用。
[0088]
免疫印迹实验:使用同实施例1一样的洗涤人血小板,加入asebogenin(20μm)预孵育5min后,再加入crp(0.1μg/ml)激活血小板5min,或者使用趋化肽fmlp(1μm)激活pmn,细胞裂解后测定蛋白浓度,电泳转膜后,孵育抗磷酸化蛋白的抗体,检测asebogenin对血小板及pmn中syk及其下游信号分子plcγ2等蛋白的酪氨酸磷酸化水平的影响。
[0089]
由实施例1-2可得到tyr525是asebogenin抑制syk激活的靶点,故采用免疫印迹法检测了asebogenin对于血小板gpvi受体诱导的syk tyr525磷酸化水平的影响,结果显示,asebogenin(20μm)显著抑制gpvi受体激动剂crp诱导的血小板syktyr525磷酸化(图9中的(a)),并且asebogenin还明显抑制syk下游信号分子plcγ2和erk1/2磷酸化水平(图9中的
(b)和(c))。结果表明asebogenin抑制血小板syk tyr525磷酸化水平,从而抑制syk活化。(根据磷酸化蛋白灰度值与总蛋白灰度值的比值进行定量,图9中的*为p《0.05,代表具有统计学意义)
[0090]
实施例4 asebogenin抑制syk介导的血小板和中性粒细胞活化及nets形成
[0091]
(一)血小板聚集实验
[0092]
为了进一步确定syk在asebogenin抑制血小板活化中作用,对比分析了asebogenin和syk抑制剂r406的对胶原诱导的血小板聚集的作用。
[0093]
采用同实施例1一样的洗涤人血小板,分别设置4组,对照组中仅向血小板中加入胶原(1μg/ml)诱导聚集;实验1组为加入asebogenin(3μm)预孵育5min后,再加入胶原(1μg/ml)诱导聚集;实验2组为加入r406(0.1μm)预孵育5min后,再加入胶原(1μg/ml)诱导聚集;实验3组为加入asebogenin(3μm)和r406(0.1μm)预孵育5min后,再加入胶原(1μg/ml)诱导聚集。四组处理完后均采用血小板聚集仪,观察血小板聚集功能变化,研究asebogenin通过抑制syk发挥抗血小板活化的作用。
[0094]
结果显示,asebogenin和r406均可显著性抑制血小板聚集,两者相比并无显著性差异;并且,asebogenin同r406联合使用不会进一步抑制血小板的聚集(图10),结果表明,asebogenin抑制胶原诱导的血小板聚集的效应是由syk介导的。(其中n=5,图10中的*为p《0.05,代表具有统计学意义)
[0095]
(二)体外诱导pmn形成nets及nets含量检测
[0096]
采用免疫印迹的方法检测asebogenin对趋化肽fmlp诱导的中性粒细胞活化过程中的syktyr525的磷酸化水平的影响。将分离的pmn加入预包被纤维蛋白原的96孔板中分成4组,对照组不作处理,实验1组为pmn中加入asebogenin(20μm)预孵育5min,实验2组为pmn中直接加入fmlp(1μm)刺激5min,实验3组为pmn中先加入asebogenin(20μm)预孵育5min,再加入fmlp(1μm)刺激5min。然后通过免疫印迹检测不同组别syk tyr525磷酸化水平。
[0097]
将分离的pmn加入预包被纤维蛋白原的96孔板中,fmlp(1μm)刺激3小时后加入sytox green荧光染料(5μm)标记游离的dna,荧光酶标仪检测荧光强度,激发光485nm,发射光535nm,通过检测细胞上清中游离dna含量观察nets形成情况。
[0098]
结果显示,asebogenin显著降低中性粒细胞活化过程中的syk tyr525的磷酸化水平(图11中的(a)),asebogenin并能显著抑制nets形成(图11中的(b))。(图11中的*为p《0.05,代表具有统计学意义,n.s.代表无显著差异)
[0099]
由以上实施例可知,本发明中的asebogenin能直接结合syk蛋白,抑制血小板、中性粒细胞以及其它多种细胞内的syk激酶的磷酸化和活化,发挥syk抑制剂的作用,作用稳定性高;asebogenin作用模式不同于传统的syk激酶抑制剂,并非通过阻止atp结合而抑制syk激酶固有活性,而是通过干扰syk残基tyr525的磷酸化影响syk激酶的诱导激活,相互作用较强,asebogenin与syk结合的解离常数kd值约为r406与syk的kd值的10倍;且asebogenin抑制gpvi信号通路中的syk激活,而对其他血小板活化相关激酶活性无明显影响,作用选择性高、特异性强。
[0100]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1