一种对肠道菌群具有保护效果的粪便溶解液的制作方法
1.本发明涉及肠道菌群溶解液的领域,特别涉及一种对肠道菌群具有保护效果的粪便溶解液。
背景技术:
2.粪菌移植(fecal microbiota transplantation,fmt),其定义是将健康人粪便中的功能菌群,移植到患者胃肠道内,重建新的肠道菌群,实现肠道及肠道外疾病的治疗。粪菌移植在治疗艰难梭菌感染和炎症性肠病等肠道疾病方面具有相当的优势,它具有见效快、副作用小、复发率低等一系列优势。
3.现有的粪菌移植治疗方式主要通过口服胶囊和侵入式治疗两种。其中侵入式治疗是通过鼻肠管、肠镜等方式灌入菌液进行治疗。而口服胶囊是通过预先将粪菌制备成口服胶囊,治疗时通过口服递送的方式进行移植。相较于侵入式治疗,口服胶囊有着患者接受度高、治疗便捷、定植率高等显著优势。
4.口服胶囊的制备过程需经过搅拌、溶解、过滤、浓缩等一系列工序,而每一道工序及口服胶囊在-80℃环境中长时间的冻存都有可能影响粪菌胶囊的活性,从而导致治疗效果的降低。因此,口服胶囊制备工艺的优化及长期冻存期间胶囊较高活性水平的维持都是相应的工艺难点。
5.人体肠道内以厌氧菌为主,而口服胶囊在制备时需经过相当一段时间的均质过程,容易导致肠道厌氧菌的死亡。目前,肠道菌群提取过程均使用生理盐水作为溶解液进行均质生产,生理盐水对肠道菌群特别是对厌氧菌并无任何保护效果,这将极大程度的影响口服胶囊的治疗效果。
6.为此,亟需对现有常用的溶解液(生理盐水)的基础上进行升级优化,以寻求在均质过程中具有良好的保护效果,同时也能提高口服胶囊粪菌的活性水平。
技术实现要素:
7.为解决上述问题,本发明的首要目的是提供一种对肠道菌群具有保护效果的粪便溶解液,该溶解液能够在均质过程中对厌氧菌起到了良好的保护效果,同时也能提高口服胶囊长期冻存期间粪菌的活性水平。
8.为实现上述目的,本发明采用的技术方案是:
9.一种对肠道菌群具有保护效果的粪便溶解液,按照质量百分比,溶解液包括有:0.01%-1%维生素c、1%-20%聚葡萄糖、1%-8%海藻糖、0.3%-10%山梨糖醇、0.3%-10%抗性糊精,余量为生理盐水。
10.所述生理盐水的用量为51%-97.39%。
11.进一步,所述溶解液的ph为5.5-9.0。
12.所述溶解液需高压蒸汽灭菌锅121℃灭菌后,再室温冷却后使用。高压蒸汽灭菌一是能够消除水中所含有的其余细菌的干扰,二是能够进一步排出水中所含有的氧分子,从
而构建一个无氧环境。
13.申请人在经过深入的研究工作之后,发现粪便所含的肠道菌群以瘤胃球菌属、拟杆菌菌属、普氏菌属为主。其中厌氧菌占据绝大部分,好氧菌及兼性厌氧菌只占据一小部分;单纯的生理盐水中依然含有一定量的氧气,因此不能保护厌氧菌,而本技术通过维生素c、聚葡萄糖、海藻糖、山梨糖醇、抗性糊精所组成的溶解液能够使降低水中的溶氧量,构建成低氧或无氧环境,从而对厌氧菌具有保护作用。维生素c是良好的还原剂,能够与溶液中的氧气结合反应,从而消耗溶液中的氧气,降低溶氧量以起到对厌氧菌的保护效果。
14.因此,本发明的有益效果是:
15.本发明的溶解液在均质阶段能更好的保护厌氧菌,对厌氧菌起到了良好的保护效果,使得提取出的菌泥具有更高的活性;同时灌装成口服菌群胶囊后,在-80℃条件下冻存时残留在菌泥内溶解液成分能够继续起到保护剂的作用,使得口服胶囊在存放30天内存活率保持在80%以上,能提高口服胶囊长期冻存期间粪菌的活性水平。
附图说明
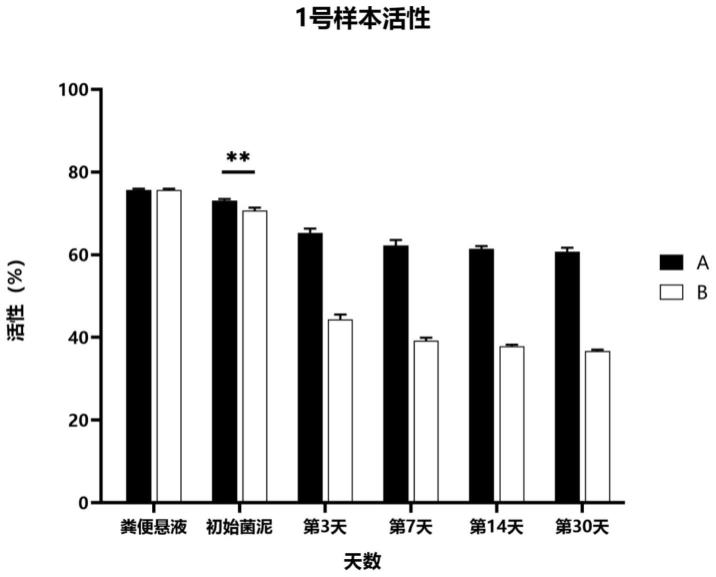
16.图1为本发明的1号粪便样本活性检测数据示意图。
17.图2为本发明的2号粪便样本活性检测数据示意图。
18.图3为本发明的3号粪便样本活性检测数据示意图。
19.图4为本发明的1号粪便样本胶囊冻存存活率示意图。
20.图5为本发明的2号粪便样本胶囊冻存存活率示意图。
21.图6为本发明的3号粪便样本胶囊冻存存活率示意图。
具体实施方式
22.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
23.本发明所实现的对肠道菌群具有保护效果的粪便溶解液,按照质量百分比,溶解液包括有:0.01%-1%维生素c、1%-20%聚葡萄糖、1%-8%海藻糖、0.3%-10%山梨糖醇、0.3%-10%抗性糊精,51%-97.39%生理盐水,ph 5.5-9.0。
24.下面结合实验对本发明的实施进行说明。
25.1.试验材料
26.1.1试验仪器
27.水浴锅、制冰机、-80℃冰箱、涡旋振荡仪、离心机、磁力搅拌器、灭菌锅。
28.1.2试验试剂:
29.生理盐水、维生素c、聚葡萄糖、海藻糖、山梨糖醇、抗性糊精、live/dead
tm
baclight
tm
bacterial viability kit死活荧光染料。
30.1.3试验材料
31.供体新鲜粪便、配置保护液。
32.2.试验方法
33.2.1溶解液成分
34.新溶解液配方(溶解液a):0.01%-1%维生素c、1%-20%聚葡萄糖、1%-8%海藻糖、0.3%-10%山梨糖醇、0.3%-10%抗性糊精,51%-97.39%生理盐水,ph 5.5-9.0。
35.原溶解液配方(溶解液b):0.9%nacl溶液(生理盐水)。
36.将溶解液a及溶解液b一同用高压蒸汽灭菌锅121℃灭菌20min,室温冷却备用。
37.2.2粪菌样品制备
38.称量供体新鲜粪便重量,并将粪便均等分为两份。一组粪便按1:5的比例加入溶解液a,记为a组。另一组粪便按1:5的比例加入溶解液b,记为b组。两组经150rpm均质30min。随后依次通过20目、50目、100目、150目、200目、250目的筛网,过滤去除大颗粒杂质。过滤所得滤液经5000
×
g 4℃离心5min,弃去上清液。a组菌泥按1:2的比例用溶解液a重悬,b组菌泥按1:2的比例用溶解液b重悬,并将菌悬液再次经5000
×
g 4℃离心5min,弃去上清液,收集菌泥。
39.2.3菌泥初始活性检测
40.称取粪菌样本制备步骤保存的粪便样本重量,按粪便:生理盐水=1:9的比例,用生理盐水溶解,震荡混合均匀,制备成粪便悬液。吸取3份1ml混悬液至3根离心管,并再次用生理盐水稀释10倍,获得粪便100倍稀释液。用live/dead
tm
baclight
tm
bacterial viability kit死活荧光染料对粪便100倍稀释液进行染色,暗反应15min后用bd accuri c6 plus流式细胞仪进行计数。
41.a、b两组离心收集菌泥搅拌均匀后分别挖取3份1g菌泥至离心管中,用生理盐水稀释100倍后,用live/dead
tm
baclight
tm
bacterial viability kit死活荧光染料对菌泥100倍稀释液进行染色,暗反应15min后用bd accuri c6 plus流式细胞仪进行计数。
42.2.4口服胶囊保存活性跟踪
43.将a、b两组菌泥分别灌装成胶囊后,置于-80℃超低温冰箱中冷冻保存。于第3、7、14、30天时分别随机取出三颗胶囊,37℃水浴5min化冻,每颗胶囊取0.1g菌泥,用生理盐水稀释100倍后,用live/dead
tm
baclight
tm
bacterial viability kit死活荧光染料对菌泥100倍稀释液进行染色,暗反应15min后用bd accuri c6 plus流式细胞仪进行计数。
44.2.5数据分析
45.使用graphpad prism来处理数据。采用welch的校正的双尾未配对student’s t测验(two-tailed unpaired student’s t test with welch;s correction)来评价两个独立组之间的差异。差异的显著性水平用*p《0.05、**p《0.01、***p《0.001来表示。
46.3.实验结果
47.3.1菌泥初始活性
48.a、b两组菌泥活性检测结果如图1、2、3所示。制备成菌泥后,a组(新溶解液)菌泥活性显著高于b组(原溶解液),即在均质过程中新保护液对菌群的起到了相当的保护作用。
49.3.2口服胶囊保存活性跟踪
50.a、b两组口服胶囊活性检测结果如图1、2、3所示。在制备成胶囊-80℃冻存的过程中,a组(新溶解液)口服胶囊活性均显著高于b组(原溶解液)。从存活率来看(图4、5、6),a组在30天内的存活率保持在80%以上,而b组的存活率只有40%-60%。
51.结果讨论
52.a组溶解液在均质阶段能更好的保护厌氧菌,使得提取出的菌泥具有更高的活性。
同时灌装成口服菌群胶囊后,在-80℃条件下冻存时残留在菌泥内溶解液成分能够继续起到保护剂的作用,使得口服胶囊在存放30天内存活率保持在80%以上。因此相较于原溶解液,新溶解液不论是在均质处理过程或是-80℃冻存过程,均能对粪菌起到良好的保护效果。
53.以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1