一种改进增效的妥布霉素滴眼液及制备方法
1.本发明涉及滴眼液技术领域,特别是涉及一种改进增效的妥布霉素滴眼液及制备方法。
背景技术:
2.临床常见感染性眼病,如眼角膜炎、结膜炎常常由细菌、真菌、病毒等病原微生物引起,细菌性角膜炎是临床最常见的致盲性角膜病变之一。起病急、发展快,治疗不及时或控制不佳常造成严重的视力损害及眼球穿孔等并发症。根据世界卫生组织的报告,细菌性角膜炎是世界范围内导致失明的主要疾病之一,尤其是在发展中国家。
3.大量的临床病原学分析表明,革兰氏阳性球菌,如表皮葡萄球菌、金黄色葡萄球菌和微球菌等是细菌性角膜炎的主要致病菌;革兰氏阴性杆菌,如铜绿假单胞菌和大肠杆菌等次之。革兰氏阳性球菌感染的比例有逐年增高的趋势,革兰氏阴性杆菌感染呈下降趋势。在大多数细菌性角膜炎病例中通常存在局部和/或系统性的危险因素,最常见的危险因素包括佩戴隐形眼镜、眼外创伤、眼表疾病和眼睑疾病(如干眼病、神经营养性角膜病等)、角膜手术后(如角膜移植术、角膜交联)和系统性疾病(如糖尿病、免疫抑制)等。由于上述因素使人体眼部处于较为脆弱的状态,因此细菌可趁虚而入,进而引发眼部感染。
4.而目前,细菌的耐药性问题已经成为全球严峻的公共卫生问题,正在严重威胁全球人类的生命健康。细菌对抗生素产生耐药主要是由于产生钝化酶、改变靶标、主动外排抗生素等,由于目前全球经济一体化,“超级细菌”的传播速度变得更为迅速,且抗生素新药的研发周期过长、资金投入巨大,抗生素新药的开发不容乐观,因此提高现有抗生素的杀菌效果成为目前科研人员重要的研发内容。在临床上,抗生素浓度越高越有可能诱发超级耐药细菌的产生,导致现有抗生素无法再对该细菌产生杀灭作用,从而导致今后临床上无药可用的危机。因此,能在维持有效杀菌浓度的前提下尽量减少抗生素的用量这对临床十分重要。
技术实现要素:
5.本发明的目的是提供一种改进增效的妥布霉素滴眼液及制备方法,以解决上述现有技术存在的问题,实现妥布霉素滴眼液的减毒增效,改变现有妥布霉素滴眼液抗生素浓度过高,副作用过大的现状。
6.为实现上述目的,本发明提供了如下方案:
7.本发明提供一种妥布霉素滴眼液,所述妥布霉素滴眼液由妥布霉素、甘油、苯扎氯铵及超纯水配制而成;
8.其中,所述妥布霉素的浓度为1mg/ml,所述甘油的浓度为0.25m-0.35m,所述苯扎氯铵的浓度为0.1mg/ml。
9.作为本发明的进一步优选,所述甘油的浓度为0.3m。
10.本发明还提供上述妥布霉素滴眼液的制备方法,包括以下步骤:
11.(1)将甘油加入到经高温灭菌处理的超纯水中,定容,配制得到甘油溶液;
12.(2)将妥布霉素、苯扎氯铵加入到所述甘油溶液中,定容;
13.(3)将步骤(2)得到的混合物进行0.22μm微孔滤膜过滤,去除杂质及病原菌,得到所述妥布霉素滴眼液。
14.本发明进一步提供上述布霉素滴眼液的制备方法,包括以下步骤:
15.(1)将21.9ml甘油加入到经高温灭菌处理的超纯水中,定容至500ml,配制成甘油溶液;
16.(2)将1g妥布霉素、0.1g苯扎氯铵加入到步骤(1)配制的0.3m甘油溶液中,定容至1l;
17.(3)将步骤(2)得到的混合物进行0.22μm微孔滤膜过滤,去除杂质及病原菌,得到所述妥布霉素滴眼液。
18.妥布霉素(tobramycin,tob)是目前治疗细菌性眼部感染的重要药物,属于杀菌型抗生素。其分子结构有一个氨基环醇类和一个或多个氨基糖分子,并由配糖键连接成苷。妥布霉素与细菌核糖体30s小亚基结合,导致细菌合成错误的蛋白质,产生有害的蛋白质聚集体,最终杀死细菌。
19.目前临床上常用的治疗型滴眼液多以抗生素为主要杀菌物质,这类产品为了扩大抗菌谱和杀菌效果,常常添加过量抗生素,以妥布霉素滴眼液为例,中国药典规定的妥布霉素最大添加量为3mg/ml,这虽然对常见的敏感菌有较好的杀菌作用,但同时也使过量的抗生素残留在人体内造成肾、耳毒害作用,不仅如此,滥用抗生素还会造成原本敏感型的细菌逐步进化成耐药型细菌,长此以往,高剂量的抗生素也无法杀灭它们,这便会出现临床上无药可用的严重后果。因此,在临床上应该控制抗生素的剂量,合理使用,防止细菌进化成“超级细菌”。
20.甘油是一种无色无味的粘稠液体,广泛应用于工业、医药、食品行业,可用作溶剂,润滑剂,药剂和甜味剂。
21.考虑到滴眼液渗透压问题,本发明最终选定甘油浓度为0.3m(与生理盐水等渗)用于新型滴眼液的制作,本发明与市面上常见的妥布霉素滴眼液相比抗生素浓度更低(市面上妥布霉素滴眼液浓度3mg/ml,本发明产品仅为1mg/ml),但从小鼠角膜感染模型的治疗及体外杀菌试验中本发明配方的滴眼液杀菌效果可以做到与传统配方一样甚至更好的效果,真正做到减毒增效。
22.本发明公开了以下技术效果:
23.本发明的滴眼液由主要杀菌剂妥布霉素、杀菌增效佐剂甘油及防腐剂苯扎氯铵配制而成,具有配方简单、原料易得价廉的特点,且可大大提高对病原菌的杀菌效果,可有效降低病原菌产生的耐药风险,同时在达到同样治疗效果的前提下,减少用药量和给药时间,从而降低副作用。
24.与现有妥布霉素滴眼液相比,本发明滴眼液中妥布霉素含量低,仍可实现与现有配方相当甚至更优的技术效果,这在很大程度上减少了抗生素残留造成的毒害作用以及细菌往耐受菌演变,同时相对现有产品苯扎氯铵的防腐性也得到了提升。综合来看,本技术实现了滴眼液的减毒增效,具有积极的现实意义。
附图说明
25.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
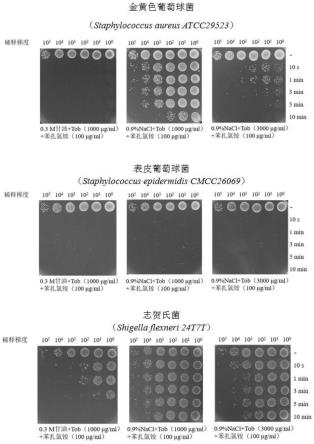
26.图1为本发明实施例滴眼液及对照组滴眼液针对金黄色葡萄球菌、表皮葡萄球菌、志贺氏菌的体外杀菌实验对比;
27.图2为本发明实施例滴眼液及对照组滴眼液针对大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌的体外杀菌实验对比;
28.图3为本发明实施例滴眼液及对照组滴眼液体内杀菌实验的体内实验过程图及实验结果对比;
29.图4为本发明实施例滴眼液及纯水、生理盐水对照组滴眼液各成分分解针对金黄色葡萄球菌体外杀菌实验对比;
30.图5为本发明实施例滴眼液及纯水、生理盐水对照组滴眼液各成分分解针对铜绿假单胞菌体外杀菌实验对比;
31.图6为本发明实施例滴眼液及纯水、生理盐水对照组滴眼液各成分分解针对大肠杆菌体外杀菌实验对比。
具体实施方式
32.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
33.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
34.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
35.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
36.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
37.为验证本发明滴眼液的杀菌效果,本发明采用以下处理方法:
38.在室温下吸取各种培养至平台期的细菌菌液50-100μl分别转移至不同的1.5ml规格的ep管中,13000rpm离心2min,去掉上清液,然后按照不同时间梯度处理加入本发明滴眼
液,使用振荡器充分混匀,使滴眼液与细菌充分接触。
39.所述细菌为革兰氏阳性菌及革兰氏阴性菌。
40.所述革兰氏阳性菌为金黄色葡萄球菌、表皮葡萄球菌。
41.所述革兰氏阴性菌为大肠杆菌、铜绿假单胞菌、志贺氏菌、鲍曼不动杆菌、肺炎克雷伯菌。
42.所述不同时间梯度处理时间为10s,1min,3min,5min,10min。
43.当所述细菌为金黄色葡萄球菌时,取菌液含量为100μl,滴眼液含量为30μl。
44.当所述细菌为表皮葡萄球菌时,取菌液含量为100μl,滴眼液含量为30μl。
45.当所述细菌为大肠杆菌时,取菌液含量为50μl,滴眼液含量为50μl。
46.当所述细菌为铜绿假单胞菌时,取菌液含量为50μl,滴眼液含量为50μl。
47.当所述细菌为志贺氏菌时,取菌液含量为100μl,滴眼液含量为30μl。
48.当所述细菌为鲍曼不动杆菌时,取菌液含量为50μl,滴眼液含量为50μl。
49.当所述细菌为肺炎克雷伯菌时,取菌液含量为50μl,滴眼液含量为50μl。
50.下面以本发明中妥布霉素浓度1mg/ml、甘油浓度0.3m、苯扎氯铵浓度0.1mg/ml的滴眼液配方为例,结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围:
51.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例1、2中的定量试验,均设置三次重复实验,结果取平均值。
52.实施例中菌种来源及特性见表1。
53.表1
54.[0055][0056]
实施例1本发明滴眼液与对照组滴眼液体外杀菌效果对比测试
[0057]
(1)3组滴眼液的制备
[0058]
本发明滴眼液:先将21.9ml甘油加入到提前高温灭菌过的超纯水中,定容至500ml,配制成甘油溶液;然后称量1g妥布霉素、0.1g苯扎氯铵加入到刚配制好的甘油溶液中,定容至1l;最后将配置好的滴眼液经0.22μm微孔滤膜过滤,去除杂质及病原菌,完成甘油妥布霉素滴眼液的制备。标记为:0.3m甘油+tob(1000μg/ml)+苯扎氯铵(100μg/ml)。
[0059]
对照组1:先称量1g妥布霉素、0.1g苯扎氯铵加入到提前高温灭菌过的生理盐水中,定容至1l;将配置好的滴眼液经0.22μm微孔滤膜过滤,去除杂质及病原菌,完成对照组1滴眼液的制备。标记为:0.9%nacl+tob(1000μg/ml)+苯扎氯铵(100μg/ml)。
[0060]
对照组2:先称量3g妥布霉素、0.1g苯扎氯铵加入到提前高温灭菌过的生理盐水中,定容至1l;将配置好的滴眼液经0.22μm微孔滤膜过滤,去除杂质及病原菌,完成对照组1滴眼液的制备。标记为:0.9%nacl+tob(3000μg/ml)+苯扎氯铵(100μg/ml),该配方为市售滴眼液常见配方。
[0061]
(2)活化金黄色葡萄球菌(staphylococcus aureμs atcc29523)、表皮葡萄球菌(staphylococcus epidermidis cmcc26069)、志贺氏菌(shigella flexneri 24t7t):分别吸取保存于-80℃冰箱中的这3种菌种的40%甘油菌液1μl,加至1ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养12h,将得到的菌液稀释500倍后接种于20ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养到平台期(24h),得到这3种细菌的菌液。
[0062]
(3)取18支1.5ml规格的ep管,排列成6
×
3阵列,编号命名为a1-a6,b1-b6,c1-c6,分别吸取100μl平台期金黄色葡萄球菌菌液至这18支ep管中,全部置于离心机中13000rpm离心2min,去除上清液,a2-a6吸取30μl本发明滴眼液,b2-b6吸取30μl对照组1配制的滴眼液,c2-c6吸取30μl对照组2配制的滴眼液。其中a1、b1、c1加入30μl各组的空白对照(a1为0.3m甘油,b1、c1为0.9%nacl),a2、b2、c2处理时间为10s,a3、b3、c3处理时间为1min,a4、b4、c4处理时间为3min,a5、b5、c5处理时间为5min,a6、b6、c6处理时间为10min。
[0063]
(4)处理时间结束后立刻放入超速离心机中13000rpm离心2min,去除上清液,用100μl 10mm灭菌磷酸盐缓冲液(ph=7.4)重悬菌体,洗涤两次,最终用100μl 10mm磷酸盐缓冲液重悬后备用(与原菌液相同的体积)。
[0064]
(5)将菌液按照每次10倍的梯度用10mm磷酸盐缓冲液(ph=7.4)依次稀释,每个稀释度取4μl菌液点滴在lb固体培养基平板上,置于37℃温箱培养至少12h后,检查细菌死亡,菌落计数,计算经处理后金黄色葡萄球菌的存活率,实验结果见表2以及图1。
[0065]
(6)表皮葡萄球菌及志贺氏菌的处理方式同步骤(3)-(5)。在细菌存活率分析中,取三次独立实验结果的平均值,实验结果见表3(志贺氏菌的)和图1。
[0066]
表2
[0067][0068]
表3
[0069]
[0070][0071]
注:a:存活率=本发明(或对照组1、对照组2)在规定时间杀菌处理后存活菌落数/无抗生素处理后存活菌落数
×
100%
[0072]
b:相对存活率=本发明(或对照组1、对照组2)在规定时间杀菌处理后细菌存活率/对照1在规定时间杀菌处理后细菌存活率
[0073]
c:存活率为0.0000%表明经处理后,细菌存活率为0,检测不到菌落。下同。
[0074]
结果显示,本发明在处理金黄色葡萄球菌10s的时间后,即可杀灭所有细菌,而对照组1在10s内仅杀灭约1个数量级的细菌,对照组2在10s内也仅是杀灭了3-4个数量级细菌,要达到同样杀菌效果需要处理10min,与2组对照组相比,本发明展现了优异的杀灭金黄色葡萄球菌的效果。
[0075]
在杀灭表皮葡萄球菌时,3组配方均展现了良好的杀菌效果,杀菌结果如说明书附图图1所示。
[0076]
本发明在处理志贺氏菌5min后,可杀灭约4个数量级的细菌,而对照组1杀菌效果不理想,对照组2也仅为1-2个数量级。
[0077]
实施例2本发明滴眼液与对照组滴眼液体外杀菌效果对比测试
[0078]
采用实施例1配制的3组滴眼液进行如下实验:
[0079]
(1)活化大肠杆菌(escherichia coli bw25113)、铜绿假单胞菌(pseudomonas aeruginosa pa01)、鲍曼不动杆菌(acinetobacter baumannii ab6)、肺炎克雷伯菌(klebsiella pneumoniae kp-d367):分别吸取保存于-80℃冰箱中的这4种菌种的40%甘油菌液1μl,加至1ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养12h,将得到的菌
液稀释500倍后接种于20ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养到平台期(24h),得到这4种细菌的菌液。
[0080]
(2)取18支1.5ml规格的ep管,排列成6
×
3阵列,编号命名为a1-a6,b1-b6,c1-c6,分别吸取50μl平台期大肠杆菌菌液至这18支ep管中,全部13000rpm离心2min,去除上清液,a2-a6吸取50μl本发明滴眼液,b2-b6吸取50μl对照组1配制的滴眼液,c2-c6吸取50μl对照组2配制的滴眼液。其中a1、b1、c1加入50μl各组的空白对照(a1为0.3m甘油,b1、c1为0.9%nacl),a2、b2、c2处理时间为10s,a3、b3、c3处理时间为1min,a4、b4、c4处理时间为3min,a5、b5、c5处理时间为5min,a6、b6、c6处理时间为10min。
[0081]
(3)处理时间结束后立刻放入超速离心机中13000rpm离心2min,去除上清液,用100μl 10mm灭菌磷酸盐缓冲液(ph=7.4)重悬菌体,洗涤两次,最终用50μl 10mm磷酸盐缓冲液重悬后备用(与原菌液相同的体积)。
[0082]
(4)将菌液按照每次10倍的梯度用10mm磷酸盐缓冲液(ph=7.4)依次稀释,每个稀释度取4μl菌液点滴在lb固体培养基平板上,置于37℃温箱培养至少12h后,检查细菌死亡,菌落计数,计算经处理后大肠杆菌的存活率。在细菌存活率分析中,取三次独立实验结果,实验结果见表4及图2。
[0083]
(5)铜绿假单胞菌、鲍曼不动杆菌和肺炎克雷伯菌的处理方式同步骤(2)-(4)。在细菌存活率分析中,取三次独立实验结果,实验结果见表5-7和图2。
[0084]
表4
[0085]
[0086]
表5
[0087][0088]
表6
[0089]
[0090][0091]
表7
[0092][0093]
结果显示:本发明在处理大肠杆菌10s的时间后,即可杀灭所有细菌,杀菌效果极为显著,而对照组1在10s内杀菌效果不显著,需要持续处理3-5min才可杀灭所有细菌,对照组2则需要持续处理1-3min才可达到同样效果。
[0094]
本发明在处理铜绿假单胞菌3min后,即可杀灭所有细菌,杀菌效果极为显著,而对照组1在处理铜绿假单胞菌3min后,仅杀灭约1个数量级,对照组2在处理铜绿假单胞菌3min后,也仅是杀灭约3个数量级。
[0095]
本发明所用的鲍曼不动杆菌及肺炎克雷伯菌为多重耐药菌,在上述实验条件下3个配方均不能完全杀死所有的细菌,尽管如此,与两组对照组相比,本发明在处理鲍曼不动杆菌10min后,细菌存活率为0.0018%,对照组1则为0.0385%,对照组2则为0.0929%,本发
明处理后细菌存活率更低,杀菌效果更好;与2组对照组相比,本发明在处理肺炎克雷伯菌10min后,细菌存活率为0.0043%,对照组1则为0.0134%,对照组2则为0.0103%。从此结果可得出,本发明较两个对照组配方更为优异。
[0096]
实施例3本发明滴眼液与对照组滴眼液体内杀菌效果对比测试
[0097]
(1)建立小鼠细菌性角膜炎感染模型:吸取保存于-80℃冰箱中的铜绿假单胞菌菌种的40%甘油菌液1μl,加至1ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养12h,将得到的菌液稀释500倍后接种于20ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养到平台期(24h),得到铜绿假单胞菌的菌液。然后称量小鼠体重,使用水合氯醛对小鼠进行麻醉,深层麻醉后使用1ml规格的注射器针头对小鼠角膜处进行刮伤,刮出3个1mm左右的平行切口,切口较深但不至于使眼前房房水流出,再使用移液枪将铜绿假单胞菌菌液吸取4μl(菌落数约为8.81
×
106cfu)滴加在小鼠角膜处,轻柔按摩小鼠眼部,使菌液与角膜充分接触以提高感染率,结束后放入鼠房静养,感染48h。
[0098]
(2)对小鼠角膜感染情况进行评估:使用裂隙灯显微镜选取眼睑粘连、结膜重度水肿充血、前房积脓面积大于3/4、角膜全浸润、角膜呈现灰白色混浊且巩膜瞳孔不可见的小鼠,即四级感染小鼠,舍弃一级、二级、三级感染小鼠。选取12只符合四级感染且感染状态一致的小鼠,随机分成4组,每组3只。刮伤、加菌及角膜感染图见说明书附图图3。
[0099]
(3)治疗:第一组小鼠作为本实验的空白对照,给药为生理盐水,第二组小鼠给药为本发明滴眼液,第三组小鼠给药为对照组1(0.9%nacl+tob(1000μg/ml)+苯扎氯铵(100μg/ml)),第四组小鼠给药为对照组2(0.9%nacl+tob(3000μg/ml)+苯扎氯铵(100μg/ml)),以上四组小鼠均给药4次,每次给药量为10μl,给药间隔时间为4h。
[0100]
(4)角膜菌落计数:治疗结束后,立即处死四组小鼠,使用手术剪摘取每只小鼠的左右眼,置于装有1ml 10mm磷酸盐缓冲液(ph=7.4)的12ml规格塑料摇菌管中,然后使用可调高速分散器对小鼠角膜进行匀浆1min,转速为15000转/分钟。匀浆结束后将菌液按照每次10倍的梯度用10mm磷酸盐缓冲液(ph=7.4)依次稀释,每个稀释度取4μl菌液点滴在lb固体培养基平板上,置于37℃温箱培养至少12h后,检查细菌死亡,菌落计数,计算经处理后铜绿假单胞菌的存活率。在细菌存活率分析中,分别取各组3只小鼠的6只角膜匀浆点板结果计数,结果取6次点板结果平均值,实验结果见表8和图3。
[0101]
表8
[0102][0103]
注:
“‑”
表示感染后对小鼠滴加生理盐水,作为本实验空白对照。
[0104]
体内杀菌结果显示,通过4次给药,本发明能够有效杀灭小鼠急性角膜感染模型的铜绿假单胞菌,生物统计学分析可知本发明处理组(0.3m甘油+tob(1000μg/ml)+苯扎氯铵(100μg/ml)与对照组1(0.9%nacl+tob(1000μg/ml)+苯扎氯铵(100μg/ml))有极显著差异(p《0.01),本发明组与对照组2(0.9%nacl+tob(3000μg/ml)+苯扎氯铵(100μg/ml))在统计
学上无显著差异(p》0.05),说明本发明在活体应用是可以起到良好杀菌效果的。且本发明中抗生素含量较低,治疗效果较好,能有效降低病原菌产生的耐药风险。
[0105]
实施例4
[0106]
(1)吸取保存于-80℃冰箱中的金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌菌种的40%甘油菌液1μl,加至1ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养12h,将得到的菌液稀释500倍后接种于20ml lb液体培养基中,放置于摇床中(37℃,220rpm)培养到平台期(24h),得到这3种细菌的菌液。
[0107]
(2)将实验组(0.3m甘油+tob(1000μg/ml)+苯扎氯铵(100μg/ml))、纯水对照组(ddwater+tob(1000μg/ml)+苯扎氯铵(100μg/ml))、生理盐水对照组(0.9%nacl+tob(1000μg/ml)+苯扎氯铵(100μg/ml))各组成分分解,分别进行杀菌实验,探究各成分在此组中起到的杀菌效果,其中各组各成分的分解杀菌实验均进行不同的处理时间,为0s,10s,1min,3min,5min,10min;当所述细菌为金黄色葡萄球菌时,取菌液含量为100μl,各组分药品含量为30μl、当所述细菌为铜绿假单胞菌时,取菌液含量为50μl,各组分药品含量为50μl、当所述细菌为大肠杆菌时,取菌液含量为50μl,各组分药品含量为50μl。
[0108]
(3)处理时间结束后立刻放入超速离心机中13000rpm离心2min,去除上清液,用100μl 10mm灭菌磷酸盐缓冲液(ph=7.4)重悬菌体,洗涤两次,最终用100μl 10mm磷酸盐缓冲液重悬后备用(与原菌液相同的体积)。
[0109]
图4-6分别为金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌的处理结果,结果显示,0.3m甘油不仅具有辅助妥布霉素杀灭以上3种细菌的作用,而且与0.9%nacl相比,0.3m甘油、ddwater这两种物质分别与苯扎氯铵双处理可以不对苯扎氯铵防腐作用产生抑制,而0.9%nacl介质中,妥布霉素及苯扎氯铵的杀菌效果均不及本发明滴眼液,显示出本发明杀菌的优越性。
[0110]
实验证明,本发明研制的滴眼液可以显著提高不同细菌的杀菌效果。针对金黄色葡萄球菌,本发明在处理10s时即可杀灭9个数量级,而对照组1(使用0.9%nacl配制的妥布霉素,浓度同样为1mg/ml)仅能杀灭约1个数量级。阳性对照组(即对照组2,按上市配方配制,妥布霉素浓度为3mg/ml)仅能杀灭约3个数量级。此外,进一步研究发现,本发明对常见敏感菌杀菌效果更好,而对耐药细菌(鲍曼不动杆菌、肺炎克雷伯菌)也有很好的杀菌效果。本发明研制的滴眼液能大幅提高对病原菌的杀菌效果,有效降低病原菌所产生耐药的风险,且降低了抗生素的用量,使抗生素对患者造成的肾、耳毒性降低,实现“减毒增效”的目标。
[0111]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1