一种提高肠道中拟杆菌和条件致病菌比值的组合物及其制备方法和应用与流程
1.本发明涉及微生物技术领域,具体而言,涉及一种提高肠道中拟杆菌和条件致病菌比值的组合物及其制备方法和应用。
背景技术:
2.数以万亿的微生物存在于人体的肠道中,被统称为“肠道微生物群”。这些微生物通过母婴传播的方式从产前开始在肠道定植。基因测序数据显示,尽管在健康个体中发现了多种多样的细菌物种,但肠道宏基因组(即肠道微生物群落中的所有基因)都参与宿主的核心功能,如难以消化的营养物质的消化和降解,以及宿主免疫系统和消化道的发育和刺激。肠道微生物群也产生与宿主的代谢相互作用的信号分子,如短链脂肪酸(scfa)是通过肠道细菌发酵膳食纤维而产生的,它们与g蛋白偶联受体(gpcr)的相互作用,影响脂肪细胞和外周器官中的胰岛素敏感性,从而调节能量代谢。
3.在整个生命过程中,肠道生态系统的瞬时变化可导致微生物-宿主共生关系的破坏。例如,长期摄入高脂肪食物会导致肠道菌群失调,使肠道中存在更高水平的乙酸,这种正向的调节机制使食量越来越大,从而促进肥胖,和产生胰岛素抵抗。肥胖发展过程中肠道优势菌群变化会促使肠道微生物环境进一步失调:肠道中有益菌(例:faecalibacterium粪杆菌属;bacteroides uniformis单形拟杆菌;bifidobacteriumbifidum双歧杆菌)比重显著降低,而条件致病菌(例:eggerthella lenta迟缓埃格特菌)比重显著增加,进而诱发炎症反应。
4.由于肠道生态系统在维持宿主生理方面的重要作用,它的改变会引发多种生理障碍,包括低度炎症、代谢紊乱、脂质过度积累和胰岛素敏感性丧失,进而增加了代谢性疾病发生的风险。因此本发明的目的在于提供一种提高肠道中单形拟杆菌/条件致病菌比值的组合物,来改善上述问题。鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种提高肠道中拟杆菌和条件致病菌比值的组合物及其制备方法和应用。
6.本发明是这样实现的:
7.第一方面,本发明提供一种提高肠道中拟杆菌和条件致病菌比值的组合物,其原料按质量百分数计包括麦芽-α-淀粉酶21%-64%、水飞蓟12%-22%、当归11%-21%、桑黄醇提物10%-20%、银杉树皮2%-8%、槲皮素0.5%-5%和苍术提取物0.5%-5%。
8.在可选的实施方式中,所述当归为朝鲜当归。
9.在可选的实施方式中,所述银杉树皮为欧洲银杉树皮。
10.在可选的实施方式中,所述槲皮素为从菊花中提取获得的菊花-槲皮素。
11.第二方面,本发明提供一种如前述实施方式所述的提高肠道中拟杆菌和条件致病
菌比值的组合物的制备方法,其包括将所述原料粉碎后采用缓冲液进行溶解,混合均匀。
12.第三方面,本发明提供一种提高肠道中拟杆菌和条件致病菌比值的培养基,其包括基础培养基以及如前述实施方式所述的提高肠道中拟杆菌和条件致病菌比值的组合物,所述组合物添加至所述基础培养基中。
13.在可选的实施方式中,所述组合物经缓冲液溶解并配置成浓度为4-6%的溶解液后添加至所述基础培养基,所述溶解液与所述基础培养基的体积比为1:1-1.5。
14.第四方面,本发明提供一种如前述实施方式所述的提高肠道中拟杆菌和条件致病菌比值的组合物在制备调节肠道菌群的制剂、食品或保健品中的应用。
15.在可选的实施方式中,所述提高肠道中拟杆菌和条件致病菌比值的组合物通过提高拟杆菌的丰度并降低条件致病菌的丰度以调节肠道菌群。
16.在可选的实施方式中,所述拟杆菌包括单形拟杆菌和多形拟杆菌,所述条件致病菌包括迟缓埃格特菌、大肠埃希氏菌和弗氏志贺氏菌。
17.第五方面,本发明提供一种如前述实施方式所述的提高肠道中拟杆菌和条件致病菌比值的组合物在定向发酵用于粪菌移植的特异供体菌群的方法中的应用。
18.本发明具有以下有益效果:
19.本技术提供的提高肠道中拟杆菌和条件致病菌比值的组合物通过对组分进行筛选获得的特定用量组合的麦芽-α-淀粉酶21%-64%、水飞蓟12%-22%、当归11%-21%、桑黄醇提物10%-20%、银杉树皮2%-8%、槲皮素0.5%-5%和苍术提取物0.5%-5%,本技术发现将其用于改善肠道菌群中可以得到很好的效果,尤其是,可以提高拟杆菌的丰度并降低条件致病菌的丰度以调节肠道菌群,进而该组合物可以广泛应用于调节肠道菌群的制剂、食品或保健品中、制备用于治疗或改善肠道炎症性疾病的药物中,以及应用于定向发酵用于粪菌移植的特异供体菌群的方法中,其适用范围广泛,原料简单易得,制备方法简单,适合推广。
具体实施方式
20.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
21.本发明提供一种提高肠道中拟杆菌和条件致病菌比值的组合物,其原料按质量百分数计包括麦芽-α-淀粉酶21%-64%、水飞蓟12%-22%、当归11%-21%、桑黄醇提物10%-20%、银杉树皮2%-8%、槲皮素0.5%-5%和苍术提取物0.5%-5%。
22.优选地,当归为朝鲜当归,银杉树皮为欧洲银杉树皮,槲皮素为从菊花中提取获得的菊花-槲皮素。本技术提供的上述原料都很少有用于调节肠道菌群的研究,但是本技术经研究发现,上述原料的特定组合不仅仅可以提高肠道中的拟杆菌的丰度,同时还可以降低条件致病菌的丰度,进而双向调节拟杆菌和条件致病菌比值,实现提高肠道调节能力的功能。
23.提高肠道中拟杆菌和条件致病菌比值的组合物的制备方法简单,只需要将将原料粉碎后采用缓冲液进行溶解,混合均匀即可,本技术中所选用的原料均是可溶性粉末,易于
溶解。缓冲液的种类有多种,包括但不限于pbs、磷酸、柠檬酸、三羟甲基氨基甲烷tris中的一种或多种。
24.具体来说,本技术还提供了一种提高肠道中拟杆菌和条件致病菌比值的培养基,其包括基础培养基以及上述提高肠道中拟杆菌和条件致病菌比值的组合物,组合物添加至基础培养基中。其中,组合物经缓冲液溶解并配置成浓度为4-6%的溶解液后添加至基础培养基,溶解液与基础培养基的体积比为1:1-1.5。利用本技术提供的培养基对粪便样品进行培养,可以提高粪便样品中拟杆菌和条件致病菌的比值。
25.本技术提供的提高肠道中拟杆菌和条件致病菌比值的组合物可以同时降低有益菌(例如拟杆菌)的丰度,同时还可以降低有害菌的丰度,实现提高拟杆菌和条件致病菌的比值,进而使得肠道的调节能力得到改善。
26.进一步地,本技术还提供了上述提高肠道中拟杆菌和条件致病菌比值的组合物的多种应用。
27.例如:提高肠道中拟杆菌和条件致病菌比值的组合物在制备调节肠道菌群的制剂、食品或保健品中的应用;提高肠道中拟杆菌和条件致病菌比值的组合物在制备用于治疗或改善肠道炎症性疾病的药物中的应用;提高肠道中拟杆菌和条件致病菌比值的组合物在定向发酵用于粪菌移植的特异供体菌群的方法中的应用。
28.其中,在制备调节肠道菌群的制剂、食品或保健品的应用中,提高肠道中拟杆菌和条件致病菌比值的组合物通过提高拟杆菌的丰度并降低条件致病菌的丰度以调节肠道菌群。拟杆菌包括单形拟杆菌和多形拟杆菌,条件致病菌包括迟缓埃格特菌、大肠埃希氏菌和弗氏志贺氏菌。
29.在制备用于治疗或改善肠道炎症性疾病的药物的应用中,肠道炎症性疾病包括结肠癌、克罗恩和便秘中的至少一种。
30.以下结合实施例对本发明的特征和性能作进一步的详细描述。
31.本实施例中所用的麦芽-α-淀粉酶、水飞蓟、朝鲜当归、桑黄醇提物、欧洲银杉树皮、菊花-槲皮素和苍术提取物均市购于西安奥赛生物科技有限公司。
32.实施例1
33.本实施例提供了一种提高肠道中拟杆菌和条件致病菌比值的组合物,其原料包括:500g麦芽-α-淀粉酶;180g水飞蓟、120g朝鲜当归、110g桑黄醇提物,30g欧洲银杉树皮,30g菊花-槲皮素,30g苍术提取物。
34.其制备方法包括:将上述原料用pbs缓冲液溶解至质量百分浓度为5%的混合液。
35.实施例2
36.本实施例提供了一种提高肠道中拟杆菌和条件致病菌比值的组合物,其原料包括:210g麦芽-α-淀粉酶;220g水飞蓟、210g朝鲜当归、200g桑黄醇提物,80g欧洲银杉树皮,40g菊花-槲皮素,40g苍术提取物。
37.其制备方法包括:将上述原料用pbs缓冲液溶解至质量百分浓度为5%的混合液。
38.实施例3
39.本实施例提供了一种提高肠道中拟杆菌和条件致病菌比值的组合物,其原料包括:500g麦芽-α-淀粉酶,150g水飞蓟,140g朝鲜当归、130g桑黄醇提物,50g欧洲银杉树皮,20g菊花-槲皮素,10g苍术提取物。
40.其制备方法包括:将上述原料用pbs缓冲液溶解至质量百分浓度为5%的混合液。
41.实施例4
42.本实施例提供了一种提高肠道中拟杆菌和条件致病菌比值的组合物,其原料包括:350g麦芽-α-淀粉酶,170g水飞蓟,160g朝鲜当归、150g桑黄醇提物,80g欧洲银杉树皮,50g菊花-槲皮素,40g苍术提取物。
43.其制备方法包括:将上述原料用pbs缓冲液溶解至质量百分浓度为5%的混合液。
44.实施例5
45.本实施例提供了一种提高肠道中拟杆菌和条件致病菌比值的组合物,其原料包括:420g麦芽-α-淀粉酶,180g水飞蓟,170g朝鲜当归、150g桑黄醇提物,30g欧洲银杉树皮,30g菊花-槲皮素,20g苍术提取物。
46.其制备方法包括:将上述原料用pbs缓冲液溶解至质量百分浓度为5%的混合液。
47.对比例1
48.本对比例与实施例5基本相同,区别仅在于,本对比例省略了实施例5中的麦芽-α-淀粉酶和水飞蓟,替换为等量的淀粉。
49.对比例2
50.本对比例与实施例5基本相同,区别仅在于,本对比例仅包括麦芽-α-淀粉酶,用pbs缓冲液溶解至质量百分浓度为5%的液体。
51.对比例3
52.本对比例与实施例5基本相同,区别仅在于,本对比例仅包括水飞蓟,用pbs缓冲液溶解至质量百分浓度为5%的液体。
53.对比例4
54.本对比例与实施例5基本相同,区别仅在于,本对比例中组分用量不同:700g麦芽-α-淀粉酶,100g水飞蓟,100g朝鲜当归、80g桑黄醇提物,10g欧洲银杉树皮,2g菊花-槲皮素,8g苍术提取物。
55.对比例5
56.本对比例与实施例5基本相同,区别仅在于,本对比例中组分用量不同:200g麦芽-α-淀粉酶,100g水飞蓟,250g朝鲜当归、250g桑黄醇提物,80g欧洲银杉树皮,60g菊花-槲皮素,60g苍术提取物。
57.一、体外实验:
58.1、粪便样品处理
59.(1)pbs缓冲液配制
60.以1000ml为例,用电子分析天平分别称取下列药品,倒入1000ml烧杯中,包括:kh2po
4 0.24g,na2hpo4·
12h2o 2.90g,nacl 8.00g,kcl 0.20g。用校准后的ph计测量上述溶液的ph,用0.1m的hcl或naoh调整ph=7.4
±
0.05。然后放入高压灭菌锅,121℃,15分钟。待降至室温后,将溶液需存于4℃冰箱中,可保存6个月。
61.(2)粪便样品处理
62.以10g为例,最终浓度为10%。
63.用百分之一的天平称量出10g粪便样品,用自动移液枪取适量上述pbs缓冲液加至离心管中,在振荡器上充分混匀。然后将完全混匀的样品平均分装至新50ml离心管中,每管
再加适量pbs缓冲液。
64.混匀后在生物安全柜内进行过滤,把稀释好的样品依次通过20目、50目、100目、200目的滤网。收集滤液至离心管中,将离心管放入离心机,配平,6000g,4℃离心15min,弃上清。将沉淀称量之后,以终浓度为5%用pbs溶液定容,得到肠道微生物样品。
65.2、基础培养基配制
66.配制用于培养肠道微生物的基础培养基:gam培养基,以1000ml为例。用电子分析天平称取60g改良gam肉汤药品,倒入1000ml烧杯中。用量筒量取800ml超纯水倒入烧杯中,放入搅拌转子,并放到磁力加热搅拌器上搅拌至完全溶解,定容至1000ml。121℃,15分钟。灭菌完后,立即把瓶盖拧紧,冷却至室温。
67.3、分组和干预
68.于无菌操作台上,用1ml的移液枪取上述gam培养基分装至玻璃管中,每管2ml。接着用1ml移液器取实施例5组合物,加入上述装有gam培养基的玻璃管中,每管2ml,作为实施例组。接着用1ml移液器取对比例1-5组合物,加入上述装有gam培养基的玻璃管中,每管2ml,作为对比例组;同时还设置有对照组,分组具体如下:
69.实施例组:2ml gam培养基+2ml实施例5混合液+1ml pbs缓冲液;
70.对比例组:2ml gam培养基+2ml对比例1-5混合液+1ml pbs缓冲液;
71.对照组:2ml gam培养基+3ml pbs缓冲液;
72.确认好每个玻璃管盖拧紧后,转移至厌氧箱传递箱中,放置之前需用84消毒液消毒处理。放入厌氧箱后,拧松瓶盖,置换氧气,需置换12个小时。
73.将上述处理后得到的肠道微生物样品分别接种至试验组(组合物-gam培养基)以及空白对照组(gam培养基-pbs缓冲液)中,每管1ml。
74.于厌氧箱中培养72小时后,观察菌群(例如单形拟杆菌(bacteroides uniformis)、多形拟杆菌(bacteroides thetaiotaomicron)、霍氏真杆菌(eubacterium hallii)、酸胺球菌属(acidaminococcus)、迟缓埃格特菌(eggerthella lenta)、大肠埃希氏菌(escherichia coli)、沙门氏菌属(salmonella)和弗氏志贺氏菌(shigella flexneri))的生长状况,拍照留存。
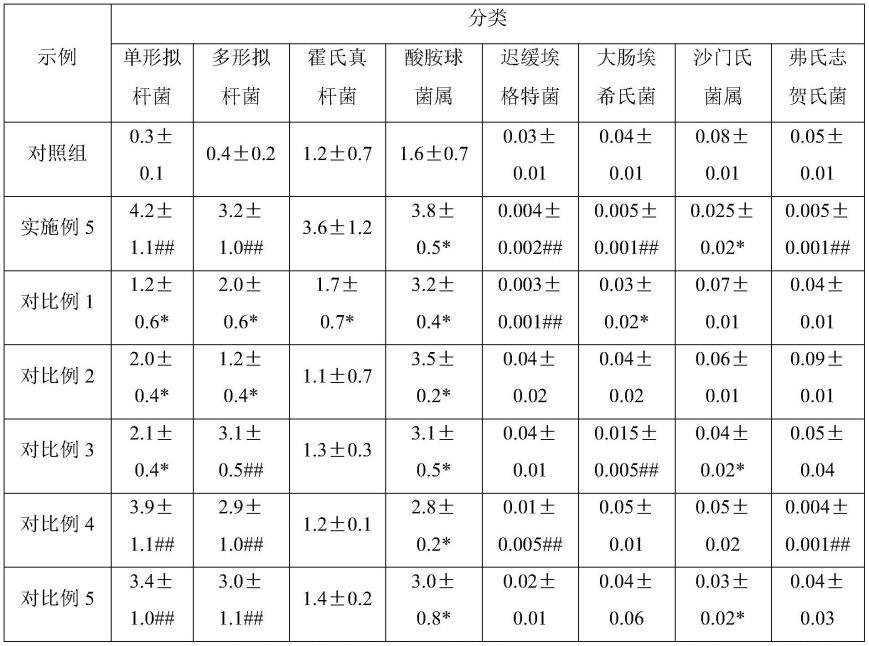
75.接着分别将试验组样品和对照组样品,10000rpm,3min离心,弃上清,将沉淀用液氮处理,并送至武汉艾康健生物科技有限公司,分别测定试验组和对照组中的肠道菌群丰度,其中部分肠道菌群的丰度测定结果如表1所示,并对部分肠道菌群干预前后的丰度变化进行显著性分析。
76.结果分析:
77.表1.肠道菌群的丰度测定结果统计表
[0078][0079]
注:*p《0.05,代表一定程度降低或增加,##p《0.01,代表显著性的降低或增加。
[0080]
从体外实验结果结果看,单形拟杆菌(bacteroides uniformis)和多形拟杆菌(bacteroides thetaiotaomicron)显著增加,霍氏真杆菌(eubacterium hallii)以及酸胺球菌属(acidaminococcus)有一定丰度的增加,迟缓埃格特菌(eggerthella lenta)和大肠埃希氏菌(escherichia coli)显著性降低,总之经过组合物干预的实验组单形拟杆菌(bacteroides uniformis)丰度显著富集,条件致病菌数量减少,肠道的调节能力得到了改善。
[0081]
二、eggerthella lenta菌分析
[0082]
1、粪便样品处理
[0083]
(1)pbs缓冲液配制
[0084]
以1000ml为例,用电子分析天平分别称取下列药品,倒入1000ml烧杯中,包括:kh2po
4 0.24g,na2hpo4·
12h2o 2.90g,nacl 8.00g,kcl 0.20g。用校准后的ph计测量上述溶液的ph,用0.1m的hcl或naoh调整ph=7.4
±
0.05。然后放入高压灭菌锅,121℃,15分钟。待降至室温后,将溶液需存于4℃冰箱中,可保存6个月。
[0085]
(2)粪便样品处理
[0086]
以10g为例,最终浓度为10%。
[0087]
用百分之一的天平称量出10g粪便样品,用自动移液枪取适量上述pbs缓冲液加至离心管中,在振荡器上充分混匀。然后将完全混匀的样品平均分装至新50ml离心管中,每管再加适量pbs缓冲液。
[0088]
混匀后在生物安全柜内进行过滤,把稀释好的样品依次通过20目、50目、100目、200目的滤网。收集滤液至离心管中,将离心管放入离心机,配平,6000g,4℃离心15min,弃
上清。将沉淀称量之后,以终浓度为5%用pbs溶液定容,得到肠道微生物样品。
[0089]
2、基础培养基配制
[0090]
配制用于培养肠道微生物的基础培养基:gam培养基,以1000ml为例。用电子分析天平称取60g改良gam肉汤药品,倒入1000ml烧杯中。用量筒量取800ml超纯水倒入烧杯中,放入搅拌转子,并放到磁力加热搅拌器上搅拌至完全溶解,定容至1000ml。121℃,15分钟。灭菌完后,立即把瓶盖拧紧,冷却至室温。
[0091]
3、分组和干预
[0092]
(1)eggerthella lenta的培养
[0093]
迟缓埃格特菌是一种专性厌氧革兰阳性杆菌,生长缓慢,培养5d内放可形成肉眼可见菌落,从公司购买的迟缓埃格特菌种,将其在接种于血平板上,加入厌氧包在37℃和5%co2箱厌氧培养5d后,取菌落进行后续鉴定。
[0094]
(2)eggerthella lenta的鉴定
[0095]
将原始菌分纯扩大培养后提取原始菌基因组dna。
[0096]
正向引物:27f(5'-agagtttgatcatggctcag-3')
[0097]
反向引物:1492r(5'-tacggctaccttgtacgactt-3')
[0098]
进行16srrna基因pcr扩增实验。反应程序如下:96℃3min、96℃30s、58℃30s、72℃1min,此条件下35个循环、72℃10min,pcr反应结束后,1%的琼脂糖鉴定并使用凝胶回收试剂盒回收所需pcr产物片段。测序后与genebank数据库中已知菌的16s rrna基因进行比对。
[0099]
(3)操作步骤
[0100]
于无菌操作台上,用1ml的移液枪取上述gam培养基分装至玻璃管中,每管3ml。接着用1ml移液器取实施例5组合物的混合液,加入上述装有gam培养基的玻璃管中,每管1ml,作为实施例组,还设有条件对照组和空白组,分组具体如下:
[0101]
实施例组:3ml gam培养基+1ml实施例5组合物混合液+1ml eggerthella lenta菌培养液+1ml pbs缓冲液;
[0102]
条件对照组:3ml gam培养基+1ml eggerthella lenta菌培养液+2ml pbs缓冲液;
[0103]
空白组:3ml gam培养基+3ml pbs缓冲液。
[0104]
确认好每个玻璃管盖拧紧后,转移至厌氧箱传递箱中,放置之前需用84消毒液消毒处理。放入厌氧箱后,拧松瓶盖,置换氧气,需置换12个小时。
[0105]
将上述处理后得到的肠道微生物样品分别接种至实验组、条件对照组以及空白对照组中,每管1ml。
[0106]
于厌氧箱中培养72小时后,观察菌群的生长状况,拍照留存。
[0107]
接着分别将试验组样品和对照组样品,10000rpm,3min离心,弃上清,将沉淀用液氮处理,并送至武汉艾康健生物科技有限公司,分别测定试验组和对照组中的肠道菌群丰度,即不同肠道微生物在检测到的所有菌种中所占的百分比,其中部分肠道菌群的丰度测定结果如表2所示。
[0108]
并对部分肠道菌群干预前后的丰度变化进行显著性分析。
[0109]
表2.肠道菌群的丰度测定结果表
[0110]
示例迟缓埃格特菌(eggerthella lenta)b空白组0.07
±
0.01
条件对照组28.4
±
3.5*实施例56.5
±
3.2#
[0111]
对比空白组*p<0.01,对比条件对照组#p<0.01。
[0112]
结果表明迟缓埃格特菌(eggerthella lenta)经过组合物的干预后,丰度是有显著性的降低的。
[0113]
综上所述,本技术提供的提高肠道中拟杆菌和条件致病菌比值的组合物通过对组分进行筛选获得的特定用量组合的麦芽-α-淀粉酶21%-64%、水飞蓟12%-22%、当归11%-21%、桑黄醇提物10%-20%、银杉树皮2%-8%、槲皮素0.5%-5%和苍术提取物0.5%-5%,本技术发现将其用于改善肠道菌群中可以得到很好的效果,尤其是,可以提高拟杆菌的丰度并降低条件致病菌的丰度以调节肠道菌群,进而该组合物可以广泛应用于调节肠道菌群的制剂、食品或保健品中、制备用于治疗或改善肠道炎症性疾病的药物中,以及应用于定向发酵用于粪菌移植的特异供体菌群的方法中,其适用范围广泛,原料简单易得,制备方法简单,适合推广。
[0114]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1