一种胶原纤维定向排列的卷轴型神经导管及其制备方法和应用与流程
1.本发明涉及医用生物材料领域,具体涉及的是一种胶原纤维定向排列的卷轴型神经导管及其制备方法和应用。
背景技术:
2.周围神经损伤是临床常见损伤,通常引起运动和感觉功能障碍,患者致残率高,给社会带来沉重的医疗和经济负担。损伤的周围神经难以重建,尤其是大段缺损的神经再生能力非常有限。修复大段神经缺损的黄金标准是自体神经移植,然而供体来源有限,捐赠部位功能缺失严重,供体和受体不易匹配。神经导管也称作人工神经和人工神经移植物,是由天然和/或合成生物高分子制成的管状结构,充当覆盖/填充神经受损处或连接神经断端之间的桥梁,为轴突沿导管再生提供结构支持和营养保障。神经导管克服了自体和异体神经移植的多个弊端,已有多个神经导管用于临床修复神经损伤,越来越多的专业人士相信神经导管能够逐渐替代神经移植,将来在周围神经修复中发挥关键作用。
3.目前用于制造神经导管有天然高分子、合成高分子及二者的复合物,其中胶原蛋白和聚己内酯广泛用于制造神经导管的天然生物高分子和合成高分子。胶原蛋白等天然生物高分子具有优良的生物相容性和诱导组织再生能力,可以为细胞提供友好的生存环境,但是机械性能较弱,合成高分子具有良好的机械性能,但生物相容性和生物活性欠佳。因此,通常通过联合使用天然生物高分子和合成高分子,天然生物高分子为细胞提供仿生环境,合成聚合物提供适当的结构/力学支持。
4.神经导管有多种结构类型,如中空无孔单壁、中空多孔单壁、中空沟槽单壁、多通道、单壁内部填充纤维或水凝胶。营养物质和生长因子渗透是对神经导管的关键要求,无孔单壁设计不能满足此类要求,该结构设计已经很少采用;沟槽和多通道设计可以很好地引导轴突定向生长,但是制造技术要求高;带有水凝胶填料的神经导管会阻止轴突长入导管,因此,多孔单壁和纤维填充的结构在目前临床使用的神经导管最为常见,如被fda批准的是由i型胶原蛋白制成的中空多孔单壁圆管,3d神经导管是的基础上,内部填充由i型胶原蛋白和硫酸软骨素-6组成的多孔基质。
5.理想的神经导管要求具有仿生结构、适当的机械性能、足够渗透性提供营养、使用灵活性和生物降解性,能够为轴突再生提供合适的微环境,提高神经再生的效率,快速恢复受损的运动和感觉功能。目前临床使用的神经导管离理想的神经导管相距甚远,一般用于缺损长度为3cm以下的神经缺损修复,而对于较长的神经修复效果不尽人意。此外,与其他治疗方法相比,作为黄金标准的自体神经移植疗效效果最佳,但其移植术后的成功率也仅为50%,研发治疗周围神经损伤疗效优秀的神经导管一直是临床医生和科研人员的努力方向。
技术实现要素:
6.本发明提供了一种胶原纤维定向排列的卷轴型神经导管及其制备方法和应用,该神经导管能够用于桥接缺损的神经,并且引导神经细胞定向生长,促进神经修复重建和功能恢复。
7.本发明首先提供了一种神经导管,所述神经导管由胶原蛋白薄片卷曲而成;
8.所述胶原蛋白薄片中的胶原蛋白定向有序排列是原料组织中胶原蛋白的自然固有定向有序排列。
9.上述的神经导管,所述胶原蛋白薄片至少卷曲1周制成神经导管;
10.优选的,所述胶原蛋白薄片卷曲多周,制成卷轴,保证神经导管内部也有定向排列的胶原蛋白。
11.所述胶原蛋白薄片中的胶原蛋白排列方向与神经导管长轴方向相同或相近。
12.上述的神经导管,所述原料组织为胶原蛋白丰富且排列定向有序的动物组织,包括但不限于肌腱、韧带或神经。
13.所述胶原蛋白薄片的制备方法,包括如下步骤:
14.将原料组织切成薄片,去除组织切片中的细胞和大分子,干燥,得到所述胶原蛋白薄片。
15.所述原料组织为胶原蛋白丰富且排列定向有序的动物组织;包括但不限于肌腱、韧带和神经中的至少一种;
16.将原料组织切成薄片的厚度为5微米~500微米,优选100微米~300微米;
17.去除组织切片中的细胞的方法可以采用反复冻融的方法或采用化学试剂;
18.具体的,采用的化学试剂包括但不限于甲酸、过氧乙酸、氢氧化钠、十二烷基磺酸钠、triton x-100、脱氧胆酸钠及其联合处理。
19.所述联合处理包括但不限于0.5~2%(体积百分数)triton x-100的tris-hcl缓冲液与1~5%(重量百分数)脱氧胆酸钠溶液联合使用、0.1~5%(体积百分数)过氧乙酸/5~40%(体积百分数)乙醇溶液与0.01~0.2m氢氧化钠/0.05~0.2m edta溶液联合使用。
20.去除的组织切片中的大分子包括dna和rna,dna和rna可以用核糖核酸酶和脱氧核糖核酸酶除去。
21.所述切成薄片是获取原料组织中胶原蛋白的定向有序排列方式切片,并非将组织结构彻底破坏,再重新组装所得。
22.所述切成薄片的方式包括但不限于组织冰冻切片或组织石蜡包埋切片。
23.本发明可以对所述胶原蛋白薄片先进行修饰,然后再卷曲成卷轴状,得到所述神经导管;
24.所述修饰为如下任一种:
25.(1)对所述胶原蛋白薄片进行化学偶联;
26.具体的,所述化学偶联的试剂为醛类化合物、碳二亚胺、京尼平和原花色素中的任意一种或至少两种的组合;醛类化合物优选戊二醛和/或甲醛;
27.(2)在所述胶原蛋白薄片上吸附或化学偶联促进神经再生的生物因子或多肽;
28.所述生物因子具体可为神经生长因子、脑源性神经营养因子、碱性成纤维细胞生长因子、血管内皮细胞生长因子、类胰岛素生长因子和血小板源性生长因子中的至少一种;
29.所述多肽具体可为能促进神经细胞的分化的多肽yigsr;
30.(3)在所述胶原蛋白薄片上直接培养干细胞;
31.具体的,所述干细胞为神经干细胞、骨髓间充质干细胞、脂肪间充质干细胞、脐带间充质干细胞和诱导多能干细胞中的至少一种。
32.去除薄片中的主要非胶原成分、化学偶联或生物因子修饰后,胶原蛋白薄片干燥后储藏和运输。所述干燥的方法有晾干、吹干或冷冻干燥。
33.还可以对干燥的胶原蛋白薄片进行灭菌处理,灭菌处理的方式包括环氧乙烷灭菌、高能电子束辐照灭菌或γ射线灭菌。
34.本发明还进一步提供了上述神经导管在制备神经修复材料或神经修复中的应用。
35.上述神经导管的制备方法,包括如下步骤:将胶原蛋白薄片铺平,用生理盐水润湿,在胶原蛋白薄片一端放置一根与胶原纤维平行的医用真丝编织线,卷曲胶原蛋白薄片,正好覆盖真丝编织线,然后用双手拉直真丝编织线,旋转,带动胶原蛋白薄片卷曲,制成由多层胶原纤维轴向排列的卷轴,最后抽出真丝编织线。
36.临床使用时,需根据修补损伤神经的长度和直径,将干燥的胶原蛋白薄片剪成一定形状,润湿,再卷曲成所需长度和直径的神经导管。
37.神经缺失部位、粗细、长短不同,神经导管在体内最佳降解时间不同,需要优化胶原蛋白薄片在体内降解时间;胶原蛋白薄片在体内降解时间的优化可以通过改变胶原蛋白薄片厚度实现,也可以通过化学偶联实现。
38.本发明具有如下有益效果:
39.(1)本发明制备的神经导管中的胶原蛋白源于异体组织或异种组织,特别之处在于神经导管中胶原蛋白保持了其在原料组织中自然的定向排列方式,沿导管轴向定向排列,为神经细胞提供了友好的仿生环境,定向排列的胶原蛋白纤维为神经细胞迁移、轴突定向延伸提供了指导线索;
40.(2)本发明将二维定向排列的胶原蛋白薄片卷曲,制成三维的卷轴结构,实现多层填充的神经导管,不仅外膜中胶原蛋白排列有序,内部填充的胶原蛋白也有序排列,利于神经内外部细胞同时定向迁移和生长,更好地促进轴突的再生;
41.(3)本发明的神经导管胶原蛋白有序排列方式是源于原料组织中胶原蛋白本身的排列方式,制造无需直接操控胶原蛋白分子和纤维,而仅是将异体组织或异种组织切成薄片,然后进行脱细胞等处理,制造过程简便,产品质量容易控制;
42.(4)本发明制备的神经导管可以在手术时,根据神经损伤处的尺寸和需桥接神经的直径/长度,将干燥的胶原蛋白薄片剪成一定形状,湿润,再卷曲成所需长度和直径的神经导管;因此在手术时无需准备多种型号产品,在修复神经之前,方便地卷出个性化的神经导管。
附图说明
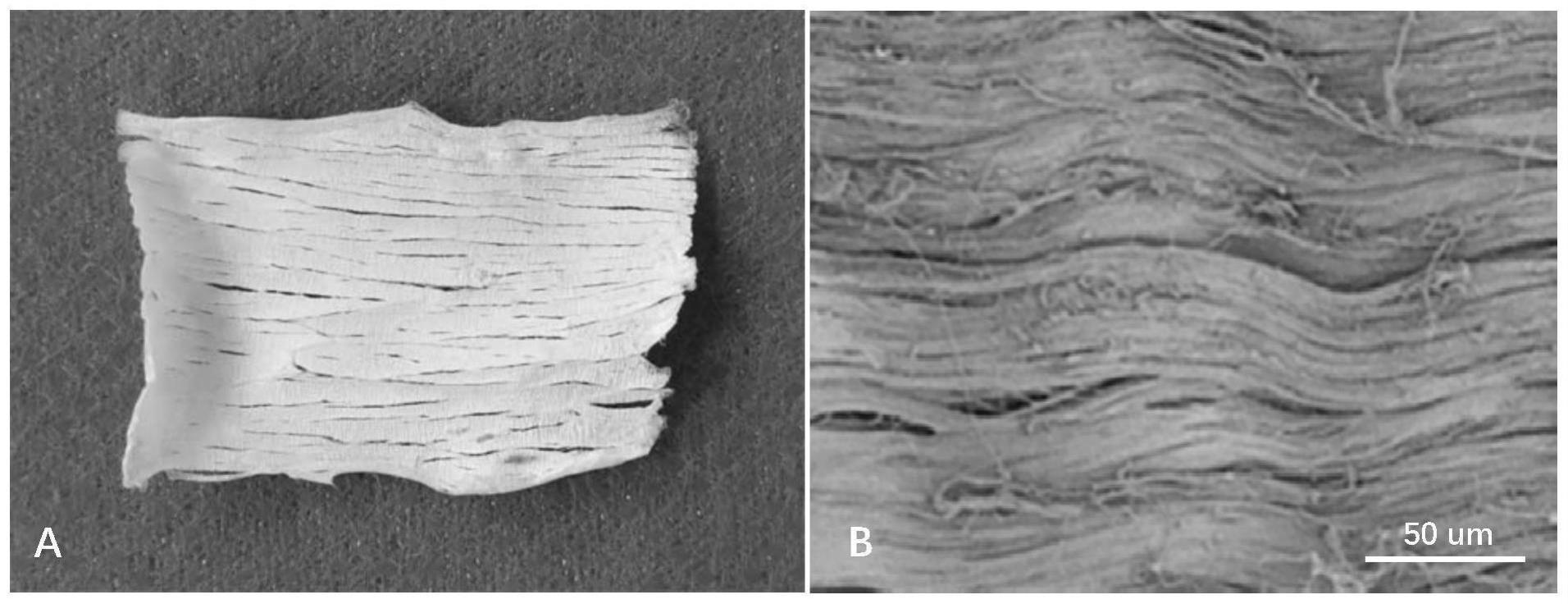
43.图1为实施例1制备的胶原蛋白薄片及其表面胶原蛋白纤维形貌。
44.图2为在胶原蛋白薄片上生长的骨髓干细胞。
45.图3为神经导管的制作方法。
46.图4为神经导管的横截面。
47.图5为神经导管修复大鼠坐骨神经缺损。
48.图6为修复12周后的大鼠坐骨神经。
具体实施方式
49.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
50.下述实施例中的实验方法,如无特殊说明,均为常规方法。
51.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
52.下述实施例中的核糖核酸酶购自sigma-aldrich,货号为r5503;脱氧核糖核酸酶购自sigma-aldrich,货号为dn25;
53.乙基二甲氨基丙基碳二亚胺购自阿拉丁,货号为e106172;n-羟基琥珀酰亚胺购自阿拉丁,货号为h109330;
54.钙黄绿素购自碧云天,货号为c2012。
55.实施例1、胶原蛋白薄片的制备
56.从屠宰场购得新鲜牛跟腱,从其腱性区域截取50mm长的节段,浸入oct冰冻切片包埋剂中,用冷冻切片机纵向切片,切片厚度为100μm,之后将肌腱切片浸入生理盐水中,洗去包埋剂。肌腱切片反复冻融5个循环(-80℃10分钟,37℃10分钟),再在37℃的磷酸盐缓冲溶液中用核糖核酸酶(150iu/ml)和脱氧核糖核酸酶(100μg/ml)处理肌腱切片4小时,用蒸馏水清洗,放入冰箱冷冻(-80℃10分钟),然后放入冷冻抽干机中冷冻抽干(仪器极限真空度≤5pa)。所得胶原蛋白薄片照片见图1中的a。最后将胶原蛋白薄片密封在产品包装袋中,以25kgy的剂量进行γ辐照灭菌,室温储存。用扫描电子显微镜观察胶原蛋白薄片表面,胶原蛋白纤维以定向有序的方式排列(见图1中的b)。
57.采用同样方法可以制备源于牛坐骨神经的胶原蛋白薄片。
58.实施例2、胶原蛋白薄片的化学偶联
59.1)将实施例1中制备的胶原蛋白薄片(牛跟腱)浸于含1%戊二醛(体积百分数)的偶联缓冲液(0.1m碳酸盐,0.15m nacl,ph8.5)中,室温反应6小时,然后用蒸馏水漂洗,冷冻干燥(放入冰箱-80℃冷冻10分钟,然后放入冷冻抽干机中冷冻抽干)。
60.2)将实施例1中制备的胶原蛋白薄片(牛跟腱)浸于含50mm乙基二甲氨基丙基碳二亚胺和20mm n-羟基琥珀酰亚胺的偶联缓冲液(0.1m mes(吗啉乙磺酸),ph4.7)中,室温反应2小时,之后用蒸馏水漂洗,冷冻干燥(放入冰箱-80℃冷冻10分钟,然后放入冷冻抽干机中冷冻抽干)。
61.3)将实施例1中制备的胶原蛋白薄片(牛跟腱)浸于含1%京尼平(质量百分数)的生理盐水中,室温反应24小时,之后用蒸馏水漂洗,冷冻干燥(放入冰箱-80℃冷冻10分钟,然后放入冷冻抽干机中冷冻抽干)。
62.实施例3、生物因子修饰胶原蛋白薄片
63.采用实施例2中的方法1)或2)将胶原蛋白薄片经戊二醛或乙基二甲氨基丙基碳二亚胺化学偶联后,蒸馏水漂洗,室温凉至半干,在胶原蛋白薄片上均匀(50μl/cm2)滴加神经生长因子(鼠神经生长因子,从小鼠颌下腺中提取的神经生长因子,是一种分子量为26.5kd的生物活性蛋白)水溶液(50μg/ml),于4℃静置12小时,冷冻干燥(放入冰箱-80℃冷冻10分
钟,然后放入冷冻抽干机中冷冻抽干)。
64.实施例4、载有干细胞的胶原蛋白薄片
65.将实施例1制备的胶原蛋白薄片(牛跟腱)修剪成1.0cm
×
1.5cm大小,置于细菌培养皿底部,先用细胞培养基(dmem添加10%(v/v)胎牛血清)浸润,再将200微升大鼠骨髓干细胞悬液(2
×
105cell/ml)均匀加载到胶原蛋白薄片上,然后将材料放入细胞培养箱中,37℃、5%(v/v)co2下培养3小时,待细胞充分粘附在材料上后,沿培养皿壁缓慢补加培养基,完全浸没胶原蛋白薄片,隔天更换培养基。培养7天后,样品用钙黄绿素染色,在激光共聚焦扫描显微镜下检测细胞形态观察细胞排列,发现许多细胞长轴方向沿胶原蛋白纤维方向排列(图2,白色箭头代表胶原蛋白纤维方向)。
66.实施例5、神经导管的制作
67.将长方形胶原蛋白薄片(10)从包装袋中取出,胶原蛋白纤维排布方向以虚实线走向表示(图3),铺平,用生理盐水润湿,在胶原蛋白薄片一端放置一根与胶原纤维平行的医用真丝编织线(11),卷曲胶原蛋白薄片,正好覆盖真丝编织线,然后用双手拉直真丝编织线,旋转,带动胶原蛋白薄片卷曲,制成由多层胶原纤维轴向排列的卷轴(12),最后从神经导管中抽出真丝编织线。胶原蛋白薄片可以根据需要切成不同形状进行卷曲,例如将胶原蛋白薄片剪成上宽下窄形状,按照上面同样方法卷曲,制成二端有套管的卷轴型神经导管,使用时,神经断端填入套管,然后缝合固定,套管可以限制外源细胞长入吻合间隙,更好地促进神经修复。如果需要粗的神经导管,卷完一张胶原蛋白薄片后,用卷好的卷轴为轴,继续卷第2张、第3张
……
胶原蛋白薄片,直至达到所需直径,用于修复神经。将神经导管用oct冰冻切片包埋剂包埋,冷冻,横向切片,用苯胺蓝染色,拍照,结果见图4。
68.实施例6、大鼠坐骨神经的修复
69.选取体重约300~350g的sd大鼠12只,随机分配至损伤组、自体移植组、神经导管组和神经生长因子修饰的神经导管组,向大鼠腹腔注射2%(重量百分比)的戊巴比妥钠进行麻醉,待大鼠麻醉后,将其固定于手术台,左股后外侧剃毛备皮,碘酒消毒,于后正中凹陷处切开皮肤1cm,沿肌间隙小心分离肌肉,暴露坐骨神经(20)(图5),切除中段坐骨神经,形成10mm缺损。损伤组是在制造10mm神经缺损后,不做任何修复;自体移植组将坐骨神经切断10mm,进行原位缝合;神经导管组是用实施例1制备的胶原蛋白薄片(牛跟腱),按照实施例5方法制作直径较坐骨神经略粗、长度为10mm神经导管,连接受损神经的远端和近端,接头用9-0手术缝合线缝合(图5);神经生长因子修饰的神经导管组是用实施例3制备的神经生长因子修饰的胶原蛋白薄片(乙基二甲氨基丙基碳二亚胺偶联),按照实施例5方法制作直径较坐骨神经略粗、长度为10mm神经导管,连接受损神经的远端和近端,接头用9-0手术缝合线缝合。神经缝合完成后,逐层缝合关闭切口,用4-0手术缝合线缝合肌肉和表皮。所有大鼠均在标准实验条件下饲养,手术后12周,大鼠安乐死,发现神经导管组的大鼠坐骨神经形态上已经连接(图6),其中中间较细部分为再生的神经。从每只大鼠实验侧和未手术对照侧取胫前肌,测量肌肉重量,损伤组、自体移植组、神经导管组和神经生长因子修饰的神经导管组中手术侧与对侧未手术胫前肌重量比率分别是0.171、0.429、0.335和0.412,研究结果证实神经导管能够修复大鼠坐骨神经缺损,显著减缓了胫骨前肌的萎缩,神经生长因子修饰有助于神经导管修复大鼠坐骨神经缺损。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1