槲皮素在制备治疗及延缓椎间盘退变性疾病药物中的应用的制作方法
1.本发明涉及椎间盘疾病医疗技术领域,具体涉及一种槲皮素在制备治疗及延缓椎间盘退变性疾病药物中的应用。
背景技术:
2.椎间盘退变(intervertbral disc degeneration,idd)是引起颈、腰、背痛的重要病理因素,在当今世界影响人民群众健康的主要疾患之中扮演重要的一员。一般认为idd是颈肩腰腿痛的最主要始动因素之一,研究表明40%以上的颈肩腰腿痛由idd引起。但是,目前临床上尚无针对idd的治疗药物,所以,目前急需发现新的能够有效治疗idd的药物。
3.目前的常规治疗手段(保守治疗或手术)均只是对症治疗,难以修复重建退变椎间盘的结构及功能。以间充质干细胞(mesenchymal stem cells,msc) 移植为基础的生物疗法在治疗idd方面表现出较好的前景,但移植后的msc难以长期存活成为目前msc生物学治疗的主要障碍。近年来,内源性msc主导的修复越来越受到研究者的重视。退变椎间盘的局部不利环境导致内源性髓核来源的间充质干细胞(npmscs)数量减少及功能下降,从而不能有效发挥内源性修复作用可能是idd的另一主要原因。
4.槲皮素(quercetin)是一种广泛存在于各种植物中的天然黄酮类化合物,具有抗氧化应激、抗炎特性和抗衰老作用。有研究发现槲皮素可以通过选择性杀死衰老的人上皮细胞和小鼠骨髓间充质干细胞来减少细胞衰老。然而,槲皮素对 npmscs的保护作用尚不清楚。本发明研究了槲皮素是否可以缓解叔丁基过氧化氢(tbhp)诱导的npmscs衰老,并在体外细胞实验和体内sd大鼠idd动物模型中确定mir-34a/sirt1通路是否参与其中。
技术实现要素:
5.本发明的目的是提供槲皮素在降低氧化应激对npmscs造成的损伤以及抗npmscs衰老的应用。特别涉及槲皮素在制备治疗及延缓椎间盘退变性疾病药物中的应用。
6.本发明的技术方案为:一种槲皮素在制备治疗及延缓椎间盘退变性疾病药物中的应用。
7.本发明所述槲皮素的分子式为:c
15h10
o7,分子量为:302.24,结构式为式(ⅰ)所示:
8.(ⅰ)
9.进一步地,槲皮素具有抗npmscs衰老和延缓椎间盘退变的作用。
10.进一步地,一种治疗及延缓椎间盘退变性疾病的药物制剂,有效成分包括槲皮素。
11.进一步地,所述药物的剂型包括片剂、颗粒、乳剂或胶囊。
12.本发明的有益效果主要体现在:槲皮素是一种广泛存在于各种植物中的天然黄酮
类化合物,对npmscs具有抗氧化应激、抗炎和抗衰老作用。槲皮素可通过mir-34a-5p/sirt1通路改善npmscs中氧化应激诱导的衰老。此外,大鼠动物模型的体内实验表明,槲皮素可以减少npmscs细胞外基质的降解,并能延缓椎间盘退变。因此,槲皮素可视为一种治疗椎间盘退变性疾病的潜在药物;并且相对于西药而言,具有作用温和及副作用小等特点。
附图说明:
13.图1:npmscs的鉴定。(a)原代npmscs呈细长纺锤形,呈花状生长。 (b)npmscs的cd34和cd45低表达,cd73、cd90和cd105高表达。
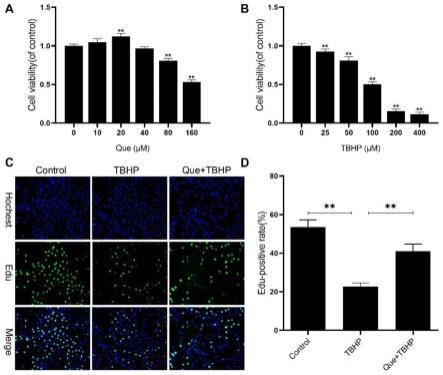
14.图2:细胞存活率测定和细胞增殖测定。(a)细胞计数试剂盒-8(cck-8) 结果:不同浓度的槲皮素(que)处理npmscs 24小时的结果。(b)不同浓度的叔丁基过氧化氢(tbhp)处理npmscs的结果。(c)不同浓度组npmscs的edu测定结果。(d):edu结果的定量分析。
15.图3:衰老相关β-半乳糖苷酶(sa-β-gal)染色。(a)不同组别中npmscs 的sa-β-gal染色结果。衰老的细胞在蓝色染色中显示出sa-β-gal的高表达。(b) 不同组别中npmscs的细胞周期结果。
16.图4:线粒体膜电位(mmp)检测和活性氧检测(ros)。(a)通过荧光检测不同组别中mmp的结果。红色荧光代表线粒体聚合jc-1,绿色荧光表示单体jc-1。(b)mmp结果的定量分析。(c)荧光检测不同组别中ros的结果。红色荧光代表高水平的ros(比例尺=50μm)。(d):ros结果的定量分析。
17.图5:槲皮素上调了sirt1的表达,下调了p16和p21以及p53的表达。 (a,b)sirt1的免疫荧光染色和定量分析。(c,d)免疫荧光染色和p16的定量分析。(e,f)免疫荧光染色和p21的定量分析。(g,h)免疫荧光染色和p53的定量分析。(i-m)不同组别中sirt1、p16、p21和p53的蛋白表达和定量分析。
18.图6:槲皮素下调了衰老相关分泌表型(sasp)的表达:il-1β、il-6 和mmp13。(a,b)il-1β的免疫荧光染色和定量分析。(c,d)il-6的免疫荧光染色和定量分析。(e,f)免疫荧光染色和mmp-13的定量分析。(g-j)不同组别中il-1β、il-6和mmp-13的蛋白表达和定量分析。
19.图7:槲皮素通过mir-34a-5p/sirt1轴减轻tbhp诱导的衰老。(a)不同组别中sirt1、p16、p21、p53、il-1β、il-6和mmp-13的蛋白水平。(b-h)不同组别中蛋白表达的定量分析。
20.图8:槲皮素改善体内ivdd的情况。(a)对照组、idd组和que组大鼠尾部完整椎间盘中段矢状面的宏观表现。(b)不同组在穿刺后0周和4周的x 射线。(c)椎间盘高度指数(dhi)的测量。(d)dhi的定量分析。(e)不同组的aggrecan和ii型胶原蛋白的表达。(f-g)不同组中aggrecan和ii型胶原蛋白的定量分析。(h-i)不同组穿刺后4周的苏木精-伊红染色和组织学评分的定量分析(比例尺=1mm)。
具体实施方式
21.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步的详细描述。
22.1.实验步骤
23.(1)npmscs的分离和培养
24.本研究的所有程序均经扬州大学临床医学院伦理委员会批准。sprague-dawley(sd) 大鼠(年龄,2-4个月;体重,200-300g)获自扬州大学(许可证号syxk(su)2017-2007)。首先在无菌条件下通过显微镜仔细分离从sd大鼠获得的髓核组织,然后将髓核组织机械破碎成1mm3并在37℃和5%co2条件下用0.2%ii型胶原酶(gibco,美国)消化12小时。用 0.75μm细胞过滤器过滤并以1000rpm离心3分钟后,将用磷酸盐缓冲液(pbs)洗涤的细胞重悬于含有10%胎牛血清(fbs,hyclone,美国)和1%抗生素(gibco,美国),然后在37℃和5%co2中培养当npmscs达到80%融合时,以1:3的比例进行传代培养。所有实验均获得第三代npmscs。
25.(2)npmscs的表面标记鉴定
26.npmscs在具有25mm直径细胞载玻片的12孔板中在完全培养基中培养。然后将细胞在4%多聚甲醛中固定15分钟,并用0.5%tritonx-100透化15分钟。随后,将细胞在室温下用10%牛血清白蛋白封闭1小时,并根据国际细胞治疗学会(isct):cd34(abclonal,中国)、 cd45(abclonal,中国)、cd73(abclonal,中国)、cd90(abclonal,中国)、cd105(proteintech,中国)和酪氨酸激酶与ig和egf同源结构域2(tie2)(一种椎间盘髓核祖细胞标记)(biodragon,中国)在4℃条件下过夜。然后在室温下与1:200稀释的fitc或cy3标记的二抗在黑暗中孵育1小时,用4',6-二脒基-2-苯基吲哚(dapi)处理5分钟后,在荧光显微镜(leica,wetzlar,德国)下观察细胞载玻片。
27.(3)细胞处理和细胞活力测定
28.为建立npmscs的氧化应激诱导模型,如我们之前所述,使用含有tbhp(100μm) 的完全培养基培养6小时。在加入tbhp(100μm)之前,使用不同浓度(0-160μm,0-48h) 的槲皮素(medchem express,中国)对细胞进行预处理,以研究槲皮素的合适剂量和时间。根据制造商的说明,使用细胞计数试剂盒kit-8(cck-8,beyotime,中国)评估细胞活力。简而言之,将2
×
103个细胞/孔接种在96孔板中,并在37℃、5%co2条件下培养过夜,如上所述处理细胞。然后将10μl的cck8试剂和100μl新鲜培养基的混合物加入每个孔中,在 37℃下放置1小时。通过酶标仪(bio-rad,美国)在450nm处测量每个孔的光密度(od) 值。
29.(4)细胞增殖试验
30.通过5-ethynyl-2'-deoxyuridine(edu)(beyotime,中国)评估细胞增殖。将5
×
105个细胞/孔接种在12孔板中,并在37℃、5%co2条件下培养。根据制造商的说明,将npmscs 与edu孵育2小时,用4%多聚甲醛固定10分钟,用0.5%tritonx-100透化15分钟,并用click reaction mixture孵育30分钟。用pbs洗涤后,细胞在避光条件下hoechst 33342复染 10分钟。最后,在荧光显微镜下观察细胞并通过imagej软件(nih,美国)进行分析。
31.(5)衰老相关β-半乳糖苷酶(sa-β-gal)染色
32.npmscs以4
×
105个细胞/孔的密度在37℃、5%co2条件下接种在6孔板中。按照 sa-β-gal染色试剂盒(beyotime,中国)提供的说明进行sa-β-gal染色。将细胞用sa-β-gal 固定液在室温下固定15分钟,然后用sa-β-gal工作液在37℃无co2条件下孵育过夜。显微镜下观察细胞,imagej软件分析。
33.(6)活性氧(ros)
34.根据ros检测荧光探针-dhe试剂盒(keygen,中国)提供的制造商说明,将npmscs 与20μm的dhe在37℃下孵育30分钟,然后在荧光显微镜下观察细胞并通过imagej软件进行
ii型胶原蛋白(abclonal,中国)和aggrecan(abclonal,中国)。然后在室温下与1:200稀释的fitc或cy3标记的二抗在黑暗中孵育1小时。使用荧光显微镜和imagej软件对切片进行观察和分析。
47.(13)统计分析
48.所有数据均由prism8(graphpad,lajolla)分析。数据表示为平均值
±
标准差。t检验或方差分析(anova)用于分析两组或多个独立组的数据。kruskal-wallish检验用于分析组织学评分。p《0.05表示差异有统计学意义。
49.2.实验结果
50.(1)npmscs的特征
51.从大鼠ivd中成功分离和培养了延长的纺锤形npmsc(图1a)。根据免疫荧光染色分析,msc相关标记物cd73、cd90和cd105的荧光表达较高,而cd34和cd45的荧光表达较低(图1b)。同时,椎间盘np祖细胞标记tie2也表现出高荧光表达(图1b)。这些结果表明,从ivd中分离出的npmscs符合isct描述的干细胞标准。
52.(2)槲皮素对npmscs活力和增殖的影响
53.采用cck-8法评估槲皮素和tbhp对npmscs生存能力的影响。如图2a所示,槲皮素在高达20μm的浓度下持续24小时没有明显的细胞毒性作用。因此,在以下实验中选择了20μm的浓度。tbhp处理后,细胞活力以剂量依赖性的方式降低(图2b),然后接受100μm tbhp进行以下实验。edu染色检测槲皮素对npmscs增殖的影响。与对照组相比,tbhp 组edu的阳性率显著降低(p《0.05),槲皮素+tbhp组的edu阳性率部分升高(p《0.05)(图 2c-d)
54.(3)槲皮素对npmscs中sa-β-gal染色和细胞周期的影响
55.sa-β-gal的积累是细胞衰老的标志之一,sa-β-gal试剂盒将衰老细胞染成蓝色。如图3a所示,tbhp组衰老npmscs sa-β-gal阳性率显著高于对照组(p《0.05),而槲皮素 +tbhp组sa-β-cal阳性细胞减少。tbhp组npmscs g2/m期细胞周期阻滞百分比高于对照组,而槲皮素可降低npmscs g1/m相阻滞百分比(图3b)。
56.(4)槲皮素对对npmscs基质金属蛋白酶和活性氧生成的影响
57.当金属蛋白酶较高时,jc-1以聚合物j聚集体的形式存在于线粒体中,并产生红色荧光。当金属蛋白酶较低时,jc-1从线粒体基质中释放出来,以单体形式存在于细胞质中,产生绿色荧光,红光强度减弱。如图4a-b所示,tbhp治疗降低了金属蛋白酶水平,而槲皮素预处理部分逆转了这种作用。图4c-d显示tbhp组的npmscs显示出比对照组更高的ros 水平,槲皮素预治疗部分逆转了tbhp对ros生成的影响。
58.(5)槲皮素抑制氧化应激诱导的npmscs衰老
59.细胞衰老的广泛特征是细胞周期停滞和sasp的产生。为了探讨槲皮素在tbhp诱导的npmscs中的作用,采用免疫荧光染色和western blot检测sirt1、细胞衰老相关蛋白(p16、 p21和p53)和sasp(il-1β、il-6和mmp-13)的表达。western blot和免疫荧光染色显示, tbhp治疗下调了sirt1的表达,que预处理部分逆转了这种影响(p《0.05)(图5a和5i)。同时,槲皮素治疗显著降低tbhp诱导的p16、p21、p53、il-1β、il-6和mmp-13的上调表达(p《0.05)(图5和6)。综上所述,这些结果表明que可能在tbhp诱导的npmscs氧化应激损伤中起保护作用。
60.(6)槲皮素通过mir-34a-5p/sirt1途径调控tbhp诱导的npmscs衰老
61.为了探讨mir-34a-5p/sirt1与槲皮素处理的npmscs氧化应激诱导衰老之间的关系,使用mir-34a-5p模拟物和si-sirt1研究mir-34a-5p过度表达和sirt1敲低是否可以抵消槲皮素对衰老相关蛋白(p16、p21和p53)、sasp(il-1β、il-6和mmp-13)及sirt1表达的影响。如图7所示,槲皮素可以抑制衰老相关蛋白和sasp的表达,并促进sirt1的表达,而过度表达mir-34a-5p和敲低sirt1则削弱了tbhp对npmsc的作用。这些结果表明,槲皮素可能通过mir-34a-5p/sirt1途径保护npmscs免受tbhp诱导的衰老。
62.(7)槲皮素改善大鼠椎间盘退变模型
63.建立穿刺诱导大鼠模型,研究槲皮素在体内对idd的影响,并在穿刺后0周和4周通过x射线图像测量椎间盘高度(图8b)。与对照组相比,idd组的dhi显著降低(图8c-d)。有趣的是,槲皮素组的dhi显著高于idd组(p《0.05)(图8c-d)。免疫荧光还用于评估椎间盘组织中ii型胶原和聚集蛋白聚糖的表达。idd组ii型胶原和聚集蛋白聚糖的表达显著低于对照组,而与idd组相比,槲皮素治疗可以显著减弱ii型胶原及聚集蛋白聚糖含量的降低 (图8e-g)。h&e染色显示np组织占据了椎间盘的大部分空间,np细胞在基质中分布良好。纤维环(af)在静止空间组织良好。相反,idd组的np组织几乎消失,np和af之间的边界严重破坏(图8h)。然而,槲皮素治疗减轻了np和af的变性和形态学变化(图8h)。idd 组的组织学评分显著高于对照组(p《0.05)(图8i)。综上所述,槲皮素可以减轻穿刺诱导大鼠idd过程。
64.以上对本发明的一个实施例进行了详细说明,但以上所述仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。因此,依本发明权利要求所作的等同变化与改进等,仍属本发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1