KLF7基因在制备逆转细胞衰老的药物中的应用的制作方法
klf7基因在制备逆转细胞衰老的药物中的应用
技术领域
1.本发明涉及生物医药技术领域,具体涉及klf7基因在制备逆转细胞衰老的药物中的应用。
技术背景
2.随着现代社会人们寿命的延长,人们罹患与年龄相关疾病的风险也随之增加。事实上,数据显示,心脏病、癌症和神经退行性疾病的最大危险因素就是年龄,而阻止或逆转衰老的关键在于细胞重编程。“山中因子”(yamanakafactors),即oct4、sox2、klf4、c-myc四种转录因子,通过病毒载体导入成熟体细胞后,可将体细胞转化为诱导多能干细胞。因其发现者为山中伸弥而得名,山中伸弥也因“发现四个转录因子具有细胞重编程能力”被授予2012年的诺贝尔生理学或医学奖。在2016年,首次报告称,可以使用山中因子逆转患有过早衰老疾病小鼠的衰老迹象,并改善心脏和大脑中的组织功能。此外,他们还发现,即使在年幼小鼠身上,山中因子也可以加速肌肉再生。然而,山中因子对生理衰老野生型小鼠的作用尚不清楚。除了山中因子,探索其他因子或者蛋白是否也能产生相似或者更强大的能够逆转衰老的效果,具有极大的社会与经济效应。
3.大部分细胞在体外或体内复制的代数有限,在复制一定代数或受到环境氧化因子,促衰老因子等的作用下会出现细胞衰老现象,在体外影响细胞传代、代谢,在体内影响组织修复、更新,并随年龄增长表现为个体水平的衰老并出现诸多老龄疾病。延缓衰老的小分子药物包括二甲双胍、nmn、尿苷等,但作用机制不明。
4.目前也有少数针对衰老相关因子通过驱动表观遗传重编程改变细胞状态的文献报道,例如,专利申请cn112154210a公开了一种用于逆转细胞老化的瞬时细胞重编程方法,包括用编码一种或多种细胞重编程因子的一种或多种非整合型信使rna来转染细胞不超过五个连续日,从而产生更生的细胞;其更生的细胞的转录组谱与年轻细胞的转录组谱更相似,包括选自rpl37、rhoa、srsf3、ephb4、arhgap18、rpl31、fkbp2、map1lc3b2、elf1、phf8、pol2s2、taf1和sin3a的一种或多种基因的表达增加。但是重编程方法操作复杂,可重复性差,不利用规模化应用。
5.现有研究大多关注于klf7在治疗某些实际病症中的机制/机理等,例如《klf7对创伤性脑损伤海马神经元细胞模型凋亡和增殖的影响》揭示了klf7可抑制tbi损伤海马神经元的凋亡,其机制可能与调控jak2/stat3信号通路有关;《klf7在ffas促进前列腺癌发生发展过程中的作用及分子机制研究》揭示了klf7高表达与肥胖相关pca发生发展密切相关及il-6、p21可能是klf7的下游靶基因,klf7可通过上调il-6表达,下调p21表达,促进pca细胞的生物学行为;《klf7在冠心病心外膜脂肪组织巨噬细胞炎症反应中的作用及初步机制研究》揭示了cad患者eat中klf7表达增加以及klf7通过调控nf-κb炎症信号通路来介导eat中炎症因子的释放。
6.目前,并未发现klf7与细胞衰老相关以及逆转细胞衰老用途的文献报道。
技术实现要素:
7.针对上述存在的技术局限性,本发明首次发现了klf7基因与细胞衰老相关,过表达该基因能够逆转细胞衰老,进而治疗衰老相关疾病,这是现有技术从未报道过的;基于此发现,本发明提出了klf7基因在制备逆转细胞衰老的药物中的应用,克服了
背景技术:
中提到的不足和缺陷。
8.为实现上述目的,本发明采用了以下技术方案:
9.本发明的发明点是提供了klf7基因在制备逆转细胞衰老的药物中的应用。
10.可选地,上述的应用,所述klf7基因的核苷酸序列如seq id no.1所示,所述klf7基因编码蛋白质的氨基酸序列如seq id no.2所示。
11.klf7基因的核苷酸序列seq id no.1为:
12.atggacgtgttggctagttatagtatattccaggagctacaacttgtccacgacaccggctacttctcagctttaccatccctggaggagacctggcagcagacatgccttgaattggaacgctacctacagacggagccccggaggatctcagagacctttggtgaggacttggactgtttcctccacgcttcccctcccccgtgcattgaggaaagcttccgtcgcttagaccccctgctgctccccgtggaagcggccatctgtgagaagagctcggcagtggacatcttgctctctcgggacaagttgctatctgagacctgcctcagcctccagccggccagctcttctctagacagctacacagccgtcaaccaggcccagctcaacgcagtgacctcattaacgcccccatcgtcccctgagctcagccgccatctggtcaaaacctcacaaactctctctgccgtggatggcacggtgacgttgaaactggtggccaagaaggctgctctcagctccgtaaaggtgggaggggtcgcaacagctgcagcagccgtgacggctgcgggggccgttaagagtggacagagcgacagtgaccaaggagggctaggggctgaagcatgtcccgaaaacaagaagagggttcaccgctgtcagtttaacgggtgccggaaagtttatacaaaaagctcccacttaaaggcccaccagaggactcacacaggtgagaagccttataagtgctcatgggagggatgtgagtggcgttttgcacgaagcgatgagctcacgaggcactacaggaaacacacaggtgcaaagcccttcaaatgcaaccactgcgacaggtgtttttccaggtctgaccatcttgccctccacatgaagagacatatcggatccggc。
13.klf7基因编码的蛋白质的氨基酸序列seq id no.2为:
14.mdvlasysifqelqlvhdtgyfsalpsleetwqqtclelerylqteprrisetfgedldcflhaspppcieesfrrldplllpveaaicekssavdillsrdkllsetclslqpasssldsytavnqaqlnavtsltppsspelsrhlvktsqtlsavdgtvtlklvakkaalssvkvggvataaaavtaagavksgqsdsdqgglgaeacpenkkrvhrcqfngcrkvytksshlkahqrthtgekpykcswegcewrfarsdeltrhyrkhtgakpfkcnhcdrcfsrsdhlalhmkrhi。
15.可选地,上述的应用,所述细胞包括人脐带静脉内皮细胞、人神经母细胞瘤细胞、成纤维细胞、间充质干细胞。
16.可预期地,本发明制备的过表达klf7基因的表达载体还可用于制备治疗细胞衰老引起的相关疾病。
17.细胞衰老引起的相关疾病包括有动脉粥样硬化、心血管疾病、恶病质、关节炎、白内障、骨质疏松症、糖尿病视网膜病变、高血压、神经退行性变性疾病、中风/脑卒中、萎缩性胃炎、躯干前驱症、慢性阻塞性肺疾病、冠状动脉疾病、多巴胺失调综合征、代谢综合征、桥本甲状腺炎、心力衰竭、老年抑郁症、心肌梗死、急性冠脉综合征、肌肉减少症、肌肉减少性肥胖、老年骨质疏松症、尿失禁、自然衰老。
18.细胞衰老引起的相关疾病优选为白内障、糖尿病视网膜病变、自然衰老。
19.可选地,上述的应用,所述应用是将klf7基因插入至骨架载体中构建过表达klf7基因的表达载体;然后用腺相关病毒包装所述过表达klf7基因的表达载体,获得过表达klf7基因的腺相关病毒;最后将所述过表达klf7基因的腺相关病毒转染上述的细胞或直接注射于人或动物体内。
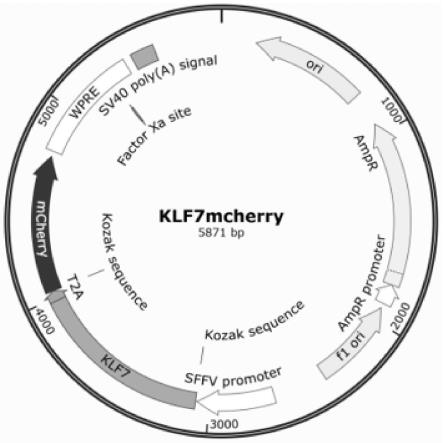
20.可选地,上述的应用,所述骨架载体为psffv-t2a-mcherry质粒载体。
21.可选地,上述的应用,所述过表达klf7基因的表达载体的构建方法为,将klf7基因序列采用同源重组的方法插入至骨架载体psffv-t2a-mcherry质粒的psffv和t2a之间,构建得到过表达载体psffv-klf7-t2a-mcherry质粒。
22.可选地,上述的应用,所述腺相关病毒为aav2/2血清型aav载体或aav2/9血清型aav载体。
23.可选地,上述的应用,所述逆转细胞衰老表现在降低细胞中β-半乳糖苷酶染色阳性的比例。
24.与现有技术相对比,本发明具有以下优点:
25.本发明首次发现klf7基因与细胞衰老相关,并提供了klf7基因在制备逆转细胞衰老的药物中的应用,过表达klf7基因的表达载体能够有效逆转机体体内关键细胞的衰老,通过实验证实过表达klf7基因确实能够逆转细胞衰老,进一步实现了针对由于机体衰老所引起的多种疾病的有效治疗,且效果良好,细胞实验也证明了其有效提高了未衰老细胞的比例。
附图说明
26.图1为psffv-klf7-t2a-mcherry的质粒载体结构。
27.图2为转入klf7基因的huvec细胞和对照组细胞染色后在光学显微镜下的形态,显示电转klf7能够有效逆转huvec细胞衰老。
28.图3为klf7转入人神经母细胞瘤细胞sh-sy5y后检测得到的未衰老细胞比例及对照。
29.图4为电转klf7基因逆转成纤维细胞衰老的结果示意图。
30.图5显示为电转klf7基因逆转间充质干细胞衰老的结果示意图。
具体实施方式
31.为使本发明的目的、技术方案和优点更加清楚明了,下面对本发明进行进一步详细说明。但是应该理解,此处所描述仅仅用以解释本发明,并不用于限制本发明的范围。
32.除非另有定义,本文所使用的所有的技术术语和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同,本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在限制本发明。本文中所使用的试剂和仪器均商购可得,所涉及的表征手段均可参阅现有技术中的相关描述,本文中不再赘述。
33.为了进一步了解本发明,下面结合最佳实施例对本发明作进一步的详细说明。实施例1
34.klf7基因在制备逆转细胞衰老的药物中的应用。
35.klf7基因的核苷酸序列如seq id no.1所示,klf7基因编码蛋白质的氨基酸序列
如seq id no.2所示。
36.klf7基因的核苷酸序列seq id no.1为:
37.atggacgtgttggctagttatagtatattccaggagctacaacttgtccacgacaccggctacttctcagctttaccatccctggaggagacctggcagcagacatgccttgaattggaacgctacctacagacggagccccggaggatctcagagacctttggtgaggacttggactgtttcctccacgcttcccctcccccgtgcattgaggaaagcttccgtcgcttagaccccctgctgctccccgtggaagcggccatctgtgagaagagctcggcagtggacatcttgctctctcgggacaagttgctatctgagacctgcctcagcctccagccggccagctcttctctagacagctacacagccgtcaaccaggcccagctcaacgcagtgacctcattaacgcccccatcgtcccctgagctcagccgccatctggtcaaaacctcacaaactctctctgccgtggatggcacggtgacgttgaaactggtggccaagaaggctgctctcagctccgtaaaggtgggaggggtcgcaacagctgcagcagccgtgacggctgcgggggccgttaagagtggacagagcgacagtgaccaaggagggctaggggctgaagcatgtcccgaaaacaagaagagggttcaccgctgtcagtttaacgggtgccggaaagtttatacaaaaagctcccacttaaaggcccaccagaggactcacacaggtgagaagccttataagtgctcatgggagggatgtgagtggcgttttgcacgaagcgatgagctcacgaggcactacaggaaacacacaggtgcaaagcccttcaaatgcaaccactgcgacaggtgtttttccaggtctgaccatcttgccctccacatgaagagacatatcggatccggc。
38.klf7基因编码的蛋白质的氨基酸序列seq id no.2为:
39.mdvlasysifqelqlvhdtgyfsalpsleetwqqtclelerylqteprrisetfgedldcflhaspppcieesfrrldplllpveaaicekssavdillsrdkllsetclslqpasssldsytavnqaqlnavtsltppsspelsrhlvktsqtlsavdgtvtlklvakkaalssvkvggvataaaavtaagavksgqsdsdqgglgaeacpenkkrvhrcqfngcrkvytksshlkahqrthtgekpykcswegcewrfarsdeltrhyrkhtgakpfkcnhcdrcfsrsdhlalhmkrhi。
40.细胞包括人脐带静脉内皮细胞、人神经母细胞瘤细胞、成纤维细胞、间充质干细胞。
41.细胞衰老引起的相关疾病包括有动脉粥样硬化、心血管疾病、恶病质、关节炎、白内障、骨质疏松症、糖尿病视网膜病变、高血压、神经退行性变性疾病、中风/脑卒中、萎缩性胃炎、躯干前驱症、慢性阻塞性肺疾病、冠状动脉疾病、多巴胺失调综合征、代谢综合征、桥本甲状腺炎、心力衰竭、老年抑郁症、心肌梗死、急性冠脉综合征、肌肉减少症、肌肉减少性肥胖、老年骨质疏松症、尿失禁、自然衰老。
42.细胞衰老引起的相关疾病优选为白内障、糖尿病视网膜病变、自然衰老。
43.应用是将klf7基因插入至骨架载体中构建过表达klf7基因的表达载体;然后用腺相关病毒包装过表达klf7基因的表达载体,获得过表达klf7基因的腺相关病毒;最后将过表达klf7基因的腺相关病毒转染上述的细胞或直接注射于人或动物体内。
44.骨架载体为psffv-t2a-mcherry质粒载体。
45.过表达klf7基因的表达载体的构建方法为,将klf7基因序列采用同源重组的方法插入至骨架载体psffv-t2a-mcherry质粒的psffv和t2a之间,构建得到过表达载体psffv-klf7-t2a-mcherry质粒。
46.腺相关病毒为aav2/2血清型aav载体或aav2/9血清型aav载体。
47.逆转细胞衰老表现在降低细胞中β-半乳糖苷酶染色阳性的比例。实施例2
48.载体构建:
49.1、以psffv-osk-t2a-mcherry质粒为基因表达的骨架载体;
50.2、基因合成基因序列,将klf7等基因序列用同源重组的方法插入psffv-t2a-mcherry质粒的psffv和t2a之间,载体命名为psffv-klf7-t2a-mcherry。
51.psffv-klf7-t2a-mcherry的质粒载体结构如图1所示。实施例3
52.一、腺相关病毒包装:
53.1、细胞接种:
54.t175 flasks接种2
×
107个293ft细胞。加30ml含10%fbs的dmem培养基,37℃,5%co2培养箱过夜培养,16-24h后转染。
55.2、细胞转染:
56.细胞生长的交汇度达到80-90%,准备转染。转染体系如下表1所示。
57.表1
58.a液和b液分别混合后,室温静置5min。接着b液逐滴加入a液中,边加边摇匀,室温22-26℃静置20min。逐滴加到培养皿中,轻轻摇匀,5% co2,37℃过夜培养。
59.3、转染换液:
60.16-18h后,去掉含转染试剂的培养基,加入30ml含10%fbs的dmem,5%co2、37℃条件下继续培养。
61.4、病毒第一次收获:
62.从转染开始算48h后,收获细胞上清,转移到50ml离心管中,上清用0.45μm滤膜过滤,4℃保存。细胞加入30ml含10%fbs的dmem,5% co2、37℃条件下继续培养。
63.5、病毒第二次收获:
64.收获细胞上清,转移到50ml离心管中,上清用0.45μm滤膜过滤,4℃保存。细胞用10%消毒液(84消毒液)处理后丢弃。
65.6、病毒浓缩:
66.将收集到的腺相关病毒组分用0.45μm滤器过滤去除细菌污染,将过滤后组分与peg8000按照体积比3:1混合,轻轻颠倒混匀。
67.7、4℃孵育30min或过夜。
68.8、4℃,1500g离心45min,离心后会在管底看到白色沉淀。
69.9、小心吸去上清液,不能破坏白色沉淀。
70.10、用适当体积腺相关病毒保存液重悬沉淀,对病毒进行qpcr检测测定病毒滴度并将所获取的腺相关病毒分别分装、保存于-80℃。
71.二、病毒滴度测定:
72.对腺相关病毒进行qpcr检测测定病毒滴度:
73.1.将待测定病毒的标准质粒10倍梯度稀释,选10
11
~107copies/μl作为实验标准曲线建立的标准品。
74.2、按照top green qpcr supermix说明书及荧光定量pcr仪反应体系要求配置qpcr反应的试剂,反应体系如下表2所示。
75.表2成分体积正向引物(10μm)1μl反向引物(10μm)1μl2
×
transstar top/tip green qpcr supermix10μl无核酸酶水7μldna1μl总体积20μl
76.正向引物序列为ggagttgtggcccgttgt;
77.反向引物序列为gagcccctgtccagcagc。
78.3、将反应混合液取19μl/孔(20μl体系)分装至8联管中,依次在孔中加入1μl/孔反应标准品及待检样品。
79.4、将加入反应液的8联管瞬离,轻微震荡混匀,瞬离后放入96system仪中,设定反应程序,运行。反应程序如表3所示。
80.表3
81.5、反应程序结束后,取出检测8联管丢弃,拷出数据进行保存分析。
82.三、实验结果:
83.将klf7转入腺相关病毒后,aav2/2-klf7病毒滴度为1.3
×
10
12
。实施例4
84.huvec细胞培养及电转化:
85.1、实验材料:
86.具体如表4所示。
87.表4名称公司货号内皮细胞培养基sciencellbncc342473
人脐带静脉内皮细胞huvecsciencell#8000neon
tm
转染系统起始套装thermo fishermpk5000sdpbs(无钙镁)gibco23800050.25%胰酶cytivaj210027细胞衰老β-半乳糖苷酶染色试剂盒碧云天c0602
88.2、实验方法:
89.(1)huvec细胞复苏:
90.1)从液氮罐中取出1支冻存管,立即在37℃水中不断摇晃,使冻结的细胞悬液彻底融化。
91.2)冻存管中的细胞一旦彻底融化(液态),立即将其从热水桶中取出,75%的酒精彻底消毒冻存管表面,放入超净工作台内。冻存管即将融化时,将含有已预热至37℃内皮培养基的离心管经酒精消毒后,放置于超净工作台内。
92.3)严格无菌操作条件下将冻存管中的细胞悬液取出,加入预热e8培养基15ml离心管内,轻轻吹打2-3次,1300rpm,5min离心,离心结束后弃上清。
93.4)加入内皮培养基,轻轻吹打2-3次,将细胞转移至细胞培养瓶中,加入培养液。将培养瓶放置于co2培养箱中培养。
94.(2)huvec消化传代:
95.1)从培养箱取出待传代的孔板/培养瓶,吸弃上清,dpbs洗一次。
96.2)加胰蛋白酶,铺满瓶底后,吸弃胰蛋白酶,置于培养箱孵育4-5min,期间可镜下观察,细胞收缩变圆且分散开即可。
97.3)轻轻拍打培养瓶/板,使细胞脱壁,然后用枪头轻轻吹打几次,最后加入内皮培养基终止消化,将细胞吹打脱落后转移至新培养瓶,加入内皮培养基,置于37℃,5% co2培养箱培养。
98.4)每三天均进行换液操作,待细胞汇合度约70%-80%时,进行传代。
99.(3)huvec细胞电转化:
100.使用第6代huvec细胞,20万细胞1μg质粒。
101.电转条件:电压:1350v,脉冲时间:30ms,脉冲数:1;
102.电转后3天一换液,9天后进行衰老细胞统计。
103.(4)衰老细胞染色:
104.使用β-半乳糖苷酶染色试剂盒对huvec细胞进行染色。
105.a、对于24孔板中培养的细胞,吸除细胞培养液,用dpbs洗涤1次,加入0.5毫升β-半乳糖苷酶染色固定液,室温固定15分钟。对于其它类型的培养板,固定液及后续溶液的用量参照此比例进行操作。
106.b、吸除细胞固定液,用dpbs洗涤细胞3次,每次3分钟。
107.c、吸除pbs或hbss,每孔加入1毫升染色工作液。染色工作液的配制方法如表5所示。
108.表5染色工作液组分用量体积β-半乳糖苷酶染色液a10μl
β-半乳糖苷酶染色液b10μlβ-半乳糖苷酶染色液c930μlβ-半乳糖苷酶显色底物x-gal溶液50μl总计1000μl(1ml)
109.d、37℃孵育过夜,可以用parafilm或保鲜膜封住6孔板防止蒸发。37℃孵育不能在二氧化碳培养箱中进行。
110.e、普通光学显微镜下观察。
111.3、实验结果:
112.β-半乳糖苷酶染色结果如图2所示,衰老细胞呈现蓝色,转入klf7基因的huvec细胞中衰老细胞比例明显少于对照组huvec细胞。说明转入klf7基因能够延缓huvec细胞的衰老。实施例5
113.sh-sy5y(人神经母细胞瘤细胞)衰老细胞活体标记及流式分析:
114.1、实验材料:
115.具体如表6所示。
116.表6
名称公司货号mem培养基invitrogen11090081f12培养基invitrogen11765054胎牛血清fbsgibco—gluta-max添加剂invitrogen35050061丙酮酸钠invitrogen11360070非必需氨基酸neaainvitrogen11140050sh-sy5y中国科学院典型培养物保藏委员会细胞库/干细胞库scsp-5014c12fdg活性染料abcam138777-25-0二甲基亚砜dmsosigmad2650巴佛洛霉素a1abcam88899-55-2dpbs缓冲液(无钙镁)gibco2380005
117.2、实验方法:
118.sh-sy5y培养基配方(100ml):mem培养基43.5ml,f12培养基43.5ml,胎牛血清fbs 10ml,gluta-max添加剂1ml,丙酮酸钠1ml,非必需氨基酸1ml。
119.(1)诱导sh-sy5y衰老:用150μm h2o2处理sh-sy5y 2h后更换正常培养基培养24h;
120.(2)用100μm巴佛洛霉素(bafilomycin)处理细胞1h,抑制溶酶体中β-半乳糖苷酶活性,再加β-半乳糖苷酶的活性荧光底物染料于sh-sy5y培养基中,37度培养2h,用dpbs洗两遍,用胰酶消化收集细胞,进行流式细胞分析。从平均荧光强度及染色降低细胞比例比较过表达基因对逆转衰老效果。
121.3、实验结果:
122.如图3所示,将klf7转入sh-sy5y后,未衰老细胞比例为41.7%,明显高于对照组的18.6%和转入tp53基因sh-sy5y的17.5%,也高于同时转入tp53和klf7基因的sh-sy5y的31.3%。表明至少在sh-sy5y上,klf7基因的过表达可以延缓细胞衰老,维持年轻状态。
实施例6
123.成纤维细胞培养及电转化:
124.1、实验材料:
125.具体如表7所示。
126.表7名称公司货号dmem高糖培养基gibco12100-046fetal bovine serum胎牛血清cellmasa211.02neon
tm
转染系统起始套装thermo fishermpk5000sdpbs(无钙镁)gibco23800050.25%胰酶cytivaj210027细胞衰老β-半乳糖苷酶染色试剂盒碧云天c0602
127.2、实验方法:
128.(1)成纤维细胞复苏:
129.1)从液氮罐中取出1支冻存管,立即在37℃水中不断摇晃,使冻结的细胞悬液彻底融化。
130.2)冻存管中的细胞一旦彻底融化(液态),立即将其从热水桶中取出,75%的酒精彻底消毒冻存管表面,放入超净工作台内。冻存管即将融化时,将含有已预热至37℃内皮培养基的离心管经酒精消毒后,放置于超净工作台内。
131.3)严格无菌操作条件下将冻存管中的细胞悬液取出,加入预热e8培养基15ml离心管内,轻轻吹打2~3次,1300rpm,5min离心,离心结束后弃上清。
132.4)加入内皮培养基,轻轻吹打2~3次,将细胞转移至细胞培养瓶中,加入培养液。将培养瓶放置于co2培养箱中培养。
133.(2)成纤维细胞消化传代:
134.1)从培养箱取出待传代的孔板/培养瓶,吸弃上清,dpbs洗一次。
135.2)加胰蛋白酶,铺满瓶底后,吸弃胰蛋白酶,置于培养箱孵育4-5min,期间可镜下观察,细胞收缩变圆且分散开即可。
136.3)轻轻拍打培养瓶/板,使细胞脱壁,然后用枪头轻轻吹打几次,最后加入内皮培养基终止消化,将细胞吹打脱落后转移至新培养瓶,加入内皮培养基,置于37℃,5% co2培养箱培养。
137.4)每三天均进行换液操作,待细胞汇合度约70%~80%时,进行传代。
138.(3)成纤维细胞电转化:
139.使用第24代细胞,20万细胞1μg质粒。
140.电转条件:电压:1350v,脉冲时间:30ms,脉冲数:1,电转后3天一换液,9天后进行衰老细胞统计。
141.(4)衰老细胞染色:
142.使用β-半乳糖苷酶染色试剂盒对成纤维细胞进行染色。
143.a、对于24孔板中培养的细胞,吸除细胞培养液,用dpbs洗涤1次,加入0.5毫升β-半乳糖苷酶染色固定液,室温固定15分钟。对于其它类型的培养板,固定液及后续溶液的用量
参照此比例进行操作。
144.b、吸除细胞固定液,用dpbs洗涤细胞3次,每次3分钟。
145.c、吸除pbs或hbss,每孔加入1毫升染色工作液。染色工作液的配制方法如实施例4表5所示。
146.d、37℃孵育过夜,可以用parafilm或保鲜膜封住6孔板防止蒸发。注意:37℃孵育不能在二氧化碳培养箱中进行。
147.e、普通光学显微镜下观察。
148.3、实验结果:
149.β-半乳糖苷酶染色结果如图4所示,衰老细胞呈现蓝色,转入klf7基因的成纤维细胞中未衰老细胞的比例明显多于对照组成纤维细胞。说明转入klf7基因能够延缓成纤维细胞的衰老。实施例7
150.间充质干细胞培养及电转化:
151.1、实验材料:
152.具体如表8所示。
153.表8
154.2、实验方法:
155.(1)间充质干细胞复苏:
156.1)从液氮罐中取出1支冻存管,立即在37℃水中不断摇晃,使冻结的细胞悬液彻底融化。
157.2)冻存管中的细胞一旦彻底融化(液态),立即将其从热水桶中取出,75%的酒精彻底消毒冻存管表面,放入超净工作台内。冻存管即将融化时,将含有已预热至37℃内皮培养基的离心管经酒精消毒后,放置于超净工作台内。
158.3)严格无菌操作条件下将冻存管中的细胞悬液取出,加入预热e8培养基15ml离心管内,轻轻吹打2~3次,1300rpm,5min离心,离心结束后弃上清。
159.4)加入内皮培养基,轻轻吹打2~3次,将细胞转移至细胞培养瓶中,加入培养液。将培养瓶放置于co2培养箱中培养。
160.(2)间充质干细胞消化传代:
161.1)从培养箱取出待传代的孔板/培养瓶,吸弃上清,dpbs洗一次。
162.2)加胰蛋白酶,铺满瓶底后,吸弃胰蛋白酶,置于培养箱孵育4-5min,期间可镜下观察,细胞收缩变圆且分散开即可。
163.3)轻轻拍打培养瓶/板,使细胞脱壁,然后用枪头轻轻吹打几次,最后加入内皮培养基终止消化,将细胞吹打脱落后转移至新培养瓶,加入内皮培养基,置于37℃,5% co2培养箱培养。
164.4)每三天均进行换液操作,待细胞汇合度约70%~80%时,进行传代。
165.(3)间充质干细胞电转化:
166.使用第3代细胞,20万细胞1μg质粒。
167.电转条件:电压:1350v,脉冲时间:30ms,脉冲数:1,电转后3天一换液,9天后进行衰老细胞统计。
168.(4)诱导msc衰老:
169.用600nm阿霉素处理msc 2天。
170.(5)衰老细胞染色:
171.使用β-半乳糖苷酶染色试剂盒对间充质干细胞进行染色。
172.a、对于24孔板中培养的细胞,吸除细胞培养液,用dpbs洗涤1次,加入0.5毫升β-半乳糖苷酶染色固定液,室温固定15分钟。对于其它类型的培养板,固定液及后续溶液的用量参照此比例进行操作。
173.b、吸除细胞固定液,用dpbs洗涤细胞3次,每次3分钟。
174.c、吸除pbs或hbss,每孔加入1毫升染色工作液。染色工作液的配制方法如实施例4表5所示。
175.d、37℃孵育过夜,可以用parafilm或保鲜膜封住6孔板防止蒸发,其中,37℃孵育不能在二氧化碳培养箱中进行。
176.e、普通光学显微镜下观察。
177.3、实验结果:
178.β-半乳糖苷酶染色结果如图5所示,衰老细胞呈现蓝色,转入klf7基因的间充质干细胞中未衰老细胞的比例明显多于对照组间充质干细胞。说明转入klf7基因能够延缓间充质干细胞的衰老。实施例8
179.间充质干细胞衰老细胞活体标记及流式分析:
180.1、实验材料
181.具体如表9所示。
182.表9名称公司货号α-mem培养基hyclonesh30265.01z41hpcplcrl05f5427c12fdg活性染料abcam138777-25-0dmsosigmad2650
bafilomycin a1abcam88899-55-2dpbs(无钙镁)gibco2380005
183.2、实验方法:
184.用100μm bafilomycin处理细胞1h,抑制溶酶体中β-半乳糖苷酶活性,再加β-半乳糖苷酶的活性荧光底物染料于α-mem培养基中,37℃培养2h,用dpbs洗两遍,用胰酶消化收集细胞,进行流式细胞分析。从平均荧光强度及染色降低细胞比例比较过表达基因对逆转衰老效果。
185.3、实验结果:
186.将klf7转入间充质干细胞后,未衰老细胞比例为19.3%,明显高于对照组的12.4%。说明转入klf7基因能够延缓间充质干细胞的衰老。
187.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1