RS3型抗性淀粉基结肠靶向递送载体及其制法与应用
rs3型抗性淀粉基结肠靶向递送载体及其制法与应用
技术领域
1.本发明属于生物医药材料技术领域,具体涉及一种rs3型抗性淀粉基结肠靶向递送载体及其制法与应用。
背景技术:
2.生物活性物质的递送载体易在小肠中被降解,难以到达结肠部位,因此需要构建具有消化稳定性的结肠靶向递送载体,淀粉是一种良好的天然材料,可以开发用于结肠靶向递送的载体。淀粉是由直链淀粉和支链淀粉构成的生物聚合物,以颗粒形式存在。直链淀粉是由d-葡萄糖通过α-(1-4)-糖苷键连接形成的线性大分子,支链淀粉是一种含支链的分子,在由(1-6)糖苷键连接的支链中带有(1-4)键连接的α-d-葡萄糖。糊化后的淀粉易发生回生,且直链淀粉更易于回生,在一定浓度下可以生成回生淀粉颗粒。此外,直链淀粉在酶的作用下可以生成环糊精,其具有内疏水外亲水的结构,可以作为疏水性生物活性物质良好的包封及递送载体,环糊精分为α、β、γ-环糊精,其中γ-环糊精具有最大的疏水内腔和溶解度,有利于生物活性物质的包封。抗性淀粉是一类不能被健康人体小肠吸收的物质,一般分为五类:物理包埋淀粉(rs1)、未经糊化淀粉颗粒(rs2)、回生淀粉(rs3)、化学改性淀粉(rs4)、淀粉-脂质复合物(rs5),其不仅具有较低的血糖生成指数,还可以在结肠中被微生物酵解,有利于机体健康。
3.透明质酸作为一种天然的生物大分子,具有靶向细胞表面cd44受体的能力;将其接枝到载体的表面可以提高生物活性物质的靶向性,将靶向载体包埋于抗性淀粉基质中可以保护其不受胃和小肠环境的影响,有效提高其在结肠中的靶向效果。
技术实现要素:
4.本发明的主要目的在于提供一种rs3型抗性淀粉基结肠靶向递送载体及其制法与应用,以克服现有技术的不足。
5.为实现前述发明目的,本发明采用的技术方案包括:
6.本发明实施例提供了一种rs3型抗性淀粉基结肠靶向递送载体的制备方法,其包括:
7.使包含将透明质酸、γ-环糊精和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺的混合反应体系反应,制得γ-环糊精-透明质酸;
8.将疏水性生物活性物质包封于所述γ-环糊精-透明质酸中γ-环糊精的疏水空腔内,制得负载生物活性物质的γ-环糊精-透明质酸;
9.采用普鲁兰酶对淀粉进行脱支处理,制得线性糊精;
10.以及,采用回生的方法,将所述负载生物活性物质的γ-环糊精-透明质酸与线性糊精混合反应,制得rs3型抗性淀粉基结肠靶向递送载体。
11.本发明实施例还提供了前述的制备方法制得的rs3型抗性淀粉基结肠靶向递送载体,所述rs3型抗性淀粉基结肠靶向递送载体具有颗粒状结构,所述rs3型抗性淀粉基结肠
靶向递送载体的粒径为2.6~4.2μm。
12.本发明实施例还提供了前述的rs3型抗性淀粉基结肠靶向递送载体在制备结肠靶向递送生物活性物质中的应用。
13.与现有技术相比,本发明的有益效果在于:
14.(1)本发明采用edc介导γ-环糊精的伯羟基与透明质酸的羧基发生特异性酯化反应,利用透明质酸对cd44受体的靶向作用达到靶向递送生物活性物质的作用,且接枝不会破坏γ-环糊精的环状结构,从而制备了rs3型抗性淀粉基结肠靶向递送载体;
15.(2)本发明中采用的线性糊精颗粒,在回生的作用下,自发形成颗粒;回生的抗性糊精可以抵抗在小肠中酶的消化作用,在结肠中被微生物酵解,释放负载生物活性物质的γ-cd-ha,具有被动靶向作用;
16.(3)本发明制备的rs3型抗性淀粉基结肠靶向递送载体对生物活性物质起到良好的保护作用,且具有靶向作用。
附图说明
17.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
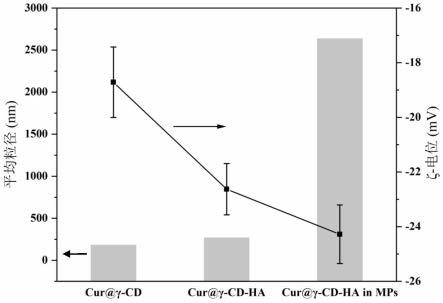
18.图1是本发明实施例1中负载姜黄素的不同载体的粒径及ζ-电位图;
19.图2是本发明实施例1中负载姜黄素的不同载体对姜黄素的包封和负载能力图;
20.图3是本发明实施例1中负载姜黄素的不同载体在模拟消化过程中粒径的变化图;
21.图4是本发明实施例1中在模拟消化过程中姜黄素的累积释放曲线图。
具体实施方式
22.鉴于现有技术的缺陷,本案发明人经长期研究和大量实践,得以提出本发明的技术方案,下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
23.具体的,作为本发明技术方案的一个方面,其所涉及的一种rs3型抗性淀粉基结肠靶向递送载体的制备方法包括:
24.使包含将透明质酸(ha)、γ-环糊精(γ-cd)和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)的混合反应体系反应,制得γ-环糊精-透明质酸γ-cd-ha;
25.将疏水性生物活性物质包封于所述γ-环糊精-透明质酸中γ-环糊精的疏水空腔内,制得负载生物活性物质的γ-环糊精-透明质酸(记为:负载生物活性物质的γ-cd-ha);
26.采用普鲁兰酶对淀粉进行脱支处理,制得线性糊精;
27.以及,采用回生的方法,将所述负载生物活性物质的γ-环糊精-透明质酸与线性糊精混合反应,制得rs3型抗性淀粉基结肠靶向递送载体。
28.具体地,采用1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)介导γ-环糊精(γ-cd)的伯羟基与透明质酸(ha)的羧基发生酯化反应。
29.在一些优选实施方案中,所述制备方法包括:分别将透明质酸、γ-环糊精溶于水,形成透明质酸溶液和γ-环糊精溶液,再将1-乙基-(3-二甲基氨基丙基)碳酰二亚胺加入所述透明质酸溶液中,之后加入所述γ-环糊精溶液混合搅拌形成所述混合反应体系,并于转速为200~800rpm,温度为20-25℃的条件下反应30~60min,制得所述γ-环糊精-透明质酸,制得所述γ-环糊精-透明质酸。
30.进一步地,所述透明质酸溶液中透明质酸的含量为0.5-2.0wt%。
31.进一步地,分别将透明质酸、γ-环糊精溶于水,在3-6℃,300-1000rpm持续搅拌2-5h,制备透明质酸溶液和γ-环糊精溶液。
32.进一步地,将edc加入透明质酸溶液中活化羰基,其添加量为透明质酸质量的0.1-0.2%。
33.进一步地,所述γ-环糊精溶液中γ-环糊精的含量为0.5-2.0wt%。
34.进一步地,所述1-乙基-(3-二甲基氨基丙基)碳酰二亚胺与透明质酸的质量比为0.1-0.2:100。
35.在一些优选实施方案中,所述制备方法包括:将疏水性生物活性物质溶于乙醇中,之后与所述γ-环糊精-透明质酸混合反应,制得所述负载生物活性物质的γ-环糊精-透明质酸。
36.进一步地,所述疏水性生物活性物质包括姜黄素、α-生育酚、白藜芦醇中的任意一种或两种以上的组合,且不限于此。
37.在一些优选实施方案中,所述制备方法包括:
38.将淀粉分散于水中形成淀粉乳,并于90-100℃糊化20-60min,再冷却至45-60℃,之后加入普鲁兰酶于45-60℃酶解8-24h,然后经沸水浴灭酶、浓缩、冻干处理,制得粗糊精;
39.以及,依次采用80vol%的乙醇溶液、60vol%的乙醇溶液、40vol%的乙醇溶液对所述粗糊精进行沉淀分级处理,制得分子量均一的线性糊精。
40.进一步地,所述vol%亦记为(v/v)%。
41.进一步地,所述淀粉乳中淀粉的含量为15-25wt%。
42.进一步地,所述沸水浴灭酶的时间为15-30min。
43.进一步地,所述普鲁兰酶与淀粉的用量比为100u:1g。
44.在一些优选实施方案中,所述制备方法还包括:在所述沉淀分级处理完成后,收集60(v/v)%的乙醇溶液、40(v/v)%的乙醇溶液分级得到的线性糊精并经冷冻干燥处理,制得所述分子量均一的线性糊精。
45.在一些优选实施方案中,所述制备方法包括:将所述负载生物活性物质的γ-环糊精-透明质酸分散于线性糊精溶液中,随后置于2-6℃的环境中储藏12-36h,制得所述rs3型抗性淀粉基结肠靶向递送载体。
46.本发明中采用回生的方法使糊精分子自组装形成颗粒。
47.进一步地,所述线性糊精溶液中线性糊精的含量为10-15wt%。
48.进一步地,所述负载生物活性物质的γ-环糊精-透明质酸与线性糊精的质量比为0.2-1:100。
49.在一些更为具体的实施方案中,所述rs3型抗性淀粉基结肠靶向递送载体的制备方法包括:
50.(1)将透明质酸和γ-环糊精溶解在去离子水中,加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)将透明质酸(ha)共价连接到γ-环糊精(γ-cd)上,进一步将疏水性生物活性物质包封在γ-环糊精的疏水空腔内,构建负载生物活性物质的γ-cd-ha。
51.(2)通过普鲁兰酶对淀粉进行脱支,制得线性糊精;
52.(3)将步骤(1)得到的负载生物活性物质的γ-cd-ha添加到步骤(2)得到的线性糊精溶液中,进一步通过回生的方法制得rs3型抗性淀粉基结肠靶向颗粒(即前述的“rs3型抗性淀粉基结肠靶向递送载体”)。
53.本发明实施例的另一个方面还提供了前述的制备方法制得的rs3型抗性淀粉基结肠靶向递送载体,所述rs3型抗性淀粉基结肠靶向递送载体具有颗粒状结构,所述rs3型抗性淀粉基结肠靶向递送载体的粒径为2.6~4.2μm。
54.进一步地,所述rs3型抗性淀粉基结肠靶向递送载体对生物活性物质起到良好的保护和靶向递送作用。
55.本发明实施例的另一个方面还提供了前述的rs3型抗性淀粉基结肠靶向递送载体在制备结肠靶向递送生物活性物质中的应用。
56.下面结合若干优选实施例及附图对本发明的技术方案做进一步详细说明,本实施例在以发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
57.下面所用的实施例中所采用的实验材料,如无特殊说明,均可由常规的生化试剂公司购买得到。
58.实施例1
59.(1)配置0.5%的透明质酸溶液和1%的γ-cd溶液,在4℃,800rpm下持续搅拌4h保证充分水和;将edc加入透明质酸溶液中活化羰基,其添加量为透明质酸质量的0.1%,随后将γ-cd溶液加入透明质酸溶液中,500rpm反应60min,反应结束后,洗涤干燥得到γ-cd-ha;姜黄素(cur)溶于乙醇中,滴加到γ-cd-ha溶液中,制备cur@γ-cd-ha。
60.(2)配置浓度为20%的淀粉乳,并于100℃糊化30min,再冷却至60℃,之后加入普鲁兰酶(普鲁兰酶:淀粉=100u:1g)于60℃酶解24h,然后经沸水浴灭酶(30min)、浓缩、冻干处理,制得粗糊精;之后,依次采用80、60(v/v)%的乙醇溶液对所述粗糊精进行沉淀分级处理,弃去80(v/v)%的乙醇溶液分级得到的线性糊精,收集60(v/v)%的乙醇溶液分级得到的线性糊精并冻干,制得分子量均一的线性糊精。
61.(3)将cur@γ-cd-ha分散于10%线性糊精溶液中,cur@γ-cd-ha与线性糊精的质量比为0.2%,随后将混合体系中置于4℃的环境中储藏24h,制得rs3型抗性淀粉基结肠靶向颗粒(记为:cur@γ-cd-hain mps)。
62.此外,本案申请人还采用上述条件制备了cur@γ-cd、cur@γ-cd-ha,将其与本实施制备的cur@γ-cd-ha in mps进行了表征,图1是本实施例中cur@γ-cd、cur@γ-cd-ha、cur@γ-cd-ha in mps的粒径及ζ-电位图;图2是本实施例中cur@γ-cd、cur@γ-cd-ha、cur@γ-cd-ha in mps的包封和负载能力图;图3是本实施例中cur@γ-cd、cur@γ-cd-ha、cur@γ-cd-ha in mps在模拟消化过程中粒径的变化;图4是本实施例中游离姜黄素、cur@γ-cd-ha、cur@γ-cd-ha in mps在模拟消化过程中姜黄素的累积释放曲线图。
63.实施例2
64.(1)配置1%的透明质酸溶液和2%的γ-cd溶液,在5℃,400rpm下持续搅拌3h保证充分水和;将edc加入透明质酸溶液中活化羰基,其添加量为透明质酸质量的0.2%,随后将γ-cd溶液加入透明质酸溶液中,600rpm反应40min,反应结束后,洗涤干燥得到γ-cd-ha;姜黄素溶于乙醇中,滴加到γ-cd-ha溶液中,制备cur@γ-cd-ha。
65.(2)配置浓度为10%的淀粉乳,并于90℃糊化20min,再冷却至45℃,之后加入普鲁兰酶(普鲁兰酶:淀粉=100u:1g)于45℃酶解8h,然后经沸水浴灭酶(15min)、浓缩、冻干处理,制得粗糊精;之后,依次采用60、40(v/v)%的乙醇溶液对所述粗糊精进行沉淀分级处理,弃去60(v/v)%的乙醇溶液分级得到的线性糊精,收集40(v/v)%的乙醇溶液分级得到的线性糊精并冻干,制得分子量均一的线性糊精。
66.(3)将cur@γ-cd-ha分散于10%线性糊精溶液中,cur@γ-cd-ha与线性糊精的质量比为0.4%,随后将混合体系中置于2℃的环境中储藏12h,制得rs3型抗性淀粉基结肠靶向颗粒。
67.实施例3
68.(1)配置0.5%的透明质酸溶液和2%的γ-cd溶液,在6℃,800rpm下持续搅拌1h保证充分水和;将edc加入透明质酸溶液中活化羰基,其添加量为透明质酸质量的0.1%,随后将γ-cd溶液加入透明质酸溶液中,800rpm反应30min,反应结束后,洗涤干燥得到γ-cd-ha;姜黄素溶于乙醇中,滴加到γ-cd-ha溶液中,制备cur@γ-cd-ha。
69.(2)配置浓度为15%的淀粉乳,并于95℃糊化40min,再冷却至50℃,之后加入普鲁兰酶(普鲁兰酶:淀粉=100u:1g)于50℃酶解16h,然后经沸水浴灭酶(20min)、浓缩、冻干处理,制得粗糊精;之后,依次采用80、60(v/v)%的乙醇溶液对所述粗糊精进行沉淀分级处理,弃去80(v/v)%的乙醇溶液分级得到的线性糊精,收集60(v/v)%的乙醇溶液分级得到的线性糊精并冻干,制得分子量均一的线性糊精。
70.(3)将cur@γ-cd-ha分散于10%线性糊精溶液中,cur@γ-cd-ha与线性糊精的质量比为0.6%,随后将混合体系中置于3℃的环境中储藏18h,制得rs3型抗性淀粉基结肠靶向颗粒。
71.实施例4
72.(1)配置1%的透明质酸溶液和1%的γ-cd溶液,在4℃,700rpm下持续搅拌3h保证充分水和;将edc加入透明质酸溶液中活化羰基,其添加量为透明质酸质量的0.2%,随后将γ-cd溶液加入透明质酸溶液中,700rpm反应50min,反应结束后,洗涤干燥得到γ-cd-ha;姜黄素溶于乙醇中,滴加到γ-cd-ha溶液中,制备cur@γ-cd-ha。
73.(2)配置浓度为25%的淀粉乳,并于100℃糊化60min,再冷却至55℃,之后加入普鲁兰酶(普鲁兰酶:淀粉=100u:1g)于55℃酶解12h,然后经沸水浴灭酶(25min)、浓缩、冻干处理,制得粗糊精;之后,依次采用80、60(v/v)%的乙醇溶液对所述粗糊精进行沉淀分级处理,弃去80(v/v)%的乙醇溶液分级得到的线性糊精,收集60(v/v)%的乙醇溶液分级得到的线性糊精并冻干,制得分子量均一的线性糊精。
74.(3)将cur@γ-cd-ha分散于10%线性糊精溶液中,cur@γ-cd-ha与线性糊精的质量比为0.8%,随后将混合体系中置于4℃的环境中储藏30h,制得rs3型抗性淀粉基结肠靶向颗粒。
75.实施例5
76.(1)配置2%的透明质酸溶液和1%的γ-cd溶液,在4℃,400rpm下持续搅拌4h保证充分水和;将edc加入透明质酸溶液中活化羰基,其添加量为透明质酸质量的0.2%,随后将γ-cd溶液加入透明质酸溶液中,400rpm反应50min,反应结束后,洗涤干燥得到γ-cd-ha;白藜芦醇(res)溶于乙醇中,滴加到γ-cd-ha溶液中,制备res@γ-cd-ha。
77.(2)配置浓度为10%的淀粉乳,并于95℃糊化50min,再冷却至60℃,之后加入普鲁兰酶(普鲁兰酶:淀粉=100u:1g)于60℃酶解20h,然后经沸水浴灭酶(30min)、浓缩、冻干处理,制得粗糊精;之后,依次采用60、40(v/v)%的乙醇溶液对所述粗糊精进行沉淀分级处理,弃去60(v/v)%的乙醇溶液分级得到的线性糊精,收集40(v/v)%的乙醇溶液分级得到的线性糊精并冻干,制得分子量均一的线性糊精。
78.(3)将res@γ-cd-ha分散于10%线性糊精溶液中,res@γ-cd-ha与线性糊精的质量比为1%,随后将混合体系中置于5℃的环境中储藏36h,制得rs3型抗性淀粉基结肠靶向颗粒。
79.实施例6
80.(1)配置1%的透明质酸溶液和0.5%的γ-cd溶液,在5℃,800rpm下持续搅拌3h保证充分水和;将edc加入透明质酸溶液中活化羰基,其添加量为透明质酸质量的0.2%,随后将γ-cd溶液加入透明质酸溶液中,800rpm反应30min,反应结束后,洗涤干燥得到γ-cd-ha;α-生育酚溶于乙醇中,滴加到γ-cd-ha溶液中,制备α-生育酚@γ-cd-ha。
81.(2)配置浓度为20%的淀粉乳,并于90℃糊化30min,再冷却至50℃,之后加入普鲁兰酶(普鲁兰酶:淀粉=100u:1g)于50℃酶解18h,然后经沸水浴灭酶(20min)、浓缩、冻干处理,制得粗糊精;之后,依次采用60、40(v/v)%的乙醇溶液对所述粗糊精进行沉淀分级处理,弃去60(v/v)%的乙醇溶液分级得到的线性糊精,收集40(v/v)%的乙醇溶液分级得到的线性糊精并冻干,制得分子量均一的线性糊精。
82.(3)将α-生育酚@γ-cd-ha分散于10%线性糊精溶液中,α-生育酚@γ-cd-ha与线性糊精的质量比为0.2%,随后将混合体系中置于6℃的环境中储藏24h,制得rs3型抗性淀粉基结肠靶向颗粒。
83.综上所述,藉由本发明的上述技术方案获得的rs3型抗性淀粉基结肠靶向递送载体,利用透明质酸对cd44受体的靶向作用达到靶向递送生物活性物质的作用,且接枝不会破坏γ-环糊精的环状结构;回生的线性糊精基质可以保护生物活性物质,避免在胃和小肠阶段的提前释放。本发明制备rs3型抗性淀粉基结肠靶向颗粒的方法,操作简单,成本低,有效提高了生物活性物质的靶向性。
84.此外,本案发明人还参照实施例1~6的方式,以本说明书中列出的其它原料和条件等进行了试验,并同样制得了rs3型抗性淀粉基结肠靶向递送载体。
85.应当理解,本发明的技术方案不限于上述具体实施案例的限制,凡是在不脱离本发明宗旨和权利要求所保护的范围情况下,根据本发明的技术方案做出的技术变形,均落于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1