T2DM全因死亡风险预测模型及其构建方法和构建系统
t2dm全因死亡风险预测模型及其构建方法和构建系统
技术领域
1.本发明涉及生物技术领域,具体涉及一种t2dm全因死亡风险预测模型及其构建方法和其构建系统。
背景技术:
2.本发明中全因死亡是指任何原因导致的死亡;采用t2dm指代2型糖尿病(diabetes mellitus type 2)。
3.糖尿病的发病率和流行率在全球范围内不断上升,是世界范围内呈现不健康状态人数越来越多的主要原因之一。据估计,在过去的13年里,全球糖尿病患者的人数增加了88%,从2006年的2.46亿人增加到2019年的4.63亿人,预计到2045年会突破7个亿。目前,我国成人糖尿病患病率为12.8%,t2dm由于微血管和大血管等并发症增加了死亡的风险,糖尿病患者的全因死亡率显著高于非糖尿病人群,据估计,糖尿病相关死亡人数占全球总死亡人数的11.3%。
4.在糖尿病的治疗工作中,识别与死亡风险增加相关的因素可以促进风险分层、疾病监测和机制的研究,并由此可能转化为降低死亡风险的治疗方法。
5.研究显示心血管疾病、糖尿病相关并发症、血糖水平等因素都与糖尿病高死亡风险相关,预防或延缓上述因素的方法也许可以降低糖尿病患者的死亡率。而肌肉作为机体进行葡萄糖代谢的最大场所,近年研究表明,肌肉也是机体最大的内分泌器官,产生数百种肌肉素(myokine),对机体糖脂代谢、炎症、内皮细胞功能起重要影响。t2dm患者中肌肉质量和肌肉分布变化与非t2dm患者不同,相较正常人群,t2dm患者下肢肌肉量快速丢失,躯干肌肉量相对增加,肌肉分布产生变化。t2dm患者中,认知障碍等不良结局和下肢肌肉量减少关系密切。
6.目前关于t2dm死亡风险开展的研究尚大多基于患者基础信息或临床检测数据进行,缺少与患者肌肉分布数据。因此,亟需开发一种纳入患者相关数据更全面、更高效精准的t2dm死亡风险预测模型和预测方法。
技术实现要素:
7.针对上述问题,本发明的提出一种基于t2dm患者肌肉分布数据的全因死亡风险预测模型,同时公开了该模型的构建方法、构建系统及其应用。通过该风险预测模型可筛选出与t2dm患者全因死亡相关的危险因素,更精准地评估t2dm患者全因死亡风险,并指导采取所有可能的预防措施以预防、治疗t2dm及降低患者死亡风险。
8.具体地,一方面,本发明提出的t2dm全因死亡风险预测模型,采用以下步骤进行构建:
9.s10,获取样本的多个属性数据和肌肉分布数据;
10.s20,采用cox比例风险回归法,以样本是否发生全因死亡为因变量,利用多个属性数据和肌肉分布数据为自变量建立cox回归模型,并得到与t2dm全因死亡风险相关的独立
预测因子;
11.s30,根据步骤s20获取的独立预测因子建立列线图,即所述t2dm全因死亡风险预测模型。
12.进一步,步骤s10中获取的样本多个属性数据包括样本的
13.1)基础信息,如样本的年龄、性别,保险情况、吸烟情况、饮酒情况等;
14.2)临床数据,如糖尿病病程、收缩压、舒张压、糖化血红蛋白(glycated hemoglobin a1c,hba1c)、估算肾小球滤过率(estimated glomerular filtration rate,egfr)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,ldl-c)、血白蛋白、冠心病病史、脑血管疾病、恶性肿瘤、蛋白尿、骨质疏松、肾功能不全、心房颤动、使用抗血小板药物、抗高血压药物、降糖药物、调脂药物、体质指数(body mass index,bmi)数据。
15.需注意,本发明对以上多个属性数据的测量和获取方法没有限制。
16.在上述技术方案中,样本的肌肉分布数据包括样本的全身肌肉量、躯干肌肉量、上肢肌肉量、下肢肌肉量、android肌肉量、gynoid肌肉量数据,以及基于android肌肉量和gynoid肌肉量数据计算得出的android/gynoid肌肉量比数据。其中,android/gynoid肌肉量比计算方法为:android/gynoid肌肉量比=android肌肉质量/gynoid肌肉质量
×
100。
17.进一步,步骤s20中得到的与t2dm全因死亡风险相关的独立预测因子包括样本的年龄、性别、android/gynoid肌肉量比、下肢肌肉量、目前饮酒情况、egfr、hba1c、血白蛋白恶性肿瘤史数据。
18.本发明测量样本全身和局部肌肉量的方法可采用双能x线测量法(dexa)、生物电阻抗分析(bia)、计算机体层扫描(ct)或核磁共振成像(mri)法;优选采用dexa进行测量。
19.本发明中,android为男性形态兴趣区(region of interest,roi),如图1所示,由三条界限围成的区域构成:下方界限选取骨盆切线作为底部的边界,上部界限选取骨盆切线上方作为顶部边界,上下界限的距离是骨盆到颈切线之间长度的20%;臂切线作为双侧边界。gynoid为女性形态roi,如图1所示,由两条界限组成:上方界限是骨盆切线下的顶部边界,高度是android的1.5倍;gynoid的上下距离为android上下距离的2倍;侧边界由外侧腿的切线构成。图1的来源为美国芝加哥ge healthcare公司骨密度仪用户手册。需注意,本发明中由专业医护人员来获取样本的多个属性数据和肌肉分布数据。本发明所述多个属性数据和肌肉分布数据不限于以上所例举的种类,本领域普通技术人员可通过非创造性的劳动获取样本其他种类的多个属性数据和肌肉分布数据。
20.另一方面,本发明提出了一种t2dm全因死亡风险预测模型构建方法,该方法包括以下步骤:
21.s100,获取样本的多个属性数据和肌肉分布数据;
22.s200,采用cox比例风险回归法,以样本是否发生全因死亡为因变量,利用多个属性数据和肌肉分布数据为自变量建立cox回归模型,并得到与t2dm全因死亡风险相关的独立预测因子;
23.s300,根据步骤s20获取的独立预测因子建立列线图,即所述t2dm全因死亡风险预测模型。
24.另一方面,本发明提出了一种t2dm全因死亡风险预测模型的构建系统,该构建系统包括:
25.数据获取模块,用于获取样本的多个属性数据及肌肉分布数据;
26.独立预测因子获取模块,采用cox比例风险回归法,以样本是否发生全因死亡为因变量,利用多个属性数据和肌肉分布数据为自变量建立cox回归模型,并得到与t2dm全因死亡风险相关的独立预测因子;
27.模型构建模块,根据独立预测因子获取模块所得独立预测因子构建列线图,即所述t2dm全因死亡风险预测模型。
28.另一方面,本发明提出了一种计算机可读取储存介质,该存储介质上存储有计算机程序;所述计算机程序被处理器执行时,实现上述的全因死亡风险预测模型的构建方法。
29.可选地,所述存储介质包括rom、ram、磁碟或者光盘等各种可以存储程序代码的介质。
30.另一方面,本发明提出了一种信息数据处理终端,用于实现上述t2dm全因死亡风险预测模型的构建方法。
31.可选地,所述信息数据处理终端包括处理器及存储器;所述的存储器可能包含ram,也可能还包括非易失性存储器(nvram),例如至少一个磁盘存储器。所述处理器可以是通用处理器,包括cpu、网络处理器(np)等;还可以是数字信号处理器(dsp)、专用集成电路(asic)、现场可编程门阵列(fpga)或者其它可编程逻辑器件、分立门或者晶体管逻辑器件、分立硬件组件。
32.可选地,所述信息数据处理终端包括处理器、存储器和通信器。
33.相对于现有技术,本发明的有益效果为:
34.1.本发明除采用患者基础数据和临床数据外,还纳入患者的肌肉分布数据进行模型构建,使得与t2dm全因死亡相关数据更全面,由此获得的模型具有更佳的全因死亡风险预测准确性。本发明经实施例1与对比例1对比验证:基于同一样本数据构建t2dm全因死亡风险预测模型时,纳入肌肉分布数据后改善了模型c统计量、综合判别改善指数(integrated discrimination index,idi)和-2倍对数似然值。
35.2.本发明风险预测模型可用于临床评估t2dm患者的全因死亡风险,并以动态列线图形式直观、简明地进行展示;本发明实施例1中采用动态列线图的方式呈现t2dm全因死亡风险预测模型,直接输入患者多个属性数据和肌肉分布数据就可输出预测生存曲线、给定时间点生存概率值及95%置信区间,使用方式便捷高效,辅助医护人员在临床应用中精准、快速地进行患者个体化预测。
36.3.通过本发明方法可筛选出t2dm患者的全因死亡相关的危险因素,通过该模型可得到t2dm患者的全因死亡预后,辅助进行临床分析和调整治疗方案,应用前景广泛。
附图说明
37.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
38.图1为本发明android和gynoid肌肉分布示意图;
39.图2为本发明t2dm全因死亡风险预测模型的构建方法流程示意图;
40.图3为实施例1所示普通列线图t2dm全因死亡风险预测模型;
41.图4为实施例1所示普动态线图t2dm全因死亡风险预测模型;
42.图5为实施例1高危和低危t2dm患者生存曲线;
43.图6为实施例1所示t2dm全因死亡风险预测模型校准图;
44.图7为实施例1与对比例1所示预测模型idi比较结果;
45.图8为本发明所示t2dm全因死亡风险预测模型的构建系统。
具体实施方式
46.为了便于理解本发明,下面将对本发明进行更全面的描述,给出了本发明的较佳实施例。但应当理解为这些实施例仅仅是用于更详细说明之用,而不应理解为用以任何形式限制本发明,即并不意于限制本发明的保护范围。
47.实施例1
48.本实施例展示了一种情况下本发明一种t2dm全因死亡风险预测模型,该模型采用如图2所示的步骤进行构建。
49.具体地,在本实施例中,发明人获取了2013年6月至2018年5月期间,天津医科大学总医院内分泌与代谢病科出院诊断中t2dm连续住院患者作为预测模型构建的样本,用于采用本发明预测模型的构建方法进行t2dm全因死亡风险预测模型构建。
50.本实例预测模型构建包括以下步骤:
51.s10,获取患者的多个属性数据和肌肉分布数据。
52.包括患者的1)基础信息:年龄、性别、保险情况、吸烟情况、饮酒情况;
53.2)临床数据:糖尿病病程、收缩压、舒张压、hba1c、egfr、ldl-c、血白蛋白、冠心病病史、脑血管疾病、恶性肿瘤、蛋白尿、骨质疏松、肾功能不全、心房颤动、使用抗血小板药物、抗高血压药物、降糖药物、调脂药物、bmi数据;
54.3)肌肉分布数据:全身肌肉量、躯干肌肉量、上肢肌肉量、下肢肌肉量、android肌肉量、gynoid肌肉量,并由此计算出android/gynoid肌肉量比用于后续建模步骤。
55.具体地,本实施例中患者基础信息及临床数据的获取方法为:
56.(1)所有患者的血液患者均在入院后的第二天早晨空腹抽取,禁食时间至少为10小时以上。
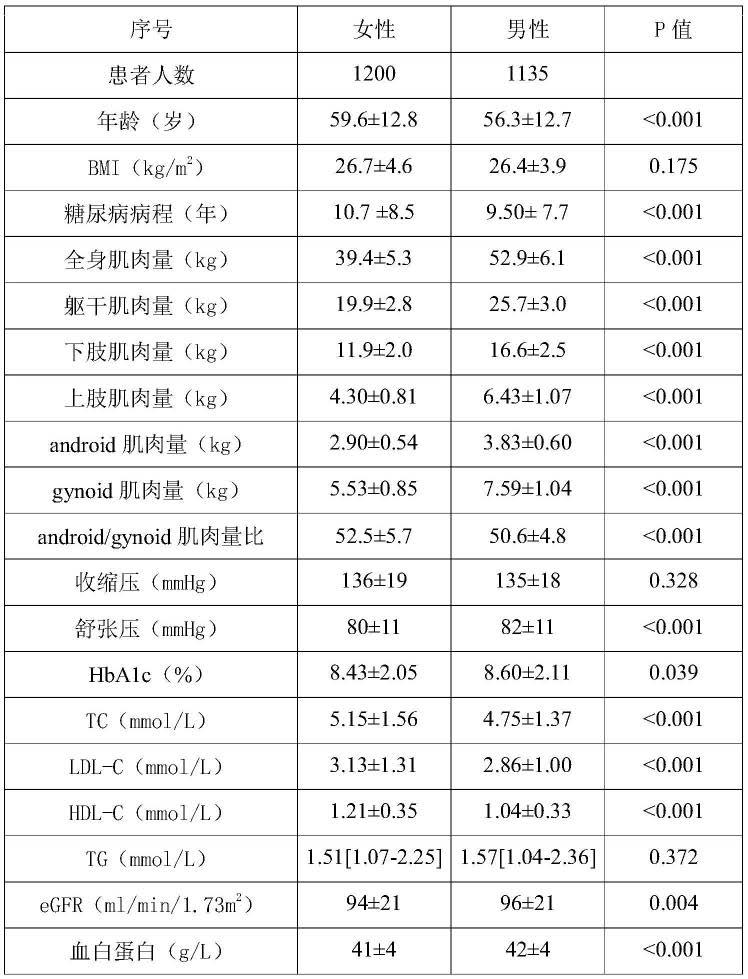
57.(2)生化指标采用标准酶促技术(日立7600全自动生化分析仪;日立,日本东京,2013年6月至2016年12月,日立008a全自动生化分析仪;日立,日本东京,2017年1月至2018年5月)检测。测定受试者的ldl-c,ldl-c值≥2.6mmol/l,定义为ldl-c升高。
58.(3)根据ckd-epi肌酐方程计算估算的肾小球滤过率(egfr)。
59.(4)hba
1c
用hlc-723g8分析仪(tosoh g8;tosoh公司)在标准模式下检测,hba
1c
值≥7%,定义为hba
1c
水平升高。
60.具体地,本实施例中患者的肌肉分布数据获取方法为:
61.采用prodigy型号的dxea(仪器来源于ge healthcare公司)评估患者的全身、躯干、上肢、下肢、android及gynoid肌肉量,并计算android/gynoid肌肉量比。
62.具体地,本实施例中进行统计分析的方法为:
63.应用卡方检验、方差分析和cox比例风险回归法,所有分析均使用r3.5.3版本进行。分析结果中当p《0.05,认为差异有统计学差异。
64.可选地,s10步骤中还包括步骤s11:对患者进行筛选。
65.具体地,研发团队共获取t2dm连续住院患者4562例,排除重复住院患者767人次住院记录、身体身份数据不全的患者928例、失访患者(即全因死亡结局不明的患者)523例后,共筛选出患者2335例患者进入后续建模步骤。
66.对获取的患者数据进行统计学分析,其中分类变量采用卡方检验,连续变量采用方差分析;分析结果如表1,表中显示各参数的均数加减标准差(mean
±
sd)和百分比。
67.表1
68.[0069][0070]
s20,采用cox比例风险回归法,以患者是否发生全因死亡为因变量,利用多个属性数据和肌肉分布数据为自变量建立cox回归模型,得到与t2dm全因死亡风险相关的独立预测因子。
[0071]
可选地,步骤s20中还包括在进行cox比例风险回归时在赤池信息准则(akaike information criterion,aic)最小值的基础上采用向后逐步消除的cox回归分析方法简化模型,最终得到的独立预测因子包括患者的年龄、性别、android/gynoid肌肉量比、下肢肌肉量、目前饮酒情况、egfr、hba1c、血白蛋白恶性肿瘤史8个独立预测因子。表2展示t2dm预测模型纳入的参数。
[0072]
表2
[0073]
[0074][0075]
cox比例风险回归的公式为:
[0076]
h(t,x)=h0(t)exp(β1x1+β2x2+
……
+βmxm)
[0077]
其中,h(t,x):t时点上m个危险因素起作用时的风险率,即在时间t上的死亡率;
[0078]
h0(t):某时间t上当m个危险因素为0时的基准风险率;
[0079]
x=(x1,x2,
…
,xm):与生存时间可能有关的自变量;
[0080]
β=(β1,β2,
…
,βm):cox模型的回归系数。
[0081]
本实施例步骤s20进行cox比例风险回归,得到t2dm全因死亡风险预测模型(1),该模型中1年、3年、5年基准风险率分别为0.9977948、0.9718472、0.9440493。
[0082]
s30,根据步骤s20获取的独立预测因子建立列线图,即t2dm全因死亡风险预测模型;纳入的独立因子包括,包括患者的年龄、性别、android/gynoid肌肉量比、下肢肌肉量、目前饮酒情况、egfr、hba1c、血白蛋白恶性肿瘤史。可选地,本实施例t2dm全因死亡风险预测模型可采用普通列线图(如图3)或动态列线图(如图4)呈现。
[0083]
图3示出了本实施例t2dm全因死亡风险预测模型计算出的患者3年死亡风险线性预测值,位于第三分位(风险最高的1/3患者)定义为高风险,位于第一和第二三分位患者为低风险,如图5所示,两组患者的生存曲线有统计学差异(p《0.001)。
[0084]
如图4所示的动态列线图中,左侧为独立预测因子的选择或输入单元,右侧为输出预测结果,可输出的项目包括患者生存曲线、估计生存概率和模型展示,在具体临床应用中可根据需要选择合适的输出项目用于个体化预测。
[0085]
优选地,本实施例采用动态列线图对t2dm全因死亡风险预测模型进行展示,将复杂的计算公式用“网页版软件”的方式呈现出来,在使用的时候,医护人员只需输入患者对应预测因子的数值,就可以快速计算出患者的t2dm全因死亡风险值,对比采用普通列线图预测时需要用尺子测量并计算才能得出患者的风险值的操作方式,本发明t2dm全因死亡风险动态列线图预测模型使用简单,可操作性更强,在临床实践中有很大的应用价值。
[0086]
可选地,由步骤s30构建所述预测模型后,还包括对预测模型进行验证的步骤;具体地,在模型构建的原始数据集中,利用自主抽样法(bootstrap)进行预测模型的内部验证,图6示出了本实施例t2dm全因死亡风险预测模型的校准图,由图6可验证预测风险随实际风险增加而增加。
[0087]
对比例1
[0088]
研发团队就纳入患者的肌肉分布数据对所构建的t2dm全因死亡风险预测模型的精准度的影响进行了对比验证。
[0089]
具体的,本对比例参考实施例1所示的t2dm全因死亡风险模型的构建方法,采用实施例1中研发团队获取的t2dm患者数作为样本进行对比例1中的t2dm全因死亡风险预测模型构建,但在步骤s10中仅获取了样本除肌肉量及肌肉分布参数以外的患者多个属性数据进行后续的建模步骤,得到如下t2dm全因死亡风险预测模型(2),该预测模型中1年、3年、5年基准风险率分别为0.9948109、0.938733、0.8811001。表3示出了对比例1中t2dm全因死亡风险预测模型(2)的回归系数。
[0090]
表3
[0091][0092]
进一步,研发团队通过计算基于同一数据样本构建t2dm全因死亡风险预测模型的实施例1(纳入肌肉分布数据)和对比例1(未纳入肌肉分布数据)综合判别指数(如图7所示),验证了纳入肌肉分布数据的实施例1预测模型的c统计量更高(84.1[81-87.2]vs82.6[79.2-86],p=0.043),提升综合判别指数3.4%[1.4%-5.7%],p《0.001,降低模型-2倍对数似然值(-828.99vs-840.67,p=0.001)。
[0093]
实施例2
[0094]
本实施例展示了一种t2dm全因死亡风险预测模型的构建方法,该方法包括以下步骤:
[0095]
s100,获取样本的多个属性数据和肌肉分布数据;
[0096]
s200,采用cox比例风险回归法,以样本是否发生全因死亡为因变量,利用多个属性数据和肌肉分布数据为自变量建立cox回归模型,并得到与t2dm全因死亡风险相关的独立预测因子;
[0097]
s300,根据步骤s20获取的独立预测因子建立列线图,即所述t2dm全因死亡风险预测模型。
[0098]
进一步,步骤s100还包括对获取的样本数据进行筛选,选择t2dm样本数据并排除重复住院、失访的样本以及身体身份数据不全的样本数据。
[0099]
进一步,步骤s200中还包括在进行cox比例风险回归时在赤池信息准则最小值的基础上采用向后逐步消除的cox回归分析方法简化模型。
[0100]
进一步,由步骤s300构建所述预测模型后,还包括对预测模型进行验证的验证步骤;
[0101]
更进一步,验证步骤为采用bootstrap方法进行对预测模型进行内部验证。
[0102]
可选地,t2dm全因死亡风险预测模型可采用普通列线图或动态列线图进行展示,本领域普通技术人员可通过非创造性的劳动选择其他的cox回归模型展示方式,由此形成的技术方案均在本发明保护范围内。
[0103]
实施例3
[0104]
本实施例展示一种t2dm全因死亡风险预测模型的构建系统,如图8所示,该构建系统包括:
[0105]
数据获取模块,用于获取样本的多个传统属性数据及肌肉分布数据;
[0106]
独立预测因子获取模块,采用cox比例风险回归法,以样本是否发生全因死亡为因变量,利用传统多个属性数据和肌肉分布数据为自变量建立cox回归模型,并得到与t2dm全因死亡风险相关的独立预测因子;
[0107]
模型构建模块,根据独立预测因子获取模块所得独立预测因子构建列线图,即所
述t2dm全因死亡风险预测模型。
[0108]
需注意,本实施例提供的各个模块与实施例1和实施例1所提供的方法、实施方式类似,处于简要目的,此处不再赘述。
[0109]
本领域普通技术人员应理解,该实施例预测模型构建系统中的各个模块的划分仅仅是一种逻辑功能的划分,实际实现过程中可全部或部分集成到一个物理实体上,或进行物理上的分开;且这些模块可全部经软件、通过处理元件调用的形式来实现;或全部以硬件的形式实现;或部分模块通过处理元件调用、部分模块通过硬件的形式实现。此外,需注意,本实施例中这些模块可全部、部分地集成在一起,也可以独立实现。这里的处理元件可以是一种集成电路,具有信号处理能力。
[0110]
在本实施例实现过程中,上述方法的各个步骤或以上各个模块可以通过处理器元件中的硬件的集成逻辑电路或者软件形式的指令完成。例如,以上这些模块可以是被配置成本发明风险预测模型建模方法的一个或多个集成电路,如一个或多个特定的集成电路,或,一个或多个微处理器,或,一个或多个现场可编程门阵列等。再如,当以上模块通过处理元件程序代码的形式实现时,该处理元件可以是通用处理元件,例如中央处理器或其他可以调用程序代码的处理器。再如,这些模块可集成在一起,以片上系统的形式实现。
[0111]
以上仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1