水杨酸类化合物作为NDM-1与KPC-2双重抑制剂的应用
水杨酸类化合物作为ndm-1与kpc-2双重抑制剂的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及水杨酸类化合物作为ndm-1与kpc-2双重抑制剂的应用。
背景技术:
2.在治疗细菌感染过程中,由于抗生素的广泛使用,临床上出现了各类机制不同的耐药菌,导致耐药问题愈发严峻。目前,β-内酰胺类抗生素是全球范围内应用最广的抗生素,β-内酰胺类抗生素失活的主要原因是β-内酰胺酶的产生和广泛传播,该类酶可催化β-内酰胺环的水解,使细菌对β-内酰胺类抗生素的敏感性降低。被称为“最后一道防线”的碳青霉烯类药物也未能幸免,其耐药率逐年增高,耐药革兰氏阴性菌感染的临床治疗面临巨大挑战。
3.β-内酰胺酶根据作用机制可以分为以丝氨酸为活性中心的丝氨酸-β-内酰胺酶(serine-β-lactamases,sbls)和以zn离子为活性中心的金属-β-内酰胺酶(metallo-β-lactamases,mbls)两类,而根据序列同源性可分为a、b、c、d四类,其中a、c、d类为丝氨酸-β-内酰胺酶,b类为金属-β-内酰胺酶。在2008年以前,a类β-内酰胺酶占主导,临床上使用的β-内酰胺酶抑制剂如克拉维酸、舒巴坦和三唑巴坦等,均为抑制a类β-内酰胺酶的丝氨酸-β-内酰胺酶抑制剂。
4.自新德里金属-β-内酰胺酶-1(new delhi metallo-β-lactamase-1,ndm-1)首次报道后,携带ndm-1基因的菌株在世界各地广泛传播,已从病人的尿道、血液和肺组织中分离得到。ndm-1最早发现于肺炎克雷伯菌中,又陆续在鲍曼不动杆菌、柠檬酸杆菌等多种菌株中发现携带有ndm-1耐药基因的质粒。目前文献报道的ndm-1抑制剂高达五百多个,但除双环硼酸盐类抑制剂vnrx-5133与头孢吡肟的联合用药方案进入三期临床试验阶段外,目前还没有临床可用的ndm-1抑制剂。
5.肺炎克雷伯菌碳青霉烯酶-2(klebsiella pneumoniae carbapenemase-2,kpc-2)β-内酰胺酶是美国碳青霉烯类耐药肠杆菌科(cre)中最普遍的碳青霉烯酰胺酶,并在全世界传播。kpc-2的活性范围包括目前所有可用的β-内酰胺类和克拉维酸、舒巴坦和他唑巴坦。kpc-2可以水解所有fda批准的β-内酰胺类抗生素和β-内酰胺酶抑制剂,如舒巴坦,他唑巴坦和克拉维酸等。
6.针对sbls研发的抑制剂(如克拉维酸、舒巴坦)已被批准用于临床,并取得了较好的疗效,但对mbls无效,目前无临床可用的针对mbls的抑制剂,因此迫切需要研发mbls抑制剂或者对sbls和mbls均有效的双重抑制剂。
技术实现要素:
7.本发明的目的在于提供水杨酸类化合物作为新德里金属-β-内酰胺酶-1(new delhi metallo-β-lactamase-1,ndm-1)和肺炎克雷伯菌碳青霉烯酶-2(klebsiella pneumoniae carbapenemase-2,kpc-2)ndm-1与kpc-2双重抑制剂的应用,所述水杨酸类化
合物对ndm-1和kpc-2具有显著的抑制活性,并可恢复多种β-内酰胺类抗生素对产ndm-1耐药株和kpc-2耐药菌的抗菌活性。
8.本发明提供了水杨酸类化合物作为ndm-1和kpc-2双重抑制剂的应用,所述水杨酸类化合物包括漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1。
9.优选的,所述漆树酸anacardic acid的结构式如式i所示,银杏酸ginkgolic acid c15:1的结构式如式ii所示:
[0010][0011]
本发明还提供了漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1作为β-内酰胺类抗生素的增效剂中的应用。
[0012]
本发明还提供了漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1在制备预防和/或治疗耐药菌感染的药剂中的应用,所述耐药菌产ndm-1酶和kpc-2酶。
[0013]
本发明还提供了漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1在制备恢复β-内酰胺类抗生素的抗菌活性的药剂中的应用。
[0014]
有益效果:本发明提供了水杨酸类化合物作为ndm-1和kpc-2双重抑制剂的应用,所述水杨酸类化合物包括漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1,并通过实施例证实了,anacardic acid对ndm-1酶的ic
50
为0.63μm;ginkgolic acid c15:1对ndm-1酶的ic
50
为1.32μm;anacardic acid对kpc-2酶的ic
50
为1.30μm;ginkgolic acid c15:1对kpc-2酶的ic
50
为2.51μm;通过酶动力学研究发现,anacardic acid和ginkgolic acid c15:1对ndm-1酶及kpc-2酶均为非竞争性抑制;通过表面等离子共振实验,证实anacardic acid和ginkgolic acid c15:1与ndm-1酶之间存在中等强度的相互作用,kd值分别为2.48
×
10-4
m、2.57
×
10-5
m,anacardic acid和ginkgolic acid c15:1与kpc-2酶之间存在中等强度的相互作用,kd值分别为8.35
×
10-6
m、1.92
×
10-5
m。
[0015]
本发明实施例还研究了所述水杨酸类化合物对多种β-内酰胺类抗生素的抗菌作用恢复效果,如16μg/ml anacardic acid可使青霉素、氨苄西林、头孢噻吩、头孢他啶、美罗培南对ndm-1重组工程菌的mic分别降低至原来的1/16、1/16、1/2、1/4和1/256;16μg/ml ginkgolic acid c15:1可使青霉素、氨苄西林、头孢噻吩、头孢他啶、美罗培南对ndm-1重组工程菌的mic分别降低至原来的1/16、1/16、1/2、1/4和1/128;16μg/ml anacardic acid可使头孢噻吩、头孢哌酮、头孢克洛和美罗培南对kpc-2重组工程菌的mic分别降低至原来的1/2、1/4、1/2和1/2;16μg/ml ginkgolic acid c15:1可使头孢噻吩、头孢哌酮和美罗培南对kpc-2重组工程菌的mic分别降低至原来的1/2、1/4和1/4,并且anacardic acid和ginkgolic acid c15:1可剂量依赖性地恢复碳青霉烯类抗生素对产ndm-1耐药菌株和kpc-2耐药菌株的抗菌活性。
附图说明
[0016]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0017]
图1为anacardic acid和ginkgolic acid c15:1分别对ndm-1酶的ic
50
值;
[0018]
图2为anacardic acid和ginkgolic acid c15:1分别对kpc-2酶的ic
50
值;
[0019]
图3为anacardic acid和ginkgolic acid c15:1分别对ndm-1酶的酶动力学研究结果图;
[0020]
图4为anacardic acid和ginkgolic acid c15:1分别对kpc-2酶的酶动力学研究结果图;
[0021]
图5为anacardic acid和ginkgolic acid c15:1分别对ndm-1酶的不同抑制剂浓度下的荧光曲线;
[0022]
图6为anacardic acid和ginkgolic acid c15:1分别对kpc-2酶的不同抑制剂浓度下的荧光曲线;
[0023]
图7为anacardic acid和ginkgolic acid c15:1分别对ndm-1酶的spr结果图;
[0024]
图8为anacardic acid和ginkgolic acid c15:1分别对kpc-2酶的spr结果图;
[0025]
图9为anacardic acid(左)和ginkgolic acid c15:1(右)降低美罗培南的对ndm-1重组工程菌的mic值图;
[0026]
图10为anacardic acid(左)和ginkgolic acid c15:1(右)降低美罗培南的对kpc-2重组工程菌的mic值图。
具体实施方式
[0027]
本发明提供了水杨酸类化合物作为ndm-1和kpc-2双重抑制剂的应用,所述水杨酸类化合物包括漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1。
[0028]
在本发明中,所述漆树酸anacardic acid的cas号为16611-84-0,分子式为c
22h36
o3,结构式如式i所示:
[0029][0030]
银杏酸ginkgolic acid c15:1的cas号为22910-60-7,分子式为c
22h34
o3,结构式如式ii所示:
[0031][0032]
在本发明实施例中,通过研究漆树酸anacardic acid和银杏酸ginkgolic acid c15:1对ndm-1和kpc-2的生物活性和作用机制,确定该化合物对ndm-1和kpc-2具有显著的抑制活性,并可恢复多种β-内酰胺类抗生素对产ndm-1耐药株和kpc-2耐药菌的抗菌活性。
[0033]
本发明还提供了漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1作为β-内酰胺类抗生素的增效剂中的应用。
[0034]
本发明所述β-内酰胺类抗生素包括以丝氨酸为活性中心的丝氨酸-β-内酰胺酶(serine-β-lactamases,sbls)类抗生素和/或以zn离子为活性中心的金属-β-内酰胺酶(metallo-β-lactamases,mbls)类抗生素,实施例中以青霉素、氨苄西林、头孢噻吩、头孢他啶、美罗培南、头孢哌酮和头孢克洛为例进行说明,如16μg/ml anacardic acid可使青霉素、氨苄西林、头孢噻吩、头孢他啶、美罗培南对ndm-1重组工程菌的mic分别降低至原来的1/16、1/16、1/2、1/4和1/256;16μg/ml ginkgolic acid c15:1可使青霉素、氨苄西林、头孢噻吩、头孢他啶、美罗培南对ndm-1重组工程菌的mic分别降低至原来的1/16、1/16、1/2、1/4和1/128;16μg/ml anacardic acid可使头孢噻吩、头孢哌酮、头孢克洛和美罗培南对kpc-2重组工程菌的mic分别降低至原来的1/2、1/4、1/2和1/2;16μg/ml ginkgolic acid c15:1可使头孢噻吩、头孢哌酮和美罗培南对kpc-2重组工程菌的mic分别降低至原来的1/2、1/4和1/4。
[0035]
本发明还提供了漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1在制备预防和/或治疗耐药菌感染的药剂中的应用,所述耐药菌产ndm-1酶和kpc-2酶。
[0036]
本发明在实施例中,分别利用产ndm-1酶和kpc-2酶的重组菌研究所述水杨酸类化合物对于耐药菌的抗药活性,证实anacardic acid和ginkgolic acid c15:1可剂量依赖性地恢复碳青霉烯类抗生素对产ndm-1耐药菌株和kpc-2耐药菌株的抗菌活性。
[0037]
本发明还提供了漆树酸anacardic acid和/或银杏酸ginkgolic acid c15:1在制备恢复β-内酰胺类抗生素的抗菌活性的药剂中的应用。
[0038]
本发明所述应用优选与上述相同,在此不再赘述。
[0039]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的水杨酸类化合物作为ndm-1与kpc-2双重抑制剂的应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0040]
在本发明实施例中,所涉及的仪器、材料和试剂,如非特别说明,均为本领域的常规市售产品。
[0041]
本发明的实施例中涉及的实验材料、试剂、仪器包括:
[0042]
漆树酸anacardic acid,购自上海陶术生物科技有限公司,货号为145949;
[0043]
银杏酸ginkgolic acid c15:1,购自上海陶术生物科技有限公司,货号为131126;
[0044]
96孔紫外分析板,购自corning,货号为3635;
[0045]
96孔细胞培养板,购自costar,货号为3599;
[0046]
ndm-1酶,纯化自e.coli bl21(de3)/pet30a(+)-blandm-1-m(带有ndm-1成熟蛋白基因的表达工程菌),由中国医学科学院医药生物技术研究所游雪甫老师实验室提供;kpc-2酶,纯化自e.coli bl21(de3)/pet28a(+)-blakpc-2(带有kpc-2成熟蛋白基因的表达工程菌)。
[0047]
ndm-1重组工程菌,e.coli bl21(de3)/pet30a(+)-blandm-1(带有ndm-1全长蛋白基因的表达工程菌),由中国医学科学院医药生物技术研究所游雪甫老师实验室提供,参照文献(白银磊.基于ndm-1的抗耐药菌药物评价模型的建立及实验诱导肠杆菌科细菌的药敏分析与机制研究[d].北京协和医学院,2013.);kpc-2重组工程菌,e.coli bl21(de3)/
pet28a(+)-blakpc-2(带有kpc-2全长蛋白基因的表达工程菌),由生工生物工程(上海)有限公司合成,kpc-2的ncbi参考序列genbank为mh477636.1;
[0048]
hepes free acid,购自amresco;
[0049]
酶标仪,购自perkinelmer公司,型号为enspire 2300multiabel reader;
[0050]
96孔黑板,购自costar,3915;
[0051]
edc/nhs,购自阿拉丁;
[0052]
cm5芯片,购自reichert;
[0053]
醋酸钠溶液,购自ge healthcare bio-sciences ab;
[0054]
乙醇胺,购自sigma;
[0055]
dmso,购自amresco;
[0056]
20
×
pbs tweentm-20,购自thermo scientific,货号为28352;
[0057]
pbs,购自solarbio,货号为p1010;
[0058]
spr,购自reichert公司,型号为2spr;
[0059]
青霉素、氨苄西林、头孢哌酮、头孢噻吩、头孢拉定、头孢他啶、头孢克洛、美罗培南(mepm),购自中国食品药品检定研究院;
[0060]
头孢硝噻吩,购自toronto research chemicals公司,货号为n493815;
[0061]
edta,购自生工生物工程(上海)股份有限公司;
[0062]
封口膜,购自bemis;
[0063]
cck-8检测试剂盒,购自上海陶术生物科技有限公司,货号为c0005;
[0064]
非洲绿猴肾细胞vero细胞,由中国医学科学院医药生物技术研究所李玉环老师实验室赠送;
[0065]
肝癌细胞hepg2细胞,由中国医学科学院医药生物技术研究所何琪扬老师实验室赠送;
[0066]
hepes缓冲液(10mm),其配制方法为:hepes freeacid 2.383g溶于1l蒸馏水中,用naoh调ph至7.5,0.45μm过滤后置于0℃保存;
[0067]
非洲绿猴肾细胞vero培养基和人肝癌细胞hepg2培养基,其配制方法为:dmem(invitrogen)450ml、fbs(gibco)50ml,混匀后0.22μm过滤4℃保存。
[0068]
本发明的实施例涉及的英文缩写的含义如下:
[0069]
ndm-1:新德里金属-β-内酰胺酶-1(new delhi metallo-β-lactamase-1,ndm-1);
[0070]
kpc-2:肺炎克雷伯菌碳青霉烯酶-2(klebsiella pneumoniae carbapenemase-2);
[0071]
hepes:羟乙基哌嗪乙磺酸(hydroxyethyl piperazine ethanesulfonic acid);
[0072]
edc/nhs:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/n-羟基琥珀酰亚胺(1-ethyl-3-(3
’‑
dimethylaminopropyl)carbodiimide/n-hydroxysuccinimide);
[0073]
dmso:二甲基亚砜(dimethyl sulfoxide);
[0074]
pbst:磷酸盐吐温缓冲液(phosphate buffered saline with tweentm-20);
[0075]
pbs:磷酸盐缓冲液(phosphate buffer solution);
[0076]
spr:表面等离子共振(surface plasmon resonance);
[0077]
cfu:菌落形成单位(colony-forming unit);
[0078]
edta:乙二胺四乙酸(ethylene diamine tetraacetic acid);
[0079]
mic:最小抑菌浓度(minimal inhibitory concentration);
[0080]
mh:mh培养基(mueller-hinton broth);
[0081]
cck-8:cell countingkit-8;
[0082]
od:光密度(optical density);
[0083]
ic
50
:半数抑制浓度(50%inhibiting concentration)。
[0084]
下面实验中所用浓度单位“m”表示mol/l,mm表示mmol/l,μm表示μmol/l。
[0085]
实施例1
[0086]
活性化合物(anacardic acid和ginkgolic acid c15:1)对ndm-1酶及kpc-2酶半数抑制浓度ic
50
的测定
[0087]
(1)活性化合物的终浓度设置为20μm、10μm、5μm、2.5μm、1.25μm、0.625μm、0.3125μm和0.15625μm共八个浓度;各取2μl对应浓度的化合物加入96孔板中,每组三个平行;同时设置dmso阴性对照孔和阳性药edta对照孔;
[0088]
(2)ndm-1酶和kpc-2酶通过10mm hepes稀释至终浓度为0.25μg/ml,每孔加入98μl与化合物在37℃孵育15min;
[0089]
(3)ndm-1酶用底物美罗培南,kpc-2酶用底物头孢硝噻吩,底物美罗培南和头孢硝噻吩均通过10mm hepes稀释至终浓度为60μm,酶与化合物孵育结束后每孔加入100μl的底物,立即放入酶标仪中检测吸光值,美罗培南为底物检测在300nm处的吸光值,头孢硝噻吩为底物检测在486nm处的吸光值,37℃下每隔1min检测,连续检测15min;
[0090]
(4)分别计算各浓度抑制剂下的酶抑制率,用graphpad prism 8软件分析各计算ic
50
。
[0091]
酶抑制率的计算公式为:
[0092][0093]
反应速率公式为:
[0094][0095]
t1和t2分别为检测时间
[0096]
结果显示,anacardic acid对ndm-1酶的ic
50
为0.63μm;ginkgolic acid c15:1对ndm-1酶的ic
50
为1.32μm(图1);anacardicacid对kpc-2酶的ic
50
为1.30μm;ginkgolic acid c15:1对kpc-2酶的ic
50
为2.51μm(图2)。
[0097]
实施例2
[0098]
活性化合物(anacardic acid和ginkgolic acid c15:1)对ndm-1酶及kpc-2酶的酶动力学研究
[0099]
(1)活性化合物的终浓度设置为不同浓度梯度(0、1.25μm、2.5μm、5μm);各取2μl对应浓度的化合物加入96孔板中,每组三个平行;
[0100]
(2)ndm-1酶和kpc-2酶通过10mm hepes稀释至终浓度为0.25μg/ml,每孔加入98μl与化合物在37℃孵育15min;
[0101]
(3)ndm-1酶用底物美罗培南,kpc-2酶用底物头孢硝噻吩,底物美罗培南和头孢硝
噻吩均通过10mm hepes稀释8个浓度梯度,酶与化合物孵育结束后每孔加入100μl的底物,立即放入酶标仪中检测吸光值,美罗培南为底物检测在300nm处的吸光值,头孢硝噻吩为底物检测在486nm处的吸光值,37℃下每隔1min检测,连续检测15min;
[0102]
(4)分别计算各化合物浓度下的反应速率,以1/底物浓度即1/[s]为横坐标,1/反应速率即1/v为纵坐标,绘制不同化合物浓度下的lineweaver-burke曲线,分析化合物对ndm-1和kpc-2的抑制作用类型。
[0103]
结果如图3和图4所示,加入不同浓度的anacardic acid和ginkgolic acid c15:1后,以1/[s]为横坐标,1/v为纵坐标作图得到了一组交于x轴负半轴的直线,随着anacardic acid和ginkgolic acid c15:1浓度增大直线的斜率增大,即km不变、vmax变小,表明anacardic acid和ginkgolic acid c15:1对ndm-1酶及kpc-2酶均为非竞争性抑制。
[0104]
实施例3
[0105]
anacardic acid和ginkgolic acid c15:1与ndm-1酶和kpc-2酶的相互作用检测
[0106]
1、荧光淬灭实验
[0107]
荧光检测在96孔黑板中进行,检测体系为200μl,检测温度为37℃:
[0108]
(1)荧光检测在96孔黑板中进行,活性化合物终浓度设置为不同浓度梯度(0、15.625μm、31.25μm、62.5μm、125μm、250μm),每孔加入10μl;同时设置单加抑制剂组和单加ndm-1酶组;
[0109]
(2)ndm-1酶或者kpc-2酶每孔加100μl,终浓度为416.7μg/ml;每孔再加入90μl的10mm hepes,使检测体系为200μl;
[0110]
(3)在37℃下设置激发波长为270nm,扫描295nm~500nm的发射光,绘制不同抑制剂浓度下的荧光曲线。
[0111]
结果如图5和图6所示,随着anacardic acid浓度增加,ndm-1酶的最大荧光值均逐渐降低并从343nm处向更大波长移动的“红移”现象;同样随着ginkgolic acid c15:1浓度增加,ndm-1酶的最大荧光值均逐渐降低并从342nm处向更大波长移动的“红移”现象。结果表明anacardic acid和ginkgolic acid c15:1可能与ndm-1酶的芳香氨基酸存在相互作用,使其微环境向极性转变,从而改变了ndm-1酶的发射光谱。但由于anacardic acid和ginkgolic acid c15:1本身具有荧光,250μm的anacardic acid在410nm处有最大荧光强度,随着浓度的降低,最大荧光强度逐渐降低,并且向更小波长移动;250μm的ginkgolic acid c15:1在409nm处有最大荧光强度,随着浓度的降低,最大荧光强度逐渐降低,并且向更小波长移动(图5)。随着anacardic acid浓度增加,kpc-2酶的最大荧光值均逐渐降低并从350nm处向更大波长移动的“红移”现象;同样随着ginkgolic acid c15:1浓度增加,kpc-2酶的最大荧光值均逐渐降低并从352nm处向更大波长移动的“红移”现象。结果表明anacardic acid和ginkgolic acid c15:1可能与kpc-2酶的芳香氨基酸存在相互作用,使其微环境向极性转变,从而改变了kpc-2的发射光谱。但由于anacardic acid和ginkgolic acid c15:1本身具有荧光,250μm的anacardic acid在405nm处有最大荧光强度,随着浓度的降低,最大荧光强度逐渐降低,并且向更小波长移动;250μm的ginkgolic acid c15:1在407nm处有最大荧光强度,随着浓度的降低,最大荧光强度逐渐降低,并且向更小波长移动(图6)。
[0112]
2、表面等离子共振实验
[0113]
(1)将pbst、pbst+2%dmso、20%乙醇和蒸馏水经过0.22μm过滤并脱气,spr仪器依次用20%乙醇、蒸馏水以及pbst清洗;
[0114]
(2)注射edc/nhs,流经1,2个通道,活化芯片;选择合适ph的醋酸钠稀释ndm-1酶或者kpc-2酶至终浓度为200μg/ml,注射200μl,单独固定在1通道,2通道作为空白对照;蛋白固定至合适值后注射ph8.51 m乙醇胺,流过1,2个通道,封闭芯片表面未结合蛋白的位点;
[0115]
(3)活性化合物用pbst+2%dmso稀释至不同浓度梯度,分别将不同浓度的化合物依次注入蛋白通道,每三个化合物设置两个pbst+2%dmso空白对照,观察不同浓度anacardic acid和ginkgolic acid c15:1与蛋白的结合情况;
[0116]
(4)使用trace drawer软件计算活性化合物与蛋白的平衡解离常数(kd),并用graphpad prism 8软件作spr结合图。
[0117]
结果如图7和图8所示,anacardic acid和ginkgolic acid c15:1与ndm-1酶之间存在中等强度的相互作用,kd值分别为2.48
×
10-4
m、2.57
×
10-5
m(图7);anacardic acid和ginkgolic acid c15:1与kpc-2酶之间存在中等强度的相互作用,kd值分别为8.35
×
10-6
m、1.92
×
10-5
m(图8)。
[0118]
实施例4
[0119]
anacardic acid和ginkgolic acid c15:1对β-内酰胺类抗生素的增效作用检测
[0120]
1、anacardic acid和ginkgolic acid c15:1可恢复多种β-内酰胺类抗生素对产ndm-1耐药菌株和kpc-2耐药菌株的抗菌活性
[0121]
(1)在无菌96孔板中,第一列每孔加入190μl mh培养基,其余各列加入100μl mh培养基,然后第一列加入抗生素母液10μl,梯度稀释使抗生素终浓度为256μg/ml~0.25μg/ml;
[0122]
(2)化合物用含10
×
105cfu/ml的菌液稀释至32μg/ml;每孔加入100μl,菌液终浓度为5
×
105cfu/ml,化合物终浓度为16μg/ml;
[0123]
(3)96孔板置于37℃温箱中孵育;培养21h后用酶标仪检测在600nm处的吸光值。
[0124]
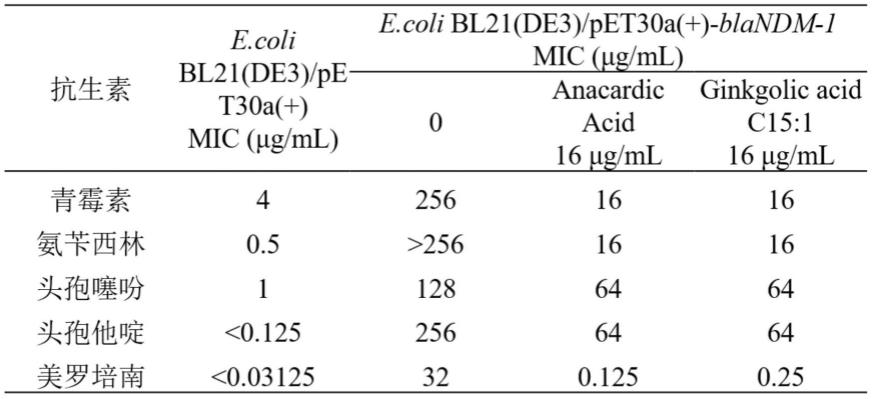
实验结果如表1和表2所示,16μg/ml anacardic acid可使青霉素、氨苄西林、头孢噻吩、头孢他啶、美罗培南对ndm-1重组工程菌的mic分别降低至原来的1/16、1/16、1/2、1/4和1/256;16μg/ml ginkgolic acid c15:1可使青霉素、氨苄西林、头孢噻吩、头孢他啶、美罗培南对ndm-1重组工程菌的mic分别降低至原来的1/16、1/16、1/2、1/4和1/128(表1);16μg/ml anacardic acid可使头孢噻吩、头孢哌酮、头孢克洛和美罗培南对kpc-2重组工程菌的mic分别降低至原来的1/2、1/4、1/2和1/2;16μg/ml ginkgolic acid c15:1可使头孢噻吩、头孢哌酮和美罗培南对kpc-2重组工程菌的mic分别降低至原来的1/2、1/4和1/4。
[0125]
表1 anacardic acid及ginkgolic acid c15:1可使抗生素对ndm-1重组工程菌的mic降低
[0126][0127]
表2 anacardic acid及ginkgolic acid c15:1可使抗生素对kpc-2重组工程菌的mic降低
[0128][0129]
2、anacardic acid和ginkgolic acid c15:1可剂量依赖性地恢复碳青霉烯类抗生素对产ndm-1耐药菌株和kpc-2耐药菌株的抗菌活性
[0130]
(1)检测方法同实施例4的第1部分;
[0131]
(2)设置美罗培南浓度梯度为64μg/ml~0.03125μg/ml;
[0132]
(3)第一行每孔加入4μl活性化合物,补加96μl菌稀释液,向下二倍稀释四个浓度,使每行化合物终浓度分别为100、50、25、12.5和6.25μg/ml;对照组每孔加2μl dmso;补加100μl lb培养基;
[0133]
(4)96孔板置于37℃温箱中孵育;培养21h后用酶标仪检测在600nm处的吸光值。
[0134]
实验结果如图9和图10所示,6.25μg/ml anacardic acid和ginkgolic acid c15:1均能使美罗培南的对ndm-1重组工程菌的mic降低至原来的1/128(图9);25μg/ml anacardic acid和ginkgolic acid c15:1均能使美罗培南的对kpc-2重组工程菌的mic降低至原来的1/4(图10)。
[0135]
实施例5
[0136]
anacardic acid和ginkgolic acid c15:1的细胞毒性评价
[0137]
(1)采用cck-8试剂盒(cell counting kit-8),检测活性化合物对人肝癌细胞hepg2和非洲绿猴肾细胞vero生长的影响。
[0138]
(2)细胞复苏:从液氮中取出冻存管,放在水浴锅中迅速融化,随后转移到离心管中,800转,离心3分钟,将液体完全吸出,1ml培养基加入离心管中,混匀后加到培养皿中,添加8~10ml培养基后放置在5%co2的37℃培养箱中培养。
[0139]
(3)细胞传代:待细胞密度达到90%以上时,将培养基吸掉,使用0.25%胰酶消化至细胞变圆,随后加入适量培养基于大皿中,使细胞停止消化,吹打均匀后加到离心管中离心。离心完成后将液体吸出,加入3ml培养基,混匀后加入500μl于大皿中,随后补充一些培养基,摇晃均匀后于培养箱中培养。
[0140]
(4)细胞接种:用胰蛋白酶消化细胞后,取40μl细胞悬液稀释10倍后计数,用培养基稀释至vero细胞的接种密度为3
×
104个/ml,hepg2细胞的接种密度为5
×
104个/ml,96孔板中间每孔100μl,周围一圈用200μl pbs封闭。将细胞置于37℃、5%co2培养箱中培养24h,使细胞贴壁。
[0141]
(5)稀释化合物:使用含10%fbs的培养基稀释化合物为不同浓度梯度,每孔加入100μl,继续培养48h;并设置细胞对照组、空白对照组和dmso对照组。
[0142]
(7)加入cck8:每孔加入10%即20μl cck-8检测试剂,孵育1-2小时,细胞对照组od450达到1左右,使用酶标仪震荡1min,混合均匀后检测在450nm的吸光值,计算细胞存活率(%),使用graphpad prism 8.0计算ic
50
值。
[0143]
细胞存活率(%)=(给药组平均od值-空白平均od值)/(细胞对照组平均od值-空白组平均od值)
×
100%。
[0144]
结果如表3所示。
[0145]
表3 anacardic acid和ginkgolic acid c15:1的细胞毒性评价结果
[0146][0147]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1