一种沙库巴曲缬沙坦钠胃滞留缓释片及其制备方法与流程
1.本发明涉及药物制剂领域,具体涉及一种沙库巴曲缬沙坦钠胃滞留缓释片及其制备方法。
背景技术:
2.心力衰竭(heart failure,hf)是一种进行性致衰疾病,患者的心脏不能泵出足够的血液以供给全身,呼吸困难、乏力和体液潴留等症状可缓慢出现,并逐渐加重,明显影响生活质量。
3.沙库巴曲缬沙坦钠(lcz696)由诺华公司研发,是全球近年来慢性心衰治疗领域具有突破性的创新药物,其是首个血管紧张素受体-脑啡肽酶抑制剂,具有双重作用机制。缬沙坦抑制raas,而沙库巴曲进入体内后在肝脏酶的作用下代谢为有活性的脑啡肽酶抑制剂lbq657,具有抑制脑啡肽酶的作用。该药于2015年先后在美国和欧盟通过上市审批,于2017年进入中国市场,目前已被各国治疗指南推荐为慢性hf的一线治疗药物。
4.目前,国内销售的沙库巴曲缬沙坦钠制剂仅有诺华公司的普通片(50mg、100mg、200mg规格),需一日给药2次,易引起血药浓度波动,且患者顺应性差。将沙库巴曲缬沙坦钠制备成一日给药一次的缓释片,可以减少给药次数,使患者减小漏服和错服的概率,提高患者依从性,并且能够平稳血药浓度,避免服用速释制剂出现的峰谷现象,降低药物毒副作用。
5.cn113456607a公开了一种沙库巴曲缬沙坦钠单层渗透泵控释片及其制备方法,主要是片芯、半透包衣膜和释药小孔三部分,实现长效缓释、零级释放的效果,但药物无法在胃中滞留,可能在药物完全释放之前就被排出体内。cn112641742a公开了一种沙库巴曲缬沙坦钠缓释片,选用缓释材料和填充剂等辅料湿法制粒、压片制得片芯,然后包防潮型薄膜衣。其公开的片剂可以凭借缓释材料水化形成凝胶层,但由于处方中无膨胀剂或崩解剂,稀释剂无法膨胀或崩解,所以凝胶层无法在胃液中持续膨胀或不断溶蚀,所以不能达到胃滞留效果,药物在胃中滞留时间较短,药物可能会释放不完全。cn105748420b公开了一种治疗心力衰竭的lcz696缓释骨架片,处方由主药、骨架材料、稀释剂和润滑剂组成,采用全粉末直接压片制得缓释骨架片;其处方同样无膨胀剂或崩解剂,所以凝胶层无法在胃液中持续膨胀或不断溶蚀,所以不能达到胃滞留效果。cn106176681a公开了一种抗心脏衰竭药物lcz696口服缓释微丸及其制备方法,缓释微丸包括由主药、稀释剂和粘合剂构成的丸芯及丸芯外部由缓释材料、致孔剂、增塑剂和抗粘剂组成的包衣;根据其专利中处方信息分析可知,该缓释微丸丸芯仅有主药和稀释剂,无漂浮材料和亲水凝胶材料,故该微丸无法达到在胃液中长时间漂浮或膨胀滞留的效果。
6.药物在吸收部位的停留时间是影响治疗效果的关键因素之一。传统的口服给药系统往往由于快速的胃排空、较短的胃肠道转运时间,在药物完全释放之前就被排出体内,导致生物利用度降低。胃滞留片的开发使药物在胃部长时间停留成为可能,它主要依靠增大制剂的尺寸、增加胃内漂浮时间的方式来避免快速胃排空。因此开发的沙库巴曲缬沙坦钠
胃滞留缓释片,可实现片剂口服后能够长时间停留于胃部,不被胃排空到肠道,从而实现定位释放,增加药物在胃肠道上端的吸收,药物作用时间有效延长、生物利用度提高,减少给药频率,增加患者顺应性,具有临床价值。
技术实现要素:
7.针对现有剂型的不足,本发明的目的是提供一种沙库巴曲缬沙坦钠胃滞留缓释片及其制备方法,以延长药物在胃中滞留时间,增加药物在胃肠道上端吸收,提高生物利用度,降低给药次数,提高药品安全性和患者顺应性。
8.本发明是由以下技术方案实现的:
9.一方面,本发明提供一种沙库巴曲缬沙坦钠胃滞留缓释片,素片组成成分占片芯重量百分比如下:30%~65%沙库巴曲缬沙坦钠,10%~30%缓释材料,5%~20%稀释剂,10%~40%膨胀剂和0.1%~8%润滑剂。
10.在一些实施方案中,所述的沙库巴曲缬沙坦钠胃滞留缓释片,素片组成成分占片芯重量百分比如下:45%~50%沙库巴曲缬沙坦钠,20%~23%缓释材料,5%~11%稀释剂,16%~23%膨胀剂和1.3%~1.5%润滑剂。
11.在一些实施方案中,所述缓释材料选自聚氧乙烯、羟丙甲基纤维素、羟丙基纤维素、海藻酸钠、卡波姆和聚乙烯吡咯烷酮中的一种或几种的组合,优选为hpmc k100lv、hpmc k4m或hpmc k15m中的一种或几种的组合,更优选为hpmc k100lv。
12.在一些实施方案中,所述膨胀剂选自交联聚维酮、交联羧甲纤维素钠、交联羧甲纤维素钙、羧甲淀粉钠、预胶化淀粉或低取代羟丙基纤维素中的一种或几种的组合,优选为交联聚维酮、交联羧甲纤维素钠或羧甲淀粉钠中的一种或几种的组合,更优选为交联聚维酮。
13.在一些实施方案中,所述稀释剂选自乳糖、甘露醇、微晶纤维素或预胶化淀粉中的一种或几种的组合,优选为乳糖。
14.在一些实施方案中,所述润滑剂选自硬脂酸镁、滑石粉、月桂醇硫酸镁、微粉硅胶、聚乙二醇中的一种或几种的组合,优选为硬脂酸镁。
15.在一些实施方案中,所述的沙库巴曲缬沙坦钠胃滞留缓释片由素片进行外部薄膜包衣制得,外部薄膜包衣层的包衣材料为胃溶型包衣材料,优选为胃溶型欧巴代包衣粉。
16.在一些实施方案中,所述的包衣材料的用量为每100片用3.8g。
17.在一些典型的实施方案中,所述的沙库巴曲缬沙坦钠胃滞留缓释片的组成如下:
[0018][0019]
另一方面本发明提供了所述的沙库巴曲缬沙坦钠胃滞留缓释片的制备方法,包括以下步骤:
[0020]
(1)按沙库巴曲缬沙坦钠胃滞留缓释片中各组分的处方组成,称取各组分,过筛,
混合均匀;
[0021]
(2)将称取的各组分过筛,混合均匀,加入适量润湿剂无水乙醇制粒,过20目筛湿整粒,40℃烘箱干燥0.5小时,过20目筛干整粒;
[0022]
(3)加入润滑剂总混均匀;冲模压片;
[0023]
(4)按处方量称取胃溶型薄膜包衣剂,并分别溶解于处方量的蒸馏水中,混合均匀形成包衣液,素片置包衣锅内包衣,即得沙库巴曲缬沙坦钠胃滞留缓释片。
[0024]
优选地,步骤(3)压片模具为直径22.75mm的圆形浅凹冲模;压片硬度为8-11kg。
[0025]
优选地,步骤(4)片床温度为40~45℃,包衣增重3~5%。
[0026]
本发明的有益效果:本发明开发的胃滞留缓释片主要依靠亲水凝胶骨架材料和膨胀剂来同时达到缓释效果和胃滞留效果。按照本发明制得的胃滞留缓释片,在ph1.2盐酸溶液释放时间延长,释放度高;在ph1.2盐酸溶液中起漂时间短,总漂浮时间大。因此,本发明制得的胃滞留缓释片可在胃中滞留时间有效增加,使药物作用时间有效延长、生物利用度提高,减少给药频率,增加患者顺应性,具有临床价值。
附图说明
[0027]
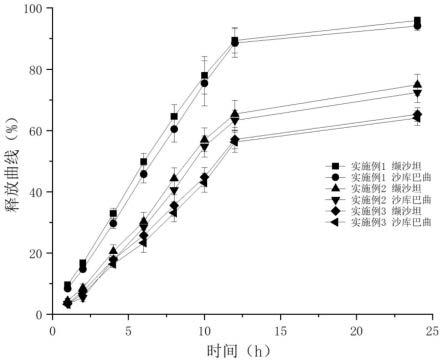
图1实施例1~3沙库巴曲缬沙坦钠胃滞留缓释片的体外累积释放百分数—时间曲线;
[0028]
图2实施例4~6沙库巴曲缬沙坦钠胃滞留缓释片的体外累积释放百分数—时间曲线;
[0029]
图3实施例7~8沙库巴曲缬沙坦钠胃滞留缓释片的体外累积释放百分数—时间曲线;
[0030]
图4实施例9~10沙库巴曲缬沙坦钠胃滞留缓释片的体外累积释放百分数—时间曲线。
具体实施方式
[0031]
以下结合具体实施方式对本发明作进一步详细说明。应该强调的是:下述说明仅仅是示例性的,而本发明不受以下实施例的范围限制,实施例中采用的实施条件可以根据具体要求做进一步调整。
[0032]
实施例1~实施例10的制备方法:称取处方量药物和辅料(除硬脂酸镁外),过筛,混合均匀。加入3-7g(20片量)润湿剂无水乙醇制粒,过20目筛湿整粒,40℃烘箱干燥0.5小时,过20目筛干整粒。加入处方量的硬脂酸镁总混。直径22.75mm的圆形浅凹冲模压片,硬度8-11kg。按处方量称取包衣粉,磁力搅拌下,加入水中,搅拌至分散均匀。片芯置于包衣锅内,控制片床温度40~45℃,包衣增重3~5%。
[0033]
根据中国药典2020版四部通则0931溶出度与释放度测定方法第二法桨法,以ph1.2盐酸溶液(含0.5%吐温80)900ml为释放介质,加沉降篮,转速50rpm,温度为(37
±
0.5)℃,分别在1h,2h,4h,6h,8h,10h,12h和24h取液10ml,并同时补充等量同温新鲜介质。样品经0.45μm微孔滤膜滤过,取续滤液1ml作为供试品溶液。另取沙库巴曲缬沙坦钠水合物对照品450mg,精密称定,置100ml量瓶中,加稀释剂水-乙腈(1:1)溶液稀释、定容,作为对照溶液贮备液,移取1ml贮备液置10ml量瓶中,加溶出介质使溶解,并稀释至刻度,摇匀,作为
对照品溶液。照高效液相色谱法(中国药典2015年版四部通则0512)测定。用十八烷基硅烷键合硅胶为填充剂(gl inersil ods-3,4.6
×
150mm,3μm),柱温为30℃,以水-乙腈-三氟乙酸(500:500:1)为流动相,流速为每分钟2.0ml,检测波长为255nm,进样量10μl,外标法计算其累积释放百分率。在ph1.2盐酸溶液中测定起漂时间和总漂浮时间。
[0034]
按照本发明制得的缓释片,在ph1.2盐酸溶液(含0.5%吐温80)中进行释放度实验,具有以下药物释放特性:
[0035]
时间累计释放度2h10%~30%8h45%~65%12h>80%
[0036]
按照本发明制得的缓释片,在ph1.2盐酸溶液中具有以下漂浮特性:
[0037]
起漂时间总漂浮时间<1min>8h
[0038]
实施例1
[0039]
片芯处方
[0040][0041][0042]
包衣膜处方
[0043][0044]
实施例2
[0045]
片芯处方
[0046]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k4m215mg交联聚维酮xl207mg乳糖100mg硬脂酸镁13mg
[0047]
包衣膜处方
[0048]
[0049]
实施例3
[0050]
片芯处方
[0051]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k15m215mg交联聚维酮xl207mg乳糖100mg硬脂酸镁13mg
[0052]
包衣膜处方
[0053][0054]
通过图1可以看出,该片重条件下,hpmc作为缓释材料时均可以延迟药物释放,体外总漂浮时间均在8h以上。hpmc k100lv作为缓释材料时,在12h可释放接近90%,而hpmc k4m和hpmc k15m作为缓释材料时,在12h释放均低于80%,这两种缓释材料对药物释放的阻滞能力较强,难以满足目标溶出程度,所以优选hpmc k100lv作为缓释材料。
[0055]
实施例4
[0056]
片芯处方
[0057]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k100lv210mg交联聚维酮xl207mg乳糖100mg硬脂酸镁13mg
[0058]
包衣膜处方
[0059][0060]
实施例5
[0061]
片芯处方
[0062]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k100lv210mg羧甲淀粉钠207mg乳糖100mg硬脂酸镁13mg
[0063]
包衣膜处方
[0064][0065]
实施例6
[0066]
片芯处方
[0067]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k100lv210mg交联羧甲纤维素钠207mg乳糖100mg硬脂酸镁13mg
[0068]
包衣膜处方
[0069][0070]
如图2所示,实施例4、5、6比较了不同膨胀剂对处方的影响,交联聚维酮xl作为膨胀剂时体外总漂浮时间在8h以上;而羧甲淀粉钠、交联羧甲纤维素钠作为膨胀剂时,总漂浮时间均为0h。所以优选交联聚维酮xl作为膨胀剂。
[0071]
实施例7
[0072]
片芯处方
[0073]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k100lv200mg交联聚维酮xl207mg乳糖100mg硬脂酸镁13mg
[0074]
包衣膜处方
[0075][0076]
实施例8
[0077]
片芯处方
[0078]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k100lv200mg交联聚维酮xl150mg乳糖100mg
硬脂酸镁13mg
[0079]
包衣膜处方
[0080][0081]
实施例7、8比较了膨胀剂用量对处方的影响,体外总漂浮时间均在8h以上。通过图3可以看出,交联聚维酮xl 207mg时,在12h可释放接近90%;交联聚维酮xl 150mg时,在12h释放低于80%,所以选择膨胀剂用量为207mg。
[0082]
实施例9
[0083]
片芯处方
[0084][0085][0086]
包衣膜处方
[0087][0088]
实施例10
[0089]
片芯处方
[0090]
组成用量(每片)沙库巴曲缬沙坦钠452mghpmc k100lv205mg交联聚维酮xl207mg乳糖50mg硬脂酸镁13mg
[0091]
包衣膜处方
[0092][0093]
如图4所示,实施例9、10比较了稀释剂用量对处方的影响,体外总漂浮时间均在8h以上。乳糖用量为100mg时,在12h可释放接近90%;乳糖用量为50mg时,在12h释放低于80%,所以选择稀释剂用量为100mg。
[0094]
下表为实施例1~实施例10沙库巴曲缬沙坦钠胃滞留缓释片的体外起漂时间和总漂浮时间。
[0095]
样品起漂时间(s)总漂浮时间(h)实施例1<1>8实施例2<1>8实施例3<1>8实施例4<1>8实施例5/0实施例6/0实施例7<1>8实施例8<1>8实施例9<1>8实施例10<1>8
[0096]
最后说明的是,以上实施例仅用于说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者同等替换,而不脱离本发明技术方案的宗旨和范围,均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1