一种富含外泌体的水凝胶及其制备方法和应用
1.本发明属于组织工程技术领域,尤其涉及一种富含外泌体的水凝胶及其制备方法和应用。
背景技术:
2.前列腺癌根治术导致的海绵体神经损伤(cavernous nerve injury,cni) 是术后阴茎勃起功能障碍(erectile dysfunction,ed)的根本原因。尽管近几年相关技术和解剖学研究取得了一定进展,尤其是保留海绵体神经的技术已被用于避免性功能障碍,但ed仍然是前列腺癌根治术的主要并发症。
3.组织工程(tissue engineering),是一门以细胞生物学和材料科学相结合,进行体外或体内构建组织或器官的新兴学科。将体外扩增的细胞与具有良好生物相容性、可降解性和可吸收的生物材料(支架)按一定的比例混合,使细胞黏附在生物材料(支架)上形成细胞-材料复合物;将该复合物植入机体的组织或器官病损部位,随着生物材料在体内逐渐被降解和吸收,植入的细胞在体内不断增殖并分泌细胞外基质,最终形成相应的组织或器官,从而达到修复创伤和重建功能的目的。
4.生物材料支架是组织工程的核心内容之一。生物材料支架所形成的三维结构在客观上要求需要具有一定的机械强度、降解性能、孔隙率、良好的表面活性及生物组织相容性等特点。所以,惰性生物材料的选择尤为重要。海藻酸钠(sodium alginate,sa)是一种天然多糖,具有成本效益高、吸水率高、生物相容性高、易于加工等优点,已广泛应用于生物医学和组织工程技术;壳聚糖(carboxymethyl chitosan,cmcs)为天然多糖甲壳素脱除部分乙酰基的产物,具有生物降解性、生物相容性、无毒性、抑菌等特点,广泛应用于医用可吸收材料与组织工程载体材料等领域;明胶(gelatin,gel),是一种大分子的亲水胶体,增强了凝胶强度。
5.间充质干细胞疗法在再生医学有着重要的研究前景。然而,考虑到mscs 可能造成的代谢的不稳定性,体内增殖的不可控性以及受损微环境的存活问题。mscs来源的膜性微囊泡外泌体(msc-derived exosomes,msc-exos) 是干细胞研究领域的热点话题。所有培养的细胞类型均可分泌外泌体 (exosomes,exos),exos作为纳米级粒子,具有体积小可快速穿过细胞间隙到达目标,并且具备干细胞相似的生物学功能,又比干细胞利于储存,适合大规模生产。已有研究表明,msc-exos治疗能显著减轻sd大鼠cni,改善勃起功能。但现有技术在采用msc-exos治疗阴茎海绵体神经损伤性勃起功能障碍是通过阴茎海绵体注射方式,注射中使用到的针头插入以及动脉夹阻断血液循环的治疗过程,仍存在微创损伤以及msc-exos体内流失的可能性,mscs的效益较低。
技术实现要素:
6.有鉴于此,本发明的目的在于提供一种富含外泌体的水凝胶,可在海绵体神经损伤部位通过外泌体发挥干细胞的调节功效,改善勃起功能。
7.为了实现上述发明目的,本发明提供了以下技术方案:
8.本发明提供了一种富含外泌体的水凝胶,由外泌体与明胶/海藻酸钠/羧甲基壳聚糖水凝胶经氯化钙交联得到。
9.优选的,所述外泌体包括成体干细胞来源的外泌体。
10.优选的,水凝胶体系中,外泌体终浓度为5
×
107~5
×
109个/ml,明胶终浓度为0.05~0.15g/ml,海藻酸钠终浓度为0.005~0.02g/ml,羧甲基壳聚糖终浓度为0.01~0.03g/ml。
11.本发明还提供了上述富含外泌体的水凝胶的制备方法,包括以下步骤:将明胶、海藻酸钠、羧甲基壳聚糖按体积比1~2:1~2:1~2进行混合,混合均匀后加入等体积外泌体上清液,混匀静置,加入氯化钙溶液交联,弃去多余液体。
12.优选的,所述氯化钙溶液的浓度为0.01~0.03g/ml。
13.优选的,所述混匀静置时间为10~40min,交联时间为5~20min。
14.本发明还提供了上述富含外泌体的水凝胶在制备治疗cni导致的勃起功能障碍的药物中的应用。
15.本发明还提供了上述富含外泌体的水凝胶在制备增加cni条件下神经一氧化氮合酶表达的药物中的应用。
16.本发明还提供了上述富含外泌体的水凝胶在制备减轻cni后的炎症效应的药物中的应用。
17.本发明还提供了上述富含外泌体的水凝胶在制备减少cni条件下原纤维沉积、降低cni条件下纤维化的药物中的应用。
18.相对于现有技术,本发明具有如下有益效果:
19.本发明中富含外泌体的水凝胶,可移植入海绵体神经损伤部位,在海绵体本身受损的前提下,实现无痛无创干预。
20.本发明富含外泌体的水凝胶通过外泌体发挥干细胞的调节功效,作用于海绵体神经损伤部位,通过所述外泌体植于cni表面,达到外泌体在损伤部位发挥干细胞的生物学功能的作用,可有效改善cni导致的勃起功能障碍,减轻cni后的炎症效应,增加cni条件下神经一氧化氮合酶nnos的表达,减少原纤维沉积,降低纤维化。
附图说明
21.图1:本发明整体研究流程图;
22.图2:脂肪间充质干细胞鉴定结果,a为原代及其第三代单层脂肪间充质干细胞光镜,b为adscs流式细胞仪鉴定结果;
23.图3:脂肪间充质干细胞源性外泌体鉴定结果,a为透射电镜图,图片刻度尺度为100nm,b为nanofcm纳米粒径分析结果,c为western blot 结果;
24.图4:外泌体-水凝胶体外活性检测结果,a为不同放大倍数下的扫描电镜图,b为共聚焦显微镜下外泌体荧光染料dir染色;
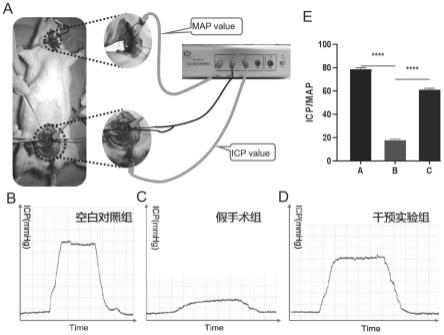
25.图5:治疗4周后sd大鼠勃起功能的情况,a为使用md3000生物电生理刺激仪测定sd大鼠勃起功能的示意图,b-d为在治疗4周后海绵体神经(cn)电刺激时的海绵体内压(icp),b为空白对照组,c为假手术组, d为干预实验组,e为icp/map值(n=3),数据显示为平均
±
sd, ****p《0.0001,与cni比较。
26.图6:治疗4周后阴茎组织中nnos的表达情况,a为激光共聚焦下的荧光图片,图片刻度尺度均为20μm,b示柱状图为各组nnos阳性信号的表达情况,****p《0.0001,与cni比较。
27.图7:治疗4周后海绵体的组织学分析,a为masson三色染色检测海绵体纤维化的代表性组织学图像,图片刻度尺度均为50μm,b示柱状图表示各组的胶原蛋白容积分数,*p《为0.05,**p《0.01,与cni组比较。
具体实施方式
28.本发明提供了一种富含外泌体的水凝胶,由外泌体与明胶/海藻酸钠/羧甲基壳聚糖水凝胶经氯化钙交联得到。本技术所述富含外泌体的水凝胶是以明胶、海藻酸钠和羧甲基壳聚糖生物大分子合成的水凝胶生物支架,荷载间充质干细胞源性的外泌体得到的,为立体凝胶结构,可直接移植入海绵体神经损伤部位。
29.本发明所述外泌体为成体干细胞来源的外泌体,优选为脂肪间充质干细胞来源的外泌体或骨髓间充质干细胞来源的外泌体。在mscs中,脂肪间充质干细胞(adipose-derived stem cells,adscs)更易获得,对机体的损伤更小,是更为理想的mscs的来源。因此所述外泌体更优选为脂肪间充质干细胞来源的外泌体。
30.在本发明制备的水凝胶体系中,外泌体终浓度为5
×
107~5
×
109个/ml,优选为1~10
×
108个/ml,更优选为9.34
×
108个/ml;明胶终浓度为 0.05~0.15g/ml,优选为0.08~0.12g/ml,更优选为0.09~0.1g/ml;海藻酸钠终浓度为0.005~0.02g/ml,优选为0.009~0.015g/ml,更优选为 0.01~0.012g/ml;羧甲基壳聚糖终浓度为0.01~0.03g/ml,优选为 0.015~0.022g/ml,更优选为0.019~0.02g/ml。
31.本发明还提供了所述富含外泌体的水凝胶的制备方法,包括以下步骤:将明胶、海藻酸钠、羧甲基壳聚糖按体积比1~2:1~2:1~2进行混合,混合均匀后加入等量外泌体上清液,混匀静置,加入氯化钙溶液交联,弃去多余液体。
32.本发明分别制备明胶、海藻酸钠、羧甲基壳聚糖、氯化钙溶液备用。所述明胶的制备方法包括:明胶溶解在去离子水中,水浴加热至45~55℃,搅拌至完全溶解后,梯度使用微孔滤膜过滤至无菌;所述海藻酸钠的制备方法包括:海藻酸钠溶解在含有磁力转子的去离子水中,启动磁力搅拌器,调节转速,室温下反应2~3小时后,梯度使用微孔滤膜过滤至无菌;所述羧甲基壳聚糖的制备方法包括:羧甲基壳聚糖溶解在去离子水中,搅拌至无颗粒,梯度使用微孔滤膜过滤至无菌;所述氯化钙溶液的制备方法包括:无水氯化钙粉末溶解在去离子水中,搅拌至无颗粒,梯度使用微孔滤膜过滤至无菌。
33.本发明分离培养间充质干细胞,提取间充质干细胞来源的外泌体备用。
34.在富含外泌体的水凝胶制备时,先将明胶、海藻酸钠、羧甲基壳聚糖进行混合,混合均匀后加入等量外泌体上清液,反复颠倒混匀,转移至皿状容器中静置。所述明胶、海藻酸钠、羧甲基壳聚糖的体积比优选为1:1:1,所述静置时间为10~40min,优选为15~32min,更优选为25~30min。
35.本发明再向混合体系中加入过量的氯化钙溶液进行交联反应,所述氯化钙溶液的浓度为0.01~0.03g/ml,优选为0.015~0.02g/ml,所述交联反应时间为5~20min,优选为8
~12min,更优选为10min。
36.本发明在交联反应结束后弃去多余液体,即得富含外泌体的水凝胶。
37.作为一种可选的实施方式,本发明adsc-exos-gel/sa/cmsc水凝胶的制备方法包括以下步骤:
38.(1)脂肪间充质干细胞的分离培养;
39.(2)脂肪间充质干细胞来源的外泌体的提取;
40.(3)明胶的制备:将明胶溶解在去离子水中,水浴加热至50℃,搅拌至完全溶解后,0.8μm、0.45μm、0.22μm梯度使用微孔滤膜过滤至无菌。
41.(4)海藻酸钠的制备:将海藻酸钠溶解在含有磁力转子的去离子水中,随后启动磁力搅拌器,调节转速,室温下反应3小时,0.8μm、0.45μm、0.22μm 梯度使用微孔滤膜过滤至无菌。
42.(5)羧甲基壳聚糖的制备:将羧甲基壳聚糖溶解在去离子水中,搅拌至无颗粒,0.8μm、0.45μm、0.22μm梯度使用微孔滤膜过滤至无菌。
43.(6)氯化钙的制备:将无水氯化钙粉末溶解在去离子水中,搅拌至无颗粒,0.8μm、0.45μm、0.22μm梯度使用微孔滤膜过滤至无菌。
44.(7)复合水凝胶的制备:将明胶、海藻酸钠、羧甲基壳聚糖以体积比1: 1:1的比例进行混合,混合均匀后加入等体积的外泌体上清液,反复颠倒混匀,转移至皿状容器中静置30分钟,加入过量氯化钙交联10分钟,弃去多余液体。
45.本发明制备的adsc-exos-gel/sa/cmsc水凝胶可为长
×
宽
×
高约为 10mm
×
10mm
×
0.2mm的立体凝胶结构,可直接移植入海绵体神经损伤部位。
46.本发明还提供了所述富含外泌体的水凝胶在制备治疗cni导致的勃起功能障碍的药物中的应用。
47.本发明还提供了所述富含外泌体的水凝胶在制备增加cni条件下神经一氧化氮合酶表达的药物中的应用。
48.本发明还提供了所述富含外泌体的水凝胶在制备减轻cni后的炎症效应的药物中的应用,所述炎症效应具体反映在白细胞介素1β、白细胞介素6、肿瘤坏死因子的下调表达。
49.本发明还提供了所述富含外泌体的水凝胶在制备减少cni条件下原纤维沉积、降低cni条件下纤维化的药物中的应用,所述纤维化集体反映在 masson染色中肌纤维与胶原纤维的比值变化。
50.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
51.下述实施例中,如无特殊说明,均为常规方法。
52.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
53.实施例1
54.本实施例提供了adsc-exos-gel/sa/cmsc水凝胶的制备:
55.(1)sd大鼠脂肪间充质干细胞的分离培养
56.从2周龄的sd大鼠腹股沟皮下取出新鲜的脂肪组织,用含5%青霉素/ 链霉素的磷酸盐缓冲液(pbs)洗涤,剔除血管,剪成小块,加入1ml的 0.25%胰酶放置37℃摇床上消化20分钟,用含10%的胎牛血清dmem高糖培养基中和,收集至离心管,1000rpm,5分钟离心弃
上清。重悬至25cm2的培养瓶中,在37℃,5%湿度的培养箱中培育,培养基每三天更换一次。当细胞单层生长至70~80%时,使用0.25%胰酶消化细胞3分钟,镜下观察细胞皱缩变圆脱壁,即可加入完全培养基中止消化,按1:3的比例进行传代培养。
57.(2)sd大鼠脂肪间充质干细胞外泌体提取
58.将传代至第三代的adscs,细胞单层融合至80%时用pbs洗涤2~3次,更换无血清培养基在37℃,5%湿度的培养箱中培育24~48小时,收集细胞上清液,使用50ml离心管2000
×
g离心15分钟,清除细胞碎片,将上清液转移至50ml圆底螺口离心管,12000
×
g离心30分钟,再次收集上清至 100kda mwco(millipore)1500
×
g离心20分钟。收集浓缩上清液,置于 50ml圆底螺口离心管,缓慢滴加至5ml30%蔗糖重水溶液上,100000
×
g,3 小时。收集试管底端富集微囊泡的部分5ml,用pbs稀释,然后使用pbs 清洗在100kda mwco超滤管下1000
×
g离心20分钟,重复3次。最后,收集滤芯上方液体,在0.22μm微孔过滤器上进行过滤,所有实验均在4℃下进行。提取出的外泌体在-80℃下保存或用于下游实验。
59.(3)明胶制备:将明胶溶解在去离子水中(明胶质量为4g,去离子水体积为40ml),水浴加热至50℃,搅拌至完全溶解后,0.8μm、0.45μm、 0.22μm梯度使用微孔滤膜过滤至无菌。
60.(4)海藻酸钠的制备:将海藻酸钠溶解在含有磁力转子的去离子水中 (海藻酸钠质量为0.4g,去离子水体积为40ml),随后启动磁力搅拌器,调节转速,室温下反应3小时,0.8μm、0.45μm、0.22μm梯度使用微孔滤膜过滤至无菌。
61.(5)羧甲基壳聚糖的制备:将羧甲基壳聚糖溶解在去离子水中(羧甲基壳聚糖质量为0.8g,去离子水体积为40ml),搅拌至无颗粒,0.8μm、 0.45μm、0.22μm梯度使用微孔滤膜过滤至无菌。
62.(6)氯化钙的制备:将无水氯化钙粉末溶解在去离子水中(氯化钙质量为2g,去离子水体积为100ml),搅拌至无颗粒,0.8μm、0.45μm、0.22μm 梯度使用微孔滤膜过滤至无菌。
63.(7)外泌体-水凝胶的制备:在无菌条件下,将明胶、海藻酸钠、羧甲基壳聚糖以体积比1:1:1的比例进行混合,准备浓度为1
×
105/ml的adscs 细胞悬液,提取的adsc-exos在水凝胶中均匀混合,转移至培养皿中静置 30分钟,加入过量氯化钙交联10分钟,弃去多余液体,即可。
64.得到的凝胶体系中的外泌体终浓度为9.34
×
108个/ml,明胶终浓度为 0.1g/ml,海藻酸钠终浓度为0.01g/ml,羧甲基壳聚糖终浓度为为0.02g/ml。
65.对实施例1步骤(1)分离培养的脂肪间充质干细胞进行鉴定:
66.胰酶消化传至第三代的脂肪间充质干细胞后,制成单细胞悬液,pbs清洗细胞两次,1000rpm离心5分钟,弃去上清液,100μlpbs重悬细胞至流式管,使用细胞计数仪调整细胞浓度1
×
105个/ml。分别加入2μlpe-cd90, cd-29及cd-31。四℃避光孵育30分钟,使用pbs反复清洗三次,之后使用贝克曼流式分析仪上机测定,观察并记录结果。测试结果如图2所示。
67.由图2可知,细胞阳性表达干细胞表面标志性抗原cd29和cd90,阴性表达造血干细胞表面标志性抗原cd31。表明成功提取了脂肪间充质干细胞。
68.对实施例1步骤(2)提取得到的脂肪间充质干细胞源性外泌体进行鉴定:
69.透射电镜鉴定外泌体形态:吸取外泌体10μl滴加于铜网上沉淀1分钟,滤纸吸去浮
液。磷钨酸10μl滴加于铜网上沉淀1分钟,滤纸吸去浮液。常温干燥数分钟。80kv进行电镜检测成像。获得透射电子显微镜成像结果。
70.外泌体粒径分析:准备外泌体10μl,使用标准品进行nanofcm纳米流式分析,为避免样本堵塞进样针,测试合格后将梯度稀释后的样本进行上样,检测外泌体的直径。
71.western-blot检测外泌体表面标志物:
72.a.bca检测外泌体浓度。
73.b.根据蛋白分子量大小配置电泳胶。
74.c.取出蛋白样品,加入1/4的5%的loading buffer,恒温金属浴上煮3~5 min,离心甩下。
75.d.进行电泳:将蛋白样品以及蛋白maker按所需顺序用移液器加入到电泳胶上的孔内。电泳条件:80v跑胶至样品跑出浓缩胶,转100v跑胶至溴酚蓝至胶底部。
76.e.转膜:将在甲醇中活化好的pvdf膜,按照海绵-滤纸-电泳胶-膜-滤纸
ꢀ‑
海绵的顺序制作转膜“三明治”。放置转膜槽中,倒入转膜液,300ma,90 分钟转膜。
77.f.封闭:将pvdf膜放置5%的脱脂奶粉中,摇床慢摇1小时。
78.g.tbst清洗3遍后,加入一抗(cd9,1:1000;calnexin,1:1000;tsg101, 1:1000),4℃孵育过夜。
79.h.tbst清洗3遍后,加入二抗(1:5000),室温孵育1h左右。之后使用tbst室温下洗膜3次,每次10分钟。
80.i.将pvdf膜放在成像仪中,滴加成膜液,设置好参数,曝光。
81.检测结果如图3所示,可以看到外泌体为典型的“杯盘”形态,形态完整,大小均一。外泌体平均粒径约为89.61nm。外泌体标记物tsg101和cd9的阳性表达、细胞内质网的特异性分子calnexin阴性表达。
82.对实施例1步骤(7)制备得到的外泌体-水凝胶进行体外活性检测:
83.电子扫描显微镜:使用2.5%戊二醛固定混合后的外泌体-水凝胶样品,使用冷冻干燥机干燥12h,表面喷金用于导电,采用扫描电子显微镜观察。
84.荧光染色:用亲脂性的近红外荧光花青染料(dir)来检测种植外泌体后水凝胶的活性。在1ml外泌体悬液中加入100μm 100μl的dir染料,涡旋振荡混匀,37℃避光孵育30分钟,加入10ml pbs稀释使用超滤管进行提纯,将浓缩上清液与水凝胶混合,2%氯化钙交联后,使用激光共聚焦显微镜观察,最大激发波长为647nm。
85.测试结果如图4所示,可以看到外泌体均匀散在的黏附在水凝胶的孔隙结构内。可以看到红色荧光既外泌体囊泡,定位干细胞源性外泌体在水凝胶中的存在。
86.实施例2
87.本实施例与实施例1的区别在于,将脂肪间充质干细胞外泌体替换为骨髓间充质干细胞外泌体:
88.(1)sd大鼠骨髓间充质干细胞的分离培养
89.从2周龄的sd大鼠取双侧股骨,摘除两端软骨,取含5%青霉素/链霉素的磷酸盐缓冲液(pbs)用1ml注射器冲洗骨髓腔,收集骨髓冲洗液用红细胞裂解液裂解2次,接种于25毫升培养瓶中。在37℃,5%湿度的培养箱中培育,培养基每三天更换一次。当细胞单层生长至70~80%时,使用0.25%胰酶消化细胞3分钟,镜下观察细胞皱缩变圆脱壁,即可加入完全
培养基中止消化,按1:3的比例进行传代培养。
90.(2)sd大鼠骨髓间充质干细胞外泌体提取
91.将传代至第三代的bmscs,细胞单层融合至80%时用pbs洗涤2~3次,更换无血清培养基在37℃,5%湿度的培养箱中培育24~48小时,收集细胞上清液,使用50ml离心管2000
×
g离心15分钟,清除细胞碎片,将上清液转移至50ml圆底螺口离心管,12000
×
g离心30分钟,再次收集上清至 100kda mwco(millipore)1500
×
g离心20分钟。收集浓缩上清液,置于 50ml圆底螺口离心管,缓慢滴加至5ml30%蔗糖重水溶液上,100000
×
g,3 小时。收集试管底端富集微囊泡的部分5ml,用pbs稀释,然后使用pbs 清洗在100kda mwco超滤管下1000
×
g离心20分钟,重复3次。最后,收集滤芯上方液体,在0.22μm微孔过滤器上进行过滤,所有实验均在4℃下进行。提取出的外泌体在-80℃下保存或用于下游实验。
92.其余步骤同实施例1。
93.实验例
94.采用实施例1制备得到的adsc-exos-gel/sa/cmsc水凝胶进行实验。
95.1、动物模型的建立
96.(1)实验动物:共选取30只8周大的sd大鼠(rat;rattus norvegicus),所有动物均购自济南朋悦实验动物繁育有限公司,所有动物实验均经济宁学院附属医院医学科学研究伦理委员会批准,批准号为(2021-08-c016)。饲养于济宁医学院动物房。20只sd大鼠,进行双侧海绵状神经损伤,随机分为两组:adsc-exos-gel/sa/cmcs组(干预实验组),损伤部位移植源性外泌体-水凝胶;假手术组,仅做钳夹损伤处理。其余10组作为空白对照组只进行神经显露。
97.(2)sd大鼠cn模型的建立
98.将大鼠称重,大鼠腹腔注射2%戊巴比妥钠(0.2ml/100g)麻醉,消毒后,于中下腹纵行切口,充分显露膀胱、前列腺及周围组织,在外科手术显微镜下于两侧前列腺背外侧找到盆神经节(mpg)及海绵体神经(cn),游离cn后,用显微血管夹钳夹两侧海绵体神经各2次,每次60秒。干预实验组在钳夹损伤的基础上,即刻在损伤部位植入 adsc-exos-gel/sa/cmsc水凝胶,用可吸收缝线逐层关闭腹腔,饲养两周后进行检测。
99.2、将adsc-exos-gel/sa/cmsc水凝胶移植后损伤部位进行功能检测
100.(1)勃起功能测量
101.治疗四周后,在2%戊巴比妥钠(0.2ml/100g)麻醉下。从颈部到上胸的中线切口暴露右颈动脉,血管内固定含有100u/ml肝素溶液的24g硅胶套管,并连接到md3000-f生物机能实验系统以测量平均动脉(map)。通过中线剖腹手术暴露右侧mpg及cn。随后,将一个含有肝素化的24g针插入一侧海绵体近端,以测量海绵体内压力(icp)。双极不锈钢钩电极进行 cn神经刺激。参数为1.5ma,20hz,脉冲宽度为0.2ms,持续时间为60秒。记录最大阴茎海绵体内压(icp)、icp变化(dicp)、计算icp和map 变化比值(dicp/map)评价勃起功能。
102.测试结果如图5所示,b-d为各组sd大鼠icp曲线,其中,空白对照 (control)组icp曲线正常(b),与空白对照sd大鼠相比,cni始终造成勃起功能下降,假手术(cni)组持续导致ed(c),干预实验组勃起功能部分恢复(d)。这反映在adsc-exos-gel/sa/cmsc组(81
±
0.03)与 cni组(20
±
0.05)相比,对cn电刺激的icp/map反应显着增加 (****p《0.0001)。
103.(2)组织学功能测定
104.勃起功能测试后,采集阴茎中段。用2%的甲醛固定,采用石蜡包埋组织。切片厚度3μm,通过二甲苯和梯度酒精进行脱蜡水合。使用tris(三羟甲基氨基甲烷)盐缓冲液于微波炉内抗原修复,恢复至室温,封闭后孵育一抗兔抗神经型一氧化氮合酶(nnos;1:100)4℃12小时,清洗后二抗孵育,细胞核用含dapi防淬灭封片剂染色。激光共聚焦显微镜观察nnos的表达情况,并使用imagej软件进行荧光阳性信号的定量分析。
105.测试结果如图6a、b所示,a为治疗4周后的各组代表性nnos表达情况,b为荧光信号的表达情况。可见,cni的阴茎中段内nnos荧光强度低于control组,但adsc-exos-gel/sa/cmcs移植治疗后荧光强度明显高于cni(****p《0.0001)。
106.(3)masson染色
107.采取阴茎中段,用pbs清洗。4%甲醛固定,石蜡包埋。切片厚度为3μm,采用masson三色染色法制备。染色后,海绵体肌纤维呈红色,胶原纤维呈蓝色。图像分析采用image进行,用于量化海绵体内胶原纤维与组织总面积的比值情况。
108.测试结果如图7a、b所示,a为治疗4周后的各组代表性组织学图像。 b为各组胶原蛋白容积分数,cni组与干预实验组相比胶原容积分数增高 (*p《0.01)。表明adsc-exos-gel/sa/cmcs预防了海绵体纤维化。
109.统计分析:数据分析采用graphpadprism软件(版本为8)。数据以平均数和标准差表示,统计学比较采用单因素方差及t检验分析,事后比较采用bonferroni检验。统计学显著性标准设定为*p《0.05、**p《0.01、**p《0.001、和****p《0.0001。
110.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1