一种果胶基紫外光响应型纳米载体及其制备方法
1.本发明涉及一种纳米载体及其制备方法,尤其涉及一种果胶基紫外光响应型纳米载体及其制备方法。
背景技术:
2.肿瘤是威胁人类健康的杀手之一,目前,化学药物治疗是最常用的癌症治疗手段之一,但化疗药物缺乏肿瘤特异性,患者常受到消化障碍、骨髓抑制、肝肾损伤及免疫功能下降等毒副作用的困扰。近年来,纳米载体在肿瘤的靶向治疗及药物的可控释放等生物医学领域的应用日益受到人们的关注。理想的纳米载体应该具备高的载药量,运输过程中低的药物泄露和有效的靶点药物可控释放。释药可控的药物递送系统能够被人为控制实现治疗药物在病灶处(如肿瘤)可控快速释放,克服了传统药物递送系统的诸多缺点(药物释放缓慢,选择性差,药物利用率低等)。因此,设计开发刺激响应触发的释药可控药物递送系统正受到科研工作者的广泛关注。构成可控释药递送系统的材料被称为“智能材料”,他们可以对生物体的一些内部(ph、氧化还原、酶等)或外部(温度、电/磁、超声和光等)的刺激响应,响应前后,材料发生组成或构象上的变化,破坏递送系统原有的平衡,从而使药物从递送系统中释放。而光是一种清洁,无创和有效的刺激源。将特定波长的光用于肿瘤的精准治疗主要有光动力治疗、光热治疗、光声成像以及光控释放药物递送系统等,在这几种治疗系统中,光控释药型药物递送体系通过调节光的波长和强度以及光照时间和空间,实现药物在病灶部位的高浓度光控释放,减少药物对正常部位的毒性,因此光控释药的药物递送系统在精准医疗领域有着巨大的应用价值和广阔的发展前景。
3.果胶是由单糖单元通过糖苷键连接成不同长度的线性或支链复杂生物聚合物。果胶不仅具有较高生物利用度、较好生物相容性和较低生物毒性,而且其结构中还具有多种活性基团,如氨基、羧基或羟基,通过酯化、醚化和酰胺化等方式,在主链修饰上多种官能团。单体重复单元中含有可电离基团的多糖称为聚电解质,分为聚阳离子和聚阴离子,利用聚阴离子和聚阳离子之间的静电相互作用可以合成聚电解质复合物。当在多糖主链上修饰上相应的刺激响应基团后,聚电解质复合物将以预设的方式响应温度、ph、光、生物分子或其他刺激,这在药物递送系统的设计中具有很大的应用价值。
4.偶氮苯基团作为一种常见的光响应性基团,在光诱导下会发生顺-反异构。在紫外光刺激下,修饰有偶氮苯基团的聚电解质复合物由于偶氮苯顺-反异构所引起的极性、空间等变化,其结构可能会发生分解,实现光刺激响应性药物释放。但是目前还缺少能负载药物并对紫外光具有刺激响应性的果胶基纳米载体。
技术实现要素:
5.发明目的:本发明旨在提供一种能有效负载抗癌药物的果胶基紫外光响应型纳米载体,有利于提高药物的利用率,减缓抗肿瘤药物对正常细胞的损伤,提高药物对肿瘤细胞的药效;本发明的另一目的在于提供一种所述果胶基紫外光响应型纳米载体的制备方法。
6.技术方案:本发明所述的果胶基紫外光响应型纳米载体是先将偶氮苯通过酰胺键连接到果胶上,再将聚二烯丙基二甲基氯化铵与连接有偶氮苯的果胶通过静电吸附层-层堆叠形成的纳米囊。
7.所述果胶基紫外光响应型纳米载体的制备方法包括以下步骤:
8.(1)将原硅酸四乙酯的乙醇溶液加入氨水、纯水和乙醇的混合溶液中,搅拌,得到sio2纳米粒溶液;
9.(2)将果胶加入n-羟基丁二酰亚胺和n-羟基丁二酰亚胺中,活化,加入4-氨基偶氮苯-4'-磺酸钠盐得到cp-azo溶液;
10.(3)将cp-azo溶液与聚二烯丙基二甲基氯化铵溶液交替加入sio2纳米粒溶液中,离心,加入氢氟酸,洗涤,离心,得到药物载体cp-azo/pdadmac。
11.优选地,步骤(1)中所述sio2纳米粒子为150-180nm。
12.优选地,步骤(2)中所述果胶、n-羟基丁二酰亚胺、n-羟基丁二酰亚胺的质量比为1:3:1~1:2:1。
13.优选地,步骤(3)中所述cp-azo溶液、聚二烯丙基二甲基氯化铵溶液质量浓度范围均为0.1mg ml-1
~1.0mg ml-1
。
14.以所述果胶基紫外光响应型纳米载体作为药物载体的载药纳米颗粒,所述药物为盐酸阿霉素。
15.优选地,所述载药纳米颗粒能通过紫外光照射在细胞分子内释放药物盐酸阿霉素。
16.所述载药纳米颗粒的制备方法为:先配置盐酸阿霉素标准品水溶液,再将其加入到权利要求1所述的纳米载体中,然后摇床避光条件下摇晃,离心、洗涤、冷冻干燥,最终获得dox/cp-azo/pdadmac样品载药纳米颗粒。
17.所述载药纳米颗粒可应用于治疗癌症。
18.本发明所述的生物相容性良好的果胶基紫外光响应型纳米载体,利用生物相容性良好的果胶基偶氮衍生物(cp-azo)和聚二烯丙基二甲基氯化铵(pdadmac)物质,利用静电层层自组装、氢键作用等制备了具有紫外光响应性能的纳米囊泡,生物相容性良好,特定靶向肝癌细胞,在血液生理环境条件下稳定对肝癌细胞特定靶向,在光照下裂解释放大量药物,从而减少药物在血液循环中对正常细胞的损伤,在肿瘤微环境下可以实现药物的光控释放,提高抗癌活性。
19.为了减少药物的浪费提高药物的利用率,减缓抗肿瘤药物(dox)对正常细胞的损伤,提高药物对肿瘤细胞的药效等问题,本发明提供了一种载药纳米颗粒,使其在血液生理环境条件下稳定对肝癌细胞特定靶向,在光照下裂解释放大量药物,从而减少药物在血液循环中对正常细胞的损伤,提高药物对肿瘤细胞的药效。本发明采用上述方案后,具有以下
20.本发明制备得到偶氮苯修饰的柑橘果胶(cp-azo),基于生物相容性良好的偶氮苯柑橘果胶(cp-azo)和聚二烯丙基二甲基氯化铵(pdadmac)等物质,利用静电自组装、氢键作用等制备了具有紫外光(uv)响应性能的纳米颗粒,生物相容性良好,可以实现药物对肝癌细胞靶向释放,提高药物的利用率和对癌细胞的杀伤率。
21.有益效果:与现有技术相比,本发明具有如下显著优点:(1)dox/cp-azo/pdadmac nps在生理条件下形态良好,为单一均匀的球形结构;(2)dox/cp-azo/pdadmac nps在生理
条件下特异性靶向肝癌细胞;(3)dox/cp-azo/pdadmac nps在紫外光照下结构分解并释放dox;(4)dox/cp-azo/pdadmac nps对肝癌细胞没有毒性,dox/cp-azo/pdadmac nps能减少对正常细胞的毒性;(5)载体cp-azo/pdadmac nps对肝癌细胞没有毒性,dox/cp-azo/pdadmac nps能在细胞内紫外光响应性释放dox,抑制肝癌细胞生长。
附图说明
22.图1为cp-azo/pdadmac nps的tem图;
23.图2为cp-azo/pdadmac nps经紫外光照后的tem图;
24.图3为cp-azo的氢-核磁共振吸收谱图;
25.图4为cp-azo的红外吸收谱图;
26.图5为dox/cp-azo/pdadmac nps在不同温度(4.0℃、37.0℃)和不同ph条件下(ph=4.0、7.4、8.0)的稳定性测试图;
27.图6为dox/cp-azo/pdadmac nps在365nm紫外光照射和未照射下不同时间的dox释放曲线;
28.图7为dox/cp-azo/pdadmac nps的细胞摄取图。
具体实施方式
29.下面结合附图对本发明的技术方案作进一步说明。
30.实施例1
31.所述果胶基紫外光响应型纳米载体中偶氮苯通过酰胺键连接到果胶(cp)上,聚二烯丙基二甲基氯化铵与连接有偶氮苯的果胶通过静电吸附层-层堆叠形成纳米囊。该实施例中所述果胶(cp)从柑橘中提取,质量规格是≥74.0%(半乳糖醛酸计量);所述聚二烯丙基二甲基氯化铵(pdadmac)的规格或纯度为20wt.%水溶液,600-900cp(25℃)。该纳米载体的制备方法包括以下步骤:
32.sio2(150~180nm)纳米粒的制备:第一步,将3ml氨水(28%)和7ml纯水加入95ml乙醇中,得到混合溶液a;第二步,将3.5ml原硅酸四乙酯与20ml乙醇混合,得到混合溶液b;第三步,3500rmp剧烈搅拌下,将溶液b快速加入混合溶液a中,剧烈搅拌1min后,200rpm缓慢搅拌2h;第四步,将溶液离心分离,用酒精洗涤3次,最后将离心所得产品分散于纯水中,得到平均粒径约150~180nm的sio2纳米粒。
33.cp-azo的制备:取0.2g(0.1mmol)cp溶解于水溶液中(ph=6.2,100ml),然后在此溶液中加入0.6g(0.3mmol)碳化二亚胺(edc)和0.2g(0.15mmol)n-羟基丁二酰亚胺(nhs),然后室温下搅拌15min。紧接着,调节该溶液ph值为7.3,加入0.6g(3mmol)氨基偶氮苯(azo-nh2),继续室温下搅拌48h,经透析、冷冻干燥后,得到产品,产率为88.3%。
34.cp-azo的1h nmr测试
35.cp-azo的1h nmr表征在brukeravanceiii400-mhz核磁共振波谱仪上完成,将cp-azo溶于氘代水(d2o,4.79ppm)中,测试温度为25℃。结果如图1所示。
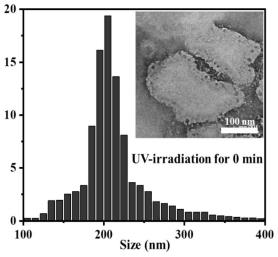
36.cp-azo的ftir测试
37.cp-azo的结构表征在红外光谱仪thermofishernicoletis5上完成。所有样品均需要真空干燥完全除水后,与kbr充分研磨,再用压片机压片,测试。结果如图2所示。
38.cp-azo/pdadmac nps的制备:
39.第一步,配置溶液:(1)聚二烯丙基二甲基氯化铵(pdadmac)溶液(1.0mg ml-1
in 0.15m nacl,10ml);(2)cp-azo溶液(1.0mg ml-1
,0.15m nacl,10ml。第二步,sio2/pdadmac的制备:将2ml sio2分散液(0.5g ml-1
)边搅拌边逐滴加入聚二烯丙基二甲基氯化铵(pdadmac)溶液(1.0mg ml-1
,0.15m nacl,10ml)中,滴加结束后继续搅拌30min。将此溶液离心、纯水洗涤3次,收集沉淀,得到sio2/pdadmac。将此产物再次分散于2ml纯水中,得到sio2/pdadmac分散液,保存、待用。第三步,sio2/pdadmac/cp-azo的制备:将上步中得到的2ml sio2/pdadmac分散液再次逐滴加入cp-azo溶液,持续搅拌30min,反复离心、洗涤3次,收集沉淀,得到sio2/pdadmac/cp-azo。第四步,重复上述第二步、第三步过程,直到得到6层sio2/pdadmac/cp-azo,最后将其分散于2ml纯水中,保存、待用。第五步,在上述sio2/pdadmac/cp-azo分散液中,加入2ml hf(10%)溶液,并置于通风橱内反应30min,消蚀除去sio2模板。第六步,将上述溶液透析,冻干,得到空心的cp-azo/pdadmac纳米囊(cp-azo/pdadmac nps)。
40.cp-azo/pdadmac nps表面电位测试
41.cp-azo/pdadmac纳米囊的zeta电位在仪器malvenzetasizernano上测试得到。将测试样品分散为0.1mg ml-1
的分散液,并超声使其分散均匀,分散液ph值保持在7.4,测试温度为25℃。同一样品重复测定3次,取平均值作为样品最终的zeta电位值,为-31.8mv。
42.紫外光照前后cp-azo/pdadmac nps流体力学直径(dls)、样貌(tem)测试
43.cp-azo/pdadmac纳米囊(光照前后)的粒径分布及水中稳定性均在动态光散射仪(dls,malvenautosizer4700)上测试完成。将样品配置为0.1mg ml-1
的分散液,置于样品池中稳定5min,测定温度为25℃,散射角度为90
°
,激光波长为532nm,功率为150w,设定分散剂水的折射率为1.332,粘度为0.89pa
·
s。光照前的结果如图3所示,其为空心的纳米囊结构,平均粒径为200nm。光照后的结果如图4所示,其显示为模糊的、杂乱的聚合物状态,这说明cp-azo/pdadmac结构发生了紫外光响应性的分解9
44.实施例2
45.所述果胶基紫外光响应型纳米载体中偶氮苯通过酰胺键连接到果胶(cp)上,聚二烯丙基二甲基氯化铵与连接有偶氮苯的果胶通过静电吸附层-层堆叠形成纳米囊。该纳米载体的制备方法包括以下步骤:
46.sio2(80~120nm)纳米粒的制备:第一步,将3ml氨水(28%)和7ml纯水加入95ml乙醇中,得到混合溶液a;第二步,将2.5ml原硅酸四乙酯与20ml乙醇混合,得到混合溶液b;第三步,3500rmp剧烈搅拌下,将溶液b快速加入混合溶液a中,剧烈搅拌1min后,800rpm缓慢搅拌2h;第四步,将溶液离心分离,用酒精洗涤3次,最后将离心所得产品分散于纯水中,得到平均粒径约80~120nm的sio2纳米粒。
47.cp-azo的制备:取0.2g(0.1mmol)cp溶解于水溶液中(ph=6.2,100ml),然后在此溶液中加入0.6g(0.3mmol)碳化二亚胺(edc)和0.2g(0.15mmol)n-羟基丁二酰亚胺(nhs),然后室温下搅拌15min。紧接着,调节该溶液ph值为7.3,加入0.6g(3mmol)氨基偶氮苯(azo-nh2),继续室温下搅拌48h,经透析、冷冻干燥后,得到产品,产率为88.3%。
48.cp-azo/pdadmac nps的制备:
49.同实施例1。
50.实施例3
51.所述果胶基紫外光响应型纳米载体中偶氮苯通过酰胺键连接到果胶(cp)上,聚二烯丙基二甲基氯化铵与连接有偶氮苯的果胶通过静电吸附层-层堆叠形成纳米囊。该纳米载体的制备方法包括以下步骤:
52.sio2(150~180nm)纳米粒的制备:同实施例1。
53.cp-azo的制备:同实施例1
54.cp-azo/pdadmac nps的制备:
55.第一步,配置溶液:(1)聚二烯丙基二甲基氯化铵(pdadmac)溶液(0.1mg ml-1
,0.15m nacl,10ml);(2)cp-azo溶液(0.1mg ml-1
,0.15m nacl,10ml。第二步,sio2/pdadmac的制备:将2ml sio2分散液(0.5g ml-1
)边搅拌边逐滴加入聚二烯丙基二甲基氯化铵(pdadmac)溶液(1.0mg ml-1
,0.15m nacl,10ml)中,滴加结束后继续搅拌30min。将此溶液离心、纯水洗涤3次,收集沉淀,得到sio2/pdadmac。将此产物再次分散于2ml纯水中,得到sio2/pdadmac分散液,保存、待用。第三步,sio2/pdadmac/cp-azo的制备:将上步中得到的2ml sio2/pdadmac分散液再次逐滴加入cp-azo溶液,持续搅拌30min,反复离心、洗涤3次,收集沉淀,得到sio2/pdadmac/cp-azo。第四步,重复上述第二步、第三步过程,直到得到6层sio2/pdadmac/cp-azo,最后将其分散于2ml纯水中,保存、待用。第五步,在上述sio2/pdadmac/cp-azo分散液中,加入2ml hf(10%)溶液,并置于通风橱内反应30min,消蚀除去sio2模板。第六步,将上述溶液透析,冻干。
56.实施例4
57.dox/cp-azo/pdadmac nps的制备
58.将按照实施例1制备的cp-azo/pdadmac nps纳米颗粒与10mg ml-1
dox水溶液混合,dox与cp-azo/pdadmac的质量比为2:3,置于摇床避光条件下摇晃48h,离心、洗涤、冷冻干燥,得到dox/cp-azo/pdadmac样品。
59.cp-azo/pdadmac nps载药量和包封率的测定
60.(1)配置dox标准溶液。dox的最大紫外吸收波长λ
max
=480nm,测定不同浓度下dox在λ
max
=480nm处的紫外吸光度值a,即可做出dox的浓度(c)-吸光度值(a)的标准曲线,用origin软件拟合该标准曲线,得到浓度(c)-吸光度值(a)的标准曲线方程式。(2)将一定质量m1的dox配成溶液。(3)测一定质量(m2)空的cp-azo/pdadmac纳米囊载药前后上清液(稀释至合适的测试浓度)在λ
max
=480nm处的吸光度值,通过dox的标准曲线方程计算出载药前后溶液中相应的dox浓度变化,计算出被nps载入的dox的质量(m3)。最后根据下列公式分别计算载药率dlc(%)和包封率dle(%)。计算得该纳米囊的载药率(dlc)为10.45%,包封率(dle)为85.03%。
[0061][0062][0063]
dox/cp-azo/pdadmac nps的累积释药量测试
[0064]
取一定质量的已载药样品,根据载药率计算出其中含有总的dox质量,在紫外光下照射不同的时间后,分别取上清液测定λ
max
=480nm处的吸光度值(测试完成后,上清液要倒回原溶液中,保持原溶液体积不变),根据dox的标准曲线方程式,计算出不同光照时间处对
应的dox累积释放浓度,折合成对应的质量,并计算出与总质量的百分比,作时间(t)—累积释药百分比(accumulation%)曲线。结果如图5所示,在紫外光照射条件下,30min内dox的累积释放率达达到最高,为69%,继续进行光照,80min内无明显累积释放率的增加。作为对照组,没有紫外光照射时,80min内dox/cp-azo/pdadmac纳米囊的dox释放率约为10%。
[0065][0066]
dox/cp-azo/pdadmac的稳定性测试:
[0067]
将载药的纳米微球分散在2ml去离子水中,再转移到截留分子量为3000da的透析袋中,紧接着快速将透析袋浸入上述200ml上述三种不同ph缓冲液中,室温下轻微磁力搅拌。每隔一段时间从释放体系中取出1ml溶液,同时再补加同种类的1ml缓冲液,确保总体积维持在200ml不变。通过用uv-vis测定不同时间点释放体系中dox的浓度计算出不同时间点的释药量。所有不同释放体系的释放实验均重复三次,最终dox的释药量取平均值。在上述实验条件下,每隔24h,取上清液进行一次紫外吸光度测试,连续监测7天,紫外吸光度结果将用于评价dox/cp-azo/pdadmac纳米囊的稳定性。结果如图6所示,在不同的ph和温度下,无外加紫外光刺激时,包封的dox无明显泄露,结构稳定。
[0068]
激光共聚焦显微镜对细胞内dox/cp-azo/pdadmac紫外光响应性释放定性检测。
[0069]
将生长状况良好的hepg2细胞按程序经过消化、计数和稀释过程,铺入含有圆玻片的12孔板中,每个孔内细胞的个数为2
×
105个,将其置于37℃培养箱中培养24h,直到细胞完全贴壁。仔细吸出培养液,将细胞用冰pbs漂洗2遍,然后在孔内加入用ph为6.5或7.4的无血清dmem培养液配制的dox/cp-azo/pdadmac分散液(10μm,1ml)。置于37℃分别培养2h后,将细胞分为2组:(1)细胞仅作dox/cp-azo/pdadmac分散液处理,不被紫外光照射;(2)细胞不仅作dox/cp-azo/pdadmac分散液处理,还要经紫外光照射不同的时间(5min、15min、30min)。将实验组内上层培养液小心移除,并用冰pbs漂洗3次,每次5min。然后,在室温下向孔洞内加入4%多聚甲醛以固定细胞,30min后,用冰pbs漂洗3次,每次5min。随后,用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,dapi)染色细胞核,然后用冰pbs漂洗3次,每次5min。最后,从12孔板中捞出圆玻片,用超纯水将其漂洗干净,稍作晾干,加入少量防淬灭剂,最后封片。将片子置于激光共聚焦显微镜下观察,并拍摄。dapi的最大激发波长为346nm,dox分子的最大激发为480nm。结果如图7所示,dox/cp-azo/pdadmac被hepg2细胞有效摄取,在细胞内发生了紫外光响应性释放dox过程。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1