化合物ARV-825在治疗NUT癌中的应用的制作方法
化合物arv-825在治疗nut癌中的应用
技术领域
1.本发明属于生物医药领域,涉及化合物arv-825新的医药用途,具体涉及化合物arv-825通过靶向brd4显示抗brd4-nut融合蛋白的抗肿瘤活性,在制备治疗nut癌药物中的用途。
背景技术:
2.目前bet蛋白家族成员中研究最多的时brd4蛋白。brd4 是一种转录和表观遗传调节因子,在胚胎发生和癌症发展过程中起着关键作用。作为溴结构域和末端外结构域 (bet) 家族的成员,brd4 的特征在于具有两个串联溴结构域(bd1、bd2)。bds 结合靶蛋白(包括组蛋白)上的乙酰化赖氨酸残基,因而对具有多个乙酰化残基的蛋白质的亲和力更高。brd4与染色质上的超乙酰化组蛋白区域相互作用,在转录活性调控元件上积累并在起始和延伸步骤中促进基因转录。brd4功能障碍与多种癌症的发生和进展相关,包括急性髓系白血病、结肠癌、burkitt氏淋巴瘤、乳腺癌、弥漫性大b细胞淋巴瘤、多发性骨髓瘤和卵巢癌。此外,它是染色体15和19之间的染色体易位的位置,这是侵袭性nut癌的原因,通常表现为单个t易位,并产生新的融合癌基因brd4-nut。
3.nutm1(也称nut)是nut中线癌家族成员1,是仅在睾丸表达的核蛋白,其功能未知。nutm1与brd4融合通常在鳞状细胞癌的nut中线亚群中发现,并在软组织肿瘤中有报道,许多其他的nutm1融合在各种其他类型的肿瘤中也有报道。brd4-nut由brd4和nutm1融合产生,导致细胞分化抑制。brd4-nutm1融合与nut中线癌相关。nut基因重排可能导致nut癌(nc),这是一种鳞状细胞癌的侵袭性亚型。nc主要作用于身体中线器官。它表现为一种单胚性低分化鳞状细胞癌。brd4-nut融合引起的染色体易位是遗传性疾病nc最常见的原因。这种癌症的发病年龄从不等。nc几乎是致命的,而且对目前已知的治疗方法几乎完全耐药,即使是积极的化疗,诊断为nc后的典型生存期不到一年(9.5个月)。
4.protac(proteolysis-targetingchimeras, 蛋白降解靶向联合体)是一种利用泛素-蛋白酶系(ubiquitin-proteasomesystem,ups)对靶蛋白进行降解的药物开发技术。protac是一个两头含有不同配体的化学分子,一头是结合e3连接酶的配体,另一头是结合细胞内蛋白质的配体,这两个配体再由一段linker连接起来。这样的化学分子既可以结合e3泛素连接酶,又可以结合胞内蛋白质,通过把靶向的蛋白质招募到e3泛素连接酶附近来实现靶向蛋白质的多泛素化,最后被蛋白酶体降解。protac可以循环使用,不被蛋白酶体降解。在患者体内,protac的靶蛋白配体和靶蛋白结合,e3泛素连接酶配体和细胞内的e3泛素连接酶的底物结合区结合,从而通过linker把靶蛋白拉近到e3泛素连接酶旁边,实现ups系统将靶蛋白降解。已有研究表明,使用protac技术将brd4抑制剂与配体结合的arv-825能更有效地分解brd4,有效地抑制肿瘤生长,并能持续地抑制。研究表明arv-825在胰腺癌、vemurafenib耐药黑色素瘤、胆管癌、甲状腺癌、急性髓系白血病、t细胞急性淋巴细胞白血病和神经母细胞瘤中的抗肿瘤作用。然而在arv-825化合物对nut癌的作用机制和抗肿瘤活性鲜有报道。
技术实现要素:
5.鉴于现有技术存在的问题,本发明的目的在于提供化合物arv-825新的医药用途,化合物arv-825通过靶向brd4显示抗brd4-nut融合蛋白的抗肿瘤活性,在制备治疗nut癌药物中的用途。本发明利用arv-825靶向brd4-nut,并在3t3细胞中使用brd4-nut融合结构检测其体内外抗肿瘤活性,为nut癌治疗提供了潜在的治疗药物。
6.为实现上述目的,本发明采用以下技术方案。
7.化合物arv-825在制备治疗nut癌药物中的应用,所述化合物arv-825的结构式如下式所示:。
8.进一步地,所述化合物arv-825通过靶向brd4,实现治疗或预防nut癌。
9.进一步地,所述化合物arv-825通过抑制brd4-nut融合蛋白表达,实现治疗或预防nut癌。
10.进一步地,所述的化合物arv-825加入药学上可接受的载体和/或辅料,制成片剂、喷雾剂、颗粒剂、胶囊剂、口服液、针剂的任一种剂型。
11.与现有技术比,本发明的有益效果如下。
12.在本发明研究中,发现arv-825在体外和体内均能快速有效地诱导brd4-nut蛋白降解,并抑制3t3-brd4-nut细胞的生长。对细胞系异位表达系统的研究极大地提高了对nutm1融合蛋白产生的分子改变的理解,为新的靶向药物的创建提供了新的视角,为个性化治疗提供了理论支持,并指出了有前途的靶向治疗途径,促进了nut癌的治疗进展。这些结果表明,arv-825是治疗brd4-nut癌的有效方法。
附图说明
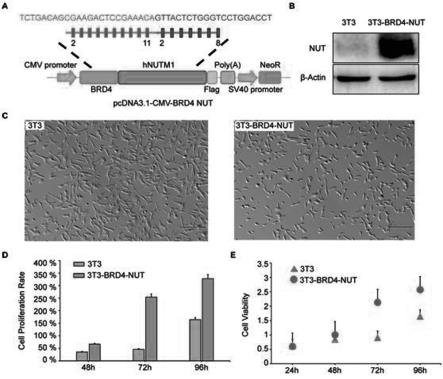
13.图1是过表达brd4-nut促进细胞活力、增殖和迁移。其中a是cmv-brd4-nut 载体构建方案。b是brd4-nut过表达和对照转染48小时wb检测。c是3t3细胞和3t3
‑ꢀ
brd4-nut细胞显微镜明场下观察,比例尺为200 μm,细胞进一步在完全培养基中并在指定的时间段进行培养;d实细胞迁移(划痕试验)检测;e是细胞活力(cck8 od)检测,数据以均数
±
标准差(sd, n=3)表示(所有数据相同)。实验重复了三次,得到了相似的结果。
14.图2a-2g是arv-825抑制brd4-nut 3t3细胞的活性。其中2a是过表达brd4-nut的细胞会降低细胞活力;2b是不同浓度arv-825处理3t3细胞后细胞增殖情况;2c是不同浓度arv-825处理后,3t3细胞在特定时间的迁移变化,比例尺为200 μm;2d是不同浓度arv-825处理后,3t3
‑ꢀ
brd4-nut细胞在特定时间的迁移变化,比例尺为200 μm;2e是arv-825处理后过表达brd4
‑ꢀ
nut的细胞减少了的3t3细胞的迁移;2f是arv-825给药后伤口愈合情况;2g是wb检测分析不同浓度arv-825处理后3t3-brd4-nut细胞中brd4蛋白表达水平的。
15.图3a-3e是显示arv-825治疗后的动态变化的转录组差异。其中3a是pca分析了四组数据,输入数据集在前两个主成分上的投影。 bn, 3t3-brd4-nut细胞,bn+0.003, 3t3-brd4-nut细胞用0.003 μm arv-825处理,bn+0.03,3t3-brd4-nut细胞用0.03μ m arv-825处理;3b是rna-seq分析brd4-nut3t3和对照细胞基因表达变化的火山图,蓝色标记的基因是向上变化的基因,蓝绿色表示下调的基因,黑色表示未改变的基因;3c是3t3-brd4-nut细胞与3t3细胞比较差异表达基因的热图,红色表示上调,蓝色表示下调;3d是关键靶点的kegg途径富集分析(前10位),横坐标标记为途径富集倍数;3e是将arv-825给药前后差异表达最高的基因进行细胞功能富集分析(p 《 0.05, |log2fc|》1);每一列代表一个不同的样本,每一行代表一个基因,一行中的颜色变化表示相对于同一种群的平均值的表达水平,红色表示上调,蓝色表示下调,白色表示基本表达水平。
16.图4-1至4-6是显示arv-825给药后rna-seq中基因集的基因富集的gsea图。
17.图5是arv-825在brd4-nut3t3异种移植瘤模型中显示抗肿瘤作用。其中a是异种移植流程图,携带异种移植瘤的裸鼠分别以10 mg/kg arv-825或对照剂腹腔注射,持续21天。数据为平均值
±
sem (n = 6);b是每3天称一次小鼠体重。c是每3天记录一次肿瘤体积,计算公式为width
ꢀ×ꢀ
width
ꢀ×ꢀ
length
×
0.52;d是arv-825或安慰剂处理的小鼠的异种移植瘤照片。
具体实施方式
18.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。细胞系3t3和293t细胞株由沈阳化工大学应用生物学实验室保存。细胞在37
°
c条件下提5%的二氧化碳,dmem培养基 (dulbecco’s modified eagle’s),培养基(thermo fisher scientific),含有100 u/ml青霉素-链霉素的培养基(millipore sigma)和10%胎牛血清(fbs) (excell bio)中培养。
19.实施例1 质粒构建。
20.从vectorbuilder中合成plv-egfp t2a puro-ef1a hnutm1质粒;pcdna3.1-cmv-brd4
ꢀ‑
flag质粒购自youbio。构建pcdna3.1-cmv-brd4 nut质粒,采用pcr扩增nut靶基因,采用正向5 '
ꢀ‑
aaacaggtcctgccctcgaggttactctgggtcctggacctg和反向5 '
ꢀ‑
gggccctctagactcgagctggctacgacgtcgtttcttc引物。pcr条件:95
°
c孵育2分钟,然后95
°
c孵育30秒,50
°
c孵育30秒,72
°
c孵育4分钟35个循环,72
°
c孵育7分钟。pcdna3.1-cmv-brd4-flag质粒用xhoi酶切。然后,从转化的dh5α细胞和单个菌落中分离质粒dna,连接到消化产物(easygeno试剂盒)中,用上述引物进行测序。
21.实施例2 细胞转染。
22.3t3细胞用pcdna3.1-cmv-brd4 nut (3 μg)电穿孔。转染后将细胞轻轻地重悬在1.5 ml预热的dmem培养基中。所有细胞在37℃、5% co2培养箱中培养。第二天,培养基改为完全dmem培养基,细胞保持原样。48小时后,应用基因素(sigma-aldrich)来选择稳定的细胞系。
23.实施例3 wb检测。
24.6-10% sds-page凝胶用于分离整个细胞裂解物(每个通道每次处理10-20 g蛋白
质),然后转移到pvdf印迹上。阻断后,应用的一、二抗体与印迹孵育,用ecl试剂盒鉴定抗体-抗原结合。
25.实施例4 细胞活性分析。
26.每孔2000个细胞被三倍地接种到96孔板上,细胞生长一夜,然后在规定的时间内使用药物。按照制造商的说明,cck-8测试被用来测量细胞活性。
27.实施例5 划痕试验。
28.6孔板培养24-48小时。当细胞达到100%融合时,使用1毫升的微移液管尖端制造伤口。去除培养基并用1ml pbs洗涤细胞后,每个孔获得2ml含有化合物的完整dmem培养基。每12小时拍摄一次照片。导出照片后使用imagej测量伤口大小。
29.实施例6 rna-sequencing和分析。
30.利用promegene提供的程序(深圳)进行rna-测序(rna-seq)。使用trizol
®
试剂(invitrogen)从细胞中提取总rna。为了建立和测序文库,rna首先被反向转录成cdna。使用bioconductor limma分析,差异表达基因(|log2fold change| 》1 and p 《 0.05)被发现。(http://www.bioinformatics.com.cn/)利用基因集富集分析(gsea)选择了多条细胞途径进行基因富集。
31.实施例7体内异种移植。
32.从中国沈阳lanpuda, ltd.购买了裸鼠。800万个3t3-brd4-nut细胞皮下植入4周龄雄性裸鼠背部(每组6个),当移植肿瘤大小达到200 mm3左右时,每天腹腔给予arv-825 10 mg/kg或对照品。当对照组肿瘤大小达到1000 mm3时,处死小鼠。每三天,用卡尺测量皮下肿瘤的大小。肿瘤体积由公式(宽
×
宽
×
长
×ꢀ
0.52)确定。
33.结果。
34.过表达brd4-nut促进3t3细胞活性。
35.考虑到brd4-nut融合蛋白是nut癌的癌蛋白,构建了过表达brd4-nut的cmv-brd4-nut质粒来模拟nut癌的致病基因,如图1a所示。brd4的外显子2-11和hnut的2-8无缝连接,模拟nc患者的brd4-nut融合。western blotting结果显示,3t3细胞中brd4-nut过表达,如图1b所示,但3t3细胞与3t3细胞在形态上无明显差异,如图1c所示。cck8试验显示,过表达brd4-nut可显著促进3t3-brd4-nut细胞增殖,如图1d所示。综上所述,这些结果表明本发明成功构建了过表达brd4-nut融合蛋白的稳定细胞系,并发现过表达brd4-nut可以促进3t3细胞的增殖和活性。
36.arv-825抑制3t3-brd4-nut细胞的增殖和迁移。
37.用不同剂量的arv-825 (0.001 ~ 0.1 m)处理过表达的brd4-nut细胞系48小时,以评估药物对细胞的作用。接受arv-825治疗后,3t3-brd4-nut细胞增殖呈剂量依赖性下降,如图2a所示。在arv-825处理后,细胞活性大幅下降,如图2b所示。即使在测试的最低浓度(0.001 μm)下,arv-825也显示出抑制作用,如图2a所示。此外,brd4 protac药物以时间依赖性的方式抑制了3t3-brd4-nut细胞活性,如图2a所示。arv-825 (0.001 ~ 0.1 μm)处理24小时后,活性开始下降,如图2b所示,表明增殖率下降。划痕试验结果显示,arv-825 (0.001-0.03 μm, 24h)显著减少迁移的3t3-brd4-nut细胞数量,如图2d所示。0.1 μm arv-825能显著抑制3t3-brd4-nut细胞的迁移,呈现剂量依赖性,如图2d所示。arv-825 (0.001 ~ 0.03 μm, 24h)对3t3细胞的迁移和增殖没有抑制作用,而0.1μm arv-825对3t3细胞的迁
移和增殖有抑制作用,说明0.1μm arv-825对3t3细胞具有毒性,如图2c、2d和2e所示。这些结果表明,arv-825有效地降低了3t3-brd4-nut细胞的活性、增殖和迁移。western blotting分析结果显示,arv-825剂量依赖性地抑制了3t3-brd4-nut细胞中的brd4-nut蛋白水平,如图2g所示。
38.基因转录丰度的比较分析。
39.通过rna-seq来研究brd4-nut在转录水平上的潜在机制。测试了3t3细胞、3t3
‑ꢀ
brd4-nut细胞、0.003 μm和0.03μmarv-825处理后的4组数据。pca分析将四组患者分离开来。0.003 μmarv-825的低浓度处理与0.03μmarv-825聚集在一起,而不是brd4-nut,说明药物处理敏感,如图3a所示。由图3b可以看出,在|log2fold change| 》 1 and an 调整后的p《 0.01的条件下,对两个过度表达brd4-nut的成对3t3细胞的转录组数据进行比较,103个基因上调,159个基因下调。与3t3细胞相比,这些基因在3t3
‑ꢀ
brd4-nut细胞中的表达水平有显著差异。对异常基因进行功能富集分析,如图3c所示。发现rap1信号通路、小细胞肺癌、非小细胞肺癌、膀胱癌相关基因富集,提示这些通路可能与brd4-nut过表达相关,如图3c所示。而在加入arv-825后,brd4过表达引起的异常上下调基因发生了变化,在转录水平呈现出拯救趋势,如图3e所示。同样,在gsea富集通路中,加入arv-825后,通路变化也呈现拯救趋势,如图4-1至4-6所示。
40.arv-825在异种移植瘤模型中抑制肿瘤生长 。
41.利用3t3-brd4-nut细胞,建立nut癌移植瘤模型,观察arv-825在体内的抗癌作用,如图5a所示。当皮下肿瘤体积达到约200 mm3时,裸鼠每天腹腔注射arv-825,剂量为10 mg/kg。与对照组相比,arv-825治疗组的肿瘤体积明显降低,如图5b、5c和5d所示,但体重与治疗组和对照组无明显差异,如图5b所示。这些结果表明,arv-825可能显著减缓nut癌肿瘤的生长。
42.arv-825治疗导致了3t3-brd4-nut细胞中brd4水平更显著和更持久的下降。 rna-seq和western blotting分析证实了arv-825对3t3-brd4-nut细胞基因表达的影响。结果表明,arv-825抑制brd4可导致3t3-brd4-nut细胞中e2f、trafs、wnt、gadd 45 g、sox 6 mrna的改变。对nut癌rna-seq数据的进一步研究可能会发现新的治疗靶点和重要的信号机制。 arv-825在3t3细胞移植模型中抑制brd4-nut肿瘤的过表达。根据体外实验结果,arv-825可以降低体内brd4蛋白水平。这进一步证明了arv-825可能有效调控brd4-nut关键基因调控网络。此外,研究还表明,接受arv-825治疗的小鼠与对照组之间的体重没有统计学上的显著差异。接受arv-825治疗的小鼠的器官没有显示出任何其他明显的负面影响。使用jq1治疗的小鼠体重下降,脂肪生成受损,但在arv-825治疗的器官中,除了体重外,未观察到明显的毒性作用。这些发现表明,arv-825既安全又有效。本发明试验研究结果表明,arv-825治疗nut癌是一种新的治疗策略。总之,在本发明研究中,发现arv-825在体外和体内均能快速有效地诱导brd4-nut蛋白降解,并抑制3t3-brd4-nut细胞的生长。对细胞系异位表达系统的研究极大地提高了对nutm1融合蛋白产生的分子改变的理解,为新的靶向药物的创建提供了新的视角,为个性化治疗提供了理论支持,并指出了有前途的靶向治疗途径,促进了nut癌的治疗进展。这些结果表明,arv-825是治疗brd4-nut癌的有效方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1