顺铂和抑制RNF31表达的药物联合使用在制备治疗肝癌的药物中的应用
顺铂和抑制rnf31表达的药物联合使用在制备治疗肝癌的药物中的应用
技术领域
1.本发明属于生物医药领域,涉及治疗肝癌的药物,具体来说是顺铂和抑制rnf31表达的药物联合使用在制备治疗肝癌的药物中的应用。
背景技术:
2.原发性肝癌是一种常见且预后较差的恶性肿瘤。据估计,全球每年约有80万例新发肝癌患者,由肝癌导致的死亡人数约为50万。肝癌因恶性度高,转移早,预后差,复发率高。被称为“癌中之王”。
3.蛋白泛素化修饰过程在调节dna损伤修复、先天性免疫和炎症抑制、蛋白质运输等多个生物学过程中发挥关键作用。泛素化修饰分为单泛素化修饰和多泛素化修饰。已知的七种多聚泛素化修饰方式均为泛素内赖氨酸连接方式。近年来,新发现的第8种泛素连接方式为线性泛素化。线性泛素化是由一种“首尾相连”的非降解型泛素化修饰方式,由远端泛素的羧基基团与近端泛素的甲硫氨酸(met1)基团形成的肽键相连形成的泛素链标记的多聚泛素化修饰。催化线性泛素链的泛素组装复合体lubac主要由rnf31(ncbi数据库,基因号 nm_001310332.2),hoil,sharpin组成。rnf31(也称hoip),是一种e3泛素连接酶,与 hoil和sharpin一起形成线性泛素链组装复合物lubac,rnf31对于激活lubac线性泛素化的活性十分重要,但其底物及其调控机制和肿瘤治疗的功能还研究很少。
4.目前的研究显示,rnf31在乳腺癌中具有致癌作用,rnf31与p53靶基因表达呈负相关, rnf31通过降低了p53的稳定性发挥致癌基因的作用。乳腺癌细胞中敲除rnf31,将导致细胞周期停滞,顺铂以p53依赖的方式诱导细胞凋亡。另外,在卵巢癌、肺癌、胃癌、结肠癌等细胞中,敲除rnf31可以显著增加肿瘤细胞的敏感性,但rnf31在肝癌中的作用目前还没有报道。另一方面,rnf31在免疫治疗耐药性中也起关键作用。敲除rnf31可使癌细胞能够被t细胞和nk细胞更有效地破坏。这些都说明rnf31是可能肿瘤的潜在治疗靶点。
5.在真核生物中,非同源末端接合(nhej)及同源重组(hr)两种修复方式共同作用,修复双链断裂的dna,维持基因组稳定性。rad51在hr修复中发挥着重要作用,是同源重组修复dna损伤的关键酶。铂类是肝癌患者常用的化疗药物,但极易产生化疗耐药。铂类药物通过整合入肿瘤细胞dna后,通过引起dna双链断裂,导致肿瘤细胞死亡。但是,肿瘤细胞在治疗过程中会通过提高自身的dna损伤修复效率,以抵抗药物杀伤,最终产生化疗耐药,导致化疗失败。虽然线性泛素化与nfκb通路、程序性坏死、炎症反应及血管发育等疾病相关,但关于rnf31线性泛素化调控rad51和应用rnf31抑制剂治疗肝癌的研究尚未见报道。
6.因此,本发明首先发现了rnf31敲除可以显著降低rad51的线性泛素化水平,rnf31 敲除同源重组修复效率降低。然后根据合成致死的原理,联合使用顺铂和rnf31抑制剂用于对肝癌的潜在治疗。
7.顺铂:别称cisplatin,是一种含铂的抗癌药物,可与dna结合,引起交联,从而破坏 dna的功能,抑制细胞有丝分裂。它是一种针对细胞的非特异性药物。cisplatin是最广泛使
用的且最有力的化疗药物之一。通过与dna相互作用形成dna交联剂诱导细胞毒性,激活多条信号转导通路,包括erk,p53,p73和mapk,其中对激活凋亡影响最大,具有有效的抗肿瘤活性,诱导肿瘤细胞死亡。cisplatin分子式如下:
[0008][0009]
rnf31抑制剂:hoipin-1(hoip inhibitor-1)是一种线性泛素链组装复合物(linear ubiquitin chain assembly complex,lubac)抑制剂,公司可以提供,货号jtp-0819958。分子式如下:
[0010]
技术实现要素:
[0011]
针对现有技术中的上述技术问题,本发明提供了顺铂和抑制rnf31表达的药物联合使用在制备治疗肝癌的药物中的应用,所述的顺铂和抑制rnf31表达的药物联合使用在制备治疗肝癌的药物中的应用要解决现有技术中的药物治疗肝癌的效果不佳的技术问题。
[0012]
本发明提供了顺铂和rnf31抑制剂的药物联合使用在制备治疗肝癌的药物中的应用。
[0013]
具体的,顺铂和rnf31抑制剂的浓度比为(0.75~3):10。优选的浓度比为1.5:10。
[0014]
本发明还提供了检测rnf31基因在制备检测肝癌患者预后的试剂盒中的应用。
[0015]
本发明还提供了rnf31基因作为靶点在筛选治疗肝癌的药物中的应用。
[0016]
本发明还提供了rnf31抑制剂在制备治疗肝癌的药物中的应用。
[0017]
具体的,所述的rnf31抑制剂为hoipin-1;分子式如下所示:
[0018][0019]
本发明的原理是:
[0020]
(1)肿瘤耐药原理:铂类是肝癌患者常用的化疗药物,但极易产生化疗耐药。铂类药物通过整合入肿瘤细胞dna后,通过引起dna双链断裂,导致肿瘤细胞死亡。但是,肿瘤细胞在治疗过程中会通过提高自身的dna损伤修复效率,以抵抗药物杀伤,最终产生化疗耐药,导致化疗失败。
[0021]
(2)“合成致死”原理:主要是指当与第一种药物合成致死的第二种药物联合使用时,相比作为单一药物,其临床活性的药物效果可以大大增强。目前,合成致死应用最多的就是在乳腺癌治疗中,利用parp抑制剂在brca基因缺陷的患者具有非常好的治疗效果。另外,parp抑制剂联合抑制同源重组修复通路的基因也有很好的治疗效果。
[0022]
本发明和已有技术相比的技术效果。
[0023]
(1)本发明首次公开了e3泛素连接酶rnf31的底物rad51,抑制rnf31促使rad51 线性泛素化修饰减弱;
[0024]
(2)本发明明确了rnf31对dna同源重组修复的影响,抑制rnf31,使rad51活性降低,同源重组修复能力下降,说明rnf31通过调控同源重组修复而影响肿瘤细胞耐药;
[0025]
(3)本发明利用肝癌细胞系,顺铂和rnf31抑制剂联用,对肿瘤细胞具有更好的杀伤效果,验证了rnf31抑制剂是一个肝癌治疗的潜在药物。
[0026]
(4)本发明明确了rnf31在肝癌组织中高表达,并且与肝癌患者预后显著相关,是潜在的肝癌诊断指标。
附图说明
[0027]
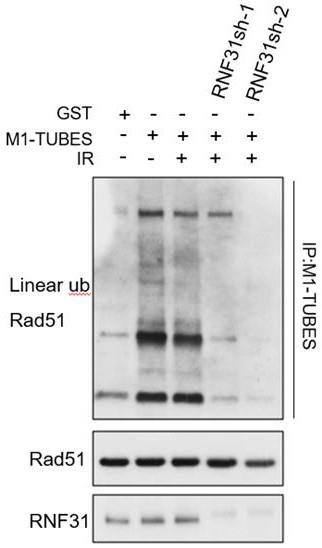
图1显示了293t细胞中shrna敲低rnf31,经ir诱导,免疫共沉淀m1-tubes,检测rad51线性泛素化水平。
[0028]
图2显示了u2os细胞中构建rnf31敲低稳转株,ir诱导后,检测rad51的foci形成。
[0029]
图3显示了肝癌细胞hepg2中敲减rnf31,检测细胞对顺铂的敏感性。
[0030]
图4显示了肝癌细胞hepg2中,检测顺铂和rnf31抑制剂单用或联用,对肝癌细胞的杀伤效果。
[0031]
图5显示了rnf31在肝癌组织中高表达。
[0032]
图6显示了rnf31表达与肝癌病人预后数据高度相关。
具体实施方式
[0033]
实施例1证明rnf31参与调控rad51的线性泛素化修饰
[0034]
首先在293t细胞中构建plko.1,rnf31shrna1,rnf31shrna2敲低稳转株。其中慢病毒包装和稳定过表达细胞株的建立的具体步骤如下:
[0035]
1)培养hek293t细胞,培养基为gibico高糖dmem培养基(含10%fbs),使汇合度达到90%-95%。
[0036]
2)转染前2-3个小时更换一次培养基;
[0037]
3)配制转染试剂:mix1:optimum加转染试剂;mix2:pspax2,pmd2.g,目的质粒 (plko.1shrna,rnf31shrna1,rnf31shrna2)按照1:3:4的比例加入;mix 1和mix 2分别混合,室温5-10min;
[0038]
4)将mix 1和mix 2混合,室温30min后,加入至hek293t细胞中;
[0039]
5)7h后更换新鲜dmem培养基(含10%fbs);
[0040]
6)24h后收取上清培养基,过0.45μm滤膜;
[0041]
7)培养293t细胞,汇合度约为70%时,加入相应的病毒感染细胞;
[0042]
8)48小时后更换为带puro筛选的dmem培养基(含10%fbs);
[0043]
9)根据细胞筛选生长情况,取一部分细胞定量pcr或者western blot检测目的基因的表达来评估感染效率。
[0044]
其次,利用免疫共沉淀linear ub技术,检测rnf31调控rad51的线性泛素化水平。具体步骤如下:
[0045]
1)用离子辐照仪ir处理细胞(10gy),培养箱中放置2h;
[0046]
2)分别在上述构建的稳转细胞株中加入细胞裂解液netn 300μl(含1%蛋白酶抑制剂cocktail),冰上裂解30min;
[0047]
3)12000r/min,4℃离心10min,取上清。每个样本另取60μl上述裂解液作为input;
[0048]
4)上述各上清中加入m1 tube 2μg(lifesensors,um306),dynabeads(thermo fisher, dynabeads m-280streptavidin)20μl,linear ub antibody 2μl,4℃旋转孵育4-6小时;
[0049]
5)上述样本取出后,8000r/min,离心1min,弃上清,每个样本加入800μl的netn 洗涤3遍,弃去上清;
[0050]
6)上述每个样本中各加入1*蛋白上样缓冲液70μl,100℃煮沸10min。
[0051]
7)westernblot检测各组细胞的线性泛素化水平。
[0052]
在本实施例中,在敲低rnf31的细胞中,免疫共沉淀linear ub,检测rnf31调控rad51 的线性泛素化水平。结果表明,经过dna损伤(ir)刺激后,敲低rnf31使rad51的泛素化水平显著降低(图1)。
[0053]
说明rnf31及其复合物参与rad51的线性泛素化作用。
[0054]
实施例2证明rnf31参与调控dna损伤同源重组修复
[0055]
首先,在u2os细胞构建中构建plko.1,rnf31shrna稳转株细胞
[0056]
其次,免疫荧光染色具体步骤如下:
[0057]
1)免疫荧光染色实验分为两组,包括:
[0058]
对照组:u2os细胞构建的plko.1稳转株细胞;
[0059]
消减rnf31细胞组:u2os细胞构建的rnf31shrna稳转株细胞;
[0060]
2)分别将各组细胞培养在6孔板的玻璃盖玻片上,培养细胞汇合度至90-95%;
[0061]
3)用离子辐照仪ir处理细胞(10gy),培养箱中放置2h;
[0062]
4)用pbs洗涤盖玻片上的细胞两次,并用4%pfa室温下固定30min;
[0063]
5)用pbs清洗三次后,细胞被阻断溶液(tbs中5%bsa和0.5%triton x-100)通透阻断10min;
[0064]
6)pbs清洗三次后,在玻片上滴加10%羊血清,室温封闭30min;
[0065]
7)用相应一抗抗体滴加在盖玻片上,室温下孵育1小时,pbs浸洗玻片3次;
[0066]
8)吸干pbs,在封闭溶液中用适当二级抗体,37℃孵育30min,pbs浸洗玻片3次;
[0067]
9)细胞用dapi染色1min。最后使用荧光显微镜下观察采集图像。
[0068]
在本实施例中,为了进一步检测rnf31通过rad51参与调控dna损伤同源重组修复,利用敲减rnf31的u2os细胞,检测dna同源重组修复关键蛋白rad51免疫荧光染色情况。
[0069]
结果显示,在u2os细胞中,经ir诱导dna损伤后,rnf31敲低后与对照细胞相比,rad51的foci形成显著降低(图2)。
[0070]
说明rnf31通过rad51参与调控dna损伤同源重组修复。
[0071]
实施例3证明敲减rnf31或使用rnf31抑制剂对顺铂的敏感性增加
[0072]
顺铂是一种肝癌患者常用的化疗药物,顺铂可以通过增加肿瘤细胞dna损伤、抑制肿瘤细胞dna损伤修复、促进肿瘤细胞发生凋亡。
[0073]
在本实施例中,为了检测rnf31是否能成为肝癌治疗的合成致死的新靶点,在肝癌
细胞 hepg2中敲减rnf31或使用rnf31抑制剂,并联合顺铂,通过克隆形成率实验,检测对肝癌细胞的杀伤效果。
[0074]
首先,检测肝癌细胞hepg2中敲减rnf31后对顺铂杀伤效果的变化。1)克隆形成实验分为三组,包括:
[0075]
对照组:hepg2细胞构建的plko.1稳转株细胞;
[0076]
消减rnf31细胞组1:hepg2细胞构建的rnf31shrna1稳转株细胞;
[0077]
消减rnf31细胞组2:hepg2细胞构建的rnf31shrna2稳转株细胞;
[0078]
2)取对数生长期,细胞状态良好的各组细胞,0.25%胰酶消化并吹打成单细胞悬液。
[0079]
3)选择6孔板作为克隆培养板,按每孔1000个的细胞密度接种进孔板中。接种轻轻晃动平板,使细胞分布均匀。
[0080]
4)接种后第二天加入顺铂,浓度分别为0、0.15um、0.3um和0.6um,每种药物处理的细胞样本接种3个复孔,独立重复3次实验。
[0081]
5)置37℃细胞培养箱中培养2~3周,当培养皿中出现肉眼可见的克隆时,终止培养。
[0082]
6)去上清,用pbs小心浸洗2次。每孔加入甲醇固定15分钟,然后去固定液,加适量 gimsa应用染色液染10-30分钟,加固定液和染色液时,覆盖住孔板底层即可。
[0083]
7)拍照或用用肉眼直接计数克隆,最后计算克隆形成率。
[0084]
结果显示,敲减rnf31后显著增加顺铂对肿瘤细胞的杀伤效果(图3)。
[0085]
其次,检测肝癌细胞hepg2中单用或联用rnf31抑制剂和顺铂对肿瘤细胞杀伤效果。
[0086]
1)药物联用杀伤实验分为三组,包括:
[0087]
对照组;plko.1稳转株细胞,单独施用顺铂,浓度分别为0、0.15um、0.3um和0.6um。
[0088]
顺铂组;rnf31稳定消减细胞株,单独施用顺铂,浓度分别为0、0.15um、0.3um和 0.6um。
[0089]
顺铂和rnf31抑制剂联用组:rnf31抑制剂2um,顺铂浓度分别为0、0.15um、0.3um 和0.6um。
[0090]
2)取对数生长期,细胞状态良好的hepg2细胞,0.25%胰酶消化并吹打成单细胞悬液。
[0091]
3)选择6孔板作为克隆培养板,按每孔1000个的细胞密度接种进孔板中。接种轻轻晃动平板,使细胞分布均匀。
[0092]
4)接种后第二天加药,每种药物处理的细胞样本接种3个复孔,独立重复3次实验。
[0093]
5)置37℃细胞培养箱中培养2~3周,当培养皿中出现肉眼可见的克隆时,终止培养。
[0094]
6)去上清,用pbs小心浸洗2次。每孔加入甲醇固定15分钟,然后去固定液,加适量 gimsa应用染色液染10-30分钟,加固定液和染色液时,覆盖住孔板底层即可。
[0095]
7)拍照或用用肉眼直接计数克隆,最后计算克隆形成率。
[0096]
结果显示,顺铂和rnf31抑制剂联用,显著提高对肝癌细胞的杀伤效果(图4)。
[0097]
实施例4证明rnf31调控肝癌发生发展
[0098]
为了确定rnf31调控肝癌发生发展的机制,在本实施例中,在gepia数据库中对369 例肝癌病人进行分析显示,与癌旁组织相比,rnf31在肝癌样本中高表达(图5)。利用kmplot 数据库分析rnf31表达对肝癌患者生存率的影响,结果显示rnf31高表达的病人,预后更差(图6)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1