普利多匹定用于治疗功能下降的用途的制作方法
普利多匹定用于治疗功能下降的用途
1.本技术是申请日为2017年8月24日,申请号为201780066778.4,发明名称为“普利多匹定用于治疗功能下降的用途”的申请的分案申请。
2.本技术要求于2016年11月2日提交的美国临时申请第62/416,685号、于2016年10月21日提交的美国临时申请第62/411,511号、于2016年9 月15日提交的美国临时申请第62/395,263号、和于2016年8月24日提交的美国临时申请第62/379,175号的权益,以上申请的每一个的内容特此通过引用以其整体并入。
3.贯穿本技术,各种出版物通过第一作者和出版年份提及。这些出版物的完整引用在紧接权利要求书之前的参考文献部分中呈现。参考文献部分中提及的出版物的公开内容特此通过引用以其整体并入到本技术中,以便更充分地描述到本文描述的本发明之日为止的现有技术。
4.发明背景
5.亨廷顿氏病
6.亨廷顿氏病(hd)是一种致命的神经退行性紊乱,具有常染色体显性遗传模式。该疾病与运动、行为和认知的三联症状相关。运动障碍是该疾病最典型的特征,舞蹈病是最明显的运动症状。虽然对于诊断有用,但舞蹈病是疾病严重程度的不良标志。而是,失能和疾病严重程度与不利运动特征,诸如精细运动技能损伤、运动迟缓和大运动协调技能,包括语言困难、步态和姿势功能异常最相关(mahant 2003)。
7.多巴胺被广泛地认为是调节包括运动功能的脑功能的若干方面的重要的神经递质(nieoullon 2003)。中断的多巴胺能信号传导已牵涉许多神经和精神病状况(zhan 2011、dunlop 2007),并且存在表明多巴胺能功能在hd 中也受损的大量临床和临床前证据(kung 2007,huot 2007)。
8.许多药物被开处方以改善与hd相关的运动和情绪问题;然而,各种药物在hd中有用的科学证据很少(mestre 2009,mestre 2009)。只有降低多巴胺的可获得性和传递的丁苯那嗪和氘代丁苯那嗪,被专门注册用于治疗患有hd的患者,以用于管理舞蹈病。没有注册药物可用于管理hd的多方面症状,导致整个疾病过程中不可避免的功能能力(functional capacity)下降。因此,存在开发延缓或改善hd中的功能缺陷的药物的重大的未满足的医学需求。
9.普利多匹定(pridopidine)
10.普利多匹定(4-[3-(甲基磺酰基)苯基]-1-丙基哌啶)(以前被称为acr16) 是正在开发的用于治疗亨廷顿氏病的药物。已经示出普利多匹定通过抑制活动过度或增强活动减退来调节运动活动。普利多匹定的神经保护性质被认为归因于其对σ-1受体(s1r,ic50~100nm结合)的高亲和力,而普利多匹定的运动活动可以主要通过其对多巴胺d2受体(d2r)(ic50~10μm结合) 的低亲和力、拮抗活性来介导(ponten 2010)。普利多匹定示出在微摩尔范围内与另外的受体的低亲和力结合。
[0011]
s1r是一种内质网(er)伴侣蛋白,其牵涉脑中的细胞分化、神经可塑性、神经保护和认知功能。最近,大鼠纹状体的转录组分析示出,普利多匹定治疗激活已知促进神经元可
塑性和存活并且在hd中受损的bdnf、多巴胺受体1(d1r)、糖皮质激素受体(gr)和丝氨酸-苏氨酸激酶蛋白激酶b (akt)/磷酸肌醇3-激酶(pi3k)途径的表达。此外,普利多匹定基因表达谱在 q175敲入(q175 ki)hd小鼠模型中示出反向模式的hd疾病基因表达谱 (geva 2016)。普利多匹定还以s1r依赖性方式增强成神经细胞瘤细胞系中的神经保护性脑源性神经营养因子(bdnf)的分泌(geva 2016)。
[0012]
发明简述
[0013]
本技术提供了以下内容:
[0014]
1).一种在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能能力的下降的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而在所述人类患者中保持功能能力、改善功能能力或减缓功能能力的下降。
[0015]
2).如项目1)所述的方法,其中所述方法包括减缓功能能力的下降,并且(a)所述药物组合物被施用持续超过26周,或者(b)所述人类患者罹患早期亨廷顿氏病。
[0016]
3).如项目1)-2)中任一项所述的方法,其中功能能力的下降被减缓至少20%、至少30%、至少40%、至少50%或至少80%。
[0017]
4).如项目1)-3)中任一项所述的方法,其中所述功能能力是总功能能力(tfc),并且任选地,所述总功能能力通过uhdrs的总功能能力(tfc) 量表或uhdrs功能评估评分(rsa)来测量。
[0018]
5).如项目1)所述的方法,其中所述功能能力是通过uhdrs的总功能能力(tfc)量表测量的总功能能力(tfc),并且所述人类患者任选地在施用所述药物组合物52周后,在tfc uhdrs中具有一(1)个或更多个点的改善。
[0019]
6).如项目1)所述的方法,其中所述功能能力是被保持或改善的总功能能力,所述人类患者罹患亨廷顿氏病,90mg或180mg剂量的普利多匹定每天被施用至所述人类患者,并且所述药物组合物被施用持续至少26 周或52周。
[0020]
7).如项目1)-3)中任一项所述的方法,其中所述功能能力是
[0021]
(a)进行日常生活活动的能力,
[0022]
(b)管理财务的能力,
[0023]
(c)进行家务的能力,和/或
[0024]
(d)所述人类患者的护理水平。
[0025]
8).如项目7)所述的方法,其中所述功能能力是通过uhdrs-tfc 的日常生活活动领域测量的被保持或改善的进行日常生活活动的能力,所述人类患者罹患亨廷顿氏病,90mg或180mg剂量的普利多匹定每天被施用至所述人类患者,并且所述药物组合物被施用持续至少26周或52周。
[0026]
9).如项目1)-8)中任一项所述的方法,其中所述方法还包括改善或保持通过uhdrs-tfc的管理财务领域测量的管理财务的能力。
[0027]
10).如项目7)所述的方法,其中所述功能能力是被保持或改善的管理财务的能力,所述人类患者罹患亨廷顿氏病,90mg剂量的普利多匹定每天被施用至所述人类患者,并且所述药物组合物被施用持续至少52周。
[0028]
11).如项目7)所述的方法,其中所述功能能力是如通过uhdrs tfc 的家务领域测
量的进行家务的能力,所述功能能力被保持、改善或其下降被减缓,90mg剂量的普利多匹定每天被施用至所述人类患者,并且所述人类患者罹患亨廷顿氏病并且具有11-13的基线tfc评分。
[0029]
12).如项目7)所述的方法,其中所述功能能力是如通过uhdrs tfc 的护理水平测量的护理水平,所述护理水平被保持、改善或其下降被减缓, 90mg剂量的普利多匹定每天被施用至所述人类患者,并且所述人类患者罹患亨廷顿氏病。
[0030]
13).一种在有相应需要的人类亨廷顿氏病患者中减少肌张力障碍或保持肌张力障碍的水平的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而在所述人类患者中减少肌张力障碍或保持肌张力障碍的水平。
[0031]
14).如项目13)所述的方法,其中所述人类亨廷顿氏病患者具有11-13 的基线tfc评分,90mg或180mg剂量的普利多匹定每天被施用至所述患者,并且所述肌张力障碍通过uhdrs tms肌张力障碍评分来测量。
[0032]
15).一种治疗人类亨廷顿氏病患者中的肢体肌张力障碍的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而治疗所述人类患者中的所述肢体肌张力障碍,其中(a)所述药物组合物被施用持续超过26周,或者(b)在周期性施用开始时不同于预期剂量的量的滴定剂量被施用持续一段时间,或者(c)所述人类患者罹患早期亨廷顿氏病。
[0033]
16).一种在人类亨廷顿氏病患者中防止人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上手部测试的减慢或不规则表现的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而在所述人类患者中防止所述人类患者的手指轻敲击力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上手部测试的减慢或不规则表现。
[0034]
17).如项目15)-16)中任一项所述的方法,其中所述方法改善了所述人类患者的q-motor敲击速度频率或所述人类患者的q-motor敲击速度启动间间隔(ioi)。
[0035]
18).一种在有相应需要的人类患者中降低与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而降低所述人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度,其中(a)所述药物组合物被施用持续超过26周,或者(b)在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间,或者(c)所述人类患者罹患早期亨廷顿氏病。
[0036]
19).一种防止罹患亨廷顿氏病的人类患者的手指敲击能力的减慢、幅度降低或受损的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至所述患者,以便从而防止所述人类患者的手指轻拍能力的减慢、幅度降低或受损。
[0037]
20).一种(1)改善或保持人类患者的(a)步态和平衡、(b)独立性或(c)跨多个领域的认知表现,或者(2)降低或保持人类患者的(a)舞蹈病水平或(b)神经丝轻蛋白的浓度的方法,
[0038]
所述方法包括向有相应需要的患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而(1)改善或保持所述人类患者的(a)步态和平衡,(b)独立性,或 (c)跨多个领域的认知表现,或者(2)降低或保持所述人类患者的(a)舞蹈病水平或(b)神经丝轻蛋白的浓度。
[0039]
21).一种(1)改善、保持人类患者的(a)步态和平衡,(b)独立性或(c)跨多个领域的认知表现,或减缓人类患者的(a)步态和平衡,(b)独立性或(c)跨多个领域的认知表现的的下降或(2)降低或保持人类患者的(a)舞蹈病水平或 (b)神经丝轻蛋白的浓度,或减轻人类患者的(a)舞蹈病水平或(b)神经丝轻蛋白的浓度的增加的方法,
[0040]
所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至所述患者,以便从而(1)改善、保持所述人类患者的(a)步态和平衡,(b)独立性,或(c)跨多个领域的认知表现,或减缓所述人类患者的(a)步态和平衡,(b)独立性或 (c)跨多个领域的认知表现的下降,或者(2)降低或保持所述人类患者的(a)舞蹈病水平或(b)神经丝轻蛋白的浓度,或减缓所述人类患者的(a)舞蹈病水平或(b)神经丝轻蛋白的浓度的增加。
[0041]
22).如项目20)所述的方法,其中所述方法包括改善、保持步态和平衡,或减缓步态和平衡的下降,所述步态和平衡通过uhdrs步态和平衡评分测量,所述药物组合物被施用持续至少52周,90mg剂量的普利多匹定每天被施用至所述患者,并且所述人类患者罹患亨廷顿氏病并且具有 11-13的基线tfc评分。
[0042]
23).如项目20)所述的方法,其中所述方法包括改善、保持独立性,或减缓独立性的下降,所述独立性通过uhdrs独立性评分测量,所述药物组合物被施用持续至少26周,并且所述人类患者罹患亨廷顿氏病。
[0043]
24).如项目20)-21)中任一项所述的方法,其中所述方法包括改善、保持所述人类患者的独立性,或减缓所述人类患者的独立性的下降,所述独立性通过uhdrs独立性评分测量。
[0044]
25).如项目20)-21)中任一项所述的方法,其中所述方法包括改善、保持人类患者跨多个领域的认知表现,或减缓人类患者跨多个领域的认知表现的下降,所述认知表现通过连线测试b(tmt-b)测量。
[0045]
26).如项目20)-21)中任一项所述的方法,其中所述方法包括改善、保持人类患者跨多个领域的认知表现,或减缓人类患者跨多个领域的认知表现的下降,所述认知表现通过节奏敲击测试或符号数字模态测试(sdmt) 测量。
[0046]
27).如项目20)-21)中任一项所述的方法,其中所述方法包括改善、保持人类患者跨多个领域的认知表现,或减缓人类患者跨多个领域的认知表现的下降,所述认知表现通过蒙特利尔认知评估(moca)量表测量。
[0047]
28).如项目20)-21)中任一项所述的方法,其中所述方法减缓认知下降。
[0048]
29).一种改善、保持人类患者的行为和/或精神状态,或减缓人类患者的行为和/或精神状态的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg 剂量的普利多匹定每天被施用至所述患者,以便从而改善、保持所述人类患者的行为和/或精神状态,或减缓所述人类患者的行为和/或精神状态的下降。
[0049]
30).如项目29)所述的方法,其中所述人类患者的行为和/或精神状态通过问题行为评估-简化形式(pba-s)来测量。
[0050]
31).如项目29)所述的方法,其中所述人类患者的行为和/或精神状态通过简化形式的问题行为评估的冷漠子项目来测量。
[0051]
32).如项目29)所述的方法,其中所述人类患者的行为和/或精神状态通过冷漠评价量表(aes)来测量。
[0052]
33).如项目29)所述的方法,其中通过用于易怒或用于迷失方向行为的问题行为评估测量的所述人类患者的行为和/或精神状态被改善或保持,所述人类患者罹患亨廷顿氏病,并且90mg或180mg剂量的普利多匹定每天被施用至所述患者持续至少26周或至少52周。
[0053]
34).一种在有相应需要的人类患者中改善或保持运动能力的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而保持或改善所述人类患者的运动能力,其中(a)所述药物组合物被施用持续超过26周,或者(b)在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间,或者(c)所述人类患者罹患早期亨廷顿氏病。
[0054]
35).如项目34)所述的方法,其中运动能力通过uhdrs总运动评分 (tms)评分来测量。
[0055]
36).一种减少或保持人类患者的不自主运动的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而减少或保持人类患者的不自主运动。
[0056]
37).一种改善或保持人类患者的可动性的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得 90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而改善或保持所述人类患者的可动性。
[0057]
38).一种改善或保持人类患者进行身体任务的能力的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而改善或保持所述人类患者进行身体任务的能力。
[0058]
39).一种改善或保持人类患者的生活质量的方法,所述方法包括向所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225 mg剂量的普利多匹定每天被施用至所述患者,以便从而改善或保持所述人类患者的生活质量。
[0059]
40).如项目39)所述的方法,其中所述人类患者的生活质量通过亨廷顿氏病生活质量评分来测量。
[0060]
41).一种减慢人类患者中的亨廷顿氏病的临床进展的方法,所述方法包括向罹患亨廷顿氏病的所述患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而减慢所述患者中亨廷顿氏病的临床进展,其中(a)所述药物组合物被施用持续超过26周,或者(b)在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间,或者(c)所述人类患者罹患早期亨廷顿氏病。
[0061]
42).如项目1)-41)中任一项所述的方法,其中90mg、135mg或180mg剂量的普利多匹定每天被施用至所述患者。
[0062]
43).如项目1)-42)中任一项所述的方法,其中所述药物组合物的单位剂量包含45mg、67.5mg或90mg的普利多匹定。
[0063]
44).如项目1)-43)中任一项所述的方法,其中所述药物组合物每天被施用两次。
[0064]
45).如项目1)-44)中任一项所述的方法,其中在每次施用时施用相等量的所述药物组合物。
[0065]
46).如项目1)-45)中任一项所述的方法,其中所述药物组合物被施用持续超过26周、至少52周或至少78周。
[0066]
47).如项目1)-46)中任一项所述的方法,其中所述患者在亨廷顿蛋白基因中具有大于或等于36个cag重复。
[0067]
48).如项目1)-47)中任一项所述的方法,其中所述人类患者罹患亨廷顿氏病。
[0068]
49).如项目48)所述的方法,其中所述人类患者罹患早期亨廷顿氏病。
[0069]
50).如项目1)-49)中任一项所述的方法,其中所述人类患者具有大于或等于9的基线tfc评分。
[0070]
51).如项目1)-49)中任一项所述的方法,其中所述人类患者具有大于或等于7的基线tfc评分。
[0071]
52).如项目1)-49)中任一项所述的方法,其中所述人类患者具有 11-13的基线tfc评分。
[0072]
53).如项目1)-49)中任一项所述的方法,其中所述人类患者具有 7-10的基线tfc评分。
[0073]
54).如项目1)-53)中任一项所述的方法,其中所述普利多匹定是普利多匹定盐酸盐。
[0074]
55).如项目1)-54)中任一项所述的方法,其中在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间,优选地其中所述滴定剂量是所述预期剂量的量的一半,更优选地其中在施用所述预期剂量之前,所述滴定剂量被施用14天。
[0075]
56).如项目1)-55)中任一项所述的方法,其中所述方法还包括不恶化与未用普利多匹定治疗的人类患者相比亨廷顿氏病的另一症状。
[0076]
57).一种预测罹患亨廷顿氏病的受试者中对普利多匹定疗法的临床响应性的方法,所述方法包括施用一定量的普利多匹定和评价所述受试者中的神经丝轻蛋白的量,以便从而预测对普利多匹定的临床响应性,任选地,其中如果所述受试者被鉴定为普利多匹定响应者,则随后对所述受试者施用包含普利多匹定的药物组合物。
[0077]
58).一种药物组合物,所述药物组合物包含普利多匹定,用于(1)(a) 在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能下降, (b)减慢亨廷顿氏病的临床进展,(c)在有相应需要的人类患者中降低肌张力障碍或保持肌张力障碍的水平,(d)在有相应需要的人类患者中治疗肢体肌张力障碍,(e)防止所述人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上测试的减慢或不规则表现,(f)在有相应需要的人类患者中改善或保持人类患者的步态和平衡,(g)在有相应需要的人类患者中改善或保持人类患者的独立性,(h)在有相应需要的人类患者中改善或保持人类患者跨多个领域的认知表现,(i)在有相应需要的人类患者中减轻与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度,(j)在有相应需要的人类患者中改善或保持运动能力,(k)在有
相应需要的人类患者中降低或保持舞蹈病的水平,(l)在有相应需要的人类患者中改善、保持人类患者的行为和/或精神状态,或减缓人类患者的行为和/或精神状态的下降,(m) 在有相应需要的人类患者中减少或保持人类患者的不自主运动,(n)在有相应需要的人类患者中改善或保持人类患者的可动性,(o)改善或保持人类患者进行身体任务的能力,(p)改善或保持人类患者的生活质量,(q)保持、降低亨廷顿氏病患者中神经丝轻蛋白的浓度或减缓神经丝轻蛋白浓度的增加,其中所述药物组合物被周期性地口服施用至所述患者,使得90mg-225mg 剂量的普利多匹定每天被施用至所述患者,或者(2)(a)在有相应需要的人类患者中改善、保持步态和平衡或减缓步态和平衡的下降,(b)在有相应需要的人类患者中改善、保持人类患者的独立性或减缓人类患者的独立性的下降,(c)在有相应需要的人类患者中改善、保持人类患者跨多个领域的认知表现或减缓认知表现的下降,(d)在有相应需要的人类患者中降低、保持舞蹈病或减缓舞蹈病的增加,其中所述药物组合物被周期性地口服施用至所述患者,使得90mg剂量的普利多匹定每天被施用至所述患者。
[0078]
59).一定量的普利多匹定在制造用于以下的药物中的用途,用于(1)(a) 在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能下降, (b)减慢亨廷顿氏病的临床进展,(c)在有相应需要的人类患者中降低肌张力障碍或保持肌张力障碍的水平,(d)在有相应需要的人类患者中治疗肢体肌张力障碍,(e)防止所述人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上测试的减慢或不规则表现,(f)在有相应需要的人类患者中改善或保持人类患者的步态和平衡,(g)在有相应需要的人类患者中改善或保持人类患者的独立性,(h)在有相应需要的人类患者中改善或保持人类患者跨多个领域的认知表现,(i)在有相应需要的人类患者中减轻与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度,(j)在有相应需要的人类患者中改善或保持运动能力,(k)在有相应需要的人类患者中降低或保持舞蹈病水平,(l)在有相应需要的人类患者中改善、保持人类患者的行为和/或精神状态,或减缓人类患者的行为和/或精神状态的下降,(m)在有相应需要的人类患者中减少或保持人类患者的不自主运动,(n)在有相应需要的人类患者中改善或保持人类患者的可动性,(o)改善或保持人类患者进行身体任务的能力,(p)改善或保持人类患者的生活质量,(q)保持、降低亨廷顿氏病患者中神经丝轻蛋白的浓度或减缓神经丝轻蛋白浓度的增加,其中所述药物组合物被周期性地口服施用至所述患者,使得90mg-225mg 剂量的普利多匹定每天被施用至所述患者,或者(2)(a)在有相应需要的人类患者中改善、保持步态和平衡或减缓步态和平衡的下降,(b)在有相应需要的人类患者中改善、保持人类患者的独立性或减缓人类患者的独立性的下降,(c)在有相应需要的人类患者中改善、保持人类患者跨多个领域的认知表现或减缓认知表现的下降,(d)在有相应需要的人类患者中降低、保持舞蹈病或减缓舞蹈病的增加,其中所述药物被配制为用于周期性地口服施用至所述患者,使得90mg剂量的普利多匹定每天被施用至所述患者。
[0079]
60).一定量的普利多匹定用于以下的用途,用于(1)(a)在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能下降,(b)减慢亨廷顿氏病的临床进展,(c)在有相应需要的人类患者中降低肌张力障碍或保持肌张力障碍的水平,(d)在有相应需要的人类患者中治疗肢体肌张力障碍, (e)防止所述人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上测试的减慢或不规则表现,(f)在有相应需要的人类患者中改善或保持人类患者的步态和平衡,(g)在有相应需要的人类患者中改善或保持人
类患者的独立性,(h)在有相应需要的人类患者中改善或保持人类患者跨多个领域的认知表现,(i)在有相应需要的人类患者中减轻与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度,(j)在有相应需要的人类患者中改善或保持运动能力,(k)在有相应需要的人类患者中降低或保持舞蹈病水平,(l)在有相应需要的人类患者中改善、保持人类患者的行为和/或精神状态或减缓人类患者的行为和/或精神状态的下降,(m)在有相应需要的人类患者中降低或保持人类患者的不自主运动,(n)在有相应需要的人类患者中改善或保持人类患者的可动性,(o)改善或保持人类患者进行身体任务的能力,(p)改善或保持人类患者的生活质量,(q)保持、降低亨廷顿氏病患者中神经丝轻蛋白的浓度或减缓神经丝轻蛋白浓度的增加,其中所述药物组合物被周期性地口服施用至所述患者,使得90mg-225mg剂量的普利多匹定每天被施用至所述患者,或者(2)(a)在有相应需要的人类患者中改善、保持步态和平衡或减缓步态和平衡的下降,(b)在有相应需要的人类患者中改善、保持人类患者的独立性或减缓人类患者的独立性的下降,(c)在有相应需要的人类患者中改善、保持人类患者跨多个领域的认知表现或减缓认知表现的下降,(d)在有相应需要的人类患者中降低、保持舞蹈病或减缓舞蹈病的增加,其中药物被配制为用于周期性地口服施用至所述患者,使得90 mg剂量的普利多匹定每天被施用至所述患者。
[0080]
本发明提供了在人类患者中保持功能能力、改善功能能力或减缓功能能力的下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中保持功能能力、改善功能能力或减缓功能能力的下降。在一些实施方案中,方法包括每天将90mg或180mg剂量的普利多匹定施用至患者。在一些实施方案中,方法包括每天将90mg剂量的普利多匹定施用至患者。在一些实施方案中,患者是亨廷顿氏病(hd)患者。
[0081]
本发明提供了在人类患者中保持功能能力、改善功能能力或降低功能能力的下降速率的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中保持功能能力、改善功能能力或降低功能能力的下降速率。在一些实施方案中,方法包括每天将90mg或180mg剂量的普利多匹定施用至患者。在一些实施方案中,方法包括每天将90mg剂量的普利多匹定施用至患者。在一些实施方案中,患者是hd患者。
[0082]
本发明另外提供了减慢人类患者中如通过总功能能力测量的hd临床进展的方法,所述方法包括向罹患hd的患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而减慢患者中如通过总功能能力测量的hd的临床进展。在一些实施方案中,方法包括每天将90mg或180mg剂量的普利多匹定施用至患者。在一些实施方案中,方法包括每天将90mg剂量的普利多匹定施用至患者。在一些实施方案中,90mg每日剂量以每天两次(bid)45mg被施用至患者。
[0083]
还提供了减少人类hd患者中的功能下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而减少患者的功能下降。在一些实施方案中,与安慰剂(未接受普利多匹定的hd受试者)相比,从基线的功能下降减少了至少10%、至少15%、至少20%、至少25%、至少30%、至少35%或至少40%。在一些实施方案中,方法包括每天将约90mg至约180mg剂量的普利多匹定施用至患者。在一些实施方案中,方法包括每天将90mg剂量的普利多匹定施用
至患者。在方法的一些实施方案中,90mg 剂量以每天两次45mg被施用至患者。在方法的一些实施方案中,普利多匹定被口服施用。在方法的一些实施方案中,施用继续持续至少26周、至少52周、约78周或至少78周。在方法的一些实施方案中,hd患者是成人患者。hd患者被分类为早期患者,例如,阶段1hd或阶段2hd(hd1 或hd2)患者。在一些实施方案中,患者具有7-13或至少7、至少8、至少 9、至少10、至少11、至少12、13或7-10或11-13的基线tfc评分。在一些实施方案中,患者的功能能力使用统一亨廷顿氏病评定量表(unifiedhuntington’s disease rating scale,uhdrs)的总功能能力(total functionalcapacity,tfc)量表,uhdrs-tfc或tfc来测量。在方法的一些实施方案中,进行患者的基线功能能力和一个或更多个随后的功能能力评估以确定功能下降的任何变化。
[0084]
还提供了人类hd患者中的uhdrs-tfc评分实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而在患者中实现uhdrs-tfc评分与未接受普利多匹定的hd受试者相比的变化。在一些实施方案中,方法包括每天将约90mg至约180mg剂量的普利多匹定施用至患者。在一些实施方案中,方法包括每天将90mg剂量的普利多匹定施用至患者。在方法的一些实施方案中,施用继续持续至少26 周、或至少52周或约78周或至少78周。在方法的一些实施方案中,基于患者的uhdrs-tfc评分,hd患者被分类为阶段1hd患者或阶段2hd 患者。在一些实施方案中,患者具有7-13或至少7、至少8、至少9、至少 10、至少11、至少12、13或7-10或11-13的基线tfc评分。在方法的一些实施方案中,与未接受普利多匹定的hd受试者相比,uhdrs-tfc评分从基线的变化差异在26周的时间段内减少了至少0.2点、或在52周内减少了至少0.3点、或在78周内减少了0.5点。在方法的一些实施方案中,与未接受普利多匹定的hd受试者相比,uhdrs-tfc评分从基线的变化差异是tfc下降速率在78周下降至少20%、至少30%、至少40%或至少50%。
[0085]
在本文公开的方法的一些实施方案中,tfc包括保持职业、打理财务、家务、需要低水平的护理和日常生活活动(activities of daily living,adl)中的一个或更多个。
[0086]
本发明另外提供了在人类hd患者中在计时起立行走(timed up and go, tug)测试中实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而减少患者与未接受普利多匹定的hd受试者相比在tug测试中的变化。
[0087]
本发明另外提供了在人类hd患者中在tug测试中实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而减少患者与未接受普利多匹定的hd受试者相比在tug测试中的变化。
[0088]
本发明另外提供了在人类hd患者中在符号数字模态测试(symboldigit modalities test,sdmt)中实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180 mg剂量的普利多匹定每天被施用至患者,以便从而减少患者与未接受普利多匹定的hd受试者相比在sdmt测试中的变化。
[0089]
本发明另外提供了在人类hd患者中在斯特鲁词卡测试(stroop wordtest)中实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而减少患者与未
接受普利多匹定的hd受试者相比在stroop word测试中的变化。
[0090]
本发明另外提供了在人类hd患者中在uhdrs-独立性量表 (uhdrs-independence scale,uhdrs-is)中实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而减少患者与未接受普利多匹定的hd受试者相比在uhdrs-is中的变化。
[0091]
本发明另外地提供了在人类hd患者中在如由uhdrs-总运动评分 (uhdrs-total motor score,uhdrs-tms)领域的步态、足尖足跟衔接行走 (tandem walking)和后退拉力(retropulsion pull)测试的总和定义的步态和平衡评分方面实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而减少患者与未接受普利多匹定的hd受试者相比在步态和平衡评分方面的变化。
[0092]
本发明另外地提供了在人类hd患者中在uhdrs-tms舞蹈病分项评分方面实现从基线减少的变化的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-180mg剂量的普利多匹定每天被施用至患者,以便从而减少患者与未接受普利多匹定的hd受试者相比在uhdrs-tms舞蹈病分项评分方面的变化。
[0093]
本发明还提供了保持或改善人类患者进行日常生活活动的能力的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持或改善人类患者进行日常生活活动的能力。
[0094]
本发明还提供了减少人类患者中的肌张力障碍或保持肌张力障碍的水平的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中减少肌张力障碍或保持肌张力障碍的水平。
[0095]
本发明还提供了治疗人类患者中的肢体肌张力障碍的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90 mg-225mg剂量的普利多匹定每天被施用至患者,以便从而治疗人类患者中的肢体肌张力障碍。
[0096]
本发明还提供了改善或保持人类患者的步态和平衡的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90 mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的步态和平衡。
[0097]
另外提供了改善、保持人类患者的步态和平衡或减慢人类患者的步态和平衡的下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的步态和平衡或减慢人类患者的步态和平衡的下降。
[0098]
本发明还提供了改善或保持人类患者的独立性的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225 mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的独立性。
[0099]
本发明还提供了改善、保持人类患者的独立性或减慢人类患者的独立性的下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的独立性或减慢人类患者的独立性的下降。
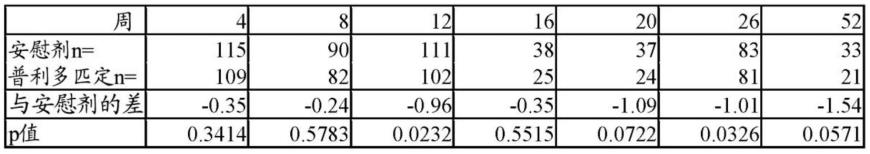
behaviors assessment forirritability)来测量。人类患者的行为和/或精神状态还可以通过用于缺乏主动性或冷漠的问题行为评估(problem behaviors assessment for lack of initiativeor apathy)来测量。人类患者的行为和/或精神状态可以例如通过用于强迫症的问题行为评估(problem behaviors assessment for obsessive-compulsiveness) 来测量。人类患者的行为和/或精神状态还可以通过用于迷失方向行为的问题行为评估(problem behaviors assessment for disoriented behavior)来测量。
[0112]
还提供了改善人类hd患者的缺乏主动性或冷漠或减缓人类hd患者的缺乏主动性或冷漠的下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善患者的缺乏主动性或冷漠或减慢患者的缺乏主动性或冷漠的下降。
[0113]
本发明还提供了减少或保持人类患者的不自主运动的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90 mg-225mg剂量的普利多匹定每天被施用至患者,以便从而减少或保持人类患者的不自主运动。
[0114]
本发明还提供了改善或保持人类患者的可动性(mobility)的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90 mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的可动性。
[0115]
本发明还提供了改善或保持人类患者进行身体任务的能力的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得 90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者进行身体任务的能力。
[0116]
在上文公开的方法的一些实施方案中,90mg或180mg剂量的普利多匹定每天被施用至患者。在上文公开的方法的一些实施方案中,90mg剂量的普利多匹定每天被施用至患者。在上文公开的方法的优选的实施方案中,每天被施用至患者的90mg剂量的普利多匹定以每天两次45mg被施用至患者。
[0117]
在一些实施方案中,患者每天一次(qd)被施用45mg普利多匹定,持续约一周至两周,并且此后每天两次被施用45mg普利多匹定。在上文公开的方法的一些实施方案中,施用继续持续至少12周、至少26周、超过26 周、至少52周或至少78周。在上文公开的方法的一些实施方案中,施用继续持续52周或78周。在上文公开的方法的一些实施方案中,hd患者是早期hd患者,并且具有至少7、至少8、至少9、至少10、至少11、至少 12、13或7-10或11-13的基线tfc评分。在上文公开的方法的一些实施方案中,hd患者已经被诊断为在亨廷顿蛋白(huntingtin)基因中具有至少36 个cag重复。在一些实施方案中,hd患者已经被诊断为在亨廷顿蛋白基因中具有至少44个重复。在上文公开的方法的一些实施方案中,hd患者是成人患者,并且是至少18岁或至少21岁。在上文公开的方法的一些实施方案中,hd患者是早期hd患者。在一些实施方案中,患者是阶段1hd (hd1)患者或阶段2hd(hd2)患者。在一些实施方案中,患者是hd1患者,并且经历hd的一种或更多种症状。在一些实施方案中,hd患者不是预先显现的(pre-manifest)hd患者。
[0118]
本文提供了包含普利多匹定的药物组合物,用于在减缓人类患者中的功能能力的下降中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,功能能力是总功能能力。在一些实施方案中,每日剂量是90mg普利多匹定。在一些实施方案中,每日剂量是每天两次45mg。
[0119]
本文提供了包含普利多匹定的药物组合物,用于在保持人类患者中的功能能力中使用,其中药物组合物被周期性地口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,功能能力包括日常生活活动(adl)。
[0120]
本文提供了一定量的普利多匹定在制造保持人类患者中的功能能力的药物中的用途,其中药物被配制为用于周期性口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,功能能力包括adl。
[0121]
本文提供了包含普利多匹定的药物组合物,用于在减慢人类患者中如通过总功能能力测量的hd的临床进展中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在许多实施方案中,(a)药物组合物被施用持续超过26周,或者(b)在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间,或者(c) 人类患者罹患早期亨廷顿氏病。
[0122]
在药物组合物和用途的一些实施方案中,tfc包括保持职业、打理财务、家务、需要低水平的护理和日常生活活动(adl)中的一个或更多个。
[0123]
本文提供了一定量的普利多匹定在制造用于减慢人类患者中如通过总功能能力测量的的hd的临床进展的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0124]
本文提供了包含普利多匹定的药物组合物,用于在人类患者中保持人类患者进行日常生活活动的能力中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0125]
本文提供了一定量的普利多匹定在制造用于在人类患者中保持人类患者进行日常生活活动的能力的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0126]
本文提供了包含普利多匹定的药物组合物,用于在人类患者中减少肌张力障碍或保持肌张力障碍的水平中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,肌张力障碍包括肢体肌张力障碍。
[0127]
本文提供了一定量的普利多匹定在制造用于在人类患者中减少肌张力障碍或保持肌张力障碍的水平的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,肌张力障碍包括肢体肌张力障碍。
[0128]
本文提供了包含普利多匹定的药物组合物,用于在治疗人类患者中的肢体肌张力障碍中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0129]
本文提供了一定量的普利多匹定在制造用于治疗人类患者中的肢体肌张力障碍的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0130]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的步态和平衡中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0131]
本文提供了一定量的普利多匹定在制造用于在人类患者中改善或保持人类患者的步态和平衡的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0132]
本文提供了包含普利多匹定的药物组合物,用于在改善、保持人类患者的步态和平衡,或减慢人类患者的步态和平衡的下降中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0133]
本文提供了一定量的普利多匹定在制造用于在人类患者中改善、保持人类患者的步态和平衡,或减慢人类患者的步态和平衡的下降的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0134]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的独立性中使用,其中药物组合物被周期性地口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。
[0135]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的独立性的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0136]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的独立性或减慢人类患者的独立性的下降中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0137]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的独立性或减慢人类患者的独立性的下降的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0138]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的认知领域中使用,其中药物组合物被周期性地口服施用至患者,使得 90mg-225mg剂量的普利多匹定每天被施用至患者。
[0139]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的认知领域的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0140]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的认知领域或减慢人类患者的认知领域的下降中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0141]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的认识领域或减慢人类患者的认知领域的下降的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0142]
本文提供了包含普利多匹定的药物组合物,用于在降低人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0143]
本文提供了一定量的普利多匹定在制造用于降低人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0144]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的运动能力中使用,其中药物组合物被周期性地口服施用至患者,使得 90mg-225mg剂量的普利多匹定每天被施用至患者。
[0145]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的运动能力的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0146]
本文提供了包含普利多匹定的药物组合物,用于在降低或保持人类患者中的舞蹈病的水平中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0147]
本文提供了一定量的普利多匹定在制造用于降低或保持人类患者中的舞蹈病的水平的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0148]
本文提供了包含普利多匹定的药物组合物,用于在人类患者中降低或保持舞蹈病或减慢舞蹈病的增加中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0149]
本文提供了一定量的普利多匹定在制造用于在人类患者中降低或保持舞蹈病或减慢舞蹈病的增加的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0150]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的行为和/或精神状态中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0151]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的行为和/或精神状态的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0152]
本文提供了包含普利多匹定的药物组合物,用于在减少或保持人类患者的不自主运动中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0153]
本文提供了一定量的普利多匹定在制造用于减少或保持人类患者的不自主运动的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0154]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的可动性中使用,其中药物组合物被周期性地口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。
[0155]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的可动性的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0156]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者进行身体任务的能力中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0157]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者进行身体任务的能力的药物中的用途,其中药物被配制为用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0158]
本文公开的方法、组合物和用途适用于例如罹患亨廷顿氏病的人类患者。在方法、组合物和用途的一些实施方案中,人类患者罹患hd并且具有在罹患亨廷顿氏病的总患者群体的最不严重的四分之一中的基线tms评分;或者
[0159]
人类患者罹患hd,并且具有在罹患亨廷顿氏病的总患者群体的最不严重的四分之二中的基线tms评分;或者
[0160]
人类患者罹患hd,并且具有在罹患亨廷顿氏病的总患者群体的最不严重的四分之三中的基线tms评分;或者
[0161]
人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分或具有大于或等于9的基线tfc评分;或者
[0162]
人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分或具有大于或等于9的基线tfc评分或在亨廷顿蛋白基因中具有小于44个cag重复;或者
[0163]
人类患者罹患hd,并且具有在罹患hd的总患者群体中的最不严重的四分之二中的基线tms评分;或者
[0164]
人类患者罹患hd,并且具有大于或等于7的基线tfc评分;或者
[0165]
人类患者罹患hd,并且具有11-13的基线tfc评分;或者
[0166]
人类患者罹患hd,并且具有大于或等于9的基线tfc评分或在亨廷顿蛋白基因中具有大于44个cag重复;或者
[0167]
人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分或在亨廷顿蛋白基因中具有小于44个cag重复;或者
[0168]
人类患者罹患hd,并且具有大于或等于9的基线tfc评分或具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分。
[0169]
在本文公开的方法、组合物和用途的一些实施方案中,普利多匹定或其药学上可接受的盐是普利多匹定盐酸盐。
[0170]
包含普利多匹定或其药学上可接受的盐,例如普利多匹定盐酸盐的药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0171]
在上文公开的组合物和用途的一些实施方案中,90mg或180mg剂量的普利多匹定每天被施用至患者。在上文公开的方法的一些实施方案中, 90mg剂量的普利多匹定每天被施用至患者。在上文公开的方法的优选的实施方案中,每天被施用至患者的90mg剂量的普利多匹定以每天两次45mg 被施用至患者。
[0172]
在一些实施方案中,患者被每天一次(qd)施用45mg普利多匹定持续约一周至两周,并且此后被每天两次施用45mg普利多匹定。在上文公开的方法的一些实施方案中,施用继续持续至少12周、至少26周、至少52周或至少78周。在上文公开的方法的一些实施方案
中,施用继续持续52周或78周。在上文公开的方法的一些实施方案中,hd患者是阶段1hd患者或阶段2hd患者,并且具有至少7、至少8、至少9、至少10、至少11、至少12、13或7-10或11-13的基线tfc评分。在上文公开的方法的一些实施方案中,hd患者已经被诊断为在亨廷顿蛋白基因中具有至少36个 cag重复。在上文公开的方法的一些实施方案中,hd患者是21岁或更大。
[0173]
在上文公开的方法、组合物和用途的一些实施方案中,hd患者是hd1 患者或hd2患者,并且不是预先显现的hd患者。
[0174]
附图的几个视图的简要描述
[0175]
在对于图和相应图的以下简要描述中,使用混合模型重复量度(mixedmodels repeated measures,mmrm)分析uhdrs-tms、uhdrs-行为学、 uhdrs-认知、tfc、uhdrs-功能评估、uhdrs-独立性量表、改良的身体性能测试(modified physical performance test,mppt)、个体tms子量表、 hd-认知评价量表(hd-cab)、问题行为评估-简化形式(pba-s)和其他结果从基线(在第0周,在施用普利多匹定之前)的变化,评估了整个52周时间段的功效。
[0176]
图1:患者血液中的普利多匹定浓度(ng/ml;平均值(+/-sd)测量值)。―pre”意指给药前,并且―post”意指给药后。v2意指第2次就诊,v3意指第3次就诊等等。wk2意指第二周,wk3意指第三周等等。
[0177]
图2:患者血液中的普利多匹定浓度(ng/ml)。在稳定状态给药后(“cmax”)(+/-sd)。
[0178]
对于图1和图2,关于测量值约40%的%变化系数(cv)被认为对于该设置[给药后1小时-2小时,患者群体,稀疏采样]是足够的。一旦考虑到真正的采样时间,预期变化性降低。
[0179]
图3:伴随普利多匹定施用的总运动评分(tms)从基线(bl)的变化。每天两次90mg的剂量(圆圈)显示了最大的治疗效果。tms的降低指示改善。下表1示出了与图3相对应的p值。
[0180]
表1
[0181]
周每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mg40.03040.0004<0001<.00018<.0001<.0001<.0001<.0001120.00020.0003<.00010.000216<.0001<.0001<.0001<,000120<.0001<.0001<0001<0001260.00130.0024<000100063
[0182]
图4:pride-hd安慰剂相对于hart和mermaihd临床试验中的历史安慰剂的总运动评分(tms)从基线的变化。越小的数字指示改善。在第 26周,存在约6.5tms点的差异。
[0183]
图5a和图5b:tms从基线的变化。图5a:使用hart和mermaihd 临床试验中的历史安慰剂,tms(从基线变化)结果对于每天两次45mg普利多匹定和每天两次90mg普利多匹定两者是显著的。越小的数字指示改善。图5b:随时间绘制的uhdrs-tms全分析集从基线的变化。pride-hd 在tms从基线的变化方面重现了之前的数据,因为从基线的变化值与 hart和mermaihd中的那些值相似。在该图中,tms从基线变化的降低指示改善。带有菱形的黑线代
表安慰剂,带有空心圆圈的线代表每天两次 45mg,带有三角形的灰线代表每天两次67.5mg,带有菱形的灰线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。每天两次90mg 的剂量证明了最大的治疗效果。
[0184]
图6a、图6b和图6c:施用不同剂量的普利多匹定的患者组在第12周 (6a);在第20周(6b);和在第26周(6c)的总肌张力障碍。y轴是肌张力障碍从基线的变化。所有数据指的是全分析集中肌张力障碍变化的调整的平均值
±
se。越小的数字指示改善。
[0185]
图6d-图6h示出了与肌张力障碍的各个方面相关的数据。
[0186]
图6d.具有》4的基线(bl)肌张力障碍评分的患者在用安慰剂、每天两次(b.i.d)45mg普利多匹定、每天两次67.5mg普利多匹定、每天两次90mg 普利多匹定或每天两次112.5mg普利多匹定给药后在52周的比较。在全分析集中,在安慰剂组和所有积极治疗组(未示出)的肌张力障碍评分方面,在第26周或第52周未注意到对于患者临床上有意义的从基线的变化。在第 52周评估的具有大于或等于4的基线肌张力障碍总评分的患者中,注意到所有治疗组的肌张力障碍的定向临床改善,对于每天两次45mg、每天两次 67.5mg和每天两次90mg的治疗组观察到最大的下降。下表示出了uhdrs 肌张力障碍评分随时间从基线的变化。
[0187][0188]
图6e-图6f:黑色柱指的是响应者:在uhdrs肌张力障碍评分方面具有改善或无变化的受试者。灰色柱指的是无响应者:在uhdrs肌张力障碍评分方面呈现出恶化的受试者。每个柱的底部的数字指的是受试者的数目。改善或无变化分别以大于或等于0的评分反映。
[0189]
图6e:接受安慰剂或每天两次45mg普利多匹定的具有uhdrs tms 肌张力障碍(≥0)的受试者(其为响应者或无响应者)的百分比。在用安慰剂或每天两次45mg普利多匹定完成52周治疗、具有≥4的基线(bl)肌张力障碍评分的患者中,基于uhdrs tms肌张力障碍从bl到52周的变化被分类为响应者(改善或无变化,例如变化≥0)或无响应者(恶化,变化<0)的百分比。
[0190]
图6f:在用安慰剂或每天两次45mg普利多匹定完成52周治疗、具有≥4的基线(bl)肌张力障碍评分的患者中,基于uhdrs tms肌张力障碍从 bl到52周的变化被分类为响应者(改善,例如变化≥1)或无响应者(恶化或无变化<1)的百分比。对于肌张力障碍项目响应者分析的结果还支持了这种改善的趋势,通过示出与安慰剂组相比,在每天两次45mg的治疗组中,更大百分比的患者被分类为肌张力障碍项目中的响应者(分别为14名患者 [77.8%]和18名患者[60.0%]),以及与安慰剂组相比,在每天两次45mg的治疗组中,更大百分比的患者被分类为舞蹈病+肌张力障碍项目中的响应者 (分别为14名患者[77.8%]和20名患者[66.7%])(未示出)。
[0191]
图6g:对于从mermaihd、hart和pride-hd研究汇集的、接受安慰剂或每天两次45mg普利多匹定、具有基线(bl)肌张力障碍(≥4)的受试者的 uhdrs肌张力障碍评分随时间变化的图。在第26周,每天两次服用45mg 普利多匹定的患者与服用安慰剂的患者相比示出了肌张力障碍评分的统计学上显著的改善。该改善的趋势在第52周被保持。
[0192]
图6h:在用安慰剂或每天两次45mg普利多匹定完成52周治疗、具有≥4的基线(bl)肌张力障碍评分的那些pride-hd患者中,基于uhdrs肢体肌张力障碍从bl到52周的变化被分类为响应者(改善,例如变化≥1)或无响应者(恶化或无变化<1)的百分比。
[0193]
针对uhdrs-肢体肌张力障碍项目,每天两次45mg普利多匹定的治疗组与安慰剂组相比统计学上显著更大比例的患者被分类为响应者(分别为 77.2%和36.7%)。图7a:第12周的肢体中的肌张力障碍(uhdrs-肢体肌张力障碍)的变化;图7b:第20周的手指敲击(finger taps)和手掌向下-手掌向上(pronate-supinate,p/s);图7c:第26周的手指敲击和手掌p/s。手指轻拍和手掌向下-手掌向上(p/s)是手指敲击(敲击双手手指的能力,其中在5秒内15次重复被认为是正常的)和手掌向下/手掌向上(在身体两侧旋转前臂和手使得手掌朝下(手掌向下)以及旋转前臂和手使得手掌是朝上(手掌向上)的能力)的组合。手掌向下-手掌向上也被称为―q-motor:pro-sup-频率-mn-手 (hz)”。所有数据示出在图7a-图7c的全分析集中肌张力障碍的变化的调整的平均值+se。在下表中,提供了与这些图相对应的数据和p-值。n指的是患者的数目。wk26指的是在第26周的相关评分。wk52指的是在第52周的相关评分。―与安慰剂的差(δto placebo)”指的是与安慰剂相比的评分差异,具体地,安慰剂组中从基线的平均变化相比于相关组的从基线的平均变化。―所有(all)”指的是普利多匹定治疗的患者,与疾病阶段无关。y轴是上表中列出的特性从基线的变化。x轴是剂量,其中p意指―安慰剂”,45意指―每天两次45mg”,67.5意指“每天两次67.5mg”,90意指“每天两次90mg”,并且112.5意指“每天两次112.5mg”。在图中,改善是从图的底部到图的顶部的方向。
[0194]
例如,图8b示出了所指示的组的患者(即,在基线具有11-13的tfc 评分的患者,即hd1)的uhdrs tms评分在基线的评分和在施用普利多匹定26周后(第26周)的评分之间的平均差异。在该图中,每天两次90mg剂量示出了最大的改善,因为其数据点是图中最高的数据点,示出与基线相比约8点的改善(即,与基线相比,在第26周-8uhdrs tms评分)。图8b 的描述下方的表格示出了,每天两次90mg组具有11名患者(“n”行)和在基线处39.1的平均uhdrs tms评分(“基线”行)。图8b的描述下方的表格还示出了,每天两次90mg组从基线的变化(约-8,图中示出,表中未示出)比安慰剂组从安慰剂的变化(约-2,图中示出,表中未示出)(“与安慰剂的差”行)好6.15点(-6.15)。此外,图8b的描述下方的表格示出了对于每天两次 90mg组的0.0361的p值(“p值”行)。hd1指的是具有11-13的基线tfc评分的早期hd患者。hd2指的是具有7-10的基线tfc评分的早期hd患者。
[0195]
图8a:第26周所有的uhdrs tms从基线的变化下表和图8a示出了与安慰剂相比,所有普利多匹定治疗的患者在26周的uhdrs tms没有显著的改善。改善以uhdrs tms评分更负的值证明。
[0196] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线46.944.546.94746.7与安慰剂的差 1.421.710.672.1p值 0.31990.22350.62820.1337
[0197]
图8b:第26周、阶段1、bl tfc 11-13的uhdrs tms从基线的变化。(具有基线总功能能力(bl tfc)评分11至13的普利多匹定治疗的患者在第26周的uhdrs tms评分)。具有基线
tfc评分11-13的hd患者通常被认为是第一阶段(阶段1)hd患者。下表和图8b示出了普利多匹定治疗的hd1患者与安慰剂相比在26周在uhdrs tms方面改善的趋势。
[0198] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线37.335.436.439.138.725与安慰剂的差
ꢀ‑
4.47-3-6.15-4.79p值 0.09760.25050.03610.0676
[0199]
图8c:第52周所有的uhdrs tms从基线的变化。下表和图8c示出了所有普利多匹定治疗的患者与安慰剂相比在52周的uhdrs tms没有显著的改善。
[0200] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线46.944.546.94746.7与安慰剂的差 0.592.551.782.71p值 0.74680.15910.31440.137
[0201]
图8d:第52周、阶段1、bl tfc 11-13的uhdrs tms从基线的变化。下表和图8d示出了普利多匹定治疗的处于hd1患者在52周的uhdrstms改善的趋势。
[0202] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线37.335.436.439.138.7wk52与安慰剂的差
ꢀ‑
5.32-0.84-7.1-0.92p值 0.10650.79180.0470.7765
[0203]
图8e:第52周uhdrs tms步态和平衡从基线的变化。下表和图8e 示出了所有普利多匹定治疗的患者在52周的uhdrs tms步态和平衡没有显著的改善。
[0204] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.84.14.143.8与安慰剂的差
ꢀ‑
0.09-0.05-0.010.04p值 0.74040.85320.97470.8923
[0205]
图8f:第52周、阶段1、bl tfc 11-13的uhdrs tms步态和平衡从基线的变化。下表和图8f示出了普利多匹定治疗的hd1患者在52周的 uhdrs tms步态和平衡中改善的趋势,对于接受每天两次45mg普利多匹定的患者是显著的。
[0206] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线2.32.82.62.62.4与安慰剂的差
ꢀ‑
0.94-0.53-0.49-0.4p值 0.04450.22940.30560.3797
[0207]
图8g:第26周所有的uhdrs tms舞蹈病从基线的变化。下表和图 8g示出了所有普利多匹定治疗的患者在26周的uhdrs tms舞蹈病没有显著的改善。
[0208] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181
基线11.410.91111.210.9与安慰剂的差 0.920.810.361.05p值 0.10830.15010.51850.0609
[0209]
图8h:第26周、阶段1、bl tfc 11-13的uhdrs tms舞蹈病从基线的变化。下表和图8h示出了普利多匹定治疗的hd1患者在26周的 uhdrs tms舞蹈病改善的趋势,对于接受每天两次90mg普利多匹定的患者是显著的。
[0210] 每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn17171118wk26与安慰剂的差-1.4-2.07-2.52-1.08p值0.18050.04380.02710.2932
[0211]
图8i:第26周所有的uhdrs tms肌张力障碍从基线的变化。下表和图8i示出了所有普利多匹定治疗的患者在26周的uhdrs tms肌张力障碍改善的趋势。
[0212] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线4.13.64.14.94.5与安慰剂的差
ꢀ‑
0.06-0.34-0.33-0.29p值 0.87110.37780.38450.4507
[0213]
图8j第26周、阶段1、bl tfc 11-13的uhdrs tms肌张力障碍从基线的变化。下表和图8j示出了普利多匹定治疗的hd1患者在26周的uhdrs tms肌张力障碍改善的趋势,对于接受每天两次90mg普利多匹定的患者是显著的。
[0214] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线2.82.12.23.22.4与安慰剂的差
ꢀ‑
0.99-0.89-1.56-0.53p值 0.15690..18820.03960.4303
[0215]
图8k:第52周uhdrs tms肌张力障碍从基线的变化下表和图8k 示出了所有普利多匹定治疗的患者在52周的uhdrs tms肌张力障碍改善的趋势。
[0216] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线4.13.64.14.945与安慰剂的差
ꢀ‑
0.39-0.35-0.27-0.24p值 0.43580.47950.58580.6382
[0217]
图8l :第52周、阶段1、bl tfc 11-13的uhdrs tms肌张力障碍从基线的变化下表和图8l示出了普利多匹定治疗的hd1患者在52周的 uhdrs tms肌张力障碍改善的趋势,对于接受每天两次45mg普利多匹定的患者是显著的。
[0218] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn127171118基线2.82.12.23.22.4与安慰剂的差
ꢀ‑
1.65-0.1-1.46-0.46p值 0.02430.88480.05750.5228
[0219]
图8m:第26周所有的uhdrs tms不自主运动从基线的变化。下表和图8m示出了所有普利多匹定治疗的患者在26周的uhdrs tms不自主运动没有显著的改善。
[0220] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线15.614.415.11615.4与安慰剂的差 0.890.480.010.76p值 0.25940.53280.98730.3268
[0221]
图8n:第26周、阶段1、bl tfc 11-13的uhdrs tms不自主运动中从基线的变化。下表和图8n示出了接受每天两次45mg、每天两次67.5mg 和每天两次90mg普利多匹定的普利多匹定治疗的hd1患者在26周的 uhdrs tms不自主运动显著的改善。
[0222] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线11.51212.212.913.2与安慰剂的差
ꢀ‑
2.49-3.07-4-1.64p值 0.04690.01170.00330.1731
[0223]
图8o:第52周uhdrs tms不自主运动从基线的变化。下表和图8o 示出了所有普利多匹定治疗的患者在52周的uhdrs tms不自主运动没有显著的改善。
[0224] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线15.614.415.11615.4与安慰剂的差 0.020.8-0.260.57p值 0.98670.41960.78930.5648
[0225]
图8p:第52周、阶段1、bl tfc 11-13的uhdrs tms不自主运动从基线的变化。下表和图8p示出了普利多匹定治疗的hd1患者特别是每天两次45mg和每天两次90mg治疗的患者在52周的uhdrs tms不自主运动改善的趋势。
[0226] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171l18基线11.51212.212.913.2与安慰剂的差
ꢀ‑
2.73-0.2-3.80.8p值 0.14870.911l0.06430.675l
[0227]
图8q:第52周排除舞蹈病的uhdrs tms从基线的变化。下表和图8q示出了所有普利多匹定治疗的患者在52周的排除舞蹈病的uhdrs tms 没有显著的改善。
[0228] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线35.533.635.935.835.8与安慰剂的差 0.051.311.671.94p值 0.96930.34950.22340.1704
[0229]
图8r:第52周、阶段1、bl tfc 11-13的排除舞蹈病的uhdrs tms 从基线的变化。下表和图8r示出了普利多匹定治疗的hd1患者特别是每天两次45mg和每天两次90mg治疗的患者在52周的排除舞蹈病的uhdrstms改善的趋势。
[0230] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线28.625.526.429.427.8与安慰剂的差
ꢀ‑
4.09-0.18-4.92-1.59p值 0.0830.93580.05050.4924
[0231]
图8s:第26周所有的排除肌张力障碍的uhdrs tms从基线的变化。下表和图8s示出了所有普利多匹定治疗的患者在26周的排除肌张力障碍的 uhdrs tms没有显著的改善。
[0232] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线42.740.942.842.142.2与安慰剂的差 1.391.971.22.4p值 0.27330.11370.33140.0539
[0233]
图8t:第26周、阶段1、bl tfc 11-13的排除肌张力障碍的uhdrstms从基线的变化。下表和图8t示出了普利多匹定治疗的hd1患者在26 周的排除肌张力障碍的uhdrs tms改善的趋势。
[0234] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线34.633.434.135.936.3与安慰剂的差
ꢀ‑
3.6-2.2-4.35-4.31p值 0.15940.3760.11670.0842
[0235]
图9a:第26周所有的uhdrs总功能评估从基线的变化。下表和图 9a示出了所有普利多匹定治疗的患者在26周的uhdrs tfc没有显著的改善。改善由较高的tfc评分证明。
[0236] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线18.61918.618.819.1与安慰剂的差 0.020.09-0.41-0.1p值 0.95110.82110.2770.7979
[0237]
图9b:第26周、阶段1、bl tfc 11-13的uhdrs总功能评估从基线的变化。下表和图9b示出了普利多匹定治疗的hd1患者特别是每天两次45mg治疗的患者在52周的uhdrs tfc改善的趋势。
[0238] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线22.82392323.122.9与安慰剂的差 1.231.080.871.33p值 0.05160.06960.18990.0273
[0239]
图9c:第26周所有的uhdrs独立性量表从基线的变化。下表和图 9c示出了所有45mg普利多匹定治疗的患者在26周的uhdrs is显著的改善。
[0240] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线76.476.174.676.375.6
与安慰剂的差 1.790.30.781.41p值 0.03280.71240.3410.0887
[0241]
图9d:第26周、阶段1、bl tfc 11-13的uhdrs独立性量表从基线的变化。下表和图9d示出了每天两次45mg治疗的hd1患者在26周后的uhdrs is的改善。
[0242] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线83.884.181.584.183.1与安慰剂的差 4.942.271.732.38p值 0.0010.11260.27380.958
[0243]
图9e:第52周所有的uhdrs独立性量表从基线的变化。下表和图 9e示出了所有普利多匹定治疗的患者在52周后的uhdrs is没有显著的改善。
[0244] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线76.476.174.676.375.6与安慰剂的差 0.860.25-0.070.18p值 0.50820.84310.95580.8871
[0245]
图9f:第52周、阶段1、bl tfc 11-13的uhdrs独立性量表从基线的变化。下表和图9f示出了每天两次45mg治疗的hd1患者在52周后的 uhdrs is改善的趋势。
[0246] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线83.884.181.584.183.1与安慰剂的差 3.050.911.16-1.61p值 0.12890.64150.58990.4193
[0247]
图9g:早期hd(tfc>7)在52周的家务。下表提供了与图9g相对应的数据和p值。在每天两次45mg普利多匹定持续52周施用的hd1患者和hd2患者中观察到tfc家务的显著改善。
[0248] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线1.41.51.41.41.4与安慰剂的差 0.240.090.160.04p值 0.01960.38290.11550.7145
[0249]
图9h:早期hd(tfc≥7)在52周的护理水平。下表提供了与图9h相对应的数据和p值。在每天两次45mg至每天两次90mg普利多匹定施用持续52周的hd1患者和hd2患者中观察到tfc护理水平的显著改善。
[0250] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线21.9222与安慰剂的差 0.120.090.080.04p值 0.00440.03190.04110.403
[0251]
图10a:第26周所有的uhdrs总功能能力从基线的变化。下表和图10a示出了所有普
利多匹定治疗的患者在26周后的uhdrs tfc改善的趋势。
[0252] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线7.98.17.87.88与安慰剂的差 0.340.210.330.42p值 0.14740.36390.14650.0676
[0253]
图10b:第26周、阶段1、bl tfc 11-13的uhdrs总功能能力从基线的变化。下表和图10b示出了每天两次45mg和每天两次90mg普利多匹定治疗持续26周的hd1患者的uhdrs is的改善。
[0254] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线11.811.511.511.711.8与安慰剂的差 1.650.841.431.75p值 0.0040.12450.01910.0019
[0255]
图10c:第52周uhdrs总功能能力从基线的变化。下表和图10c示出了所有接受每天两次45mg普利多匹定持续52周的患者的通过tfc评分测量的功能下降的减少。
[0256] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线7.98.17.87.88与安慰剂的差 0.870.110.190.24p值 0.00320.70420.50990.4061
[0257]
图10d:第52周、阶段1、bl tfc 11-13的uhdrs总功能能力从基线的变化。下表和图10d示出了接受每天两次45mg普利多匹定持续52周的hd1患者的通过tfc测量的统计学上显著降低的功能下降。
[0258] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线11.811.511.511.711.8与安慰剂的差 1.89-0.030.991.06p值 0.00590.95880.16780.1154
[0259]
图10e:第52周、阶段2、bl tfc 7-10的uhdrs总功能能力从基线的变化。下表和图10e示出了接受每天两次45mg普利多匹定持续52周的 hd2患者的通过tfc测量的统计学上显著降低的功能下降。
[0260] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线8.38.28.48.58.2与安慰剂的差 0.940.640.510.03p值 0.0090.09240.14480.9331
[0261]
图11a:第26周所有的uhdrs tfc财务adl中从基线的变化。下表和图11a示出了所有接受普利多匹定持续26周的患者在作为uhdrstfc评分的一部分被测量的adl财务改善的趋势。
[0262] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线44.13.944与安慰剂的差 0.220.160.310.38p值 0.17820.31840.05430.0168
[0263]
图11b:第26周、阶段1、bl tfc 11-13的uhdrs tfc财务adl 从基线的变化。下表和图11b示出了接受所有剂量的普利多匹定持续26周的hd1患者的作为tfc评分的一部分被测量的adl财务的统计学上显著的改善。
[0264] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线5.85.75.85.95.9与安慰剂的差 0.920.650.971.12p值 0.00120.01680.0017<0001
[0265]
图11c:第26周、阶段2、bl tfc 7-10的uhdrs tfc财务adl 从基线的变化。下表和图11c示出了接受最高剂量的普利多匹定持续26周的hd2患者的作为tfc评分的一部分被测量的adl财务的统计学上显著的改善。
[0266] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线444.34.44.54.2与安慰剂的差 0.330.260.30.46p值 0.14920.26340.16740.0459
[0267]
图11d:第52周所有的uhdrs tfc财务adl从基线的变化。下表和图11d示出了所有接受每天两次45mg普利多匹定持续52周的患者的作为uhdrs tfc评分的一部分被测量的adl财务的统计学上显著的改善。
[0268] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线44.13.944与安慰剂的差 0.460.10.170.1p值 0.01640.58310.35580.6018
[0269]
图11e:第52周、阶段1、bl tfc 11-13的uhdrs tfc财务adl 从基线的变化。下表和图11e示出了接受每天两次45mg普利多匹定持续 26周的hd1患者的作为tfc评分的一部分测量的adl财务的统计学上显著的改善。
[0270] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线5.85.75.85.95.9与安慰剂的差 0.77-0.180.40.64p值 0.02770.59970.28050.0697
[0271]
图11f:第26周、阶段2、bl tfc 7-10的uhdrs tfc财务adl从基线的变化。下表和图11f示出了接受每天两次45mg-90mg普利多匹定持续26周的hd2患者的作为tfc评分的一部分被测量的adl财务的统计学上显著的改善。
[0272] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线4.44.34.44.54.2与安慰剂的差 0.70.540.560.18p值 0.00450.04070.01990.4962
[0273]
图12a:第26周所有的uhdrs tfc财务从基线的变化。下表和图12a 示出了所有普利多匹定治疗的患者在26周的uhdrs tfc财务没有显著的改善。
[0274] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线1.61.81.71.71.7与安慰剂的差 0.10.050.150.21p值 0.36290.61310.13890.0449
[0275]
图12b:第26周、阶段1、bl tfc 11-13的uhdrs tfc财务从基线的变化。下表和图12b示出了接受每天两次≥67.5mg普利多匹定持续26 周的hd1患者的uhdrs tfc财务的统计学上显著的改善。
[0276] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线2.82.92.82.92.9与安慰剂的差 0.250.310.430.44p值 0.11830.04940.01620.0062
[0277]
图12c:第52周uhdrs tfc财务从基线的变化。下表和图12c示出了接受每天两次45mg普利多匹定持续52周的hd1患者的tfc财务的统计学上显著的改善。
[0278] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线1.61.81.71.71.7与安慰剂的差 0.310.050.160.05p值 0.01430.66440.19760.7059
[0279]
图12d:第52周、阶段2、bl tfc 7-10的uhdrs tfc财务从基线的变化。下表和图12b示出了接受每天两次45mg和90mg普利多匹定持续26周的hd2患者的uhdrs tfc财务的统计学上显著的改善。
[0280] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线1.81.91.91.91.8与安慰剂的差 0.390.230.40.01p值 0.03360.240.02480.9559
[0281]
图13a:第26周所有的uhdrs tfc家务从基线的变化。下表和图13a 示出了所有普利多匹定治疗的患者在26周的uhdrs tfc家务没有显著的改善。
[0282] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线1.21.31.31.21.2
与安慰剂的差
ꢀ‑
0.010.0200.06p值 0.90150.83310.9770.438
[0283]
图13b:第26周、阶段1、bl tfc 11-13的uhdrs tfc家务从基线的变化。下表和图13b示出了接受普利多匹定持续26周的hd1患者的tfc 家务改善的趋势。
[0284] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线21.81.91.71.9与安慰剂的差 0.340.210.340.47p值 0.05890.21690.08720.0079
[0285]
图13c:第52周所有的uhdrs tfc家务从基线的变化。下表和图13c 示出了所有普利多匹定治疗的患者在52周的uhdrs tfc家务没有显著的改善。
[0286] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5956596267基线1.31.31.31.21.2与安慰剂的差 0.23-0.030.050.04p值 0.06470.78250.68690.7093
[0287]
图13d:第52周、阶段1、bl tfc 11-13的uhdrs tfc家务从基线的变化。下表和图13d示出了接受每天两次45mg普利多匹定持续52周的hd1患者的tfc家务的统计学上显著的改善。
[0288] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线21.81.91.71.9与安慰剂的差 0.490.050.10.23p值 0.01610.77930.64420.2463
[0289]
图14a:第26周所有的uhdrs tfc adl从基线的变化。下表和图 14a示出了所有普利多匹定治疗的患者在26周的tfc adl中没有显著的改善。
[0290] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.42.32.22.32.3与安慰剂的差 0.120.090.140.17p值 0.2050.34270.12960.0773
[0291]
图14b:第26周、阶段1、bl tfc 11-13的uhdrs tfc adl从基线的变化。下表和图14b示出了接受每天两次45mg、每天两次90mg和每天两次112.5mg普利多匹定持续26周的hd1患者的uhdrs tfc adl的统计学上显著的改善。
[0292] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线2.9282.933与安慰剂的差 0.650340.580.7p值 0.00110.0715000620.0003
[0293]
图14c:第52周所有的uhdrs tfc adl从基线的变化。下表和图 14c示出了所有普
利多匹定治疗的患者在52周的uhdrs tfc adl没有显著的改善。
[0294] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线242.32.22.323与安慰剂的差 0.140.03-0.010.03p值 0.22160.79430.93180.7868
[0295]
图14d:第52周、阶段1、bl tfc 11-13的uhdrs tfc adl从基线的变化。下表和图14d示出了接受每天两次45mg或每天两次112.5mg 普利多匹定持续52周的hd1患者的uhdrs tfc adl的统计学上显著的改善。
[0296] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn121 71 7111 8基线2.92.82.933与安慰剂的差 0.620.210.420.46p值 0.00440.30540.06460.0345
[0297]
图14e:第52周、阶段2、bl tfc 7-10的uhdrs tfc adl从基线的变化。下表和图14e示出了接受每天两次45mg普利多匹定持续52周的 hd2患者的uhdrs tfc adl的统计学上显著的改善。
[0298] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线2.62.52.52.52.4与安慰剂的差 0270.310.160.15p值 0.03560.02440.18940.2776
[0299]
图15a:第52周所有的uhdrs tfc护理水平从基线的变化。下表和图15a示出了所有普利多匹定治疗的患者在52周的uhdrs tfc护理水平没有显著的改善。
[0300] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5956596267基线1.91.91.91.91.9与安慰剂的差 0.090-0.08-0.03p值 0.11530.93650.15090.5713
[0301]
图15b:第52周、阶段2、bl tfc 7-10的uhdrs tfc护理水平从基线的变化。下表和图15b示出了接受每天两次45mg普利多匹定持续52 周的hd2患者的uhdrs tfc护理水平的统计学上显著的改善。
[0302] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线1.91.9222与安慰剂的差 0.130.120.10.03p值 0.01560.03950.05850.6168
[0303]
图16a:第26周所有的hd-qol参与者总评分从基线的变化。下表和图16a示出了所有普利多匹定治疗的患者在26周的hd-qol没有显著的改善。
[0304] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mg
n8175798181基线68.167.376.573.369.9与安慰剂的差 1.918.76.95-1.36p值 0.67750.05720.12510.7663
[0305]
图16b:第26周、阶段2、bl tfc 7-10的hd-qol参与者总评分从基线的变化。下表和图16b示出了每天两次67.5mg普利多匹定治疗的hd2 患者在26周的hd-qol的显著改善。
[0306] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线62.564.382.874.378与安慰剂的差 3.2216.3310.644.29p值 0.56010.00540.05660.4577
[0307]
图17a:第26周所有的全分析集中的pba总评分从基线的变化。下表和图17a示出了普利多匹定治疗的患者在52周的pba总评分从基线的变化。
[0308]
安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线1210.913.811.211.8与安慰剂的差
ꢀ‑
0.46-1.830.51-1.85p值 0.78380.27480.75670.2659
[0309]
图17b:第26周、阶段1、bl tfc 11-13的pba总评分从基线的变化。下表和图17b示出了接受普利多匹定持续26周的hd1患者的pba总评分改善的趋势。
[0310] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171l18基线8.88.110.247.7与安慰剂的差
ꢀ‑
4.83-9.22-4.74-7.08p值 0.3190.05330.37210.1351
[0311]
图17c:第26周所有的pba抑郁情绪,严重程度x频率从基线的变化。下表和图17c示出了所有普利多匹定治疗的患者在26周的pba抑郁情绪没有显著的改善。
[0312] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线1.51.81.91.21 .3与安慰剂的差
ꢀ‑
0.29-0.65-0.34-0.52p值 0.40150.05830.31740.1237
[0313]
图17d:第26周、阶段1、bl tfc 11-13的pba抑郁情绪,严重程度x频率从基线的变化。下表和图17d示出了普利多匹定治疗的hd1患者在26周的pba抑郁情绪没有显著的改善。
[0314] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线1.91.32.20.81.1与安慰剂的差
ꢀ‑
0.63-2.01-0.84-1.43p值 0.57820.07040.49570.1942
[0315]
图17e:第52周全分析集中的pba总评分从基线的变化。下表和图 17e示出了每天
两次45mg普利多匹定治疗的患者在52周的pba总评分改善的趋势。
[0316]
n8175798181基线1210.913.811.211.8与安慰剂的差
ꢀ‑
3.98-0.63-0.380.3p值 0.06030.76020.8510.8845
[0317]
图17f:bl tfc≥7、第52周全分析集中的pba总评分从基线的变化。下表和图17f示出了每天两次45mg普利多匹定治疗的hd1患者和hd2患者在52周的pba总评分改善的趋势。
[0318] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线11.41 0.114.410.910.4与安慰剂的差
ꢀ‑
2.740.610.91.4p值 0.19110.77850.66530.5171
[0319]
图17g:第52周所有的pba易怒,严重程度x频率从基线的变化。下表和图17g示出了大多数(排除每天两次67.5mg)普利多匹定治疗的患者在 52周的pba易怒显著的改善。
[0320] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线21.61.71.41.5与安慰剂的差
ꢀ‑
1.03-0.63-1.01-0.84p值 0.01260.11760.01080.0419
[0321]
图17h:阶段3-阶段5、bl tfc 0-6、第52周的pba易怒,严重程度x频率从基线的变化。下表和图17h示出了具有基线tfc 0-6的普利多匹定治疗的患者在52周的pba易怒显著的改善。
[0322] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线1.30.90.91.31.6与安慰剂的差
ꢀ‑
2.42-1.78-1.79-1.71p值 0.01650.04290.04220.0542
[0323]
图17i:第26周所有的pba缺乏主动性(冷漠),严重程度x频率从基线的变化。下表和图17i示出了所有普利多匹定治疗的患者在26周的pba 冷漠没有显著的改善。
[0324] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.62.53.12.93与安慰剂的差
ꢀ‑
0.87-0.53-0.2-0.26p值 0.12350.34370.71980.6445
[0325]
图17j:第26周、阶段1、bl tfc 11-13的pba缺乏主动性(冷漠),严重程度x频率从基线的变化。下表和图17j示出了接受普利多匹定持续 26周的hd1患者的pba冷漠改善的趋势。
[0326] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn121717l118
基线1.211.30.41.5与安慰剂的差
ꢀ‑
1.85-1.51-1.46-2.62p值 0.07030.12670.18220.0089
[0327]
图17k:第52周全分析集中的pba缺乏主动性(冷漠),严重程度x频率从基线的变化。下表和图17k示出了接受普利多匹定持续52周的bl阶段1的患者的pba冷漠改善的趋势。
[0328]
安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mg安慰剂n8175798181基线262.53.12.93与安慰剂的差
ꢀ‑
1.270.26-0.12-0.04p值 0.07040.70520.85990.9523
[0329]
图17l:第52周、阶段1、bl tfc>7、第52周的pba缺乏主动性 (冷漠),严重程度x频率从基线的变化。下表和图17l 示出了普利多匹定治疗持续52周的hd1患者和hd2患者的pba冷漠改善的趋势。
[0330]
安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mg安慰剂n6259545658基线2.5232.728与安慰剂的差
ꢀ‑
1.39-0.29-0.020.26p值 0.06080.7030.97340.7346
[0331]
图17m:第26周所有的pba强迫症,严重程度x频率从基线的变化。下表和图17m示出了所有普利多匹定治疗的患者在26周的pba o-c没有显著的改善。
[0332] 安慰剂每天两次45mg每天两次67.5mg 每天两次90mg每天两次112.5mgn817579 8181基线1.21.11.3 1.11与安慰剂的差 0.1-0.45
ꢀ‑
0.12-0.63p值 0.80810.2512 0.75410.1061
[0333]
图17n第26周、阶段1、bl tfc 11-13的pba强迫症,严重程度x 频率从基线的变化。下表和图17n示出了接受普利多匹定持续26周的hd1 患者的pba o-c的统计学上显著的改善。
[0334] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn12171 71118基线010.40.10.1与安慰剂的差
ꢀ‑
2.11-2.03-1.71-1.73p值 0.00350.00350.02510.0114
[0335]
图17o:第52周所有的pba强迫症,严重程度x频率从基线的变化。下表和图17o示出了所有普利多匹定治疗的患者在52周的pba o-c没有显著的改善。
[0336] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线1.21.11.31.11与安慰剂的差
ꢀ‑
0.24-0.28-0.13-0.12p值 0.57330.50680.75080.7789
[0337]
图17p:第52周、阶段1、bl tfc 11-13的pba强迫症,严重程度x 频率从基线的变
化。下表和图17p示出了接受普利多匹定持续52周的hd1 患者的pba o-c的统计学上显著的改善。
[0338] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线010.40.10.1与安慰剂的差
ꢀ‑
2.73-3.24-2.47-2.73p值 0.0070.00110.0210.005
[0339]
图17q:第26周所有的pba迷失方向行为,严重程度x频率从基线的变化。下表和图17q示出了所有普利多匹定治疗的患者在26周的pba 迷失方向行为没有显著的改善。
[0340] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线0.60.40.80.60.6与安慰剂的差
ꢀ‑
0.2-0.28-0.09-0.08p值 0.28640.13570.6070.6771
[0341]
图17r:第26周、阶段1、bl tfc 11-13的pba迷失方向行为,严重程度x频率从基线的变化。下表和图17r示出了接受每天两次45mg或每天两次112.5mg普利多匹定的hd1患者在26周的pba迷失方向行为的显著改善。
[0342] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线0.100.300.3与安慰剂的差
ꢀ‑
0.19-0.16-0.16-0.18p值 0.03810.06150.0930.0357
[0343]
图18a:第26周所有的计时起立行走测试(秒)从基线的变化。下表和图18a示出了所有普利多匹定治疗的患者在26周的计时起立行走测试没有显著的改善。
[0344] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线12.112.110.410.311.6与安慰剂的差
ꢀ‑
2.16-0.09-1.54-2.33p值 0.17650.95710.32550.1456
[0345]
图18b:第26周阶段1、bl tfc 11-13的计时起立行走测试(秒)从基线的变化。下表和图18b示出了普利多匹定治疗的hd1患者在26周的计时起立行走测试改善的趋势。
[0346] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线9.78.68.79.69.4与安慰剂的差
ꢀ‑
6.98-5.59-5.87-7.24p值 0.06120.12590.14980.0482
[0347]
图18c:第52周计时起立行走测试(秒)从基线的变化。下表和图18c 示出了所有普利多匹定治疗的患者在52周的计时起立行走测试没有统计学上显著的改善。
[0348] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次1125mgn8175798181
基线12.112.110.410.311.6与安慰剂的差
ꢀ‑
1.49-0.740.22-0.47p值 0.08990.40220.79180.595
[0349]
图18d:第52周、阶段1、bl tfc 11-13的计时起立行走测试(秒)从基线的变化。下表和图18d示出了普利多匹定治疗的hd1患者在52周的计时起立行走测试中改善的趋势。
[0350] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线9.78.68.79.69.4与安慰剂的差
ꢀ‑
5.26-4.65-4.02-5.13p值 0.06270.09210.18590.0652
[0351]
图19a:第26周所有的walk-12总评分从基线的变化。下表和图19a 示出了所有普利多匹定治疗的患者在26周的walk-12ts没有显著的改善。
[0352] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线31.532.132.829729.7与安慰剂的差
ꢀ‑
2.450.131.7-4.71p值 0.33590.96040.49310.0622
[0353]
图19b:第26周、阶段1、bl tfc 11-13的walk-12总评分从基线的变化。下表和图19b示出了普利多匹定治疗的hd1患者在26周的walk-12 ts的统计学上显著的改善。
[0354] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线21.26.312.317.713与安慰剂的差
ꢀ‑
9.63-7.45-10.88-9.38p值 0.02410.0540.01160.0173
[0355]
图19c:第26周、阶段3-阶段5、bl tfc 0-6的walk-12总评分从基线的变化。下表和图19c示出了普利多匹定治疗的晚期患者(bl tfc 0-6) 在26周的walk-12ts没有显著的改善。
[0356] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线56.655.448.339.645.9与安慰剂的差
ꢀ‑
1.97-4.7-3.18-14.22p值 0.75240.42420.59340.0151
[0357]
图19d:第52周所有的walk-12总评分从基线的变化。下表和图19d 示出了普利多匹定治疗的患者在52周的walk-12ts没有统计学上显著的改善。
[0358] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线31.532.132.829.729.7与安慰剂的差 1.623.012.530.56p值 0.64860.38910.45870.8738
[0359]
图19e:第52周、阶段1、bl tfc 11-13的walk-12总评分从基线的变化。下表和图
19e示出了每天两次90mg普利多匹定治疗的hd1患者在 52周的walk-12ts的统计学上显著的改善。
[0360] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线21.26.312.317.713与安慰剂的差
ꢀ‑
5.86-8.57-13.6-4.13p值 0.30180.10320.01930.4534
[0361]
图20a:第26周、bl tfc<7的uhdrs独立性量表从基线的变化。下表和图20a示出了具有小于7的bl tfc的普利多匹定治疗的患者在26 周的uhdrs is中没有显著的改善。
[0362]
ꢀꢀ
安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线65.563.864.868.266.3与安慰剂的差 0.3-0.440.21.65p值 0.87960.80270.91160.3578
[0363]
图20b:第26周、bl tfc≥7的uhdrs独立性量表从基线的变化。下表和图20b示出了每天两次45mg普利多匹定治疗的hd1患者和hd2 患者在26周的uhdrs is的统计学上显著的改善。
[0364] 每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn59545658wk26与安慰剂的差2.220.991.481.51p值0.01280.27550.09490.0919
[0365]
图20c:第52周、bl tfc<7的uhdrs独立性量表从基线的变化。下表和图20c示出了具有小于7的基线tfc的普利多匹定治疗的患者在52 周的uhdrs is没有显著的改善。
[0366] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线65.563.864.868.266.3与安慰剂的差
ꢀ‑
1.85-3.46-5.25-0.52p值 0.57990.24150.07790.8613
[0367]
图20d:第52周、bl tfc≥7的uhdrs独立性量表从基线的变化。下表和图20d示出了每天两次90mg普利多匹定治疗的hd1患者和hd2 患者在52周的uhdrs is的统计学上显著的改善。
[0368] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线79.879.479.279.979.3与安慰剂的差 1.992.222.790.44p值 0.10470.07880.02280.7301
[0369]
图21a-图21p、图22a-图22b、图23a-图23b、图24a-图24b是比较早期(tfc≥7、hd1和hd2)hd患者或晚期(tfc<7)hd患者的特征的图。
[0370]
图21a:第26周、bl tfc<7的uhdrs总功能能力从基线的变化。下表和图21a示出了
普利多匹定治疗的晚期患者在26周的uhdrs tfc没有显著的改善。
[0371] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线8.99.29.49.19.3与安慰剂的差 0.560.330.610.67p值 0.03590.2150.01990.0125
[0372]
图21b:第26周、bl tfc≥7的uhdrs总功能能力从基线的变化。下表和图21b示出了每天两次45mg和每天两次90mg和更高的普利多匹定治疗的hd1患者和hd2患者在26周的uhdrs tfc的统计学上显著的改善。
[0373] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线8.99.29.49.19.3wk26与安慰剂的差 0.560.330.610.67p值 0.03590.2150.01990.0125
[0374]
图21c:第26周、bl tfc<7的uhdrs tfc财务adl从基线的变化。下表和图21c示出了普利多匹定治疗的晚期患者在26周的uhdrs tfc 财务adl没有显著的改善。
[0375] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线221.92.22.3与安慰剂的差
ꢀ‑
0.34-0.060.280.03p值 0.32390.84080.37470.9361
[0376]
图21d:第26周、bl tfc≥7的uhdrs tfc财务adl从基线的变化。下表和图21d示出了每天两次45mg和每天两次90mg和更高的普利多匹定治疗的hd1患者和hd2患者在26周的uhdrs财务adl的统计学上显著的改善。
[0377] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线4.64.74.94.84.7与安慰剂的差 0.460.320.470.62p值 0.01140.08170.00930.0007
[0378]
图21e:第26周、bl tfc<7的uhdrs tfc财务从基线的变化。下表和图21e示出了普利多匹定治疗的晚期患者在26周的uhdrs tfc财务没有显著的改善。
[0379] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线0.50.50.50.70.7与安慰剂的差
ꢀ‑
0.19-0.10.050.03p值 0.35080.59340.7740.8925
[0380]
图21f:第26周、bl tfc≥7的uhdrs tfc财务从基线的变化。下表和图21f示出了每天两次90mg和更高的普利多匹定治疗的hd1患者和 hd2患者在26周的uhdrs tfc财务的统计学上显著的改善。
[0381] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mg
n6259545658基线22.22.22.12.2与安慰剂的差 0.20.160.270.33p值 0.08530.18650.02360.0061
[0382]
图21g:第26周、bl tfc<7的uhdrs tfc adl从基线的变化。下表和图21g示出了普利多匹定治疗的晚期患者在26周的uhdrs tfcadl没有显著的改善。
[0383] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线1.51.51.41.51.7与安慰剂的差
ꢀ‑
0.19-0.040.18-0.04p值 0.35960.85180.35070.8438
[0384]
图21h:第26周bl tfc≥7的uhdrs tfc adl从基线的变化。下表和图21h示出了每天两次45mg和每天两次90mg和更高的普利多匹定治疗的hd1患者和hd2患者在26周的uhdrs tfcadl的统计学上显著的改善。
[0385] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线2.62.62.62.62.6与安慰剂的差 0.240.160.190.27p值 0.01760.11320.05260.0076
[0386]
图21i:第52周、bl tfc<7的uhdrs总功能能力从基线的变化。下表和图21i示出了普利多匹定治疗的晚期患者在52周的uhdrs is没有显著的改善。
[0387] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线4.54.14.54.94.7与安慰剂的差 0.07-0.5-0.640.1p值 0.91080.39330.28280.8605
[0388]
图21j:第52周、bl tfc≥7的uhdrs总功能能力从基线的变化。下表和图21j示出了每天两次45mg和每天两次90mg普利多匹定治疗的 hd1患者和hd2患者中在52周通过uhdrs tfc测量的功能下降的减慢。
[0389] 安慰剂每天两次45mg每天两次67.5mg每天两次90m每天两次112.5mgn6259545658基线8.99.29.49.19.3wk52与安慰剂的差 1.160.360.710.27p值 0.00030.27040.02390.4144
[0390]
图21k:第52周、bl tfc<7的uhdrs tfc财务adl从基线的变化。下表和图21k示出了普利多匹定治疗的晚期患者在52周的uhdrstfc财务adl没有显著的改善。
[0391] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线221.92.22.3与安慰剂的差 0.01-0.25-0.29-022
p值 0.98630.4970.43680.5626
[0392]
图21l:第52周、bl tfc≥7的uhdrs tfc财务adl从基线的变化。下表和图21l示出了每天两次45mg和每天两次90mg普利多匹定治疗的hd1患者和hd2患者在52周的uhdrs tfc财务adl的统计学上显著的改善。
[0393] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线4.64.74.9484.7与安慰剂的差 0.720.270.530.36p值 0.00040.19260.00880.0841
[0394]
图21m:第52周、bl tfc<7的uhdrs tfc财务中从基线的变化。下表和图21m示出了普利多匹定治疗的晚期患者在52周的uhdrs tfc财务没有显著的改善。
[0395] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线0.50.50.50.70.7与安慰剂的差 0.290.070.020.04p值 0.24680.76310.93180.8543
[0396]
图21n:第52周、bl tfc≥7的uhdrs tfc财务从基线的变化。下表和图21n示出了每天两次45mg和每天两次90mg普利多匹定治疗的hd1 患者和hd2患者在52周的uhdrs is的统计学上显著的改善。
[0397] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线22.22.22.12.2与安慰剂的差 0.350.070.310.12p值 0.01710.63730.03320.4466
[0398]
图21o:第52周、bl tfc<7的uhdrs tfc adl中从基线的变化。下表和图21o示出了普利多匹定治疗的晚期患者在52周的uhdrs tfcadl没有显著的改善。
[0399] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线1.51.51.41.51.7与安慰剂的差
ꢀ‑
0.33-0.4-0.39-0.32p值 0.1780.06710.0730.1393
[0400]
图21p:第52周、bl tfc≥7的uhdrs tfc adl从基线的变化。下表和图21p示出了每天两次45mg普利多匹定治疗的hd1患者和hd2 患者在52周的uhdrs tfc adl的统计学上显著的改善。
[0401] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线2.62.62.62.62.6wk52与安慰剂的差 0.350.220.210.23p值 0.00190.05980.05450.0493
[0402]
图22a:第52周、bl tfc<7的pba易怒,严重程度x频率从基线的变化。下表和图22a
示出了普利多匹定治疗的晚期患者在52周的pba 易怒的统计学上显著的改善。
[0403] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次1125mgn1916252523基线1.30.90.91.31.6与安慰剂的差
ꢀ‑
2.42-1.78-1.79-1.71p值 0.01650.04290.04220.0542
[0404]
图22b:第52周、bl tfc≥7的pba易怒,严重程度x频率从基线的变化。下表和图22b示出了每天两次90mg普利多匹定治疗的hd1患者和hd2患者在52周的pba易怒的统计学上显著的改善。
[0405] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线2.11.82.11.41.4wk52与安慰剂的差
ꢀ‑
0.59-0.33-0.95-0.6p值 0.17890.4660.03110.1927
[0406]
图23a:第26周、bl tfc<7的计时起立行走测试(秒)从基线的变化。下表和图23a示出了普利多匹定治疗的晚期患者在26周的计时起立行走测试没有显著的改善。
[0407] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线18.913.811.911.516.2与安慰剂的差 0.56.241.23-0.99p值 0.91810.17150.78460.8295
[0408]
图23b:第26周、bl tfc≥7的计时起立行走测试(秒)从基线的变化。下表和图23b示出了每天两次112.5mg普利多匹定治疗的hd1患者和hd2 患者在26周的pba易怒的统计学上显著的改善。
[0409] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线1011.79.79.89.8与安慰剂的差
ꢀ‑
2.09-2.41-2.37-2.84p值 0.13970.09330.08960.0478
[0410]
图24a:第26周、bl tfc<7的hd-qol参与者总评分从基线的变化。下表和图24a示出了普利多匹定治疗的晚期患者在26周的hd-qol ts 没有显著的改善。
[0411] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线94.7113.186.38379.5与安慰剂的差 4.8712.61-4.33p值 0.69580.93040.8170.7016
[0412]
图24b:第26周、bl tfc≥7的hd-qol参与者总评分从基线的变化。下表和图24b示出了每天两次67.5mg普利多匹定治疗的hd1患者和hd2 患者在26周的pba易怒的统计学上显著的改善。
[0413] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mg
n6259545658基线61.255.173.568.867.3与安慰剂的差 0.5110.635.17-0.99p值 0.91440.02840.28340.8365
[0414]
图25a-图25e示出了26周和52周患者组中uhdrs tms手指敲击评分的变化的柱状图。
[0415]
图25a:第26周所有的uhdrs tms手指敲击从基线的变化。下表提供了与图25a相对应的p值。下表和图25a示出了所有普利多匹定治疗的患者在26周的uhdrs tms手指敲击没有显著的改善。
[0416] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.83.54.13.73.9与安慰剂的差
ꢀ‑
0.3-0.07-0.07-0.12p值 0.14660.73060.71140.5475
[0417]
图25b:uhdrs tms手指敲击从基线的变化:具有基线总功能能力(bltfc)≥9且cag重复>44的26周患者。下表提供了与图25b相对应的p 值。下表和图25b示出了每天两次45mg和每天两次112.5mg普利多匹定治疗的具有大于或等于9的bl tfc且其htt基因中具有大于44个cag重复的患者在26周uhdrs tms手指敲击的统计学上显著的改善。
[0418] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1315192211基线2.62.73.333.6与安慰剂的差
ꢀ‑
0.86-0.34-0.52-1.07p值 0.04990.42550.19720.0424
[0419]
图25c:uhdrs tms手指敲击从基线的变化:具有bl tfc≥9,cag 重复<44的26周患者以及代表最不严重的tms的四分之三(bl tms的前3个四分位(1st 3qs))的患者。下表提供了与图25c相对应的p值。下表和图25c示出了每天两次45mg和每天两次112.5mg普利多匹定治疗的具有大于或等于9的bl tfc且其htt基因中具有小于44个cag重复的患者在26周uhdrs tms手指敲击的统计学上显著的改善。
[0420] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1 31519211 0基线2.62.73.333.5与安慰剂的差
ꢀ‑
0.87-0.36-0.54-1.05p值 0.050.410.18880.0537
[0421]
图25d:uhdrs tms手指敲击从基线的变化:已经完成52周治疗的患者:在第26周的uhdrs tms手指敲击评分。下表提供了与图25d相对应的p值。下表和图25d示出了完成52周的每天两次45mg普利多匹定治疗的患者在26周的uhdrs tms手指敲击的统计学上显著的改善。
[0422] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5243445344基线3.83.243.53.8
与安慰剂的差
ꢀ‑
0.59-0.13-0.01-0.21p值 0.01820.58810.95540.3833
[0423]
图25e:uhdrs tms手指敲击从基线的变化:已经完成52周治疗的患者:在第52周uhdrs tms手指敲击评分。下表提供了与图25e相对应的p值。下表和图25e示出了所有普利多匹定治疗的患者在52周的uhdrstms手指敲击没有显著的改善。
[0424] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5243445344基线3.83.243.53.8与安慰剂的差
ꢀ‑
0.310.130.080.1p值 0.20910.60270.71790.6835
[0425]
图26a:uhdrs tms手指敲击+手掌向下-手掌向上从基线的变化:已经完成52周的治疗的患者-在第26周的评分。下表提供了与图26a相对应的p值。下表和图26a示出了完成52周的每天两次45mg普利多匹定治疗的患者在26周的uhdrs tms手指敲击和手掌向下-手掌向上的统计学上显著的改善。
[0426] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5243445344基线7.16.176.57与安慰剂的差
ꢀ‑
0.790.020.02-023p值 0.02940.94430.94120.5268
[0427]
图26b:uhdrs tms手指轻拍+手掌向下-手掌向上从基线的变化:已经完成52周治疗的患者-在第52周的评分。下表提供了与图26b相对应的p值。下表和图26b示出了普利多匹定治疗的患者在26周的uhdrstms手指敲击和手掌向下-手掌向上没有显著的改善。
[0428] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5243445344基线7.16.176.57与安慰剂的差
ꢀ‑
0.370.680.480.28p值 0.38010.10660.23370.4978
[0429]
图27a:uhdrs tms步态和平衡从基线的变化:具有bl tfc≥7的患者在第26周的步态和平衡评分。下表提供了与图27a相对应的p值。下表和图27a示出了每天两次90mg普利多匹定治疗的hd1患者和hd2患者在26周的uhdrs tms步态和平衡的统计学上显著的改善。
[0430] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线3.23.73.43.53.1与安慰剂的差
ꢀ‑
0.48-0.37-0.62-0.49p值 0.05630.144200130.0518
[0431]
图27b:uhdrs tms步态和平衡从基线的变化:具有bl tfc≥7的患者在第52周的步态和平衡评分。下表提供了与图27b相对应的p值。下表和图27b示出了普利多匹定治疗的hd1患者和hd2患者在52周的uhdrs tms步态和平衡没有显著的改善。
[0432] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658
基线3.23.73.43.53.1与安慰剂的差
ꢀ‑
0.41-0.43-0.28-0.09p值 0.18110.16910.3650.7719
[0433]
图28a-图28d提供了示出26周和52周的患者组中的uhdrs tms肌张力障碍评分从基线变化的柱状图。
[0434]
图28a:所有的uhdrs tms肌张力障碍从基线的变化:所有患者在第26周的uhdrs tms肌张力障碍评分。下表提供了与图28a相对应的p 值。没有观察到显著的改善。
[0435] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线4.13.64.14.94.5与安慰剂的差
ꢀ‑
0.06-0.34-0.33-0.29p值 0.87110.37780.38450.4507
[0436]
图28b:uhdrs tms肌张力障碍中从基线的变化:具有bl tfc≥9 和cag重复<44的患者在第26周的uhdrs tms肌张力障碍评分。下表提供了与图28b相对应的p值。处于持续26周的每天两次45mg、每天两次67.5mg和每天两次90mg普利多匹定的具有大于或等于9的基线tfc 的患者示出uhdrs tms肌张力障碍评分的统计学上显著的改善。
[0437] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1315192211基线3.81.72.83.41.9与安慰剂的差
ꢀ‑
1.54-1.58-1.72-1.4p值 0.03130.01910.00780.0847
[0438]
图28c:uhdrs tms肌张力障碍从基线的变化:具有cag重复<44 和bl tms的前3个四分位的患者在第26周的uhdrs tms肌张力障碍评分。下表提供了与图28c相对应的p值。处于持续26周的每天两次45mg、每天两次67.5mg和每天两次90mg普利多匹定的具有代表最不严重的 tms四分之三的基线tms且在其htt基因中具有小于44个cag重复的患者在示出uhdrs tms肌张力障碍评分的统计学上显著的改善。
[0439] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn2929323722基线32.62.62.92.6与安慰剂的差
ꢀ‑
1.04-1.15-1-0.62p值 0.04370.02350.03990.2655
[0440]
图28d:uhdrs tms肌张力障碍从基线的变化:具有bl tfc≥9和 cag重复<44和bl tms的前3个四分位的患者在第26周的uhdrstms肌张力障碍评分。下表提供了与图28d相对应的p值。具有大于或等于9的基线tfc、代表最不严重的tms四分之三的基线tms且在其htt 基因中具有小于44个cag重复的处于持续26周的每天两次45mg、每天两次67.5mg和每天两次90mg普利多匹定的患者示出在uhdrs tms肌张力障碍评分的统计学上显著的改善。
[0441] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1 315192110基线3.81.72.83.12.1与安慰剂的差
ꢀ‑
1.53-1.6-1.64-1.29
p值 0.03490.020.01320.1276
[0442]
图29a、图29b和图29c是示出在第12周(29a);第20周(29b);和第 26周(29c)的步态和平衡评分从基线的变化的柱状图。y轴是uhdrs步态和平衡评分的变化。
[0443]
图30是示出了用普利多匹定和安慰剂治疗的uhdrs tfc评分在26 周内从基线的变化的图。每天两次112.5mg普利多匹定的数据由该图中的上方线条示出,而安慰剂的数据由该图中的下方线条示出。每天两次112.5 mg普利多匹定与安慰剂的p值差异在第4周为0.1498,在第12周为0.6065,在第20周为0.3238并且在第26周为0.0676。uhdrs tfc变化的增加指示功能下降的延迟/减少。
[0444]
图31a-图31h提供了示出在26周和52周的患者组中uhdrs tfc评分从基线变化的柱状图或线状图。
[0445]
图31a和图31b示出了uhdrs tfc评分随时间从基线的变化。y轴代表tfc评分的变化,x轴代表普利多匹定治疗时间,以周计。图31a示出了在52周后全分析集中的趋势。图31b示出了具有bl tfc≥7的患者 (n=54-62)中的趋势。
[0446]
图31c:具有bl cag重复<44的患者在第26周的uhdrs总功能能力中从基线的变化。下表提供了与图31c相对应的p值。
[0447] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn3737384229基线7.47.98.58.37.9与安慰剂的差 0.60.430.790.38p值 0.0560.17070.01020.2643
[0448]
图31d:具有bl tfc≥9或cag重复<44的患者在第26周的uhdrs 总功能能力从基线的变化。下表提供了与图31d相对应的p值。
[0449] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5656535249基线8.58.88.98.79.1与安慰剂的差 0.560.180.670.38p值 0.03210.50690.01170.1665
[0450]
图31e:具有bl cag重复<44和bl tms的前3个四分位的患者在第26周的uhdrs总功能能力从基线的变化。下表提供了与图31e相对应的p值。
[0451] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn2929323722基线88.798.68.6与安慰剂的差 0.730.470.710.48p值 0.04690.19520.04050.2324
[0452]
图31f:具有bl cag重复<44或bl tms的前3个四分位(在基线 tms的前3个四分位)的患者在第26周的uhdrs总功能能力从基线的变化。下表提供了与图31f相对应的p值。
[0453] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6965666668基线8.18.48.38.38.5与安慰剂的差 0.360.180.520.51
p值 0.1493047270.03490.0379
[0454]
图31g:具有第26周中值bl tfc或cag重复<44或bl tms的前 3个四分位的患者在第26周的uhdrs总功能能力从基线的变化。下表提供了与图31g相对应的p值。
[0455] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn7167666669基线8.28.58.38.38.5与安慰剂的差 0.360.210.550.53p值 0.14230.38630.02440.0289
[0456]
图31h:具有bl tfc≥9或bl tms的前3个四分位的患者在第26周的uhdrs总功能能力从基线的变化。下表提供了与图31h相对应的p值。
[0457] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次l12.5mgn3032343129基线10.310.510.410.310.9与安慰剂的差 0.690.010.540.6p值 0.06010.97410.13710.1136
[0458]
图32:示出用普利多匹定和安慰剂治疗的财务和adl tfc评分在26 周内从基线变化的图。每天两次112.5mg普利多匹定的数据由该图中的上方线条示出,而安慰剂的数据由该图中的下方线条示出。每天两次112.5mg 普利多匹定与安慰剂的p值差异在第4周为0.4382,在第12周为0.6636,在第20周为0.4437,并且在第26周为0.0125。tfc财务和adl的变化的增加指示功能下降减缓。
[0459]
图33a、图33b和图33c:普利多匹定治疗的hd患者的tfc评分中从基线的变化。在第12周(图33a)、第20周(图33b)和第26周(图33c)的剂量。对于全分析集,评分被调整为tfc变化的平均值
±
se。
[0460]
图34a、图34b和图34c:普利多匹定治疗的hd患者的tfc adl& 财务评分从基线的变化。在第12周(图34a)、第20周(图34b)和第26周(图 34c)的剂量。对于全分析集,评分被调整为tfc财务和adl变化的平均值
±
se。
[0461]
图35a-图35s是根据四分位示出26周和52周的患者组中uhdrs tfc 财务以及uhdrs tfc财务和adl评分从基线的变化的柱状图。
[0462]
图35a:具有tms的第1个四分位(第一个最不严重的tms的四分之一)的患者在第26周的uhdrs tfc财务评分从基线的变化。下表提供了与图35a相对应的p值。持续26周每天两次45mg普利多匹定施用的最不严重的tms前四分之一的患者的tfc财务改善显著。
[0463] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn2124202515基线2.22.12.32.22.6与安慰剂的差 0.380.270.260.63p值 0.03470.15560.13360.0038
[0464]
图35b:具有tms的第1个四分位的患者在第52周的uhdrs tfc财务评分从基线的变化。下表提供了与图35b相对应的p值。在持续52周每天两次45mg普利多匹定施用的最不严重的tms前四分之一的患者中观察到tfc财务改善的趋势。
[0465] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次1125mgn2124202515基线2.22.12.32.22.6与安慰剂的差 0.430.250.210.32p值 0.06730.30840.36530.2369
[0466]
图35c:具有tms的前2个四分位(最不严重的tms的前四分之二) 的患者在第26周的uhdrs tfc财务评分从基线的变化。下表提供了与图 35c相对应的p值。在持续26周每天两次45mg普利多匹定施用的最不严重的tms的前四分之二的患者中观察到tfc财务改善的趋势。
[0467] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn4244394043基线22.12.22.12.1与安慰剂的差 0.330.040.14-0.06p值 0.05660.84060.42750..7529
[0468]
图35d:具有tms的前2个四分位的患者在第52周的uhdrs tfc财务评分从基线的变化。下表提供了与图35d相对应的p值。在持续52周每天两次45mg普利多匹定施用的最不严重的tms的前两个四分位的患者中观察到tfc财务显著的改善。
[0469] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn4244394043基线22.12.22.12.1与安慰剂的差 0.290..150.230.2p值 0.02990.294l0.09940.1432
[0470]
图35e:具有tms的前3个四分位的患者在第26周的uhdrs tfc财务评分从基线的变化。下表提供了与图35e相对应的p值。在持续26周每天两次45mg普利多匹定施用的前三个最不严重的tms的四分之一的患者中的tfc财务改善的趋势。
[0471] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5859625862基线1.821.91.92与安慰剂的差 0.120.030.220.26p值 0.3150.81150.06650.0323
[0472]
图35f:具有tms的前3个四分位的患者在第52周的uhdrs tfc财务评分从基线的变化。下表提供了与图35f相对应的p值。在持续52周每天两次45mg普利多匹定施用的前三个最不严重的tms的四分之一的患者中观察到tfc财务显著的改善。
[0473] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5859625862基线1.821.91.92与安慰剂的差 0.390.010.170.05p值 0.00720.970.22950.7396
[0474]
图35g:具有bl tfc≥9的患者在第26周的uhdrs tfc财务和adl 评分从基线的变化。下表提供了与图35g相对应的p值。在每天施用两次 45mg和每天两次90mg普利多匹定持
续26周的具有大于或等于9的基线tfc的患者中观察到tfc财务和adl显著的改善。
[0475] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn3234343231基线5.25.15.45.45.4与安慰剂的差 0.530.230.510.57p值 0.01430.28740.01970.0109
[0476]
图35h:具有bl cag重复>44的患者在第26周的uhdrs tfc财务和adl评分从基线的变化。下表提供了与图35h相对应的p值。在持续 26周每天两次45mg和每天两次90mg普利多匹定施用的在其htt基因中具有大于44个cag重复的患者中观察到tfc财务和adl显著的改善。
[0477] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn3737384229基线3.74.14.2424.1与安慰剂的差 0.550.210.670.47p值 0.0170.34970.00260.0597
[0478]
图35i:具有bl tfc≥9和cag重复>44的患者在第26周的uhdrstfc财务和adl评分从基线的变化。下表提供了与图35i相对应的p值。在持续26周每天两次45mg和每天两次90mg普利多匹定施用的具有大于或等于9的基线tfc和在其htt基因中具有大于44个cag重复的患者中观察到tfc财务和adl中显著的改善。
[0479] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1315192211基线5.15.25.55.45.5与安慰剂的差 0.740.570.831.02p值 0.02960.0830.00890.0094
[0480]
图35j:具有bl tfc≥9或cag重复>44的患者在第26周的uhdrstfc财务和adl评分从基线的变化。下表提供了与图35j相对应的p值。在持续26周每天两次45mg和每天两次90mg普利多匹定施用的具有大于或等于9的基线tfc或在其htt基因中具有大于44个cag重复的患者中观察到tfc财务和adl中显著的改善。
[0481] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5656535249基线4.24.54.54.54.7与安慰剂的差 0.50.080.520.4p值 0.00550.63810.00390.0317
[0482]
图35k:具有cag重复<44和bl tms的前3个四分位的患者在第 26周的uhdrs tfc财务和adl评分从基线的变化。下表提供了与图35k 相对应的p值。在持续26周每天两次45mg和每天两次90mg普利多匹定施用的具有基线tms的前四分之三且在其htt基因中具有小于44个cag 重复的患者中观察到tfc财务和adl显著的改善。
[0483] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn2929323722基线4.14.6454.446
与安慰剂的差 0.590.180.60.57p值 0.02360.47820.01450.0478
[0484]
图35l:具有bl tfc≥9和cag重复<44和bl tms的前3个四分位的患者在第26周的uhdrs tfc财务和adl评分从基线的变化。下表提供了与图35l 相对应的p值。在持续26周每天两次45mg和每天两次90mg 普利多匹定施用的具有大于或等于9的基线tfc且在其htt基因中具有小于 44个cag重复的患者中观察到tfc财务和adl显著的改善。
[0485] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1 315192110基线5.15.25.55.35.5与安慰剂的差 0.740.570.811.08p值 0.03150.08480.01180.009
[0486]
图35m:具有bl tfc≥9和bl tms的前3个四分位患者在第26周的uhdrs tfc财务和adl评分从基线的变化。下表提供了与图35m相对应的p值。在持续26周每天两次45mg和每天两次90mg普利多匹定施用的具有大于或等于9的基线tfc或在其htt基因中具有小于44个cag重复或基线tms的前四分之三的患者中观察到tfc财务和adl显著的改善。
[0487] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn3032343129基线5.15.15.45.45.5与安慰剂的差 0.530.180.450.54p值 0.0180.40390.04550.0193
[0488]
图35n:具有tms的第1个四分位的患者在第26周的uhdrs tfc 财务和adl评分从基线的变化。下表提供了与图35n相对应的p值。在持续26周每天两次45mg和每天两次90mg普利多匹定施用的具有tms前四分之三的患者中观察到tfc财务和adl显著的改善。
[0489] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn2124202515基线4.94.854.85.3与安慰剂的差 0.630.50.631.1p值 0.0380.11360.03420.0024
[0490]
图35o :具有tms的第1个四分位的患者在第52周的uhdrs tfc 财务和adl评分从基线的变化。下表提供了与图350相对应的p值。在持续52周每天两次45mg普利多匹定施用的具有tms前四分之一的患者中观察到tfc财务和adl显著的改善。
[0491] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn2124202515基线4.94.854.85.3与安慰剂的差 0.710.610.570.74p值 0.03190.07440.07620.0534
[0492]
图35p:具有tms的前2个四分位的患者在第26周的uhdrs tfc 财务和adl评分从基线的变化。下表提供了与图35p相对应的p值。在持续26周每天两次45mg普利多匹定施用的具有tms前四分之二的患者中观察到tfc财务和adl中显著的改善。
[0493] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mg
n4244394043基线4.54.74.84.64.7与安慰剂的差 0.480.10.260.19p值 0.0450.68670.30210.4543
[0494]
图35q:具有tms的前2个四分位的患者在第52周的uhdrs tfc财务和adl评分从基线的变化。下表提供了与图35q相对应的p值。在持续 52周每天两次45mg和每天两次90mg普利多匹定施用的具有tms前四分之二的患者中观察到tfc财务和adl显著的改善。
[0495] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn4244394043基线4.54.74.84.64.7与安慰剂的差 0.470.250.470.44p值 0.02940.2550.03260.0433
[0496]
图35r:具有tms的前3个四分位的患者在第26周的uhdrs tfc财务和adl评分从基线的变化。下表提供了与图35r相对应的p值。在持续 26周普利多匹定施用的具有tms前四分之三的患者中没有观察到tfc财务和adl显著的改善。
[0497] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5859625862基线434.54.34.44.5与安慰剂的差 0.180.040.350.41p值 0.33930.82050.05550.0253
[0498]
图35s:具有tms的前3个四分位的患者在第52周的uhdrs tfc财务和adl评分从基线的变化。下表提供了与图35s相对应的p值。在持续 52周每天两次45mg普利多匹定施用的具有tms前四分之三的患者中观察到tfc财务和adl显著的改善。
[0499] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5859625862基线4.34.54.34.44.5与安慰剂的差 0.52-0.030.210.09p值 0.01220.86610.30330.6679
[0500]
图36a和图36b:关于手指敲击(q-motor敲击测量)的一般信息。图36a 示出了受试者手臂与敲击器(tapper)的图。图36b示出了正常和异常敲击测量。
[0501]
图37a和图37b:q-motor敲击测量:充分验证的客观量度。(bechtel2010)。
[0502]
图38:q-motor敲击-速度-频率。每天两次施用的90mg普利多匹定展示了持续的从基线的改善。每天两次90mg的数据由该图中的上方线条示出,而安慰剂的数据由该图中的下方线条示出。每天两次90mg与安慰剂的p值差异在第4周为0.0259,在第12周为0.0365,并且在第26周为0.0056。敲击速度的增加指示改善。y轴的测量单位是频率(hz)。
[0503]
图39a和图39b:q-motor敲击速度启动间间隔(inter onset interval,ioi)。每天两次施用的90mg普利多匹定展示了对于每天两次90mg的持续且显著的从基线的改善。每天两次90mg普利多匹定的数据由该图中的下方线条示出,而安慰剂的数据由该图中的上方线条示出。每天两次90mg普利多匹定与安慰剂的p值差异在第4周为0.0342,在第12周为0.0368,并且在第26周为0.0162。敲击间间隔的减少指示改善。图39a中y轴的测量单位是频
率(hz)。图39b示出了对于全分析集,敲击速度-启动间间隔-mn左手(tap-speed-inter-onset-interval-mn-hand-l)(秒)随时间(周)从基线的变化。
[0504]
图39c:运动控制的客观药效学量度的改善:q-motor:敲击速度-启动间间隔-mn-手(秒)第52周fas中从基线的变化。下表提供了与图39c相对应的数据和p值。在每天两次45mg治疗的患者中注意到改善的趋势。
[0505] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线0.40650.41540.46080.40290.4366与安慰剂的差
ꢀ‑
0.04020.0152-0.0064-0.017p值 0.19560.60630.82580.5689
[0506]
图39d:运动控制的客观药效学量度的改善:普利多匹定治疗的hd1 患者和hd2患者在第52周的q-motor:敲击速度-启动间间隔-mn-手(秒) 从基线的变化。下表提供了与图39d相对应的数据和p值。在所有治疗臂中注意到改善的趋势。
[0507] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线0.37250.36050.39830.37890.4056与安慰剂的差
ꢀ‑
0.0351-0.0464-0.0291-0.022p值 0.13470.04490.20390.3509
[0508]
图39e:运动控制的客观药效学量度的改善,q-motor:pro-sup-频率-mn-手(hz)第52周fas从基线的变化。下表提供了与图39e相对应的数据和p值。在每天两次45mg治疗的患者中注意到改善的趋势。
[0509] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线1.66861.77891.72551.75051.7251wk52与安慰剂的差 0.0599-0.0124-0.00870.0127p值 0.31220.82780.87630.8261
[0510]
图39f:运动控制的客观药效学量度的改善,普利多匹定治疗的hd1 患者和hd2患者中在第52周的q-motor:pro-sup-频率-mn-手(hz)中从基线的变化。下表提供了与图39f相对应的数据和p值。在每天两次45mg 治疗的患者中注意到改善的趋势。
[0511] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线1.771.85131.89281.86581.841wk52与安慰剂的差 0.11950.05480.05750.08p值 0.06920.39960.37090.229
[0512]
图40a:在第26周患者的认知评价量表霍普金斯言语学习测试,修订版(cab hvlt-r)评分中从基线的变化。下表提供了与图40a相对应的p值。在持续26周施用普利多匹定的患者中没有观察到cab hvlt-r评分的显著改善。
[0513] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线19.319.520.319.419.1
与安慰剂的差
ꢀ‑
0.530.15-0.73-0.47p值 0.58370.87580.43840.6217
[0514]
图40b:在第52周患者的认知评价量表霍普金斯言语学习测试,修订版(cab hvlt-r)评分从基线的变化。下表提供了与图40b相对应的p值。在持续52周每天两次45mg普利多匹定施用的患者中观察到cab hvlt-r 评分中改善的趋势。
[0515] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线19.319.520.319.419.1与安慰剂的差
ꢀ‑
2.21-2.74-1.07-2.19p值 0.05170.01480.32650.0562
[0516]
图41a:在第26周患者的认知评价量表cab连线测试评分从基线的变化。下表提供了与图41a相对应的p值。在持续26周施用普利多匹定的患者中没有观察到cab连线测试评分的显著改善。
[0517] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线-184.7-181.6-182.2-185-178.9与安慰剂的差
ꢀ‑
0.95-3.03-6.642.97p值 0.87730.62110.27130.6283
[0518]
图41b:在第52周患者的认知评价量表cab连线测试评分从基线的变化。下表提供了与图41b相对应的p值。在持续52周施用普利多匹定的患者中观察到cab连线测试评分改善的趋势。
[0519] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线-184.7-181.6-182.2-185-178.9与安慰剂的差
ꢀ‑
13.56-7.54-12.482.01p值 0.07730.32660.09130.7951
[0520]
图41c:在26周在认知评价量表cab 3hz节奏敲击(paced tapping)从基线的变化。下表提供了与图41c相对应的数据和p值。
[0521] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线5.9356.0355.0274.9435.572与安慰剂的差 0.4736-0.041019750.9515p值 0.40810.94410.72760.0937
[0522]
图41d:在52周在认知评价量表cab 3hz节奏敲击从基线的变化。下表提供了与图41d相对应的数据和p值。
[0523] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线5.9356.0355.0274.9435.572与安慰剂的差 1.32340.37010.26590.1523p值 0.04020.56810.66810.8152
[0524]
图42:tfc年下降率(y轴)在早期阶段的疾病中较高(marder 2000)。
[0525]
图43a:以下的安慰剂臂中的tfc从基线的平均变化:(1)亨廷顿氏病的症状治疗中的普利多匹定(acr1 6)的开放标签扩展研究 (open-hart)(n=50),(2)hd中的辅酶q10和瑞马西胺:评估 (care-hd)(n=80)(kieburtz 2001)和(3)亨廷顿氏病(hd)中的辅酶q10 (2care)(n=213):tfc评分从基线的变化(非匹配群组)。在12个月的点上的圆圈反映了,在用普利多匹定治疗的open-hart受试者中观察到的功能下降速率的~1点差异。
[0526]
图43b:在pride-hd试验中,对普利多匹定治疗的hd1受试者和 hd2受试者(n=54-62)随52周内的时间绘制的tfc评分从基线的变化。带有菱形的黑线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。y轴代表tfc评分从基线的变化, x轴代表治疗时间,以周计。
[0527]
图44a-图44c是示出多个行走相关终点的图,证明在早期hd(阶段1
‑ꢀ
阶段2患者)中支持普利多匹定的趋势。tms的数据示出了强的安慰剂效应。在52周观察到tms改善的趋势。
[0528]
图44a:在52周的uhdrs tms步态:早期hd。下表提供了与图44a 相对应的数据和p值。
[0529] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线0.91.111.11wk52与安慰剂的差
ꢀ‑
0.21-0.17-0.17-0.06p值 0.08550.1680.15210.628
[0530]
图44b:在52周的计时起立行走测试(秒):普利多匹定治疗的hd1患者和hd2患者。下表提供了与图44b相对应的数据和p值。
[0531] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线1011.79.79.89.8wk52与安慰剂的差
ꢀ‑
1.61-1.64-1.46-0.96p值 0.13480.13690.1710.3827
[0532]
图44c:普利多匹定治疗的hd1患者在52周的改善的walk-12。下表提供了与图44c相对应的数据和p值。
[0533] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线21.26.312.317.713与安慰剂的差
ꢀ‑
5.86-8.57-13.6-4.13p值 0.30180.10320.01930.4534
[0534]
图44d和图44e:普利多匹定治疗的hd1患者分别在第26周和第52 周的不自主运动:总的最大舞蹈病(total maximal chorea,tmc)。
[0535]
下表提供了与图44d相对应的数据和p值。
[0536] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn121717111 8
基线1217171118与安慰剂的差
ꢀ‑
1.4-2.07-2.52-1.08p值 0.18050.04380.02710.2932
[0537]
下表提供了与图44e相对应的数据和p值。
[0538] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn121717111 8基线12171 71 118wk52与安慰剂的差
ꢀ‑
0.93-0.13-2.430.88p值 0.53150.9310.13130.5622
[0539]
图45a-图45b:图45a:随时间绘制的pride-hd中tms随时间从基线的变化。数据重现了先前的tms从基线变化的数据,因为从基线的变化值与hart和mermaihd相似。tms中从基线变化的减少指示改善。y轴代表tms中从基线的变化,x轴代表治疗时间,以周计。图45b:随时间绘制的hd1患者的tms从基线的变化。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5 mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。每天两次45mg在52周后示出了tms评分的改善。y轴代表tms从基线的变化,x轴代表治疗时间,以周计。
[0540]
图46a-图46v和图47a-图47y示出了行走相关的改良的身体性能测试 (mppt)数据。每个图下面提供的表提供了与该图相对应的数据和p值。
[0541]
图46a:从治疗的第4周到第52周,全分析集的mppt总评分从基线的变化。mppt使用标准化的9项测试来定量患者在身体和功能任务中的表现。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90 mg,带有正方形的线代表每天两次112.5mg。每天两次施用45mg在52 周后示出了mppt评分的改善。y轴代表从基线的变化,以mppt从基线的变化计,x轴代表治疗时间,以周计。
[0542]
图46b:第26周全分析集的mppt总评分-从基线的变化。下表提供了与图46b相对应的数据和p值。
[0543] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线25.524.926.125.725.7与安慰剂的差 0.04-0.07-0.010.29p值 0.94620.89680.98530.6063
[0544]
图46c:第52周全分析集的mppt总评分-从基线的变化。下表提供了与图46c相对应的数据和p值。
[0545] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线25.524.926.125.725.7与安慰剂的差 0.460.17-0.33-0.47p值 0.55410.82840.6610.5482
[0546]
图46d:具有基线tfc<7的普利多匹定治疗的患者第26周的mppt 总评分-从基线的变化。下表提供了与图46d相对应的数据和p值。
[0547] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次1125mgn1916252523基线21.521.423.323.121.3与安慰剂的差 0.9-0.85-0.73-0.33p值 0.52660.52470.57860.802
[0548]
图46e:普利多匹定治疗的hd1患者和hd2患者第26周的mppt总评分-从基线的变化。下表提供了与图46e相对应的数据和p值。
[0549] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线26.625.927.426.927.5与安慰剂的差
ꢀ‑
0.240.590.460.79p值 0.69030.32960.44290.1889
[0550]
图46f:具有基线tfc<7的普利多匹定治疗的患者第52周的mppt 总评分-从基线的变化。下表提供了与图46f相对应的数据和p值。
[0551] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线21.521.423.323.121.3与安慰剂的差 1.57-1.37-2.73-0.49p值 0.42670.45150.12880.7822
[0552]
图46g:普利多匹定治疗的hd1患者和hd2患者第52周的mppt总评分-从基线的变化。下表提供了与图46g相对应的数据和p值。
[0553] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线26.625.927.426.927.5与安慰剂的差 0.151.040.88-0.26p值 0.85640.20870.27280.7532
[0554]
图46h:普利多匹定治疗的hd1患者在26周的mppt总评分从基线的变化。下表提供了与图46h相对应的数据和p值。
[0555] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线28.130.128.727.830.2与安慰剂的差
ꢀ‑
1.31-0.20.810.03p值 0.25370.85740.50480.9789
[0556]
图46i:普利多匹定治疗的hd2患者在26周的mppt总评分从基线的变化。下表提供了与图46i相对应的数据和p值。
[0557] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线26.324.126.826.726.3与安慰剂的差
ꢀ‑
0.070.680.350.85p值 0.92310.36030.61910.242
[0558]
图46j:普利多匹定治疗的hd患者bl阶段3-阶段5(tfc0-6)在26周的mppt总评分从基线的变化。下表提供了与图46j相对应的数据和p值。
[0559] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线21.521.423.323.121.3与安慰剂的差 0.9-0.85-0.73-0.33p值 0.52660.52470.57860.802
[0560]
图46k:普利多匹定治疗的hd1患者在52周的mppt总评分从基线的变化。下表提供了与图46k相对应的数据和p值。
[0561] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn12171 71 11 8基线28.130.128.727.830.2与安慰剂的差 0.760.451.110.08p值 0.52920.70130.3880.9456
[0562]
图46l:普利多匹定治疗的hd2患者在52周的mppt总评分从基线的变化。下表提供了与图46l 相对应的数据和p值。
[0563] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线26.324.126.826.726.3与安慰剂的差
ꢀ‑
0.3910.71-0.65p值 0.70280.35390.46720.5427
[0564]
图46m:普利多匹定治疗的hd患者bl阶段3-阶段5在52周的mppt 总评分从基线的变化。下表提供了与图46m相对应的数据和p值。
[0565] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线21.521.423.323.121.3与安慰剂的差 1.57-1.37-2.73-0.49p值 0.42670.45150.12880.7822
[0566]
图46n:示出从治疗的第4周到第52周的全分析集的mppt站立静态平衡评分从基线的变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0567]
图46o:在26周全分析集的mppt站立静态平衡评分。下表提供了与图46o相对应的数据和p值。
[0568] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.12.92.93.13与安慰剂的差 0.07-0.2-0.10.05p值 0.67680.21540.51230.7294
[0569]
图46p:在52周全分析集的mppt站立静态平衡评分。下表提供了与图46p相对应的
数据和p值。
[0570] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.12.92.93.13与安慰剂的差
ꢀ‑
0.15-0.19-0.14-0.12p值 0.40190.30180.4350.5024
[0571]
图46q:示出从治疗的第4周到第52周的全分析集的mppt座椅起立评分(chair rise score)从基线变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5 mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0572]
图46r:在26周全分析集的mppt座椅起立评分。下表提供了与图46r 相对应的数据和p值。
[0573] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.52.62.82.82.6与安慰剂的差 0.050.010.010.12p值 0.72380.94360.92220.3883
[0574]
图46s:在52周全分析集的mppt座椅起立评分。下表提供了与图46s 相对应的数据和p值。
[0575] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.52.6282.82.6与安慰剂的差
ꢀ‑
0.05-0.1-0.31-0.12p值 0.75010.52670.04140.4515
[0576]
图46t:示出从治疗的第4周到第52周全分析集的mppt举起一本书并将其放在架上评分(lift a book and put it on the shelf score)从基线变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90 mg,带有正方形的线代表每天两次112.5mg。
[0577]
图46u:在26周全分析集的mppt举起一本书并将其放在架上评分从基线的变化。
[0578] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.62.42.62.62.7与安慰剂的差 0.140.10.040.14p值 0.22770.36490.69820.2057
[0579]
图46v:在52周全分析集的mppt举起一本书并将其放在架上评分,从基线的变化。
[0580] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.62.42.62.62.7与安慰剂的差 0.250.170.220.12p值 0.07550.2240.11160.3956
[0581]
图47a:示出从治疗的第4周到第52周全分析集的mppt穿上和脱下外套(put on and remove a jacket)从基线的变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0582]
图47b:在26周全分析集的mppt穿上和脱下外套评分从基线的变化。
[0583] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.22.12.32.32.2与安慰剂的差
ꢀ‑
0.220.17-0.01-0.03p值 0.13190.23550.93310.8307
[0584]
图47c:在52周全分析集的mppt穿上和脱下外套评分从基线的变化。
[0585] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.22.12.32.32.2与安慰剂的差 0.20.210.08-0.18p值 0.23060.19430.6150.2614
[0586]
图47d:示出从治疗的第4周到第52周全分析集的mppt从地面拿起一美分(pick up a penny from the floor)从基线的变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0587]
图47e:在26周全分析集的mppt从地面拿起一美分评分从基线的变化。下表提供了与图47e相对应的数据和p值。
[0588] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.62.72.82.62.7与安慰剂的差
ꢀ‑
0.130.140.10.07p值 0.27020.24040.37640.5559
[0589]
图47f:在52周全分析集的mppt从地面拿起一美分评分从基线的变化。下表提供了与图47f相对应的数据和p值。
[0590] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.62.72.82.62.7与安慰剂的差 0.040.090.140.07p值 0.75230.51480.30070.5939
[0591]
图47g:示出从治疗的第4周到第52周全分析集的mppt 360度转身评分(turn 360degrees scores)从基线的变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0592]
图47h:在26周全分析集的mppt 360度转身评分从基线的变化。下表提供了与图47h相对应的数据和p值。
[0593] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8l7579818l基线3.23.23.133.1与安慰剂的差 0.12-0.060.120 2p值 0.5570.75860.57460.3518
[0594]
图47i:在52周全分析集的mppt 360度转身评分从基线的变化。下表提供了与图47i相对应的数据和p值。
[0595] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.23.23.133.1与安慰剂的差
ꢀ‑
0.12-0.10.04-0.08p值 0.6360.67330.88050.7413
[0596]
图47j:示出从治疗的第4周到第52周全分析集的mppt 50英尺步行评分(50feet walk scores)从基线的变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5 mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0597]
图47k:在26周全分析集的mppt 50英尺步行评分,从基线的变化。
[0598]
下表提供了与图47k相对应的数据和p值。
[0599] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.33.23.33.43.3与安慰剂的差
ꢀ‑
0.020-0.1-0.17p值 0.83670.97380.33310.0945
[0600]
图47l:在52周全分析集的mppt 50英尺步行评分从基线的变化。下表提供了与图47l 相对应的数据和p值。
[0601] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8l75798181基线3.33.23.33.43.3与安慰剂的差
ꢀ‑
0.030.15-0.23-0.15p值 0.83020.30320.10870.3004
[0602]
图47m:示出从治疗的第4周到第52周全分析集的mppt爬一段楼梯评分(climb one flight of stairs scores)从基线的变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0603]
图47n:在26周全分析集的mppt爬一段楼梯评分中从基线的变化。下表提供了与图47n相对应的数据和p值。
[0604] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.62.62.7262.8与安慰剂的差 0.080.110.150.16
p值 0.51390.36710.20610.1912
[0605]
图47o:在52周全分析集的mppt爬一段楼梯评分从基线的变化。下表提供了与图47o相对应的数据和p值。
[0606] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线2.62.62.72.62.8与安慰剂的差 0.260.130.080.11p值 0.08960.41160.60430.4606
[0607]
图47p:具有bl tfc<7的普利多匹定治疗的晚期hd患者在52周的mppt爬一段楼梯评分从基线的变化。下表提供了与图47p相对应的数据和p值。
[0608] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线2.52.5242.32.5与安慰剂的差 0.19-0.3-0.26-0.15p值 0.59140.36090.41980.6539
[0609]
图47q:普利多匹定治疗的hd1患者和hd2患者在52周的mppt爬一段楼梯评分从基线的变化。下表提供了与图47q相对应的数据和p值。
[0610] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线2.72.62.82.72.9与安慰剂的差 0.270.30.220.23p值 0.10760.07690.19550.1771
[0611]
图47r:普利多匹定治疗的hd1患者在52周的mppt爬一段楼梯评分从基线的变化。下表提供了与图47r相对应的数据和p值。
[0612] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1217171118基线2.73.22.72.93.2与安慰剂的差
ꢀ‑
0.020.01-0.060.18p值 0.95390.96270.860.5277
[0613]
图47s:普利多匹定治疗的hd2患者在52周的mppt爬一段楼梯评分从基线的变化。下表提供了与图47s相对应的数据和p值。
[0614] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn5042374540基线2.72.32.92.72.8与安慰剂的差 0.350.340.280.23p值 0.09580.11890.14820.2731
[0615]
图47t:具有bl tfc 0-6的普利多匹定治疗的晚期hd患者中在52周的mppt爬一段楼梯评分从基线的变化。下表提供了与图47t相对应的数据和p值。
[0616] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次1125mgn1916252523
基线2.52.52.42.32.5与安慰剂的差 0.19-0.3-0.26-0.15p值 0.59140.36090.41980.6539
[0617]
图47u:示出从治疗的第4周到第52周全分析集的mppt爬楼梯(上下攀爬)评分(climb stairs(flights up and down)scores)从基线的变化的图。带有黑色菱形的线代表安慰剂;带有空心圆圈的线代表每天两次45mg,带有三角形的线代表每天两次67.5mg,带有灰色菱形的线代表每天两次90mg,带有正方形的线代表每天两次112.5mg。
[0618]
图47v:在26周全分析集的mppt爬楼梯(上下攀爬)评分,从基线的变化。下表提供了与图47v相对应的数据和p值。
[0619] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.43.53.63.63.7与安慰剂的差
ꢀ‑
0.03-0.14-0.08-0.08p值 0.81340.1950.4640.4872
[0620]
图47w:在52周全分析集的mppt爬楼梯(上下攀爬)评分从基线的变化。下表提供了与图47w相对应的数据和p值。
[0621] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn8175798181基线3.43.53.63.63.7与安慰剂的差 0.170.04-0.040.1p值 0.32090.82510.82820.5759
[0622]
图47x:具有bl tfc<7的晚期hd患者中在52周的mppt爬楼梯(上下攀爬)评分从基线的变化。下表提供了与图47x相对应的数据和p值。
[0623] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn1916252523基线3.23.13.43.53.1与安慰剂的差 0.720.16-0.360.31p值 0.09150.68270.33050.4235
[0624]
图47y:普利多匹定治疗的hd1患者和hd2患者在52周的mppt爬楼梯(上下攀爬)评分从基线的变化。下表提供了与图47y相对应的数据和p 值。
[0625] 安慰剂每天两次45mg每天两次67.5mg每天两次90mg每天两次112.5mgn6259545658基线3.53.63.73.63.9与安慰剂的差
ꢀ‑
0.010.010.10.07p值 0.95720.96140.58160.7161
[0626]
发明详述
[0627]
本发明提供了在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能能力的下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg 剂量的普利多匹定每天被施用至患者,以便从而在人类患者中保持功能能力、改善功能能力或减缓功能能力的下降。在一个实施方案中,
方法包括保持功能能力、改善功能能力或减缓功能能力的下降。
[0628]
本发明提供了在有相应需要的人类患者中保持功能能力、改善功能能力、降低功能能力的下降速率、或减慢功能下降的速率的方法,所述方法包括向患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中保持功能能力、改善功能能力、降低功能能力的下降速率或减慢功能下降的速率。在一个实施方案中,方法包括保持功能能力、改善功能能力或降低功能能力的下降速率。
[0629]
在一个实施方案中,方法包括保持功能能力。在另一个实施方案中,方法包括改善功能能力。在一些实施方案中,功能能力被保持或改善持续至少12周、至少20周、至少26周、至少52周、至少78周、至少3年或至少5年。
[0630]
在另一个实施方案中,功能能力是通过uhdrs-tfc测量的总功能能力(tfc),并且人类患者在uhdrs tfc中具有一(1)个或更多个点的改善。在一些实施方案中,在施用普利多匹定52周后,人类患者在uhdrs tfc 中具有一(1)个或更多个点的改善。在另一个实施方案中,在施用普利多匹定52周后,如通uhdrs tfc测量的功能下降的速率小于一(1)个点。
[0631]
在一个实施方案中,方法包括减缓功能能力的下降。在另一个实施方案中,方法包括减缓功能能力的下降,并且(a)药物组合物被施用持续超过 26周,或者(b)人类患者罹患早期hd。在一个实施方案中,方法包括降低功能能力的下降速率。在另一个实施方案中,方法包括降低功能能力的下降速率,并且(a)药物组合物被施用持续超过26周,或者(b)人类患者罹患早期hd。在一些实施方案中,方法包括减缓功能下降。在一些实施方案中,功能能力的下降减缓了至少20%、至少30%、至少40%、至少50%或至少 80%,或者功能下降的速率减慢了至少20%、至少30%、至少40%、至少 50%或至少80%。在另一个实施方案中,功能能力的下降速率被降低持续至少12周、至少20周、至少26周、至少52周、至少78周、至少3年或至少5年。在另一个实施方案中,功能下降的速率减慢,并且功能能力降低持续至少12周、至少20周、至少26周、至少52周、至少78周、至少 3年或至少5年。
[0632]
在一个实施方案中,功能能力是总功能能力(tfc)。总功能能力可以通过uhdrs-tfc测量。总功能能力还可以通过uhdrs功能评估量表 (uhdrs-fas)来测量。在一个实施方案中,功能能力被保持至少12周、至少20周、至少26周、至少52周或至少78周。
[0633]
在一个实施方案中,人类患者没有功能能力的恶化。在其他实施方案中,人类患者持续至少52周没有功能能力的恶化。
[0634]
本发明另外提供了减慢人类患者中的hd的临床进展的方法,所述方法包括向罹患hd的患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而减慢患者中的hd的临床进展。
[0635]
在一个实施方案中,hd的临床进展通过总功能能力来测量。在一个实施方案中,hd的临床进展减慢了至少20%、至少30%、至少50%、至少 80%、或在20%和90%之间。在另一个实施方案中,hd的临床进展持续至少12周、至少20周、至少26周、至少52周、至少3年或至少5年被减慢。在另外的实施方案中,总功能能力通过uhdrs-tfc来测量。
[0636]
本发明还提供了在有相应需要的人类患者中降低如通过uhdrs总功能能力测量的功能下降的方法,所述方法包括向人类患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225 mg剂量的普利多匹定每天被施用至患者,以便从
而降低人类患者中的功能下降,其中人类患者罹患hd并且具有11-13的基线tfc评分。
[0637]
在一个实施方案中,功能下降通过uhdrs-tfc来测量。在另一个实施方案中,方法包括降低功能下降持续至少12周、至少20周、至少26周、至少52周、至少78周、至少3年或至少5年。
[0638]
本发明还提供了保持、改善人类患者进行日常生活活动的能力,或减缓人类患者进行日常生活活动的能力的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者进行日常生活活动的能力,或减缓人类患者进行日常生活活动的能力的下降。
[0639]
本发明还提供了保持、改善人类患者进行日常生活活动的能力,或降低人类患者进行日常生活活动的能力的下降速率的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者进行日常生活活动的能力,或降低人类患者进行日常生活活动的能力的下降速率。
[0640]
在一个实施方案中,人类患者进行日常生活活动的能力在至少12周、至少20周、至少26周、至少52周或至少78周的时间段内被保持、改善或减缓下降。在一个实施方案中,人类患者进行日常生活活动的能力被保持、改善持续至少12周、至少20周、至少26周、至少52周或至少78周,或者其下降速率持续至少12周、至少20周、至少26周、至少52周或至少78周被降低。在另一个实施方案中,方法包括保持人类患者进行日常生活活动的能力。在一个实施方案中,进行日常生活活动的能力通过tfc的日常生活活动(adl)领域来测量。
[0641]
本发明还提供了保持、改善人类患者管理财务的能力,或减缓人类患者管理财务的能力的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者管理财务的能力,或减缓人类患者管理财务的能力的下降速率。
[0642]
本发明还提供了保持、改善人类患者管理财务的能力,或降低人类患者管理财务的能力的下降速率的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者管理财务的能力,或降低人类患者管理财务的能力的下降速率。
[0643]
在另一个实施方案中,施用还保持、改善人类患者管理财务的能力,或减缓人类患者管理财务的能力的下降。在一个实施方案中,人类患者管理财务的能力被保持、改善持续至少12周、至少20周、至少26周、至少 52周或至少78周,或者人类患者管理财务的能力的下降持续至少12周、至少20周、至少26周、至少52周或至少78周被减缓。在另一个实施方案中,施用还保持、改善人类患者管理财务的能力,或降低人类患者管理财务的能力的下降速率。在一个实施方案中,人类患者管理财务的能力被保持、改善持续至少12周、至少20周、至少26周、至少52周或至少78 周,或者下降速率持续至少12周、至少20周、至少26周、至少52周或至少78周被降低。在一个实施方案中,方法包括保持人类患者管理财务的能力。在另一个实施方案中,方法包括改善人类患者管理财务的能力。在一些实施方案中,管理财务的能力
通过tfc的管理财务领域来测量。
[0644]
在一个实施方案中,施用还保持、改善人类患者进行家务的能力,或降低人类患者进行家务的能力的下降速率。在另一个实施方案中,施用还保持、改善人类患者进行家务的能力,或减缓人类患者进行家务的能力的下降。
[0645]
本发明还提供了保持、改善人类患者进行家务的能力,或减缓人类患者进行家务的能力的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者进行家务的能力,或减缓人类患者进行家务的能力的下降。
[0646]
本发明还提供了保持、改善人类患者进行家务的能力,或降低人类患者进行家务的能力的下降速率的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定或其药学上可接受的盐的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者进行家务的能力,或降低人类患者进行家务的能力的下降速率。
[0647]
在一个实施方案中,进行家务的能力通过uhdrs tfc的家务领域来测量。在另一个实施方案中,人类患者进行家务的能力被保持或改善持续至少12周、至少20周、至少26周、至少52周或至少78周。在另一个实施方案中,方法包括保持人类患者进行家务的能力。在一个实施方案中,方法包括改善人类患者进行家务的能力。在另一个实施方案中,人类患者进行家务的能力被保持或改善持续至少12周、至少20周、至少26周、至少52周或至少78周,或者下降速率持续至少12周、至少20周、至少26 周、至少52周或至少78周被降低。在另外的实施方案中,人类患者进行家务的能力被保持或改善持续至少12周、至少20周、至少26周、至少52 周或至少78周,或者下降持续至少12周、至少20周、至少26周、至少52周或至少78周被减缓。
[0648]
在一个实施方案中,施用还保持、改善人类患者的护理水平,或降低人类患者的护理水平的下降速率。在另一个实施方案中,施用还保持、改善人类患者的护理水平,或减缓人类患者的护理水平的下降。
[0649]
本发明还提供了保持、改善人类患者的护理水平,或减缓人类患者的护理水平的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者的护理水平,或减缓人类患者的护理水平的下降。
[0650]
本发明还提供了保持、改善人类患者的护理水平,或降低人类患者的护理水平的下降速率的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者的护理水平,或降低人类患者的护理水平的下降速率。
[0651]
在一个实施方案中,护理水平通过tfc的护理水平领域来测量。在另一个实施方案中,人类患者的护理水平被保持、改善持续至少12周、至少 20周、至少26周、至少52周或至少78周,或者下降速率持续至少12周、至少20周、至少26周、至少52周或至少78周被降低。在另一个实施方案中,人类患者的护理水平被保持、改善持续至少12周、至少20周、至少26周、至少52周或至少78周,或者人类患者的护理水平的下降持续至少12周、至少20周、至少26
周、至少52周或至少78周被减缓。在另一个实施方案中,方法包括保持人类患者的护理水平。
[0652]
在一个实施方案中,135mg-225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg-225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者, 135mg剂量的普利多匹定每天被施用至患者,180mg剂量的普利多匹定每天被施用至患者,或者225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,135mg剂量的普利多匹定每天被施用至患者,180mg剂量的普利多匹定每天被施用至患者,或者225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg剂量的普利多匹定每天被施用至患者,或者225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者,135mg剂量的普利多匹定每天被施用至患者,或者180mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天以每天两次45mg的单位剂量被施用至患者。在另一个实施方案中,135mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,135mg剂量的普利多匹定每天以每天两次67.5mg的单位剂量被施用至患者。在另一个实施方案中,180mg 剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg剂量的普利多匹定每天以每天两次90mg的单位剂量被施用至患者。在另一个实施方案中,225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,225mg剂量的普利多匹定每天以每天两次112.5mg的单位剂量被施用至患者。
[0653]
本发明还提供了在有相应需要的人类患者中减少肌张力障碍或保持肌张力障碍的水平的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中减少肌张力障碍或保持肌张力障碍的水平。
[0654]
在一个实施方案中,肌张力障碍通过uhdrs tms肌张力障碍评分来测量。在另一个实施方案中,人类患者中的肌张力障碍的水平持续至少12 周、至少20周、至少26周、至少52周或至少78周被降低或保持。
[0655]
在一些实施方案中,肌张力障碍是肢体肌张力障碍。
[0656]
本发明还提供了在有相应需要的人类患者中治疗肢体肌张力障碍的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中治疗肢体肌张力障碍。在许多实施方案中,(a)药物组合物被施用持续超过26周,或者(b)在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间,或者(c)人类患者罹患早期hd。
[0657]
在一个实施方案中,135mg-225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,135mg剂量的普利多匹定每天被施用至患者, 135mg剂量的普利多匹定每天被施用至患者,180mg剂量的普利多匹定每天被施用至患者,或者225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,135mg剂量的普利多匹定每天被施用至患者,180mg剂量的普利多匹定每天被施用至患者,或者225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg剂量的普利多匹定每天被施用至患者,或者225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg剂量的普利多匹定每天被施用至患
者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。
[0658]
在另一个实施方案中,药物组合物被施用持续至少12周、至少20周、至少26周、超过26周、至少52周、至少54周、至少78周、至少104周或更长。在另一个实施方案中,治疗肢体肌张力障碍包括在人类患者中防止人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下
‑ꢀ
手掌向上手部测试的减慢或不规则表现。
[0659]
本发明还提供了在人类hd患者中防止人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上手部测试的减慢或不规则表现的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中防止人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上手部测试的减慢或不规则表现。
[0660]
在另一个实施方案中,治疗肢体肌张力障碍包括防止人类患者的手指敲击能力受损和/或防止q-motor:手掌向上-手掌乡下-频率-mn-手掌(hz) 测试的减慢或不规则表现。在另一个实施方案中,治疗包括改善人类患者的q-motor敲击速度频率。在另一个实施方案中,治疗包括改善人类患者的q-motor敲击速度启动间间隔(ioi)。
[0661]
本发明还提供了改善或保持人类患者的步态和平衡的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的步态和平衡。
[0662]
在一个实施方案中,90mg、135mg、180mg或225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,135mg或180mg剂量的普利多匹定每天被施用至患者。
[0663]
另外提供了改善、保持人类患者的步态和平衡或减缓人类患者的步态和平衡的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的步态和平衡或减缓人类患者的步态和平衡的下降。
[0664]
还提供了改善、保持人类患者的步态和平衡或减慢人类患者的步态和平衡的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的步态和平衡或减慢人类患者的步态和平衡的下降。
[0665]
在一个实施方案中,人类患者的步态和平衡通过uhdrs步态和平衡评分来测量。在一些实施方案中,人类患者的步态和平衡被改善或保持持续至少12周、至少20周、至少26周、至少52周或至少78周,或者下降持续至少12周、至少20周、至少26周、至少52周或至少78周被减缓。
[0666]
在一个实施方案中,人类患者的步态和平衡通过uhdrs步态和平衡评分来测量。在一些实施方案中,人类患者的步态和平衡被改善或保持持续至少12周、至少20周、至少26周、至少52周或至少78周,或者下降持续至少12周、至少20周、至少26周、至少52周或至少78周被减慢。
[0667]
本发明还提供了改善或保持人类患者的独立性的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普
利多匹定每天被施用至患者,以便从而改善或保持人类患者的独立性。
[0668]
在一个实施方案中,90mg、135mg、180mg或225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,225mg剂量的普利多匹定每天被施用至患者。
[0669]
本发明还提供了改善、保持人类患者的独立性或减缓人类患者的独立性的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的独立性或减缓人类患者的独立性的下降。
[0670]
本发明还提供了改善、保持人类患者的独立性或减慢人类患者的独立性的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的独立性或减慢人类患者的独立性的下降。
[0671]
在一个实施方案中,人类患者的独立性通过uhdrs独立性评分来测量。在一些实施方案中,人类患者的独立性被改善或保持持续至少12周、至少 20周、至少26周、至少52周或至少78周,或者下降持续至少12周、至少20周、至少26周、至少52周或至少78周被减慢。在一个实施方案中,人类患者的独立性被改善或保持持续至少12周、至少20周、至少26周、至少52周或至少78周,或者下降持续至少12周、至少20周、至少26周、至少52周或至少78周被减缓。
[0672]
本发明还提供了改善或保持人类患者的认知领域的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的认知领域。患者的认知领域也可以是患者跨多个领域的认知表现。
[0673]
在一个实施方案中,90mg-180mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg、135mg或180mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg或180mg剂量的普利多匹定每天被施用至患者。
[0674]
还提供了改善、保持人类患者的认知领域或减缓人类患者的认知领域的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的认知领域或减缓人类患者的认知领域的下降。认知领域可以被理解为跨多个领域的认知表现。
[0675]
还提供了改善、保持人类患者的认知领域或减慢人类患者的认知领域的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的认知领域或减慢人类患者的认知领域的下降。认知领域可以被理解为跨多个领域的认知表现。
[0676]
人类患者的认知领域可以例如通过认知评价量表(cab)来测量。人类患者的认知领域也可以通过霍普金斯言语学习测试-修订版(hvlt-r)来测量。人类患者的认知领域另外可以通过节奏敲击测试、蒙特利尔认知评估 (montreal cognitive assessment,moca)量表或符号数字模态测试(sdmt) 来测量。人类患者的认知领域另外可以通过连线测试b(tmt-b)来测量。在一个实施方案中,人类患者的认知领域被保持或改善持续至少12周、至少 20周、至少26周、至少52周或至少78周,或者下降持续至少12周、至少20周、至少26周、至
少52周或至少78周被减慢。在一些实施方案中,减慢人类患者的认知领域的下降包括减慢认知下降的速率。在一个实施方案中,人类患者的认知领域被保持或改善持续至少12周、至少20周、至少26周、至少52周或至少78周,或者下降被减缓持续至少12周、至少 20周、至少26周、至少52周或至少78周。
[0677]
本发明还提供了在有相应需要的人类患者中降低与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而降低人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度。在许多实施方案中,(a)药物组合物被施用持续超过26周,或者(b)在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间,和/或(c)人类患者罹患早期hd。
[0678]
人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度可以通过例如uhdrs tms肌张力障碍评分来测量。
[0679]
还提供了在有相应需要的人类患者中改善或保持运动能力的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得 90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而保持或改善人类患者中的运动能力。
[0680]
运动能力可以例如通过uhdrs tms评分、排除舞蹈病的uhdrs tms 评分或排除肌张力障碍的uhdrs tms评分来测量。
[0681]
在一个实施方案中,90mg、135mg、180mg或225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,运动能力被保持或改善持续至少12周、至少20周、至少26周、至少52周、至少78周。
[0682]
本发明还提供了在有相应需要的人类患者中降低或保持舞蹈病水平的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而降低或保持在人类患者中舞蹈病水平。
[0683]
在一个实施方案中,90mg、135mg、180mg或225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,135mg或180mg剂量的普利多匹定每天被施用至患者。舞蹈病的水平还可以被降低。
[0684]
本发明还提供了在有相应需要的人类患者中降低、保持舞蹈病,或减缓舞蹈病的增加的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中降低、保持舞蹈病,或减缓舞蹈病的增加。
[0685]
本发明还提供了在有相应需要的人类患者中降低、保持舞蹈病,或减慢舞蹈病的增加的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中降低、保持舞蹈病,或减慢舞蹈病的增加。
[0686]
在一个实施方案中,人类患者的舞蹈病被改善或保持持续至少12周、至少20周、至少26周、至少52周或至少78周,或者增加持续至少12周、至少20周、至少26周、至少52周或至少78周被减慢。在一个实施方案中,人类患者的舞蹈病被改善或保持持续至少12周、至少20周、至少26 周、至少52周或至少78周,或者增加持续至少12周、至少20周、至少 26周、至少
52周或至少78周被减缓。人类患者的舞蹈病可以通过uhdrstms舞蹈病评分来测量。
[0687]
本发明还提供了改善、保持人类患者的行为和/或精神状态,降低或减缓人类患者的行为和/或精神状态的下降的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90 mg-225mg剂量的普利多匹定每天被施用至所述患者,以便从而改善、保持人类患者的行为和/或精神状态,降低或减缓人类患者的行为和/或精神状态的下降。
[0688]
在一个实施方案中,方法包括保持人类患者的行为和/或精神状态。在另一个实施方案中,方法包括改善人类患者的行为和/或精神状态。在另一个实施方案中,人类患者的行为和/或精神状态被改善、保持持续至少12 周、至少20周、至少26周、至少52周或至少78周,或者下降或减缓持续至少12周、至少20周、至少26周、至少52周或至少78周被降低。
[0689]
人类患者的行为和/或精神状态可以通过问题行为评估(pba)总评分来测量。人类患者的行为和/或精神状态还可以通过问题行为评估-简化形式 (pba-s)来测量。人类患者的行为和/或精神状态还可以通过用于抑郁情绪的问题行为评估来测量。人类患者的行为和/或精神状态还可以通过用于易怒的问题行为评估来测量。人类患者的行为和/或精神状态还可以通过用于缺乏主动性或冷漠的问题行为评估来测量。人类患者的行为和/或精神状态还可以通过简化形式的问题行为评估的冷漠子项目来测量。人类患者的行为和/或精神状态还可以通过冷漠评价量表(aes)来测量。人类患者的行为和/ 或精神状态可以通过用于强迫症的问题行为评估来测量。人类患者的行为和/或精神状态还可以通过用于迷失方向行为的问题行为评估来测量。在一些实施方案中,人类患者的行为和/或精神状态通过简化形式的问题行为评估的冷漠子项目或问题行为评估-简化形式(pba-s)来测量。
[0690]
本发明还提供了减少或保持人类患者的不自主运动的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而减少或保持人类患者的不自主运动。
[0691]
在一个实施方案中,人类患者的不自主运动持续至少12周、至少20 周、至少26周、至少52周或至少78周被减少或保持。患者的不自主运动可以通过uhdrs tms不自主运动评分来测量。
[0692]
本发明还提供了改善或保持人类患者的可动性的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的可动性。
[0693]
在一个实施方案中,人类患者的可动性被改善或保持持续至少12周、至少20周、至少26周、至少52周或至少78周。人类患者的可动性可以通过计时起立行走测试来测量。人类患者的可动性还可以通过walk-12总评分来测量。人类患者的可动性还可以通过患者的行走能力来测量。
[0694]
本发明还提供了改善或保持人类患者进行身体任务的能力的方法,所述方法包括向有相应需要的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者进行身体任务的能力。
[0695]
在一个实施方案中,人类患者进行身体任务的能力被改善或保持持续至少12周、至少20周、至少26周、至少52周或至少78周。在一个实施方案中,人类患者进行身体任务的
能力通过改良的身体性能测试(mppt)来测量。
[0696]
在另一个实施方案中,人类患者进行身体任务的能力通过mppt爬楼梯测试(stairs climbing test)来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt总评分来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt站立静态平衡测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt座椅起立测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt举起一本书并将其放在架上测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt穿上和脱下外套测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt从地面拿起一美分的测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt 360度转身测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过 mppt 50英尺步行(50feet walk)测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt爬一段楼梯测试来测量。在另一个实施方案中,人类患者进行身体任务的能力通过mppt爬楼梯测试(上下攀爬) 来测量。
[0697]
本发明还提供了改善或保持人类患者的生活质量的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225 mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的生活质量。
[0698]
在一个实施方案中,人类患者的生活质量被改善或保持持续至少12周、至少20周、至少26周、至少52周或至少78周。在另一个实施方案中,人类患者的生活质量被保持。在另一个实施方案中,人类患者的生活质量通过亨廷顿氏病生活质量(hd-qol)评分来测量。
[0699]
本发明还提供了降低hd患者的总功能能力的自然下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90 mg-225mg剂量的普利多匹定每天被施用至患者,以便从而降低人类患者的总功能能力的自然下降。在一个实施方案中,自然下降降低了20%-70%、 30%-60%或35%-45%。在另一个实施方案中,自然下降降低了20%、30%、 40%、50%、60%或70%。在一个实施方案中,如通过uhdrs-tfc测量的,自然下降每年减缓了0.16点-0.56点、0.24点-0.48点、0.28点-0.36点。在另一个实施方案中,如通过uhdrs-tfc测量的,自然下降每年减缓了0.16 点、0.24点、0.32点、0.4点、0.48点或0.56点。
[0700]
神经丝轻蛋白(neurofilament light protein,nfl)可以被用作hd患者中的神经退行的生物标志物(byrne 2017)。发现血浆中的nfl浓度随着hd疾病进展而增加。因此,hd患者的血浆中的nfl浓度可以提供用于评估和预测患有hd的患者中的神经损害的手段(byrne 2017)。此外,结果表明,血液中的nfl能够提供csf中对nfl浓度的可靠估计(byrne 2017)。
[0701]
本发明还提供了在hd患者中保持、降低神经丝轻蛋白的浓度,或减缓神经丝轻蛋白的浓度增加的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中保持、降低神经丝轻蛋白的浓度,或减缓神经丝轻蛋白的浓度增加。在一个实施方案中,人类患者中的神经丝轻蛋白的浓度的增加被减缓。在另一个实施方案中,人类患者中的神经丝轻蛋白的浓度被保持或降低。
[0702]
本发明还提供了预测罹患hd的受试者中对普利多匹定疗法的临床响应性的方法,
所述方法包括施用一定量的普利多匹定并且评价受试者中的神经丝轻蛋白的量,以便从而预测对普利多匹定的临床响应性。
[0703]
在一个实施方案中,方法还包括如果在施用普利多匹定后受试者中的神经丝轻蛋白的量与基线相比降低,则预测到对普利多匹定的有利临床响应性。在一个实施方案中,方法还包括如果在施用普利多匹定后受试者中的神经丝轻蛋白的量相对于基线被保持,则预测对普利多匹定的有利临床响应性。在另一个实施方案中,方法还包括如果在施用普利多匹定后受试者中的神经丝轻蛋白的量增加,则预测对普利多匹定的有利临床响应性。在该段落中,基线是在施用普利多匹定之前神经丝轻蛋白的量。
[0704]
在一个实施方案中,如果生物标志物的量高于参考值,则受试者被鉴定为普利多匹定响应者。在另一个实施方案中,如果生物标志物的量低于参考值,则受试者被鉴定为普利多匹定响应者。
[0705]
在另一个实施方案中,如果受试者被鉴定为普利多匹定响应者,则随后受试者被施用包含普利多匹定的药物组合物。
[0706]
在一个实施方案中,90mg、135mg、180mg或225mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg、135mg或225mg 剂量的普利多匹定每天被施用至患者。在另一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,135mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,180mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,225mg剂量的普利多匹定每天被施用至患者。
[0707]
在一个实施方案中,人类患者罹患hd。
[0708]
在一些实施方案中,单位剂量的药物组合物包含45mg、67.5mg、90mg 或112.5mg的普利多匹定。
[0709]
在一个实施方案中,药物组合物每天被施用两次。在另一个实施方案中,相等量的药物组合物在每次施用时被施用。在一个实施方案中,两个剂量间隔至少6小时、至少7小时、至少8小时、至少9小时、至少10小时、至少11小时被施用。在一些实施方案中,药物组合物被施用持续至少 12周、至少20周、至少26周、超过26周、至少52周或至少78周。
[0710]
在一个实施方案中,患者在开始治疗前具有≥25的uhdrs-tms评分。在另一个实施方案中,患者在开始治疗前具有低于90%的uhdrs-is (uhdrs-独立性量表)评分。在另一个实施方案中,患者在亨廷顿蛋白基因中具有大于或等于36个cag重复。在另一个实施方案中,人类患者在亨廷顿蛋白基因中具有大于44个cag重复。在另一个实施方案中,人类患者在亨廷顿蛋白基因中具有小于44个cag重复。在另一个实施方案中,人类患者罹患早期hd。在另一个实施方案中,人类患者具有大于或等于9 的基线tfc评分。在另一个实施方案中,人类患者具有大于或等于7的基线tfc评分。在另一个实施方案中,人类患者具有11-13的基线tfc评分。在另一个实施方案中,人类患者具有7-10的基线tfc评分。在另一个实施方案中,人类患者具有0-6的基线tfc评分。在另一个实施方案中,人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之一中的基线tms评分。在另一个实施方案中,人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之二中的基线tms评分。在另一个实施方案中,人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分。在另一个实施方案中,人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之三中的基线 tms评分或大于或等于9的基线tfc评分。在另一个
实施方案中,人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分或大于或等于9的基线tfc评分或在亨廷顿蛋白基因中具有小于44个cag重复。在另一个实施方案中,人类患者罹患hd,并且具有在罹患亨廷顿氏病的总患者群体的最不严重的四分之二中的基线tms评分。在另一个实施方案中,人类患者罹患hd,并且具有大于或等于9的基线 tfc评分或者在亨廷顿蛋白基因中具有大于44个cag重复。在另一个实施方案中,人类患者罹患hd,并且具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分或者在亨廷顿蛋白基因中具有小于44个 cag重复。在另一个实施方案中,人类患者罹患hd,并且具有大于或等于9的基线tfc评分或具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分。
[0711]
在一个实施方案中,普利多匹定是普利多匹定盐酸盐。
[0712]
在一个实施方案中,在周期性施用开始时,不同于预期剂量的量的滴定剂量被施用一段时间。在一些实施方案中,滴定剂量是预期剂量的量的一半。在另一个实施方案中,滴定剂量以每天一次施用被施用,而预期剂量以每天两次施用被施用。在一个实施方案中,在施用预期剂量之前,滴定剂量被施用持续7天-21天或7天-14天。在另一个实施方案中,在施用预期剂量之前,滴定剂量被施用持续7天、14天或21天。在施用预期剂量之前,滴定剂量优选地被施用持续14天。
[0713]
在一个实施方案中,方法还包括人类患者的其他hd症状与基线相比不恶化。在一个实施方案中,方法还包括,hd的另一种症状与未施用普利多匹定的人类患者相比不恶化。在另一个实施方案中,症状持续至少12周、至少20周、至少26周、至少52周或至少78周不恶化。
[0714]
本文提供了包含普利多匹定的药物组合物,用于在保持人类患者中的功能能力中使用,其中药物组合物被周期性地口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,功能能力包括adl。
[0715]
本文提供了一定量的普利多匹定在制造保持人类患者中的功能能力的药物中的用途,其中药物被配制为用于周期性口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,功能能力包括adl。
[0716]
本文提供了包含普利多匹定的药物组合物,用于在减慢如通过总功能能力测量的人类患者的hd的临床进展中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0717]
本文提供了一定量的普利多匹定在制造用于减慢如通过总功能能力测量的人类患者的hd的临床进展的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0718]
本文提供了包含普利多匹定的药物组合物,用于在人类患者中保持人类患者进行日常生活活动的能力中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0719]
本文提供了一定量的普利多匹定在制造用于在人类患者中保持人类患者进行日常生活活动的能力的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0720]
本文提供了包含普利多匹定的药物组合物,用于在人类患者中减少肌张力障碍或
保持肌张力障碍的水平中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,肌张力障碍包括肢体肌张力障碍。
[0721]
本文提供了一定量的普利多匹定在制造用于在人类患者中减少肌张力障碍或保持肌张力障碍的水平的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,肌张力障碍包括肢体肌张力障碍。
[0722]
本文提供了包含普利多匹定的药物组合物,用于在治疗人类患者中的肢体肌张力障碍中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0723]
本文提供了一定量的普利多匹定在制造用于治疗人类患者中的肢体肌张力障碍的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0724]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的步态和平衡中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0725]
本文提供了一定量的普利多匹定在制造用于在人类患者中改善或保持人类患者的步态和平衡的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0726]
本文提供了包含普利多匹定的药物组合物,用于在改善、保持人类患者的步态和平衡,或减慢人类患者的步态和平衡的下降中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0727]
本文提供了一定量的普利多匹定在制造用于在人类患者中改善、保持人类患者的步态和平衡,或减慢人类患者的步态和平衡的下降的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。在一些实施方案中,施用减慢了患者的步态和平衡的下降。
[0728]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的独立性中使用,其中药物组合物被周期性地口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。
[0729]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的独立性的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0730]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的独立性或减慢人类患者的独立性的下降中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0731]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的独立性或减慢人类患者的独立性的下降的药物中的用途,其中药物被配制用于周期性地口服施用至患
者,使得90mg剂量的普利多匹定每天被施用至患者。
[0732]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的认知领域中使用,其中药物组合物被周期性地口服施用至患者,使得 90mg-225mg剂量的普利多匹定每天被施用至患者。
[0733]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的认知领域的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0734]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的认知领域或减慢人类患者的认知领域的下降中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0735]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的认识领域或减慢人类患者的认知领域的下降的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0736]
本文提供了包含普利多匹定的药物组合物,用于在降低人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0737]
本文提供了一定量的普利多匹定在制造用于降低人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0738]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的运动能力中使用,其中药物组合物被周期性地口服施用至患者,使得 90mg-225mg剂量的普利多匹定每天被施用至患者。
[0739]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的运动能力的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0740]
本文提供了包含普利多匹定的药物组合物,用于在降低或保持人类患者中的舞蹈病的水平中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0741]
本文提供了一定量的普利多匹定在制造用于降低或保持人类患者中的舞蹈病的水平的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0742]
本文提供了包含普利多匹定的药物组合物,用于在人类患者中降低或保持舞蹈病或减慢舞蹈病的增加中使用,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0743]
本文提供了一定量的普利多匹定在制造用于在人类患者中降低或保持舞蹈病或减慢舞蹈病的增加的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0744]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的行为和/或精神状态中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量
的普利多匹定每天被施用至患者。
[0745]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的行为和/或精神状态的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0746]
本文提供了包含普利多匹定的药物组合物,用于在减少或保持人类患者的不自主运动中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0747]
本文提供了一定量的普利多匹定在制造用于减少或保持人类患者的不自主运动的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0748]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者的可动性中使用,其中药物组合物被周期性地口服施用至患者,使得90 mg-225mg剂量的普利多匹定每天被施用至患者。
[0749]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者的可动性的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0750]
本发明还提供了包装,包含:
[0751]
a)包含普利多匹定的药物组合物;和
[0752]
b)用于根据本发明的方法使用药物组合物的说明。
[0753]
本文提供了包含普利多匹定的药物组合物,用于在改善或保持人类患者进行身体任务的能力中使用,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0754]
本文提供了一定量的普利多匹定在制造用于改善或保持人类患者进行身体任务的能力的药物中的用途,其中药物被配制用于周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0755]
本发明还提供了保持或改善罹患hd的人类患者中的总功能能力的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg或180mg剂量的普利多匹定每天被施用至患者,以便从而在人类患者中保持功能能力或改善如通过uhdrs-tfc测量的总功能能力持续至少26周或52周。
[0756]
在一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,人类患者具有11-13的基线tfc评分。在另一个实施方案中,人类患者具有7-10的基线tfc评分。在另一个实施方案中,人类患者具有在罹患hd的总患者群体的最不严重的四分之二中的基线tms评分。在另一个实施方案中,人类患者具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分。在另一个实施方案中,人类患者在亨廷顿蛋白基因中具有小于44个cag重复。
[0757]
本发明还提供了保持或改善人类患者进行日常生活活动的能力的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg或180mg剂量的普利多匹定每天被施用至患者,以便从而保持或改善如通过uhdrs-tfc的日常生活活动领域测量的人类患者进行日常生活活动的能力持续至少26周或52周,其中人类患者罹患hd。
[0758]
在一个实施方案中,施用还保持或改善如通过uhdrs-tfc的管理财务领域测量的人类患者管理财务的能力持续至少26周或52周。
[0759]
本发明还提供了保持或改善人类患者管理财务的能力的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg 或180mg剂量的普利多匹定每天被施用至患者,以便从而保持或改善如通过uhdrs-tfc的管理财务领域测量的人类患者管理财务的能力持续至少 26周或52周,其中人类患者罹患hd。
[0760]
在一个实施方案中,90mg剂量的普利多匹定每天被施用至患者。在另一个实施方案中,人类患者具有11-13的基线uhdrs-tfc评分。在另一个实施方案中,人类患者具有7-10的基线uhdrs-tfc评分。在另一个实施方案中,人类患者具有在罹患hd的总患者群体的最不严重的四分之二中的基线tms评分。在另一个实施方案中,人类患者具有在罹患hd的总患者群体的最不严重的四分之三中的基线tms评分。
[0761]
本发明还提供了保持、改善人类患者进行家务的能力或降低人类患者进行家务的能力的下降速率的方法,所述进行家务的能力通过uhdrs-tfc 的家务领域测量,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者进行家务的能力或降低人类患者进行家务的能力的下降速率,其中人类患者罹患hd并且具有11-13的基线tfc评分。
[0762]
本发明还提供了保持、改善人类患者进行家务的能力或减缓人类患者进行家务的能力的下降的方法,所述进行家务的能力通过uhdrs tfc的家务领域测量,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者进行家务的能力或减缓人类患者进行家务的能力的下降,其中人类患者罹患hd并且具有11-13的基线tfc评分。
[0763]
本发明还提供了保持、改善人类患者的护理水平或降低人类患者的护理水平的下降速率的方法,所述护理水平通过uhdrs tfc的护理水平测量,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者的护理水平或降低人类患者的护理水平的下降速率,其中人类患者罹患hd并且具有11-13的基线tfc评分。
[0764]
本发明还提供了保持、改善护理水平测量的人类患者的护理水平或减缓人类患者的护理水平的下降的方法,所述护理水平通过uhdrs tfc,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得 90mg剂量的普利多匹定每天被施用至患者,以便从而保持、改善人类患者的护理水平或减缓人类患者的护理水平的下降,其中人类患者罹患hd并且具有11-13的基线tfc评分。
[0765]
本发明还提供了改善或保持人类患者的步态和平衡的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg 剂量的普利多匹定每天被施用至患者,以便从而改善或保持如通过uhdrs 步态和平衡评分测量的人类患者的步态和平衡持续至少52周,其中人类患者罹患hd并且具有11-13的基线tfc评分。
[0766]
本发明还提供了在罹患hd的人类患者中减少肌张力障碍或保持肌张力障碍的水平的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg或180mg剂量的普利多匹定每天被施用至患者,以便从而减少或保持如通过uhdrs tms肌张力障碍评分测量的肌张力障碍的水平,并且人类患者具有11-13的基线tfc评分。
[0767]
本发明还提供了改善、保持人类患者的独立性或减慢人类患者的独立性的下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的独立性或减慢人类患者的独立性的下降持续至少 26周,所述独立性通过uhdrs独立性评分测量,其中人类患者罹患hd。
[0768]
本发明还提供了改善、保持人类患者的独立性或减缓人类患者的独立性的下降的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而改善、保持人类患者的独立性或减缓人类患者的独立性的下降持续至少 26周,所述独立性通过uhdrs独立性评分测量,其中人类患者罹患hd。
[0769]
在一个实施方案中,人类患者具有11-13的基线tfc评分。在另一个实施方案中,人类患者具有大于或等于7的基线tfc评分。
[0770]
本发明还提供了在罹患hd的人类患者中防止人类患者的手指敲击能力的减慢、幅度降低或受损的方法,所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者,以便从而防止人类患者的手指敲击能力的减慢、幅度降低或损伤。
[0771]
在一个实施方案中,方法还包括防止人类患者中的手掌向下-手掌向上手部测试的减慢或不规则表现。
[0772]
本发明还提供了改善或保持人类患者的行为和/或精神状态的方法,所述方法包括向罹患hd的人类患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg或180mg剂量的普利多匹定每天被施用至患者,以便从而改善或保持人类患者的行为和/或精神状态持续至少26周或至少52 周,所述人类患者的行为和/或精神状态通过用于易怒或用于迷失方向行为的问题行为评估测量。
[0773]
在一个实施方案中,人类患者具有0-6的基线tfc评分,人类患者的行为和/或精神状态通过用于易怒的问题行为评估来测量,并且人类患者的行为和/或精神状态被改善或保持持续至少52周。在另一个实施方案中,人类患者具有11-13的基线tfc评分,人类患者的行为和/或精神状态通过用于迷失方向行为的问题行为评估来测量,并且人类患者的行为和/或精神状态被改善或保持持续至少26周。
[0774]
本发明还提供了保持以下的方法:
[0775]
a)人类患者的功能能力;
[0776]
b)人类患者进行日常生活活动的能力;
[0777]
c)人类患者管理财务的能力;
[0778]
d)人类患者进行家务的能力;
[0779]
e)人类患者的护理水平;
[0780]
f)人类患者的肌张力障碍;
[0781]
g)人类患者的步态和平衡;
[0782]
h)人类患者的独立性;
[0783]
i)人类患者的认知领域;
[0784]
j)人类患者的舞蹈病;
[0785]
k)人类患者的行为和/或精神状态;
[0786]
l)人类患者的运动能力;
[0787]
m)人类患者的可动性;或
[0788]
n)人类患者进行身体任务的能力;
[0789]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0790]
本发明还提供了改善以下的方法:
[0791]
a)功能能力;
[0792]
b)人类患者进行日常生活活动的能力;
[0793]
c)人类患者管理财务的能力;
[0794]
d)人类患者进行家务的能力;
[0795]
e)人类患者的护理水平;
[0796]
f)人类患者的步态和平衡;
[0797]
g)人类患者的独立性;
[0798]
h)人类患者的认知领域;
[0799]
i)人类患者的运动能力;
[0800]
j)人类患者的舞蹈病;
[0801]
k)人类患者的行为和/或精神状态;
[0802]
l)人类患者的可动性;或
[0803]
m)人类患者进行身体任务的能力;
[0804]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0805]
本发明还提供了减少以下的方法:
[0806]
a)人类患者的肌张力障碍;
[0807]
b)人类患者的不自主运动;或
[0808]
c)人类患者中与肌张力障碍相关的持续性或间歇性肌肉收缩的严重程度,
[0809]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0810]
本发明还提供了减少以下的方法:
[0811]
a)人类患者的功能能力的下降;
[0812]
b)人类患者进行日常生活活动的能力的下降速率;
[0813]
c)人类患者管理财务的能力的下降速率;
[0814]
d)人类患者进行家务的能力的下降速率;
[0815]
e)人类患者的护理水平的下降速率;或
[0816]
f)人类患者的行为和/或精神状态的下降;
[0817]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0818]
本发明还提供了减缓以下的方法:
[0819]
a)人类患者的功能能力的下降;
[0820]
b)人类患者进行日常生活活动的能力的下降;
[0821]
c)人类患者管理财务的能力的下降;
[0822]
d)人类患者进行家务的能力的下降;
[0823]
e)人类患者的护理水平的下降;或
[0824]
f)人类患者的行为和/或精神状态的下降;
[0825]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0826]
本发明还提供了以下的方法:
[0827]
a)减慢人类患者的步态和平衡的下降;
[0828]
b)减慢人类患者的独立性的下降;或
[0829]
c)减慢人类患者的认知领域的下降;
[0830]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者。
[0831]
本发明还提供了以下的方法:
[0832]
a)减缓人类患者的步态和平衡的下降;
[0833]
b)减缓人类患者的独立性的下降;或
[0834]
c)减缓人类患者的认知领域的下降;
[0835]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg剂量的普利多匹定每天被施用至患者。
[0836]
本发明还提供了以下的方法:
[0837]
a)减慢如通过总功能能力测量的人类患者的hd的临床进展;或
[0838]
b)治疗肢体肌张力障碍,优选地,其中治疗包括
[0839]
i.在人类患者中防止人类患者的手指敲击能力的减慢、幅度降低或受损并且防止手掌向下-手掌向上手部测试的减慢或不规则表现;
[0840]
ii.防止人类患者的手掌向下-手掌向上手部测试的减慢或不规则表现;
[0841]
iii.改善人类患者的q-motor敲击速度频率;或
[0842]
iv.改善人类患者的q-motor敲击速度启动间间隔(ioi);
[0843]
所述方法包括向患者周期性地口服施用包含普利多匹定的药物组合物,使得90mg-225mg剂量的普利多匹定每天被施用至患者。
[0844]
本发明还提供了包含普利多匹定的药物组合物,用于(1)(a)在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能下降,(b)减慢hd 的临床进展,(c)在有相应需要的人类患者中减少肌张力障碍或保持肌张力障碍的水平,(d)在有相应需要的人类患者中治疗肢体肌张力障碍,(e)防止人类患者的手指敲击能力的减慢、幅度降低或所述和/或防止手掌向下-手掌手部向上测试的减慢或不规则表现,(f)在有相应需要的人类患者中改善或保持人类患者的步态和平衡,(g)在有相应需要的人类患者中改善或保持人类患者的独立性,(h)在有相应需要的人类患者中改善或保持人类患者跨多个领域的认知表现,(i)在有相应需要的人类患者中减缓与肌张力障碍相关的持续或间歇性肌肉收缩的严重程度,(j)在有相应需要的人类患者中改善或保持运动能力,(k)在有相应需要的人类患者中降低或保持舞蹈病水平, (l)在有相应需要的人类患者中改善、保持人类患者的行为
和/或精神状态,或减缓人类患者的行为和/或精神状态的下降,(m)在有相应需要的人类患者中减少或保持人类患者的不自主运动,(n)在有相应需要的人类患者中改善或保持人类患者的可动性,(o)改善或保持人类患者进行身体任务的能力, (p)改善或保持人类患者的生活质量,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者,或者(2)(a) 在有相应需要的人类患者中改善、保持步态和平衡或减缓步态和平衡的下降,(b)在有相应需要的人类患者中改善、保持人类患者的独立性或减缓人类患者的独立性的下降,(c)在有相应需要的人类患者中改善、保持人类患者跨多个领域的认知表现或减缓人类患者跨多个领域的认知表现的下降,(d) 在有相应需要的人类患者中降低、保持舞蹈病或减缓舞蹈病的增加,其中药物组合物被周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0845]
本发明还提供了一定量的普利多匹定在制造用于以下的药物中的用途,用于(1)(a)在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能下降,(b)减慢hd的临床进展,(c)在有相应需要的人类患者中减少肌张力障碍或保持肌张力障碍的水平,(d)在有相应需要的人类患者中治疗肢体肌张力障碍,(e)防止人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上手部测试的减慢或不规则表现,(f)在有相应需要的人类患者中改善或保持人类患者的步态和平衡,(g)在有相应需要的人类患者中改善或保持人类患者的独立性,(h)在有相应需要的人类患者中改善或保持人类患者跨多个领域的认知表现,(i)在有相应需要的人类患者中减轻与肌张力障碍相关的持续或间歇性肌肉收缩的严重程度,(j)在有相应需要的人类患者中改善或保持运动能力,(k)在有相应需要的人类患者中降低或保持舞蹈病水平,(l)在有相应需要的人类患者中改善、保持人类患者的行为和/或精神状态,或减缓人类患者的行为和/或精神状态的下降,(m) 在有相应需要的人类患者中减少或保持人类患者的不自主运动,(n)在有相应需要的人类患者中改善或保持人类患者的可动性,(o)改善或保持人类患者进行身体任务的能力,(p)改善或保持人类患者的生活质量,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者,或者(2)(a)在有相应需要的人类患者中改善、保持步态和平衡或减缓步态和平衡的下降,(b)在有相应需要的人类患者中改善、保持人类患者的独立性或减缓人类患者的独立性的下降,(c)在有相应需要的人类患者中改善、保持人类患者跨多个领域的认知表现或减缓人类患者跨多个领域的认知表现的下降,(d)在有相应需要的人类患者中降低、保持舞蹈病或减缓舞蹈病的增加,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0846]
本发明另外提供了一定量的普利多匹定用于以下的用途,用于(1)(a)在有相应需要的人类患者中保持功能能力、改善功能能力或减缓功能下降,(b) 减慢hd的临床进展,(c)在有相应需要的人类患者中减少肌张力障碍或保持肌张力障碍的水平,(d)在有相应需要的人类患者中治疗肢体肌张力障碍, (e)防止人类患者的手指敲击能力的减慢、幅度降低或受损和/或防止手掌向下-手掌向上手部测试的减慢或不规则表现,(f)在有相应需要的人类患者中改善或保持人类患者的步态和平衡,(g)在有相应需要的人类患者中改善或保持人类患者的独立性,(h)在有相应需要的人类患者中改善或保持人类患者跨多个领域的认知表现,(i)在有相应需要的人类患者中减轻与肌张力障碍相关的持续或间歇性肌肉收缩的严重程度,(j)在有相应需要的人类患者中改善或保持运动能力,(k)在有相应需要
的人类患者中降低或保持舞蹈病水平,(l)在有相应需要的人类患者中改善、保持人类患者的行为和/或精神状态,或减缓人类患者的行为和/或精神状态的下降,(m)在有相应需要的人类患者中减少或保持人类患者的不自主运动,(n)在有相应需要的人类患者中改善或保持人类患者的可动性,(o)改善或保持人类患者进行身体任务的能力,(p)改善或保持人类患者的生活质量,其中药物组合物被周期性地口服施用至患者,使得90mg-225mg剂量的普利多匹定每天被施用至患者,或者(2)(a)在有相应需要的人类患者中改善、保持步态和平衡或减缓步态和平衡的下降,(b)在有相应需要的人类患者中改善、保持人类患者的独立性或减缓人类患者的独立性的下降,(c)在有相应需要的人类患者中改善、保持人类患者跨多个领域的认知表现或减缓人类患者跨多个领域的认知表现的下降,(d)在有相应需要的人类患者中降低、保持舞蹈病或减缓舞蹈病的增加,其中药物被配制用于周期性地口服施用至患者,使得90mg剂量的普利多匹定每天被施用至患者。
[0847]
本文公开的每个实施方案被设想为可适用于公开的其他实施方案中的每一个。例如,本文描述的各种元素的所有组合都在本发明的范围内。此外,在包装和药物组合物实施方案中提及的元素可以用于本文描述的方法和用途实施方案中。
[0848]
术语
[0849]
如本文使用的,并且除非另有说明,否则以下术语中的每一个都应具有下文阐述的定义。
[0850]
冠词―一(a)”、―一(an)”和―该(the)”是非限制性的。例如,―该方法”包括该措辞的含义的最广泛定义,其可以是多于一种方法。
[0851]
如本文使用的,作为达到终点有效的量的―有效的”意指组分当以本公开内容的方式被使用时与合理的益处/风险比相称的足以产生指示的治疗响应而无过度不良副作用(诸如毒性、刺激或过敏响应)的量。例如,对于保持功能能力或减缓功能能力下降有效的量。具体的有效量随诸如所治疗的特定状况、患者的身体状况、所治疗的哺乳动物的类型、治疗的持续时间、联合疗法(如果有的话)的性质、和所使用的具体制剂以及化合物或其衍生物的结构等因素而变化。
[0852]
如本文使用的,―治疗(treat)”或―治疗(treating)”涵盖例如减少症状,诱导对紊乱和/或疾病的抑制、消退或停滞。如本文使用的,对受试者中的疾病进展或疾病并发症的―抑制”意指防止或减少受试者中的疾病进展和/或疾病并发症。
[0853]
―施用至受试者”或―施用至(人类)患者”意指向受试者/患者提供、分配或施加药物(medicine)、药物(drug)或补救措施,以减轻、治愈或减少与状况例如病理学状况相关的症状。施用可以是周期性施用。
[0854]
如本文使用的,―周期性施用”意指间隔一定时间段的重复/反复施用。施用之间的时间段优选地是时时(from time to time)一致的。周期性施用可以包括例如每天一次、每天两次、每天三次、每天四次、每周一次、每周两次、每周三次、每周四次等等施用。
[0855]
如本文使用的,―保持人类患者的功能能力”意指在施用普利多匹定一定时间段后功能能力评分(―施用后评分”)与在就要施用的时间段之前人类患者的功能能力评分(―基线评分”)相比未改变。如果基线评分和施用后评分之间的差异不是统计学上显著的,则施用后评分被认为未改变。功能能力评分可以如本文描述的来测量,并且包括功能能力评分的子集。
[0856]
如本文使用的,―改善人类患者的功能能力”意指在施用普利多匹定一定时间段后功能能力评分(―施用后评分”)与在就要施用的时间段之前人类患者的功能能力评分(―基线评分”)相比被改善。
[0857]
罹患hd的人类患者的功能能力评分可以随时间降低。这样的下降速率可以被称为功能能力评分的下降速率或功能能力的下降速率或功能下降的速率。例如,平均地,早期hd患者(tfc评分为7-13)相比于晚期患者(tfc 评分为<7),功能下降的速率或tfc评分的降低更快。在早期hd患者中平均每年下降约0.8点-1.2点,对于具有tfc 3-6的患者小于1/2(约0.2-0.3) 点;而对于具有tfc 0-2的患者小于0.1(marder 2000)。因此,tfc对早期疾病的变化是最敏感的。总功能能力评分可以如本文描述的测量,并且包括功能能力评分的子集。该下降也可以被称为功能能力的自然下降或未治疗的下降。
[0858]
因此,如本文使用的,―降低功能能力的下降速率”、―减慢功能下降的速率”、―降低功能下降的速率”、―降低功能下降”或―减慢功能下降”意指与未接受普利多匹定的患者的功能能力评分相比,施用该普利多匹定治疗一定时间段后的功能能力评分(―施用后评分”)的下降速率被减慢、降低或降低。
[0859]
如本文使用的,―减缓功能能力的下降”或―降低功能能力的下降”意指在施用普利多匹定一定时间段后,患者的功能能力评分的下降小于在同一时间段内未接受该普利多匹定的治疗的患者的功能能力评分的下降。
[0860]
如本文使用的,―保持人类患者进行日常生活活动的能力”意指,施用普利多匹定一定时间段后的日常生活活动(adl)评分(―施用后评分”)与在就要施用的时间段之前人类患者的日常生活活动评分(―基线评分”)相比未改变。如果基线评分和施用后评分之间的差异不是统计学上显著的,则施用后评分被认为未改变。日常生活活动评分是总功能能力评分的子集,并且可以如本文描述的测量。
[0861]
存在六种基本的adl:吃、洗澡、穿衣、如厕、移动(功能可动性)和节制。adl评分如下:需要全面护理的患者=0,仅能够进行粗略任务的患者=1,具有最小损伤的患者=2,没有损伤的患者(正常)=3。
[0862]
如本文使用的,―保持人类患者管理财务的能力”意指施用普利多匹定一定时间段后的财务评分(―施用后评分”)与在就要施用的时间段之前人类患者的财务评分(―基线评分”)相比未改变。如果基线评分和施用后评分之间的差异不是统计学上显著的,则施用后评分被认为未改变。财务评分是总功能能力评分的子集,并且可以如本文描述的测量。
[0863]
财务评分如下:无法管理财务的患者=0,需要较多帮助的患者=1,需要较少帮助的患者=2,不需要帮助的患者(正常)=3。
[0864]
如本文使用的,―与基线相比其他hd症状不恶化”意指在施用普利多匹定一定时间段后,人类患者的hd症状的每一个的严重程度等于或小于在就要施用的时间段开始之前症状的严重程度(基线)。
[0865]
对于上文讨论的每个基线评分,在一个实施方案中,在达到基线评分之前,不向患者施用普利多匹定。在另一个实施方案中,在达到基线评分之前,向患者施用一定量的普利多匹定。在另外的实施方案中,在达到基线评分之前,对患者施用的普利多匹定的量小于或大于在达到基线评分之后被对患者施用的普利多匹定的量。
[0866]
如本文使用的,以毫克测量的普利多匹定的―量”或―剂量”指的是制品中存在的
普利多匹定的毫克数,与制品的形式无关。―90mg剂量的普利多匹定”意指制品中普利多匹定酸的量为90mg,与制品的形式无关。因此,当呈盐的形式例如普利多匹定盐酸盐时,由于存在额外的盐离子,提供90mg 剂量的普利多匹定所需要的盐形式的重量将大于90mg。
[0867]
本文公开的任何范围意指该范围内的所有小数点后两位的数 (hundredth)、小数点后一位的数(tenth)和整数单位量都作为本发明的部分被具体地公开。因此,例如,0.01mg至50mg意指,0.02mg、0.03mg...0.09 mg;0.1mg;0.2mg...0.9mg;和1mg、2mg...49mg单位量作为本发明的实施方案被包括。
[0868]
如本文使用的,―普利多匹定”意指普利多匹定碱或其药学上可接受的盐,以及衍生物,例如富含氘的普利多匹定和盐的形式。富含氘的普利多匹定和盐及其制备方法的实例可以在美国申请公布第2013-0197031号、第 2016-0166559和第2016-0095847号中找到,以上申请中的每一个的全部内容通过引用特此并入。在某些实施方案中,普利多匹定是药学上可接受的盐,例如hcl盐或酒石酸盐。优选地,在如本文描述的本发明的任何实施方案中,普利多匹定呈其盐酸盐的形式。
[0869]
―富含氘”意指,在化合物的任何相关位置处的氘的丰度大于一定量的化合物中该位置处天然存在的氘的丰度。氘的天然存在的分布为约0.0156%。因此,在―富含氘”的化合物中,在其任何相关位置处的氘的丰度大于 0.0156%,并且可以在从大于0.0156%至100%的范围内。富含氘的化合物可以通过用氘交换氢或用富含氘的起始材料合成该化合物来获得。
[0870]
药学上可接受的盐
[0871]
用于根据本发明的用途的活性化合物可以以适合于预期施用的任何形式提供。合适的形式包括药学上(即生理学上)可接受的盐,以及本发明的化合物的前体或前药形式。
[0872]
药学上可接受的加成盐的实例包括但不限于无毒无机酸加成盐和无毒有机酸加成盐,诸如盐酸盐、氢溴酸盐、l-酒石酸盐、硝酸盐、高氯酸盐、磷酸盐、硫酸盐、甲酸盐、乙酸盐、阿康酸盐(aconate)、抗坏血酸盐、苯磺酸盐、苯甲酸盐、肉桂酸盐、柠檬酸盐、双羟萘酸盐、庚酸盐、富马酸盐、谷氨酸盐、乙醇酸盐、乳酸盐、马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、萘-2-磺酸盐、邻苯二甲酸盐、水杨酸盐、山梨酸盐、硬脂酸盐、琥珀酸盐、酒石酸盐、对甲苯磺酸盐等。这样的盐可以通过本领域熟知和描述的程序形成。
[0873]
药物组合物
[0874]
虽然用于根据本发明的用途的化合物可以以原始化合物的形式被施用,但优选将活性成分,任选地以生理上可接受的盐的形式,与一种或更多种佐剂、赋形剂、载体、缓冲剂、稀释剂和/或其他常规药物助剂一起引入药物组合物中。
[0875]
在一个实施方案中,本发明提供了药物组合物,所述药物组合物包含活性化合物或其药学上可接受的盐或衍生物,以及其一种或更多种药学上可接受的载体,以及任选地本领域已知和使用的其他治疗性成分和/或预防性成分。载体必须在与制剂的其他成分相容并且对其接受者不是有害的意义上是―可接受的”。
[0876]
本发明的药物组合物可以通过任何适合期望的疗法的方便的途径施用。优选的施用途径包括口服施用,特别地片剂、胶囊、糖衣丸、粉末或液体形式,以及肠胃外施用,特别地皮肤、皮下、肌肉内或静脉内注射。本发明的药物组合物可以由技术人员通过使用适合于期望的制剂的标准方法和常规技术来制造。当需要时,可以使用适于给予活性成分的持续
释放的组合物。
[0877]
关于制剂和施用的技术的另外的细节可以在最新版本的remington’spharmaceutical sciences(mack publishing co.,easton,pa)中找到。
[0878]
缩写列表
[0879]
在整个本技术中使用以下缩写:
[0880]
alt:丙氨酸氨基转移酶;adl:日常生活活动;ar:自回归;auc:浓度-时间曲线下的面积;bid或b.i.d:每天两次;bl=基线;cab:认知评价量表;cab hvlt-r:认知评价量表霍普金斯言语学习测试,修订版; cgi-c:临床整体改变印象;cgi-s:临床整体严重程度印象;ci:置信区间;cibic-plus:基于临床医师访谈的改变印象加护理人员输入;cibis:基于临床医师访谈的严重程度印象;cioms:国际医学科学组织理事会 (council for international organizations of medical sciences);cmax:观察到的最大血浆药物浓度;cns:中枢神经系统;crf:病例报告表;cro:合同研究组织(contract research organization);cs:化合物对称性;c-ssrs:哥伦比亚-自杀严重程度评定量表;cyp:细胞色素p450;dsm
–
ivtr:诊断和统计手册-第四版文本修订(diagnostic and statistical manual-fourthedition text revision);em:快代谢者;eu:欧盟;fa:功能评估;fas:全分析集;freq:敲击频率;gcp:良好临床实践(good clinical practice); gfv-c:静态握力变化;ggt:γ-谷氨酰基转肽酶;hart:亨廷顿氏病 acr16随机试验;hcg:人类绒毛膜促性腺激素;hd:亨廷顿氏病;hd-qol =亨廷顿氏病生活质量;hvlt-r:had-cab霍普金斯言语学习测试-修订版;ich:国际协调会议(international conference on harmonisation);iec:独立伦理委员会(independent ethics committee);ioi:启动间间隔;ipi:峰间间隔;irb:机构审查委员会(institutional review board);irt:交互式响应技术;is:独立性评分;iti:敲击间间隔;itt:治疗意图;lso:当地安全性官员;mad:多重递增剂量;meddra:药事管理的医学词典(medicaldictionary for regulatory activities);mermaihd:hd的欧洲多国多中心 acr16研究;ml:最大可能性;mms:改良的运动评分;moca:蒙特利尔认知评估;ms:多发性硬化症;mtd:最大耐受剂量;nmda:n-甲基
ꢀ‑
d-天冬氨酸;noael:未观察到副作用水平;pba-s:问题行为评估-简化形式;pd:药效学;pds:身体失能量表;pk:药代动力学;pm:不良代谢者;ppt:身体性能测试;qd:每天一次;q-motor:定量运动;qol:生活质量;qtcf:弗雷德里希校正的qt间期(fridericia-corrected qtinterval);rbc:红细胞;reml:受限最大似然;sae:严重不良事件; sd:标准偏差;sdmt:符号数字模态测试;soc:系统器官类;sop:标准操作程序;susar:疑似意外的严重不良反应;t1/2:半衰期;tc=电话问诊;td:敲击持续时间;tf:敲击力;tfc:总功能能力;tms:总运动评分;tms不自主运动=家务和肌张力障碍性能评分的组合tms。tug:计时起立行走;uhdrs:统一亨廷顿氏病评定量表;uln:正常范围的上限;us:美国;wbc:白细胞;who:世界卫生组织;who:药物的世界卫生组织(who)药物辞典;δhr:心跳速率从基线的变化;δqtcf:qtcf 从基线的变化;δδhr:安慰剂校正的心率从基线的变化;安慰剂对照研究
ꢀ‑
亨廷顿氏病;δδqtcf:安慰剂校正的qtcf从基线的变化,wk:周;eq5d-5l 欧洲生活质量-5维(5个等级)。
[0881]
临床研究
[0882]
已经用普利多匹定完成十六(16)项临床研究,包括在健康受试者中的8 项研究(其中1项研究也包括患有精神分裂症的患者)、在患有帕金森病的患者中的1项研究、在患
有精神分裂症的患者中的2项研究(包括上文提到的研究)和在患有hd的患者中的6项研究(包括1项开放标签扩展(open-labelextension)研究)。此外,在欧洲正在患有hd的患者中进行普利多匹定的慈善用药(compassionate use)程序,并且美国(us)和加拿大正在进行开放标签、长期安全性研究。这些研究的概述在国际公布第wo 2014/205229号中呈现,其内容通过引用特此并入。
[0883]
通过参考下面的实验细节将更好地理解本发明,但是本领域技术人员将容易理解,详细的具体实验仅仅是对本发明的说明,如在其后的权利要求中更全面地描述的。
实施例
[0884]
实施例1:ii期、剂量发现、随机化、平行组、双盲、安慰剂对照研究,评价每天两次45mg、67.5mg、90mg和112.5mg普利多匹定与安慰剂相比对于患有hd的患者的症状治疗的安全性和功效(“pride-hd”)
[0885]
本研究使用uhdrs tms评估了每天两次(bid)45mg至112.5mg普利多匹定在至少52周的治疗中对患有hd的患者的运动损伤的功效。本研究还评估了用每天两次45mg至每天两次112.5mg普利多匹定治疗至少52 周对改良的身体性能测试(mppt)的影响。本研究还评估了用每天两次45mg 至每天两次112.5mg普利多匹定治疗至少52周对针对总功能能力(tfc)和认知评价量表(cab)的uhdrs量度的影响。本研究还比较了来自所有患者的数据与在hd亚群中获得的数据。本研究还(i)评价了在至少52周的治疗期间患有hd的患者中的一系列普利多匹定剂量的安全性和耐受性,(ii)探索了普利多匹定在研究群体中的药代动力学(pk),以及(iii)研究了暴露于普利多匹定和结果量度(例如,临床功效和毒性参数)之间的关系。
[0886]
研究设计
[0887]
一般设计和研究方案
[0888]
这是随机化、平行组、双盲、安慰剂对照研究,其比较了每天两次45mg、 67.5mg、90mg和112.5mg普利多匹定与安慰剂相比在治疗hd的运动损伤中的功效和安全性。普利多匹定向患者的施用总结在表2中。研究程序和评估总结在表3中。详细的临床程序,包括筛查程序和其他程序在美国专利申请公布第us 2014/0378508号和国际公布第wo 2014/205229号中作为实施例3列出,其内容通过引用特此并入。
[0889]
主要和次要变量和终点
[0890]
该研究的主要功效变量和终点是在第26周或第52周uhdrs tms(被定义为所有uhdrs运动领域评定的总和)从基线的变化。运动损伤的主要量度是由一名经训练的检查者管理的uhdrs运动评估部分。运动评估的第一部分由下文提供的五个tms分项评分组成。所有31项的总和被称为总运动评分(tms)。次要功效变量和终点是在第26周或第52周mppt从基线的变化。
[0891]
mppt对患者在身体任务中的表现定量(brown 2000)。这是标准化的9 项测试(站立静态平衡、座椅起立、举起一本书并将其放在架上、穿上和脱下外套、从地面拿起一美分、360度转身、50英尺步行(50feet walk)、爬一段楼梯,爬楼梯测试(上下攀爬)),其测量患者在功能性任务上的表现。在评分期间考虑患者完成这些项目的速度和准确性两者。测试的最高评分是 36,较高的评分指示较好的表现。多发性硬化症行走量表(msws-12)被调整以
变成对行走和可动性的通用量度,并且被改名为walk-12。
[0892]
其他功效变量和终点:本研究的其他功效变量和终点如下:
[0893]
整体功能性量表:与基线相比的cibic-plus整体评分;pds评分从基线的变化;uhdrs fa从基线的变化;与基线相比的cgic;uhdrs tfc 从基线的变化;和uhdrs is从基线的变化。
[0894]
整体/功能性量表:
[0895]
hd qol从基线的变化;和walk-12量表从基线的变化。
[0896]
tms分项评分:
[0897]
手部动作评分(被定义为uhdrs领域手指敲击、手掌向下-手掌向上和 luria[握拳-伸手-翻掌测试(fist-hand-palm test)的总和])从基线的变化;步态和平衡评分(被定义为uhdrs领域步态、足尖足跟衔接行走(tandem walking) 和后退拉力测试的总和)从基线的变化;uhdrs mms(被定义为uhdrs领域构音障碍、舌部突起(tongue protrusion)、手指敲击、手掌向下-手掌向上、 luria、僵硬、动作迟缓、步态、足尖足跟衔接行走、后退拉力测试的总和) 从基线的变化;uhdrs舞蹈病从基线的变化;uhdrs肌张力障碍从基线的变化;和响应者,被定义为具有uhdrs tms从基线的变化≤0的患者。
[0898]
其他运动评估:
[0899]
包括手指运动描述(digitomotography)(快速食指敲击)、轮替运动描述 (dysdiadochomotography)(手掌向下/手掌向上敲击)、手部运动描述 (manumotography)和舞蹈运动描述(choreomotography)(握力和舞蹈病分析) 以及脚运动描述(pedomotography)(快速脚敲击)的q-motor测量值从基线的变化;和tug测试从基线的变化。
[0900]
认知/精神评估:
[0901]
简单hd-cab:sdmt、情绪识别、连线测试、hvlt-r、3hz的节奏敲击、ots从基线的变化;和pba-s从基线的变化。
[0902]
安全性变量和终点
[0903]
安全性变量和终点包括以下:整个研究中的ae;整个研究中qtcf和其他ecg参数从基线的变化;整个研究中的临床安全性实验室(临床化学、血液学和尿液分析);整个研究中c-ssrs从基线的变化;整个研究中的生命体征。
[0904]
耐受性变量和终点
[0905]
耐受性变量和终点包括以下:未能完成研究的患者的数目(%);和由于 ae未能完成研究的患者的数目(%)。
[0906]
药代动力学变量和终点
[0907]
主要pk量度是确定普利多匹定的血浆浓度。浓度也被整合到普利多匹定群体pk模型中并且计算研究患者的个体暴露(cmax和auc)。
[0908]
研究药物和剂量:普利多匹定(作为普利多匹定盐酸盐)以尺寸2的包含 45mg普利多匹定的白色硬质明胶胶囊和尺寸4的包含22.5mg普利多匹定的白色硬明胶胶囊提供。安慰剂以白色硬质明胶胶囊呈现,与22.5mg或 45mg普利多匹定胶囊匹配,但不包含活性成分,仅包含赋形剂(硅化微晶纤维素和硬脂酸镁)。
[0909]
[0910]
[0911][0912]
表3图例
[0913]
a.这些就诊(v0和v4-12)的程序和评估可以在几天内进行,只要它们在规定的就
诊窗口内完成。
[0914]
b.在随机分配患者之前,在筛查和第0天审查时应符合纳入/排除标准。
[0915]
c.仅电解质。
[0916]
d.在筛查时的血清妊娠测试(如果需要进行尿液测试以确认);后续时间点时的尿液妊娠测试。血清妊娠测试的不确定读数应检查两次(尿液测试) 并且如果需要将患者送交妇科医师。
[0917]
e.筛查时进行单一ecg。如果在筛查时存在qtcf间期延长(被定义为qtcf间期>450毫秒)的证据,则再重复ecg两次,并且将3次筛查测量的平均值用于确定患者是否适合于被纳入研究。
[0918]
f.基线就诊时,给药前qtcf通过3次ecg(在彼此的10分钟至20分钟内)的平均数来确定,每次一式三份(共9次记录)。
[0919]
在首次给药后1小时至2小时一式三份进行给药后ecg。在现场首次剂量施用前和首次剂量施用后1小时至2小时收集pk样品。当与ecg同时时,在ecg记录后收集pk样品。
[0920]
g.在下午给药前和下午给药后1小时至2小时一式三份进行一次ecg。
[0921]
h.ecg在第8周是任选的,除非当地规定要求。,当存在证实额外ecg 合理的临床情形(例如先前发作过低钾血症而无qt延长的患者)时,根据研究者的判断进行额外ecg。
[0922]
i.在第52周,在最后一次研究(上午)给药之前收集一式三份的ecg和 pk样品。
[0923]
j.ecg在随访就诊时的任选的,但应对所有先前观察到心脏问题和/或 qtc从基线变化的患者进行。
[0924]
k.包括cag分析、细胞色素p450 2d6状态、遗传性长qt综合征(仅在导致研究中断的研究药物施用后经历qt延长的患者中评估)或任何其他与普利多匹定响应或hd有关的遗传分析。
[0925]
l.优先评价。
[0926]
m.安全性电话就诊将包括简短的pba-s(pba问题的子集,关于抑郁情绪、自杀意念、焦虑、易怒、动机丧失和强迫症行为)。
[0927]
n.包括手指运动描述(快速食指敲击)、轮替运动描述(手掌向下/手掌向上敲击)、手部运动描述和舞蹈运动描述(握力和舞蹈病分析)以及脚运动描述(快速脚敲击)。
[0928]
o.包括sdmt、情绪识别、连线测试a+b、hvlt-r;节奏敲击测试和ots。
[0929]
p.在第2周、第12周和第20周,在下午给药后1小时至2小时收集 pk样品。当与ecg同时时,在ecg记录后收集pk样品。
[0930]
q.在第4周、第6周和第16周,在下午给药前和下午给药后1小时至2小时收集pk样品。当与ecg同时时,在ecg记录后收集pk样品。
[0931]
r.在最后的研究日(第52周),在获得给药前pk样品后,研究药物施用将在现场进行。
[0932]
s.在随访就诊时,收集1份pk样品。在sae的情况下,额外的pk 样品应计划在最接近sae的时间收集。当与ecg同时时,在ecg记录后收集pk样品。
[0933]
t.该信息将被收集作为并行药物询问的一部分。
[0934]
u.仅收集。
[0935]
v.研究遵守情况在tc期间被审查。
[0936]
w.在整个研究期内,每名患者每天两次(bid)接受3个胶囊,即上午3 个胶囊和下午(在上午给药后7小时-10小时)3个胶囊。在提前结束就诊时不施用研究药物。在现场就诊时,现场服用下午剂量。
[0937]
x.由于安全性或耐受性原因不得不停止研究药物用药的患者被要求继续该研究,并且遵循所概述的就诊时间表,而不服用研究药物。
[0938]
主要功效变量和终点
[0939]
uhdrs包括对与hd相关的特征的广泛评估(huntington study group 1996)。它是一种已被开发以提供对hd的临床特征和病程的一致评估的研究工具。uhdrs的tms部分包括来自uhdrs的15个项目的31种评估,每种评估根据从0(正常)到4(最大异常)的5点量表评定。
[0940]
次要功效变量和终点
[0941]
次要功效变量和终点,改良的身体性能测试(mppt),定量了患者在身体任务中的表现(brown 2000)。其是测量患者在功能性任务上的表现的标准化9项目测试。对于需要站立姿势的任务(项目6-9)允许辅助装置。在评分期间考虑患者完成项目的速度和准确性两者。测试的最高评分是36,较高的评分指示较好的表现。
[0942]
其他功效变量和终点
[0943]
基于临床医师访谈的印象改变加护理人员输入
[0944]
cibic-plus(版本adcs-cgic)被开发、验证,并且通常用于阿尔茨海默病的抗痴呆药物的研究(joffres 2000)。一名独立的评定者评价了患者在起用普利多匹定或安慰剂之前的整体疾病严重程度。该评估,被称为cibis,根据7点likert量表评定患者,从极度严重的hd到没有hd症状。在进行评价的每次后续就诊中,cibic-plus由相同的独立评定者管理,但其他终点评估或患者在研究期间经历的ae是未知的(以免将cibic的评定混淆为功效量度,或使研究揭盲(unblind))。独立的评定者仅考虑通过访谈患者和护理人员获得的对患者的认知、功能和行为表现的观察。然后评定者将这些发现与基线评估相比较。从基线改变的总体印象(cibic-plus)根据7点量表评定:1=显著改善;2=中度改善;3=最小改善;4=无变化;5=最小恶化;6=中度恶化;7=显著恶化;所有评估都是相对于基线的。较高的评分指示整体功能的恶化。在hd中,护理人员输入的介入对整体评估特别关键,因为先前的研究已经证明患者对其具有的缺陷的认识和认知有限。
[0945]
身体失能量表
[0946]
使用pds作为研究期间失能的量度。根据量表对患者进行从10(―需要完全护理的固定姿势-胃切开术、导管插入”)至100(―正常、无明显疾病”) 的评分(myers 1991)。
[0947]
uhdrs功能评估或uhdrs总功能评估
[0948]
uhdrs的tfa量表评估了25项日常生活任务中的功能性(例如,―患者能否在他/她习惯的工作中从事有偿雇佣?”)。每个问题用―是”或―否”回答。
[0949]
临床整体严重程度和改变的印象
[0950]
在基线评估cgi-s,并且在所有随后时间点使用cgi-c评估从基线的变化。cgi-s量表最初被设计以评估患有精神障碍的患者的治疗响应(guy 1976),但现在广泛用于多种疾病。由研究者根据7点量表(1=正常、完全未患病至7=属于最严重患病的患者)评定疾病严重程度。评估基于研究者的判断,由全面、半结构化、患者/护理人员访谈支持。cgi-c量表测
量患者的临床状态从具体时间点的变化,使用7点量表,范围从1(极大改善) 至7(极大恶化),其中评分4指示无变化。
[0951]
uhdrs总功能能力(tfc)
[0952]
uhdrs的tfc量表是用于评估与下文示出的5个失能相关的功能性领域(职业、财务、家务(例如洗衣、洗碗)、日常生活活动和护理水平)的标准化量表。tfc评分具有0-13的范围,并且是已确立的对于靶向疾病进展的试验的终点。tfc评分已被开发并由huntington study group(hsg,1996) 在20多年的多次试验中开发。tfc评分被监管者认可,并且通常被认为是最广泛认可的用于hd患者的疾病进展的工具。此外,tfc被认为是用于测量hd功能下降速率的金标准。目前,尽管多次尝试,但没有药物示出减慢tfc的下降。地板和天花板效应(floor and ceiling effect)使得tfc评分对早期hd的变化比对晚期hd中的变化更敏感。
[0953]
功能能力:
[0954]
职业:0=无法工作,1=仅不重要的工作,2=对于惯常工作降低的能力, 3=正常。
[0955]
财务:0=无法进行,1=较多帮助,2=轻微帮助,3=正常。
[0956]
家务:0=无法进行,1=受损,2=正常。
[0957]
日常生活活动(adl):0=总体护理,1=仅粗略任务,2=最小损伤,3=正常。
[0958]
护理水平:0=全职熟练护理,1=家庭或长期护理,2=在家。
[0959]
uhdrs独立性量表
[0960]
uhdrs的独立性量表是一种评定量表,其中患者的独立性程度以百分比给出,从10%(管喂(tube fed),完全卧床护理)至100%(不需要特殊护理)。评分必须以0或5为终点(例如,10%、15%、20%等)。筛查就诊时具有 uhdrs-is评分>90%的患者对于该研究是不合格的。
[0961]
整体/功能性量表
[0962]
亨廷顿氏病生活质量
[0963]
hd-qol是用于测量健康相关的生活质量的标准化工具(hocaoglu 2012)。其是设计用于hd的经验证的疾病特异性量度,并且可以提供整体健康相关的生活质量的概括评分,以及关于几个离散量表的评分。hd-qol 用于带着hd生存的人;这包括处于hd风险的人,对亨廷顿蛋白基因被测试为阳性但不具有症状的人,以及处于疾病早期至晚期的人。hd-qol 可以贯穿整个hd范围使用。
[0964]
hd-qol和eq5d-5l从基线的变化使用协方差分析(ancova)模型来分析。该模型包括以下固定效果:治疗、中心、使用或不使用安定药和基线hd-qol或eq5d-5l评分。末次观察值结转(last observation carriedforward,locf)应用于提前结束的受试者的这些终点。
[0965]
总运动评分分项评分
[0966]
uhdrs手部运动评分或uhdrs tms手部运动评分
[0967]
手部运动评分被定义为uhdrs领域手指敲击、手掌向下-手掌向上和 luria(握拳-伸手-翻掌测试)的总和。
[0968]
uhdrs步态和平衡评分或uhdrs tms步态和平衡评分
[0969]
步态和平衡评分被定义为uhdrs领域步态、足尖足跟衔接行走和后退拉力测试的
总和。
[0970]
uhdrs改良的运动评分或uhdrs tms改良的运动评分
[0971]
uhdrs-mms被定义为来自uhdrs-tms的以下领域的总和:构音障碍、舌部突起、手指敲击、手掌向下-手掌向上、luria、僵硬、动作迟缓、步态、足尖足跟衔接行走和后退拉力测试。
[0972]
uhdrs舞蹈病或uhdrs tms舞蹈病
[0973]
在uhdrs中,根据以下项目中的每一项将最大舞蹈病评分为从0(不存在)至4(显著的/延长的):面部、嘴部、躯干、右上肢、左上肢、右下肢和左下肢。最大舞蹈病是所有评分的总和。
[0974]
uhdrs肌张力障碍或uhdrs tms肌张力障碍
[0975]
在uhdrs中,根据以下项目中的每一项将最大肌张力障碍评分为从 0(不存在)至4(显著的/延长的):躯干、右上肢、左上肢、右下肢和左下肢。最大肌张力障碍是所有评分的总和。
[0976]
响应者的tms比例
[0977]
响应者的百分比,响应者被定义为在第26周具有uhdrs-tms从基线变化≤0的患者。
[0978]
其他运动评估
[0979]
多发性硬化症行走量表
[0980]
多发性硬化症行走量表(msws-12)被调整以变成对行走和可动性的通用量度,并且被改名为walk-12。
[0981]
欧洲生活质量-3维(3个等级)
[0982]
在1990年引入eq5d 3等级版本(eq5d-3l)(euroqol group 1990)。它基本上由eq5d描述体系和eq视觉模拟量表(eq vas)组成。eq5d-3l描述体系包括以下5个维度:可动性、自我护理、日常活动、疼痛/不适和焦虑/抑郁。在开发5l时,保留了原始eq5d-3l的5维结构,但将每个维度的等级基于euroqol group进行的定性和定量研究扩大至5个等级。每个维度的标签是:无问题、轻微问题、中度问题、严重问题和无法胜任的/极严重问题。eq-vas仍然是eq5d-5l不可缺少的部分,但被调整以使其对使用者更友好。要求响应者在5个维度中的每一个中选择最合适的陈述来指示他/她的健康状态。eq vas在垂直、视觉模拟量表上记录响应者自我评定的健康,其中终点被标记为―最佳可想象的健康状态”和―最差可想象的健康状态”。该信息可以用作如由各个响应者判断的健康结果的定量量度。应注意,数字1-3没有算术属性并且不应用作主要评分。如果需要,患者可以在护理人员/信息提供者的帮助下完成eq5d。
[0983]
定量运动(q-motor)评估
[0984]
使用不同的q-motor评估可以客观地评估运动缺陷。所有的q-motor 评估基于遍布多中心临床研究中的多个阶段和位置应用预先校准的和温度控制的力换能器和具有高灵敏度和重测(test-retest)可靠性的3维位置传感器。因此,q-motor量度旨在降低分类性临床评定量表的有限灵敏度、评定者内和评定者间的变化性和在量表诸如uhdrs-tms中观察到的安慰剂作用。此外,q-motor评估允许客观监测临床研究中的非预期的运动副作用。因此,q-motor是一种客观、可靠且灵敏的运动功能量度,其没有评定者偏见并且限制了安
慰剂作用的影响。图36a-36b示出了正常患者、具有轻度缺陷的患者和具有严重缺陷的患者的q-motor敲击测量值。在追踪 (track)-hd中,预先显现和早期hd q-motor敲击缺陷的最大自然史研究与临床评分以及区域性脑萎缩相关(图36a-36b和图37a-37b以及bechtel 2010)。
[0985]
手指运动描述(快速食指敲击)
[0986]
患者将他们的手放在扶手(hand rest)上,其食指位于力换能器上方。试运行(practice run)后开始记录。患者被指示在2个听觉提示之间尽可能快地手指敲击。敲击的开始被定义为力上升高于最大基线水平0.05n。当在再次达到最大基线水平之前敲击降低至0.05n时,敲击结束。敲击持续时间 (td)、启动间间隔(ioi)、峰间间隔(ipi)和敲击间间隔(iti)的持续时间和变化性是对于快速敲击的探索性结果的量度。此外,计算峰敲击力(tf)的变化性作为变化系数,并且确定敲击频率(freq),即在开始第一次敲击和最后一次敲击之间的敲击次数除以两者之间的时间。每只手进行10秒持续时间的5次试验。
[0987]
轮替运动描述(手掌向下/手掌向上敲击)
[0988]
该任务评估了当进行重复性向下/向上运动的手在手掌和手背表面之间交替时手进行敲击的规律性。与快速敲击任务相似,记录了手敲击的力和持续时间。音调提示评估的开始和结束。每只手进行10秒持续时间的5 次试验。
[0989]
uhdrs手掌向下/手掌向上评估
[0990]
评估在身体两侧旋转前臂和手使得手掌朝下(手掌向下)以及旋转前臂和手使得手掌朝上(手掌向上)的能力。
[0991]
手部运动描述和舞蹈运动描述(握力和舞蹈病分析)
[0992]
该任务评估了拇指和食指之间精确夹持的等距握力的协调。评估夹持开始、物体运输和静态保持阶段期间的握力。患者被指示以拇指和食指之间的精确夹持抓住和举起配备有力换能器和3维位置传感器的装置并且保持其稳定地邻近10cm高的标志物。记录握力和物体的3维位置和方向。计算在第一次提示音后8秒开始的15秒期间的静态平均等距握力和握力变化(被表示为变化系数=标准偏差[sd]/平均值
×
100)(gfv-c)。每只手进行 20秒持续时间的5次试验。计算―位置指标”和―方向指标”来评估舞蹈病。通过提示音示意评估的开始和结束。
[0993]
脚运动描绘(快速脚敲击)
[0994]
患者将脚放在脚用装置上,使得跖球位于力换能器上方。试运行后开始记录。患者被指示在2个听觉提示之间尽可能快地用脚敲击。敲击的开始被定义为力上升高于最大基线水平0.05n。当敲击在再次达到最大基线水平之前降低至0.05n时敲击结束。td、ioi、ipi和iti的持续时间和变化性是用于快速敲击的探索性结果的量度。此外,计算峰tf的变化性作为变化系数,并且确定敲击freq,即在开始第一次敲击和最后一次敲击之间的敲击次数除以两者之间的时间。每只脚进行10秒持续时间的5次试验。
[0995]
计时起立行走测试
[0996]
tug是用于评估人的可动性的简单测试,并且需要静态平衡和动态平衡两者。其使用人从椅子上站立、行走3米、转身、走回椅子并坐下需要时间。在测试期间,预期人穿其常规鞋类并使用他们通常需要的任何动作辅助物。tug通常用于老年人群体,因为其易于实施并且大部分老人通常可以完成。该测试是快速的,不需要特殊的设备或训练,并且易于作为
常规医学检查的部分被包括(podsiadlo 1991)。已经建议tug测试与uhdrs 结合使用用于hd的临床研究(rao 1991)。
[0997]
hd-认知评价量表(cab)
[0998]
cab可以用于检测症状性的―预知(pro-cognitive)”效果(6个月-1年)和认知下降的减慢速率(>1年)。在开始治疗后的6个月-12个月内,cab对测量―预知”效果特别有用,并且在超过1年里,cab对检测认知下降的减慢速率特别有用。cab涵盖hd中影响最大的领域,使用具有良好心理测量性质的测试。以下六节描述了作为简单cab的一部分的测试。
[0999]
1.符号数字模态测试
[1000]
sdmt是精神运动速度(psychomotor speed)和工作记忆(workingmemory)的纸笔测试。参与者观察含有符号-数字配对的纸顶部的―密钥”。纸的剩余部分显示成排的符号,并且参与者有90秒书写与每个符号匹配的相对应的数字。
[1001]
2.情绪识别
[1002]
使用计算机展示的描绘6种基本情绪或自然表情的照片来检查对情绪的面部表情的情绪识别。要求参与者通过选择词语恐惧、厌恶、开心、悲伤、惊讶、愤怒和自然(neutral)来指示每张照片中表达的情绪(每种情绪10 次刺激)。
[1003]
3.连线测试a和b
[1004]
视觉注意力和任务转换使用连线测试来评估,该连线测试由标准纸张上的25个圆圈组成。对于试验a,需要参与者尽可能快地以递增编号顺序连接含有数字的圆圈。对于试验b,参与者要尽可能快地以递增顺序在数字和字母之间交替地连接含有数字和字母的圆圈(例如,1、a、2、b、3、 c等)。试验a仅用作训练的一部分。(bowie 2006)。试验a仅用作训练的一部分。
[1005]
4.霍普金斯言语学习测试,修订版
[1006]
hvlt-r提供了对言语学习和记忆(识别和回忆)的简单评估。其易于实施和评分,并且甚至被极大损伤的个人良好耐受。其作为言语学习和记忆的量度的用途已经由脑障碍群体(例如,阿尔茨海默病、hd、失忆症)验证。每个表格由12个名词(目标)的列表组成,其中从3种语义类别中的每一个类别中抽取4个词。6个表格间的语义类别不同,但这些表格在其心理测量性质方面非常相似。获得对于全面回忆、延迟回忆、保留(%保留)和识别辨别指数(recognition discrimination index)的原始评分。hvlt-r具有高的重测可靠性,并且其构想、同步和辨别有效性已被充分确立。获得对于学习试验1-3(即全面回忆)和试验4(例如延迟回忆试验)的原始评分。
[1007]
5.节奏敲击测试
[1008]
在节奏敲击测试(也被称为ptap)中评估精神运动功能。参与者以3.0 hz在拇指之间交替敲击左鼠标按键和右鼠标按键。他们先聆听在期望的敲击速率呈现的音调,然后开始敲击成该音调。在敲击该音调11次后,中断音调重复,且参与者尝试继续以相同的速率敲击直到试验结束(之后31次敲击)。
[1009]
6.剑桥的一次触摸长袜测试(one touch stockings of cambridge)(ots)
[1010]
ots是空间规划任务,其给出额叶功能的量度。ots是剑桥长袜任务的变化形式,并且对工作记忆提出更高的要求,因为参与者必须想象解决方案。与剑桥长袜一样,向参与者示出含有3个彩色球的2个显示器。这些显示器以这样的方式成像,该方式使得它们可以被
易于被感知为堆叠的彩色球被保持在悬挂于横杆的长袜或短袜中。该布置使所涉及的3维概念对参与者是明显的,并且与言语指示配合。沿屏幕底部存在一排编号的盒子。测试管理者首先向参与者演示如何使用下方显示器中的球复制上方显示器中的模式,并完成1个演示问题,其中解决方案需要1次移动。然后参与者必须完成3个另外的问题,每1个问题各自需要2次移动、3次移动和4次移动。接下来,向参与者示出另外的问题,并且其脑中必须计算出这些问题的解决方案需要多少次移动,然后触摸屏幕底部的合适的盒子以指示其响应。
[1011]
问题行为评估-简化形式(pba-s)
[1012]
由于hd中精神症状的显著性,建议在任何需要行为评估的所有hd 研究中使用pba-s表格作为对hd中最常见的精神症状的全面筛选。(craufurd 2001,kingma 2008)。pba-s还包括与自杀行为(hd中的具体忧虑) 有关的问题。pba-s基于与uhdrs行为问题相同的核心行为症状的集合,其先前用作大部分hd研究中的整体精神量度。pba-s在实施和评分方面具有更详细的问题和更具体的指导。
[1013]
pba-s是简单的半结构化访谈,其涵盖hd的最常见的行为和精神表现。访谈不限于单一构想,而是涵盖与hd有关的若干广泛症状领域,包括11个项目:情绪低落、自杀意念、焦虑、易怒、愤怒/攻击性行为、动机丧失、持续型思考或行为、强迫症性行为、偏执型思考、幻觉、提示迷失方向的行为。根据详细的评分标准在5点量表上评定每个症状的严重程度,该评分标准大致对应于以下:0=―完全没有”,1=微不足道,2=轻度, 3=中度(扰乱每天的活动)和4=严重或无法忍受。还根据如下的5点量表来对每个症状的频率评分:0=无症状,1=少于一周一次,2=一周至少一次,3=大部分日子(多达且包括每天的某部分)和4=所有日子,每天。将严重程度和频率评分相乘以产生每个症状的整体―pab评分”。
[1014]
安全性评估
[1015]
在该实施例中,由合格的研究人员通过评价以下内容来评估安全性:报道的ae、临床实验室测试结果、生命体征测量、ecg结果、身体和神经检查结果(包括体重)和并行药物使用。
[1016]
临床实验室测试
[1017]
进行如下文列出的临床实验室测试(包括电解质的血清化学、血液学和尿液分析)。
[1018]
进行以下血清化学测试:钙;磷;钠;镁;钾;氯化物;碳酸氢盐或二氧化碳;葡萄糖;血尿素氮;肌酸酐;胆固醇;尿酸;alt;ast(天冬氨酸氨基转移酶);乳酸脱氢酶;γ-谷氨酰基转肽酶(ggt);碱性磷酸酶;肌酸磷酸激酶(在肌酸磷酸激酶升高的情况下,应测量mb级分);总蛋白;白蛋白;总胆红素;直接胆红素;间接胆红素和催乳素。
[1019]
进行以下血液学测试:血红蛋白;血细胞比容;红细胞(rbc)计数;血小板计数;白细胞(wbc)计数和差异计数;中性粒细胞绝对计数;淋巴细胞绝对计数;嗜酸性粒细胞绝对计数;单核细胞绝对计数;嗜碱性粒细胞绝对计数和非典型淋巴细胞绝对计数。尿液分析包括以下测试:蛋白质;葡萄糖;酮;血(血红蛋白);ph;比重;白血球酯酶、显微镜可见的物质 (microscopic);细菌;rbc;wbc;管状物(cast)和晶体。
[1020]
生命体征
[1021]
测量生命体征,包括脉搏、血压和体温。
[1022]
药代动力学和药物基因组学的评估
[1023]
主要pk量度是确定普利多匹定的血浆浓度。浓度也被整合到普利多匹定群体pk模型中并且计算研究患者的个体暴露(cmax和auc)。
[1024]
血液取样和处理
[1025]
在以下就诊时,在研究药物施用之前,上午经由静脉穿刺或留置导管收集血液样品(每个4ml)用于血浆浓度的确定:
[1026]
滴定期:第0天(基线)——首次给药前和首次给药后1小时至2小时和第14天——下午给药后1小时至2小时。全治疗剂量期:第28天——下午给药前和下午给药后1小时至2小时、第42天——下午给药前和下午给药后1小时至2小时、第84天——下午给药后1小时至2小时、第112天——下午给药前和下午给药后1小时至2小时、第140天——下午给药后 1小时至2小时、第182天——上午给药前,以及随访-就诊。
[1027]
样品的分析
[1028]
使用合适的经验证的对于普利多匹定及其主要代谢物tv-45065(先前被称为acr30)方法来分析样品。血浆中的普利多匹定和tv-45065的定量的下限分别为约1.6ng/ml至1.8ng/ml和1.5ng/ml至1.9ng/ml。
[1029]
药物基因组学变量
[1030]
在筛查就诊时将血液样品(10ml)收集在2个乙二胺四乙酸二钾 (k2edta)的塑料瓶中用于遗传分析。分析包括cag重复、cyp2d6状态和遗传性长qt综合征、或任何其他与普利多匹定响应或hd有关的遗传分析。
[1031]
主要功效分析
[1032]
使用重复测量模型(用repeated子命令的mixed程序)分析 uhdrs-tms从基线的变化。该模型包括以下固定效果:研究中通过治疗交互作用分类的周(categorical week in study by treatment interaction)、中心 (center)、使用或不使用安定药和基线uhdrs-tms评分。使用用于患者内的重复观察的非结构化协方差矩阵。在模型不收敛的情况下,使用最大似然(ml)评估方法而非默认的受限ml(reml)。如果模型仍然不收敛,则根据以下顺序使用具有较少参数的更简单的协方差结构:异质自回归 (1)[arh(1)]、异质复合对称(heterogeneous compound symmetry)(csh)、自回归(1)[ar(1)]和复合对称(cs)。在第26周就诊时,比较主动治疗臂和安慰剂臂之间的uhdrs-tms从基线的变化的估计的平均值。
[1033]
灵敏度分析
[1034]
如下进行灵敏度分析以评价在uhdrs-tms方面观察到的效果是否是由舞蹈病uhdrs-tms分项评分、肌张力障碍uhdrs-tms分项评分或不自主运动(舞蹈病+肌张力障碍)uhdrs-tms分项评分驱动的:
[1035]
计算三个变量:(1)除舞蹈病项目外的uhdrs-tms项目的总和从基线到第26周和第52周的变化,(2)除肌张力障碍项目外的uhdrs-tms项目的总和从基线到第26周和第52周的变化,和(3)除舞蹈病和肌张力障碍项目外的uhdrs-tms项目的总和从基线到第26周和第52周的变化。除了在模型中包括基线处的变量评价而非基线uhdrs-tms外,以与主要功效终点相同的方式分析这些变量。
[1036]
药代动力学分析
[1037]
关于普利多匹定和主要代谢物tv-45065的血浆浓度数据由普利多匹定剂量并且
也由cyp2d6代谢状态通过描述性统计学来呈现。浓度也被整合到普利多匹定群体pk模型中并且计算研究患者的个体暴露(c
max
和 auc)。
[1038]
[1039]
[1040][1041]
亨廷顿氏病的阶段
[1042]
许多临床医师和诊断医生采用基于tfc评分的shoulson和fahn评定量表来跟踪hd
的进展。该评定量表将总tfc评分分为疾病的五个阶段,较低级的阶段指示更完整的功能行使。下表4提供了tfc评分、从诊断起的平均年数以及疾病的每个阶段的典型护理水平的大致指导。(johnson 2014)。下表5示出了参与研究的每个tfc阶段的患者的数目。
[1043]
表4.
[1044][1045]
阶段1或阶段2的患者具有最陡峭的自然下降速率,并且对本技术中描述的临床措施是最敏感的。tfc和hd-cab评估被设计为专门用于阶段 1或阶段2及更早的患者。阶段3、阶段4或阶段5的患者通常难以完成评估,地板和天花板(floor and ceiling)限制了跟踪变化的能力,并且具有非常显著的脑组织损失。
[1046]
如本文使用的,早期hd意指如上表4定义的阶段1或阶段2hd(bltfc≥7)。
[1047]
表5.研究中患者的hd阶段
[1048][1049][1050]
结果
[1051]
该实施例的结果在图1-图47和下表6中示出。
[1052]
表6.
[1053][1054]
在52周内未示出tfc下降的受试者的比例的显著差异在用每天两次 45mg治疗的患者和接受安慰剂的患者之间观察到。
[1055]
功能性、探索性终点和安全性的初步分析的概述:
[1056]
不依赖于评定者偏见的终点不太倾向安慰剂效应,诸如q-motor评估。检测到的信号表明普利多匹定的生物学效应。在26周的治疗后,总功能能力(tfc)示出了有利于普利多匹定的趋势。尽管高剂量,但不存在重要的安全性发现。
[1057]
tfc评分的初步结果-考虑因素
[1058]
在安慰剂组中观察到6个月时约0.5点的预期恶化。历史数据指示,患有hd的患者中tfc每年恶化约1个点。tfc在第12周至第20周开始示出与安慰剂分离,并且在第26周分离变成一种强烈的趋势。tfc数据支持这一发现,即普利多匹定导致功能下降的进展延迟。图42示出了在不同的疾病阶段tfc恶化的图示。
[1059]
不希望受该理论束缚,当治疗早期患者(包括阶段1和阶段2)时,图中所示的治疗效果更加明显,尤其是具有大于或等于7的基线tfc的早期患者,并且在阶段1中(bl tfc=11-13)更加如此。不希望受该理论束缚,这对于tfc财务和adl、tfc家务、肌张力障碍、不自主运动(肌张力障碍和舞蹈病)、步态和平衡是特别真实的。具有11-13的基线tfc评分的罹患hd的患者被认为是阶段1hd患者。
[1060]
该实施例中可能的安慰剂效应贡献因素
[1061]
以下项目可以解释该实施例中观察到的安慰剂效应:评定者偏见、患者对hd缺乏希望、以及对有效治疗的高期望和对好转的期望,普利多匹定治疗的总体正向数据导致了高期望,患者具有80%的机会接受积极治疗,大量丸剂可能导致研究期间预期、方案改变,以及每次就诊的评估数目。
[1062]
肌张力障碍
[1063]
本技术中例示的总体肌张力障碍治疗代表以下类型的肌张力障碍的治疗:早发性全身性肌张力障碍(dyt1和非dyt1)、局灶性肌张力障碍、音乐家肌张力障碍、多巴响应性肌张力障碍、肌阵挛性肌张力障碍、阵发性肌张力障碍和运动障碍、x-连锁肌张力障碍-帕金森综合征、快速发作性肌张力障碍-帕金森综合征、继发性肌张力障碍、hd患者的肌张力障碍和精神性肌张力障碍。特别地,本发明涉及治疗hd患者例如早期(阶段1或阶段2)hd患者中的肌张力障碍。
[1064]
讨论
[1065]
普利多匹定功效
[1066]
先前已在2项大型、双盲、安慰剂对照研究(hart和mermaihd)中证明了普利多匹定
在患有hd的患者中的运动功能益处。两项研究的主要终点是mms。两项研究提供了关于uhdrs-总运动评分(tms)的有益效果的证据,证明了与安慰剂相比,有利于每天两次(bid)45mg普利多匹定的差异。在2项研究的混合分析中,在第12周和第26周,与安慰剂相比每天两次45mg普利多匹定显著改善了tms(landwehrmeyer 2011)。 pride-hd研究使用tms从基线到第26周的变化作为主要终点,以进一步评价范围从每天两次45mg至每天两次112.5mg的剂量的普利多匹定的效果。
[1067]
pride-hd研究招募了处于所有疾病阶段(即早期和晚期)的患者,并且用普利多匹定治疗的患者群体的72%处于疾病的早期(阶段1和2hd;基线tfc评分为7至13(hd1和hd2))。在hd的早期期间,许多hd临床量表和评估工具对随时间的变化是最敏感的。由于大的安慰剂效应, pride-hd没有达到与安慰剂相比的主要终点。然而,对来自pride-hd 研究的数据的分析证明,与接受安慰剂的那些患者相比,接受每天两次45 mg普利多匹定的患者的uhdrs-tfc评分中下降较少(没有应用对于多重比较中的i型错误校正)。该效果在患有早期hd的患者中是最明显的。
[1068]
图1和图2是示出治疗的20周内患者血液中普利多匹定浓度(ng/ml) 测量值的图。
[1069]
图3-图5b是示出uhdrs tms随时间变化的图。越小的数字代表改善。图3示出了ride-hd研究中剂量之间的比较。图4以uhdrs tms 示出了安慰剂效应,在pride-hd研究中安慰剂效应比mermaihd或 hart研究中大。图5a示出了与mermaihd和hart研究中的安慰剂相比,对于pride-hd研究中每天两次45mg普利多匹定和每天两次90mg 普利多匹定两者的uhdrs tms的改善。图5b示出了对于在52周内每天两次45mg普利多匹定,uhdrs-tms的总体改善。
[1070]
uhdrs总功能能力(uhdrs tfc)
[1071]
本技术中的数据证明,普利多匹定示出了对hd进展的影响,如通过总功能能力(tfc)测量的。对tfc的该影响在全分析集中是统计学上显著的,并且在早期hd患者中更加明显。早期hd患者被定义为具有大于或等于7的基线(bl)tfc评分的那些患者(阶段1和阶段2)。
[1072]
在全分析集(fas)和早期hd亚群两者中,在52周与施用安慰剂的患者相比,施用一定剂量的普利多匹定的患者之间存在uhdrs tfc的显著减缓。患有早期hd(基线7-13)、接受普利多匹定的患者比患有晚期hd(基线0-6)、接受普利多匹定的患者具有更加乐观的tfc结果。在26周观察到的对tfc的影响在早期亚群中达到显著水平(图10b和图20b)。在52周观察到的对tfc的影响在早期亚群中达到显著水平(图10d、图11d、图21j、图31b)。
[1073]
例如,图10c、图21j和图31a中示出的安慰剂组的tfc每年下降与文献中报道的和历史安慰剂臂中观察到的tfc每年下降相当。如通过例如图10b、图10d、图21b、图21j、图21n和图31b中示出的,给予安慰剂的患者中的tfc恶化在患有早期hd的患者中更高。如通过tfc测量的,该数据示出hd的临床进展减慢,并且在十一(11)个其他临床试验中是第一个如此表现的临床试验。在第26周的uhdrs tfc(图21b)、在第26周的tfc财务(图12b、图21d、图21f)、在第26周的tfc财务和adl(图 11b、图21d)、在第26周的tfc adl(图21h)和在第52周的uhdrs tfc(图 21j)、在第52周的tfc财务(图21n)、在第52周的tfc财务和adl(图 11e、图21l)、在第52周的tfc adl(图21p)方面观察到显著性。
[1074]
uhdrs独立性量表(uhdrs is)
[1075]
uhdrs-is包括uhdrs功能评估的一部分(huntington study group1996)。它是一种评定量表,其中患者的独立性程度以百分比给出,从 10%(管喂,完全卧床护理)至100%(不需要特殊护理)。评分必须以0或5 为终点(例如,10%、15%、20%等)。在筛查、基线、第4周、第12周、第20周、第26周/提前终止、第28周和第52周/提前终止时的量表被评估。
[1076]
第52周uhdrs-is中从基线的变化在图9e中示出。在第52周评估的uhdrs-is从基线的变化在治疗组之间下降,但在任何治疗组中不是统计学上显著的。对于安慰剂组,在第52周的is存在下降(指示下降的趋势)。在早期hd患者(基线tfc评分≥7)中在第52周观察到期望方向的有利趋势(参见图20d)。对于具有基线tfc<7的患者没有注意到临床上有意义的变化。独立性量表支持tfc效应,它提供了终点的收敛。
[1077]
uhdrs tms和运动终点
[1078]
运动效应在阶段1亚群中是统计学上显著的。例如,对于总tms、不自主运动(肌张力障碍、舞蹈病)、移动(tms步态和平衡、计时起立行走、 walk 12),在hd阶段1患者亚组中观察到统计学上显著的变化。移动的改善可能促成了tfc数据。
[1079]
在全分析集中,大的安慰剂响应掩盖了运动效果。然而,在早期hd 中,在第26周(图8b)和第52周(图8d)存在由较低的安慰剂效应驱动的tms 的统计学上显著的影响。hd阶段1患者中如通过tms测量的不自主运动 (舞蹈病和肌张力障碍)在26周改善(图8n)。影响也持续到52周(图8p)。
[1080]
主要在每天两次45mg和每天两次90mg的情况下观察到影响,表明非线性剂量响应。
[1081]
此外,在施用每天两次45mg普利多匹定的早期患者中观察到对移动 (诸如步态、计时起立行走、和爬楼梯)的有利影响(参见例如图18b、图18d、图19b、图19d)。
[1082]
pba-s
[1083]
pba-s是简单的半结构化访谈,其涵盖hd的最常见的行为和精神表现。访谈不限于单一构想,而是涵盖与hd有关的若干广泛症状领域,包括11个项目:情绪低落(抑郁)、自杀意念、焦虑、易怒、愤怒/攻击性行为、动机丧失(冷漠)、持续型思考或行为、强迫行为、偏执型思考、幻觉和提示迷失方向的行为。根据详细的评分标准由5点量表评定每个症状的严重程度,该评分标准大致对应于以下:0=―完全没有”,1=轻微,2=轻度, 3=中度(扰乱每天的活动)和4=严重或无法忍受。也根据如下的5点量表来对每个症状的频率评分:0=无症状,1=少于一周一次,2=一周至少一次,3=大部分日子(多达且包括每天的某部分)和4=所有日子,每天。
[1084]
将严重程度和频率评分相乘(在将0-4范围之外的所有值设置为缺失后) 以产生针对每个症状的整体―pba-s评分”。总pba评分通过跨症状/领域的所有pba-s评分的总和来计算。
[1085]
pba-s评估值在基线、第4周、第12周、第26周和第52周收集。
[1086]
pba-s领域和总评分从基线到第26周的变化没有示出有意义的结果 (图17a-图17d、图17i)。然而,pba-s总评分以及若干pba-s领域从基线到第52周的变化示出了改善的趋势或显著的改善(图17d-图17h)。在全分析集中,与安慰剂组相比,每天两次45mg普利多匹定组的pba-s总评分在52周示出了改善的趋势(相对于安慰剂δ3.98点,p=0.0603,n=75)(参见图17e-图17f)。图17j和图17l分别示出了早期患者中在26周和52周 pba冷漠改善
的趋势。图17r示出了每天两次45mg的早期患者分别在26 周pba迷失方向的显著改善。
[1087]
hd-认知评价量表
[1088]
ride-hd研究是第一个包括hd-认知评价量表(hd-cab)评估的大型研究(stout等人2014)。hd-cab被设计以检测预先显现延迟的hd1和 hd2患者中的症状性的―前认知”效果(6个月-1年)和认知下降的速率减慢 (>1年)。它涵盖hd中被影响最大的认知领域,使用具有良好心理测量性质的测试。集合包括以下测试:符号数字模态测试、情绪识别、连线测试 b、霍普金斯言语学习测试(修订版)、3hz的节奏敲击和剑桥一触式长袜测试。
[1089]
对于hd-cab的6个领域,不存在改善或下降的恒定模式,如通过普利多匹定或安慰剂治疗组的从基线的平均变化证明的。
[1090]
在第52周在全分析集中观察到对于每天两次45mg的治疗组的3hz 的节奏敲击评估(精神运动功能的量度)的积极结果,该结果指示从基线的潜在改善(参见图41d)。
[1091]
实施例2:普利多匹定对患有亨廷顿氏病的患者的功能能力的影响
[1092]
目标
[1093]
为了探索用开放标签普利多匹定90mg/天治疗持续36个月 (open-hart)的患者中通过总功能能力(tfc)量表测量的功能下降,并将结果与纳入hsg赞助试验(care-hd和2care)的安慰剂患者的历史群组进行比较。
[1094]
背景
[1095]
患有hd的患者经历运动、认知和行为症状,导致严重的长期失能。 tfc(范围0-13,高评分指示更大的能力)评价患者的工作、处理财务和家务、进行日常生活活动和独立生活的能力,并且对失能的早期变化是最敏感的。tfc用于open-hart和辅酶q10研究,care-hd和2care。
[1096]
方法
[1097]
该分析比较了接受普利多匹定90mg/天的open-hart群组(n=50)和 care-hd(n=80)和2care(n=213)的安慰剂臂,而不关于基线特征匹配。对于该分析,使用来自open-hart和2care的在基线、12个月、24个月和36个月的tfc评分,以及来自care的在基线、12个月、25个月和30个月的tfc评分。
[1098]
结果
[1099]
在基线,与care-hd和2care群组相比,open-hart群组具有最低的tfc评分绝对平均值(sd)[分别为10.3(1.7)、11.05(1.47)和9.14 (2.78)]。
[1100]
在12个月tfc从基线的平均变化是open-hart:-0.49(1.60),care:
ꢀ‑
1.00(1.48)和2care:-1.11(1.62);在24个月(open-hart和2care) 和25个月(care)分别是:-1.00(1.92),-1.80(2.06)和-2.24(1.91);在36 个月(open-hart和2care)分别是:-1.68(2.22)和-2.54(2.53);并且在 30个月(care)是:-2.80(2.27)。
[1101]
结果示出,与care-hd和2care中接受安慰剂的患者相比, open-hart中接受普利多匹定的患者中的tfc下降随时间更慢。观察到 tfc下降的减慢,这表明普利多匹定具有神经保护和/或疾病调节性质。
[1102]
实施例3:3期研究
[1103]
提议的3期研究是一项78周、多中心、随机化、双盲、安慰剂对照的、平行组研究,以评价在患有早期hd的成人患者中以每天两次45mg 的剂量施用普利多匹定的功效和安全
性。
[1104]
研究由以下组成:筛查期(多达8周);两周的滴定期;76周、双盲、全剂量治疗期;和随访期(包括在治疗就诊结束后3周至4周的研究就诊终点)。
[1105]
在筛查期期间,患者提供知情同意,并且随后经历评估以确定参与研究的资格。hd的阶段由uhdrs tfc量表确定。评估tms和uhdrs-is。 tms评估经训练的评定者现场评定,并且还被录像以便由独立的不知情第三方(独立裁决委员会(iac))进行中心评定。iac在批准任何患者用于随机化之前,通过审查筛查时收集的所有信息,包括患者病史,使评定者偏见和筛查期间的错误最小化。
[1106]
邀请有资格的患者返回基线就诊和基线评估。对于参与研究仍然有资格的那些患者将被随机分配(1:1比例)到2个治疗组中的1个:每天两次45 mg普利多匹定或每天两次安慰剂。对于被分配接受普利多匹定的患者,在前2周期间,剂量从每天一次45mg滴定至每天两次45mg普利多匹定的最终剂量。
[1107]
在滴定期间(第0天至第14天),患者在第二周期间接受1个预定的电话通话(tc)。患者在第26周、第52周和第78周参加现场临床就诊以用于安全性和功效测量,并被血液取样用于药代动力学评估。在第3周、第6 周、第12周、第39周和第65周,由一名访问护士在家或在诊所进行安全性就诊以用于安全性评估。患者在每次在家或现场临床就诊后约6周至 7周接受1次预定的tc。在这些tc期间,患者被问及以下问题:不良事件、并行药物、酒精/药物的使用、研究药物的耐受性、苯二氮卓类和抗抑郁药的使用以及依从性。评估了c-ssrs(自上次就诊的版本)和简略的 pba-s(pba-s问题的子集,关于抑郁情绪、自杀意念、焦虑、易怒、动机丧失和强迫行为)。
[1108]
完成所有预定就诊的患者在治疗就诊结束时(第78周)进行最终程序和评估。在完成评价期之前退出研究的患者将在其最后就诊时进行第78周程序和评估,这被视为其提前终止就诊。
[1109]
在研究药物最后给药后约3周至4周,存在现场研究就诊的终点,以评价功效、安全性(包括单一ecg)、药代动力学、反弹和依赖性。
[1110]
主要终点:
[1111]
待评价的主要功效终点是与接受安慰剂的患者相比,用每天两次45 mg普利多匹定治疗的患者在第78周的tfc从基线的变化。主要功效分析使用线性混合模型对重复量度进行,以主要终点(tfc)从基线的变化作为修改的意图治疗群体(具有至少一次基线后tfc评估的随机化患者)的因变量。模型包括就诊(4个等级:第12周、第26周、第52周和第78周)、治疗组、治疗组交互作用就诊(visit by treatment group interaction)、国家、hd 阶段(hd1或hd2)和作为固定因素的安定药使用(是或否),并且包括相应的基线评分作为协变量。使用非结构化协方差矩阵用于患者内的重复观察结果,并且使用kenward-rodger方法以计算分母的自由度。tfc的主要分析将比较每天两次45mg普利多匹定组和安慰剂组之间从基线到第78 周的变化。较低的评分比较高的评分指示更严重的功能损伤。
[1112]
次要终点:
[1113]
两个次要终点基于观察到pride-hd的基于证据的趋势来选择。
[1114]
1.与接受安慰剂的患者相比,接受每天两次45mg普利多匹定的患者的uhdrs tms从基线到第78周的变化。
[1115]
tms是用于追踪患有hd的患者的运动症状进展的标准和公认的临床工具(huntingtonstudygroup1996)。uhdrs的运动部分评估hd的运动特征,对眼球运动功能、构音障碍、舞蹈病、肌张力障碍、步态和姿势稳定性进行标准化评定。tms是31项单个运动评定的总和,根据5点量表从0(正常)至4(最大异常)评定每个评估对象。较高的评分比较低的评分指示更严重的运动损伤。
[1116]
来自hart和mermaihd研究的结果表明普利多匹定在改善hd的运动症状方面的潜在益处(deyebenes2011;huntingtonstudygrouphartinvestigators2013)。在pride-hd研究中,tms在第26周示出在所有剂量的改善,但没有达到统计学显著性,可能是由于高且持续的安慰剂效应,从而掩盖了评估普利多匹定的潜在的运动功能益处的能力。目前提议的研究并入了若干措施,以最小化安慰剂效应,并且允许对普利多匹定提供运动功能益处的潜力进行准确评估。
[1117]
2.与接受安慰剂的患者相比,接受每天两次45mg普利多匹定的患者的冷漠评价量表(aes)从基线到第78周的变化。冷漠是hd中最普遍的神经行为症状之一,发生在约50%-70%的有症状的hd群体中,并且随着疾病进展增加。症状包括缺乏兴趣和动机、无法开始活动、社交退缩和情绪单调。患有hd的患者的冷漠评分与疾病的持续时间高度相关,表明冷漠是晚期疾病的不可避免的后果。虽然冷漠不如抑郁的症状痛苦并且不如易怒或攻击具有破坏性,但对那些罹患hd的患者具有相当大的不良影响,因为它导致了对日常生活质量贡献很大的目标导向行为的减少(krishnamoorthy2011;martinez-hortal2016)。
[1118]
pride-hd研究中的探索性分析揭示,在第52周,与接受安慰剂的患者相比,接受每天两次45mg普利多匹定的早期hd患者中的问题行为评估冷漠分项评分被改善。冷漠的改善将为主要终点,tfc的临床实用性提供收敛的证据(convergentevidence)。aes被开发以测量目标导向行为、目标相关的思考内容和情绪冷淡的异常(marin等人1991)。选择该更全面的量表为次要终点,而pba将仍然作为探索性终点。
[1119]
控制1型错误的bonferroni-holms方法将以以下方式使用:如果达到主要终点,两个次要终点将在α=0.025时同时测试。如果达到这些次要终点中的一个,则随后可以在α=0.05时测试另一个。
[1120]
引用的参考文献
[1121]
alexanderge,delongmr,strickpl.parallelorganizationoffunctionallysegregatedcircuitslinkingbasalgangliaandcortex.annurevneurosci.1986;9:357-81.
[1122]
bechtel,n.etal.,tappinglinkedtofunctionandstructureinpremanifestandsymptomatichuntingtondisease.neurology.2010dec14;75(24):2150-60.
[1123]
bezdiceko,majerovav,novakm,nikolait,ruzickae,rothj.validityofthemontrealcognitiveassessmentinthedetectionofcognitivedysfunctioninhuntington
′
sdisease.applneuropsycholadult.2013;20(1):33-40.
[1124]
bowiecr,harveypd.administrationandinterpretationofthetrailmakingtest.natprotoc.2006;1(5):2277-81.
[1125]
brownm,sinacoredr,binderef,kohrtwm.physicalandperformance
measuresfortheidentificationofmildtomoderatefrailty.jgerontolabiolscimedsci.2000jun;55a(6):m350-5.byrne,lmetal.,neurofilamentlightproteininbloodasapotentialbiomarkerofneurodegenerationinhuntington’sdisease:aretrospectivecohortanalysis,lancetneurolpublishedjune7,2017.
[1126]
carlssona,lindqvistm.effectofchlorpromazineorhaloperidolonformationof3-methoxytyramineandnormetanephrineinmousebrain.actapharmacoltoxicol(copenh).1963;20:140-4.
[1127]
cepedac,cummingsdm,andr
é
vm,holleysm,levinems.geneticmousemodelsofhuntington
′
sdisease:focusonelectrophysiologicalmechanisms.asnneuro.2010apr7;2(2):e00033.
[1128]
coenzymeq10inhuntington
′
sdisease(hd)(2care),clinicaltrials.govidentifier:nct00608881,clinicaltrials.gov/ct2/show/nct00608881?term=2care%20+huntington&rank=1,accessedseptember13,2016.
[1129]
craufurdd,thompsonjc,snowdenjs.behavioralchangesinhuntingtondisease.neuropsychiatryneuropsycholbehavneurol.2001oct-dec;14(4):219-26.
[1130]
dunlopbw,nemeroffcb.theroleofdopamineinthepathophysiologyofdepression.archgenpsychiatry.2007mar;64(3):327-37.
[1131]
dyhringt,nielsensonessonc,petterssonf,karlssonj,svenssonp,christophersenp,watersn.thedopaminergicstabilizerspridopidine(acr16)and(-)-osu6162displaydopamined(2)receptorantagonismandfastreceptordissociationproperties.eurjpharmacol.2010feb25;628(1-3):19-26.
[1132]
exploratorypopulationpharmacokineticmodelingandsimulationswithpridopidine(reportnumber:cp-13013).pharsightconsultingservices,10july2013.
[1133]
guyw.clinicalglobalimpression:ecdeuassessmentmanualforpsychopharmacology.publicationadm-76-338,usdepartmentofhealth,education,andwelfarewashingtondc:usgovernmentprintingoffice.1976:217-22.
[1134]
hobartjc,riazia,lampingdl,fitzpatrickr,thompsonaj.measuringtheimpactofmsonwalkingability:the12-itemmswalkingscale(msws-12).neurology.2003jan14;60(1):31-6.hocaoglumb,gaffanea,hoak.thehuntington
′
sdiseasehealth-relatedqualityoflifequestionnaire(hdqol):adisease-specificmeasureofhealth-relatedqualityoflife.clingenet.2012feb;81(2):117-22.
[1135]
huntingtonstudygrouptrend-hdinvestigators.randomizedcontrolledtrialofethyleicosapentaenoicacidinhuntingtondisease:thetrend-hdstudy.archneurol.2008dec;65(12):1582-9.
[1136]
huntingtonstudygroup.unifiedhuntington’sdiseaseratingscale:reliablilityandconsistency,movementdisorders,,1996,11(2):136-142.
[1137]
huntingtonstudygroup.dosageeffectsofriluzoleinhuntington
′
sdisease:amulticenterplacebo-controlledstudy.neurology.2003dec9;61(11):1551-6.
[1138]
huntingtonstudygroup.tetrabenazineasantichoreatherapyinhuntingtondisease:arandomizedcontrolledtrial.neurology.2006feb14;66(3):366-72.
[1139]
huotp,l
é
vesquem,parenta.thefateofstriataldopaninergicneuronsinparkinson
′
sdiseaseandhuntington
′
schorea.brain.2007jan;130(pt1):222-32.
[1140]
joffresc,grahamj,rockwoodk.qualitativeanalysisoftheclinicianinterview-basedimpressionofchange(plus):methodologicalissuesandimplicationsforclinicalresearch,intpsychogeriatr.2000sep;12(3):403-13.
[1141]
jjohnsonacandpaulsenjs.huntington
′
sdisease:aguideforprofessionals.d.loveckyandk.tarapataeds.2014.huntington
′
sdiseasesocietyofamericas(hdsa)
[1142]
kieburtzk,koroshetzw,mcdermottm,etal.arandomized,placebo-controlledtrialofcoenzymeq10andremacemideinhuntington’sdisease.neurol.2001aug14;57(3):397-404.
[1143]
kingmaem,vanduijne,timmanr,vandermastrc,roosra.behaviouralproblemsinhuntington
′
sdiseaseusingtheproblembehavioursassessment.genhosppsychiatry.2008mar-apr;30(2):155-6
[1144]
krishnamoorthy,a.andcraufurd,d.treatmentofapathyinhuntington’sdiseaseandothermovementdisorders.currenttreatmentoptionsinneurology,2011,13(5):508-19
[1145]
kungvw,hassamr,mortonaj,joness.dopamine-dependentlongtermpotentiationinthedorsalstriatumisreducedinther6/2mousemodelofhuntington
′
sdisease.neuroseience.2007jun8;146(4):1571-80.
[1146]
landwehrmeyerb,marderk,biilmannronnb,haglundmonbehalfofthemermaihdandhartstudyinvestigators.effectsofthedopaminergicstabilizerpridopidineonmotorsymptomsinhuntington
′
sdisease:ameta-analysis.presentedattheworldcongressonhuntington
′
sdisease,11-14september2011,melbourne(australia).
[1147]
mahantn,mccuskerea,bythk,grahams;huntingtonstudygroup.huntington
′
sdisease:clinicalcorrelatesofdisabilityandprogression.neurology.2003oct28;61(8):1085-92.
[1148]
marderk,zhaoh,myersrh,cudkowiczm,kaysone,kieburtzk,ormec,paulsenj,penneyjbjr,siemerse,shoulsoni.rateoffunctionaldeclineinhuntington
′
sdisease.huntingtonstudygroup.neurology2000;54:452-58
[1149]
marinrs,biedrzyckirc,firinciogullaris.reliabilityandvalidityof
outpatients.thephysicalperformancetest.jamgeriatrsoc.1990oct;38(10):1105-12.
[1161]
stoutjc,quellers,bakerkn,cowlishaws,sampaioc,fitzer-attasc,borowskyb;hd-cabinvestigators.hd-cab:acognitiveassessmentbatteryforclinicaltrialsinhuntington
′
sdisease.movdisord2014;29(10):1281-8.
[1162]
stroopjr.studiesofinterferenceinserialverbalreactions.jexppsychol1935;18:643-62.theeuroqolgroup.euroqol-anewfacilityforthemeasurementofhealth-relatedqualityoflife.healthpolicy1990;16:199-208.
[1163]
waterss,petterssonf,dyhringt,sonessonc,tedroffj,watersnetal.pharmacologyofthedopaminergicstabilizerpridopidine(acr16).clingenet2009;76(s1):74(abstractd10).
[1164]
zhanl,kerrjr,lafuentemj,macleana,chibalinamv,liub,burkeb,bevans,nasirj.alteredexpressionandcoregulationofdopaminesignallinggenesinschizophreniaandbipolardisorder.neuropatholapplneurobiol.2011feb;37(2):206-19.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1