一种湿证动物模型的制备方法
1.本发明属于动物模型技术领域,具体涉及一种湿证动物模型的建立方法。
背景技术:
2.湿证是中医病证名,中医认为湿生百病。因湿性重着、粘滞、易阻碍气机,损伤阳气,故其病变常缠绵留着,不易速去。其症候特点为头胀而痛,脘腹满闷,身重而痛,体倦,舌苔黏腻,脉缓或濡。湿证可分为内湿和外湿,内湿主要因摄食太多肥甘生湿食物,超过脾运化的负荷;外湿主要来源于感受外界环境中的湿邪。内湿和外湿可相互影响,说明内外湿有共同的发病机制。按现代研究,无论内湿外湿,均离不开致病微生物。内湿产生,是因为肥甘生湿食物滋助了肠道内致病微生物的定植、繁殖。外湿的产生,是因为空气或水源中致病微生物侵袭人体呼吸道、消化道粘膜。
3.湿证牵涉到几乎所有的疾病的发生发展,中医对湿证有较详细的症候描述和中医传统术语机制分析,创造了许多治疗湿证的方药,但仍未能清晰阐述湿证特定的病理生理机制,未能获得现代医学的承认。一个重要的原因是还没有一种便捷模拟湿证的症候表现的模型动物,制约了对湿证的病理机制的深入理解,和评价湿证相关新药或干预措施的效果及机制。
4.目前使用最多的湿证小鼠模型造模,以人工候箱加高脂饲料,维持湿度在95%以上,持续20天以上。但因为小鼠个体差异大,有些小鼠并不成模,或离开高湿环境,在数日内恢复正常。有研究在高湿环境和高脂饲料基础上,增加了灌服一定含量的酒或乙醇,前10d予以大鼠高脂饲料,并隔日灌服白酒(10ml/kg),再将大鼠放置于模拟高温高湿环境的人工气候箱中。有研究在高湿环境和高脂饲料基础上,增加了灌大肠杆菌或沙门氏菌。给予大鼠高脂高糖养10d,再放入高温、高湿环境中,于96、120h后灌胃鼠伤寒沙门氏菌,然后移出至自然环境。结果主要症状及体征、发病条件等均近似于中医湿热证型。上述湿证制备方法的繁琐,且条件不统一,制约了湿证机理的研究、湿证动物模型的推广。
技术实现要素:
5.为了克服现有技术的缺点与不足,本发明的主要目的在于提供一种湿证动物模型的制备方法。
6.本发明是通过以下技术方案来实现的:
7.一种湿证动物模型的制备方法,包括如下步骤:
8.(1)在培养基中培养微生物,离心得到菌体,重悬得到菌体悬液备用;
9.(2)准备健康实验动物,腹腔注射菌体悬液;
10.(3)检测实验动物的活动度、大便黏腻程度以及血液中的免疫炎症因子的水平,判断湿证模型是否建立成功。
11.步骤(1)中所述的微生物为致病或条件致病微生物;优选为包括白色念珠菌(candida albicans)、大肠杆菌(esherichia coli)或k.pintolopesii中的至少一种;更优
选为白色念珠菌。
12.当步骤(1)中所述的微生物为真菌时,培养基为ym培养基,当所述微生物为细菌时,培养基为lb培养基。
13.步骤(1)中所述的培养的条件为35~39℃培养20~30h;优选为37℃培养24h。
14.步骤(1)中所述的离心为3000~7000r/min离心5~15min;优选为6000r/min离心10min。
15.步骤(1)中所述的重悬为使用无菌pbs重悬。
16.步骤(2)中所述的实验动物为c57bj/6小鼠、km小鼠和sd大鼠中的至少一种。
17.步骤(2)中所述的腹腔注射为根据实验动物的体重,按0.8~3
×
106cfu/g的菌体量进行注射。
18.步骤(2)中所述的实验动物分为实验组和对照组。
19.步骤(3)中所述的免疫炎症因子包括il-17a和tnf-α中的至少一种;优选为il-17a和tnf-α。
20.步骤(3)中所述的大便黏腻程度的测定方法具体包括如下步骤:
21.将相同质量的粪便放于滤纸上,再加一层滤纸,滤纸上放50克砝码,2分钟后撤去法码,观察上层滤纸上粘有粪便痕迹的面积,测量直径,以直径值大小代表粪便黏湿度。
22.步骤(3)中所述的判断湿证模型的方法为当实验组中的动物相较对照组中活动度下降,大便黏腻程度测试的直径超过对照组的50%以上,且动物血液中免疫炎症因子较正常组升高50%以上时,则证明湿证模型建立成功。
23.所述的湿证动物模型的制备方法在湿证的评价和分析中的应用。
24.本发明相对于现有技术具有如下的效果:
25.采用本发明制作的湿证动物模型的表现与临床上湿证的表现极其相似,以公认的3个评判标准:活动度下降、大便黏腻、血液中免疫炎因子升高为依据,本发明的造模方法,成功率100%。
26.且原有文献记载的造模方法耗时长,操作繁琐,可重复性差。本发明对进一步深入探讨相关中医病证的机理及其干预治疗研究创造条件。
27.相对于现有技术,本发明具有以下优点:
28.(1)采用上述方法制作的湿证动物模型,在6~12小时内即出现四肢懈怠,大便黏腻的湿证症候,建模成功率100%;
29.(2)采用上述方法制作的湿证动物模型的表现与临床上湿证的表现极其相似,而湿证动物模型本身不具有这些表现,故该模型可以认为是一种湿证模型的新发明;
30.(3)本发明的湿证动物模型的建立方法的技术特点是基于肠菌异位引发免疫细胞激活,大量释放致粘致炎因子的机理的基础上,快速制备湿证动物模型。对进一步深入探讨相关中医病证的机理及其干预治疗研究创造条件。
附图说明
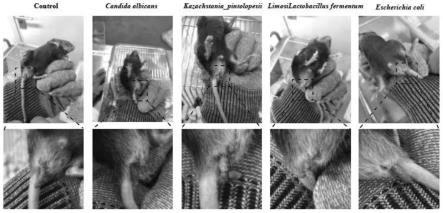
31.图1是实施例1中c57bl/6小鼠进行腹腔注射菌种8h的粪便性状照片图。
32.图2是实施例2中正常和注射白色念珠菌后km小鼠大便外观对比图。
33.图3是实施例2中注射白色念珠菌后小鼠血液炎症因子tnf-α和il-17的结果图。
34.图4是实施例4中白色念珠菌对巨噬细胞raw264.7的影响结果图。
35.图5是实施例5中sd大鼠进行腹腔注射菌种6h后粪便性状照片图。
36.图6是实施例6中造模后小鼠粪便形态的变化照片图。
37.图7是实施例6中造模后小鼠血清的il-17a含量的变化图。
具体实施方式
38.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
39.下面实施方案中若未注明具体试验条件,则通常按照常规试验条件或按照试剂公司所建议的试验条件。所使用的材料、试剂等,若无特殊说明,均为从商业途径得到的试剂和材料。
40.实施例中使用的sd大鼠和km小鼠均购于广州中医药大学实验动物中心。
41.实施例1
42.1、湿证模型的评价指标
43.炎症因子:所有报道的湿证模型,均报道血液中某几种炎症因子的升高,其中频率最高的是肿瘤坏死因子tnf-α,其他包括多种白介素如il-β、il-6等。
44.一般指标:可观察到动物进食少、活动度减少、大便黏等。其中大便黏做为定性分析的重要标准。
45.肠道菌群改变:不同造模方法制备的湿证动物模型,均有报道肠道菌群改变,小鼠肠道菌群拟杆菌门(bacteroidetes)显著减少,厚壁菌门(firmicutes)显著增加,反映内在健康菌比例减少。
46.综合现有文献中公开的标准和模型,本发明主要采用3个评判标准来评价:活动度下降、大便黏腻、血液中免疫炎症因子水平。
47.其中大便黏腻程度的测试方法为:将相同质量的粪便放于滤纸上,再加一层滤纸,滤纸上放50克砝码,2分钟后撤去砝码,观察上层滤纸上粘有粪便痕迹的面积,测量直径,以直径值大小代表粪便黏湿度。
48.当实验组中的动物相较对照组中出现活动度下降,大便黏腻程度测试的直径超过对照组的50%以上,且动物血液中免疫炎症因子较正常组升高50%以上时,则证明湿证模型建立成功。
49.2、使用c57bj/6小鼠建立湿证模型
50.(1)实验动物
51.c57bl/6小鼠购于广东省医学实验动物中心,10周龄。许可证scxk(粤)2018-0002,syxk(粤)2015-0102,雄性。饲养于普通洁净环境,12/12小时光/暗循环,正常供应食物和水。根据体重由低到高顺序打耳钉,采用excel随机函数=randbetween(1,4),进行随机分组,分为正常(对照)组,大肠杆菌组,白色念珠菌组,kp菌组,发酵乳杆菌组。
52.(2)实验菌种
53.实验所有菌种均购自商业渠道,其中白色念珠菌(candida albicans)的atcc号为10231,大肠杆菌(esherichia coli)型号dh5a,k.pintolopesii(kp菌)购于荷兰cbs菌种,编号bio-109890,发酵乳杆菌(lactobacillus fermentum)购自山东吉高药业有限公司,批
号:2022061608,活菌数100亿cfu/g。
54.上述致病菌均由实验室从湿证体质人口腔和粪便中分离获得,并经pcr鉴定证明。
55.(3)菌体准备
56.取保种菌液50~200μl于新鲜灭菌的5ml培养基中(其中大肠杆菌/发酵乳杆菌采用lb液体培养基,kp菌/白色念珠菌采用ym液体培养基),于37℃恒温摇箱中摇24h,保证细菌处于对数生长期,在600nm测吸光度od,以1od=2
×
109cfu/ml,调整菌液浓度至108cfu/ml,6000r/min,离心10min,弃上清培养基,用无菌pbs重悬得到菌体悬液,4℃静置待用。
57.(4)动物实验
58.取小鼠(20g~40g),每组10只。不同菌种注射组,根据体重确定腹腔注射菌体量,以0.8
×
106cfu/g,腹腔注射1次。对照组腹腔注射等体积生理盐水。12小时后处死小鼠,取血,使用elisa试剂盒检测小鼠血液中的il-17a和tnf-α免疫炎症因子。
59.表1腹腔注射后小鼠体内免疫因子水平
60.组别血液tnf-α含量(pg/ml)正常55.7
±
6.2注射大肠杆菌160.7
±
12.5注射白念菌150.3
±
11.4注射kp菌138.7
±
12.7注射乳杆菌60.2
±
5.3
61.(5)实验结果
62.实验结果显示,白色念珠菌(candida albicans)组、大肠杆菌(esherichia coli)组和kp菌(k.pintolopesii)组的c57bl/6小鼠,在腹腔注射后6~12小时内,出现体倦,四肢懈怠,排便黏腻等症状,如图1所示,其表现与临床上“湿证”的表现极其相似,而注射等量发酵乳杆菌(益生菌)组不具有这些疾病表征;且大肠杆菌组、白念菌组、kp菌组引起明显的tnf含量升高,证明湿证模型建立成功。由于kp菌与白念菌同属真菌,下一步比较大肠杆菌与白念菌的建模差别。
63.实施例2白色念珠菌(candida albicans)腹腔注射km小鼠制备湿证模型
64.通过实施例1的实验,筛选出建模效果较好的白色念珠菌,在其他实验动物进行进一步的建模效果验证实验,具体步骤如下:
65.(1)实验动物
66.km小鼠购于广州中医药大学实验动物中心,雄性,8周龄。12/12小时光/暗循环,随机分组为对照组和实验组,每组6只。
67.(2)菌体准备
68.取白色念珠菌保种菌液50~200μl于新鲜灭菌的5ml lb液体培养基中,于37℃恒温摇箱中摇24h,保证细菌处于对数生长期,调整菌液浓度至108cfu/ml,6000r/min,离心10min,弃上清培养基,用无菌pbs重悬,4℃静置待用。
69.(3)动物实验
70.小鼠腹腔注射实验:取小鼠(20g~40g),分为对照组和实验组注射组,每组6只。根据体重确定腹腔注射菌体量,以0.8
×
106cfu/g,腹腔注射一次,注射12小时后,观察小鼠表征,确定建模情况,并取小鼠尾梢血使用elisa试剂盒检测小鼠血液中的il-17a和tnf-α免
疫炎症因子。
71.(4)实验结果
72.12小时后观察,并根据实施例1的判断方法,发现km小鼠出现活动度下降、大便黏腻等表征,且免疫炎症因子较正常组显著升高,结果如图2和3所示。实验组中湿证动物模型组造模成功率100%,证明该模型具有很好的重复再现性和实用性,能在不同的实验动物上实现建模。
73.实施例3建模安全剂量实验
74.实验方法:
75.(1)实验动物
76.km小鼠购于广州中医药大学实验动物中心,雄性,8周龄。12/12小时光/暗循环,随机分组为:对照组、白念低剂量组、白念高剂量组、大肠杆低剂量组、大肠杆高剂量组,每组10只。
77.(2)菌体准备
78.取保种菌液50~200μl于新鲜灭菌的5ml lb液体培养基中,于37℃恒温摇箱中摇24h,保证细菌处于对数生长期,调整菌液浓度至108cfu/ml,6000r/min,离心10min,弃上清培养基,用无菌pbs重悬,4℃静置待用。
79.(3)动物实验
80.小鼠腹腔注射实验(不同菌种):取小鼠(20g~40g),分为对照组和白色念珠菌高/低剂量注射组、大肠杆菌高/低剂量注射组,每组10只。不同菌种注射组,根据体重确定腹腔注射菌体量,按低剂量1.0
×
106cfu/g、高剂量3.0
×
106cfu/g,腹腔注射1次;对照组腹腔注射等体积生理盐水,并观察3天内动物症状及死亡率。
81.(4)实验结果
82.低剂量注射后,白色念珠菌注射组、大肠杆菌注射组均未出现死亡。高剂量注射后,白色念珠菌注射组死亡1只、大肠杆菌注射组死亡3只。
83.说明白色念珠菌的安全性高于大肠杆菌组,使用白色念珠菌和低浓度大肠杆菌进行湿证小鼠建模能够快速安全的实现技术效果。
84.实施例4
85.为验证该模型的成模机制,设计体外实验,将白色念珠菌与巨噬细胞相互作用,观察是否激活巨噬细胞分泌免疫炎症因子。
86.(1)实验细胞
87.raw264.7(小鼠单核巨噬细胞白血病细胞)细胞购于atcc,在24孔板中培养,培养条件为dmem+10% fbs+1% p/s,冻存配方为55%dmem+40%fbs,于5%co2,37℃培养,传代比例1:3~1:6。
88.(2)菌体培养
89.将白色念珠菌接种到新鲜灭菌的5ml ym液体培养基中,于37℃恒温摇箱中摇16h。按1:100倍稀释:取培养的菌液50μl于新鲜灭菌的5ml ym液体培养基中,于37℃恒温摇箱中摇4.5h,保证细菌处于对数生长期。
90.(3)白色念珠菌与巨噬细胞共培养上清对不同菌种增殖影响的检测
91.取步骤(2)中培养得到的菌液,调整浓度至od600=1,加100μl至步骤(1)中培养
raw264.7的24孔板中,重复12孔,培养6h。
92.分别收集24孔板中普通培养和加od600=1的白色念珠菌100μl培养6h后的raw264.7细胞上清,0.22μm微孔过滤器过滤,使用elisa试剂盒检测tnf-α含量。
93.采用elisa试剂盒检测细胞与白色念珠菌共培养的上清液的tnf-α含量,实验结果如图4所示,其中对照组的tnf-α含量为n=41.017pg/ml,模型组的tnf-α含量为m=300.992pg/ml,说明白色念珠菌可刺激巨噬细胞大量分泌炎症因子tnf-α。
94.实施例5白色念珠菌(candida albicans)腹腔注射sd大鼠制备湿证模型
95.为了验证该建模方法在不同实验动物上的再现性,设计了相同条件下使用sd大鼠分别使用现有湿证建模方法建模的对比实验,实验步骤如下:
96.(1)实验动物
97.sd大鼠购于广州中医药大学实验动物中心,正常饲养,分为对照组和实验组,每组6只。
98.(2)实验方法
99.所使用菌液的制备方法和注射量参照实施例2,实验组腹腔注射一次,注射后观察表征确定建模情况。
100.(3)实验结果
101.注射6h后观察发现大鼠出现体倦,四肢懈怠,排便黏腻等症状,其表现与临床上“湿证”的表现极其相似,取粪便测试黏腻程度,确定出现“湿证”的表征,如图5所示。实验结果证明,本发明提供的湿证模型建立方法能在不同实验动物上快速建模。
102.实施例6传统建模法制备湿证模型对比
103.为了与现有的湿证模型建立方法进行对比,设计了使用传统建模法对小鼠进行建模的实验,实验步骤如下:
104.(1)实验动物
105.所使用实验动物为c57bj/6小鼠,与实施例1的小鼠饲养条件相同,分为正常组(coltrol)和传统模型组(model),每组10只。
106.(2)实验方法
107.正常组:湿度50%,温度25℃。
108.传统模型组:每日8:00~18:00将小鼠放在温度25℃,湿度95%的人工气候箱内饲养,期间不禁食不禁水。
109.鼠笼底部均铺垫厚锯末每日更换。动物均自由进食进水,每日观察小鼠活动状态、毛色及大便形态等情况,持续观察20天。第21天取尾梢血使用elisa试剂盒检测小鼠血液中的il-17a免疫炎症因子。
110.(3)实验结果
111.1、“湿证”小鼠的活跃程度及粪便性状的改变
112.实验结果显示,模型组小鼠在开始建模12h时,活跃程度和粪便性状基本没有变化。第20天,模型组小鼠的活跃程度降低,其粪便性状明显改变,相较于正常组显得更黏腻,如图6所示。
113.2、“湿证”小鼠血清和结肠炎症因子表达变化
114.实验结果如图7所示,温湿造模组可导致血清il-17a含量升高(p<0.05)。
115.通过结合小鼠粪便性状和血清炎症因子水平,判断传统模型组成功建立了湿证模型,但是传统模型中小鼠性状的改变在20d后才出现,可以看出传统方法建模需要较长的时间,无法满足现有实验的需求,而本发明实施例1所使用的方法能够快速制备动物湿证模型,相较传统方法具有显著优势。
116.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1