AS1411适配体作为血管生成抑制剂中的应用
as1411适配体作为血管生成抑制剂中的应用
技术领域
1.本发明属于药物制备技术领域,具体涉及as1411适配体作为血管生成抑制剂中的应用。
背景技术:
2.血管生成是从原有的血管系统中生长出新血管的过程,其在人类生殖、器官发育、伤口愈合和组织修复中发挥着重要作用。血管生成是一个严格调控的事件,由促血管生成因子和抗血管生成因子平衡,最常见的促血管生成因子包括血管内皮生长因子(vegf)、成纤维细胞生长因子(fgf)、血小板衍生生长因子(pdgf)、血管紧张素(ang)、肝细胞生长因子(hgf)和缺氧诱导因子(hif),而抗血管生成因子包括血管抑素和内皮抑素。血管生成过程中的失衡可能会导致严重的病理情况,如癌症、一些眼疾、某些皮肤病等。肿瘤血管生成的特征是肿瘤微环境中促血管生成因子和抗血管生成因子之间的失衡有利于前者。血管生成对肿瘤的生长和发展至关重要,肿瘤新生血管除了提供营养、氧气和废物运输外,还有助于肿瘤细胞向远处扩散,促进转移。大量实验表明,缺乏功能性血管网络会导致肿瘤细胞凋亡或坏死,从而强化了肿瘤血管对肿瘤生长的重要性。切除肿瘤内供应营养物质和氧气的肿瘤血管是一种有潜力的抗癌治疗策略,抗血管生成药物逐渐成为抗癌药物至关重要的一部分。目前常见的抗血管生成药物有抗血管内皮生长因子药物(贝伐单抗)、内源性泛靶点血管生成抑制剂(恩度)以及小分子多靶点酪氨酸激酶抑制剂(索拉非尼)。但目前仍缺乏效果好且对细胞毒性低的抗血管生成药物。
技术实现要素:
3.本发明的目的在于提供as1411适配体作为血管生成抑制剂中的应用。as1411适配体对血管生成有抑制作用,能够作为血管生成抑制剂。
4.本发明提供了as1411适配体作为血管生成抑制剂中的应用,所述as1411的核苷酸序列如seq id no.1所示。
5.本发明还提供了as1411适配体在制备抑制血管生成的药物中的应用,所述as1411的核苷酸序列如seq id no.1所示。
6.本发明还提供了as1411适配体在制备抑制血管内皮细胞的增殖的药物中的应用,所述as1411的核苷酸序列如seq id no.1所示。
7.本发明还提供了as1411适配体在制备降低血管内皮细胞活性的药物中的应用,所述as1411的核苷酸序列如seq id no.1所示。
8.本发明提供了as1411适配体作为血管生成抑制剂中的应用。as1411适配体能够抑制血管内皮细胞的增殖,使huvec细胞活性降低,对血管生成有抑制作用,能够用于制备血管生成抑制剂。且与索拉非尼和星形孢菌素相比,as1411适配体在1μm即对体外血管形成有抑制作用,且其对huvec细胞具有有限的细胞毒性,其细胞毒性显著低于星形孢菌素,此外,as1411适配体具有低免疫原性,易于合成和储存,易于修饰等优点,是非常有潜力的血管生
成抑制剂。
附图说明
9.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
10.图1为本发明提供的不同外源物质对huvec体外血管形成的影响结果图(t=6h);
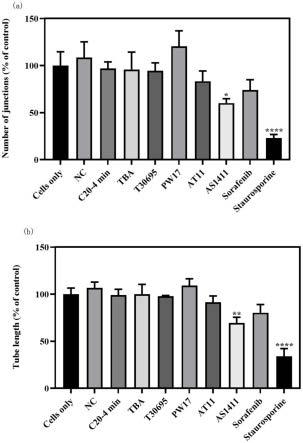
11.图2为本发明提供的利用image j相对定量分析外源物质对huvec体外血管形成的影响结果图;其中,(a)通过交叉点数目量化血管网络结果图;(b)通过血管长度量化血管网络结果图;*p<0.05,**p<0.01,***p<0.001,****p<0.0001,t=6h,n=3;
12.图3为本发明提供的mtt法评估外源物质与huvec细胞孵育24小时后细胞的相对活性结果图;*p<0.05,**p<0.01,***p<0.001,****p<0.0001,n=3。
具体实施方式
13.本发明提供了as1411适配体作为血管生成抑制剂中的应用,所述as1411的核苷酸序列如seq id no.1所示。核酸适配体是人工合成的单链dna或rna序列,具有易于合成和储存,生产成本低,批次间差异小、体积小、低免疫原性以及易于修饰等优点,已在生物传感、诊断和治疗领域被广泛研究。as1411是含有26个碱基的dna适配体,具体序列如下:5
’‑
ggtggtggtggttgtggtggtggtgg-3’。本发明通过huvec体外血管形成试验证明了as1411适配体对血管生成有抑制作用,能够用于制备血管生成抑制剂。本发明对所述as1411的来源没有特殊限定,采用as1411的常规市售产品或进行人工合成即可。
14.本发明还提供了as1411适配体在制备抑制血管生成的药物中的应用,所述as1411的核苷酸序列如seq id no.1所示。as1411能够抑制体外血管形成,是潜在的血管生成抑制剂。
15.本发明还提供了as1411适配体在制备抑制血管内皮细胞的增殖的药物中的应用,所述as1411的核苷酸序列如seq id no.1所示。内皮细胞增殖是血管生成的重要步骤,as1411可通过抑制血管内皮细胞的增殖而影响血管生成。
16.本发明还提供了as1411适配体在制备降低血管内皮细胞活性的药物中的应用,所述as1411的核苷酸序列如seq id no.1所示。as1411能够使huvec细胞活性降低。
17.为了进一步说明本发明,下面结合附图和实施例对本发明提供的as1411适配体作为血管生成抑制剂中的应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
18.实施例1
19.本发明使用7种典型的核酸适配体(nc、c20-4 min、tba、t30695、pw17、at11和as1411)来探究核酸适配体对血管生成的影响。
20.核酸适配体的名称和序列如表1所示。
21.表1 dna适配体的名称及序列
[0022][0023]
通过huvec体外血管形成实验探究不同适配体对血管生成的影响。
[0024]
首先培养生长状态良好的huvec细胞,进行huvec体外血管形成实验,随后通过mtt细胞毒性实验探究核酸适配体对体外血管形成的影响。具体实验步骤如下:
[0025]
huvec体外血管形成实验
[0026]
实验前一天将matrigel基质胶(corning matrigel基质胶,货号:354234)置于4℃冰箱中在冰上过夜解冻。同时将实验过程中需使用的枪头、96孔板置于4℃冰箱预冷。第二天将融化的液态matrigel基质胶转移到96孔板中,每孔50μl。随后将96孔板转移到37℃、5%co2的细胞培养箱中孵育1h左右,等待基质胶凝固。在等待基质胶凝固的过程中将处于对数生长期的huvec细胞从培养箱中取出,用含体积百分含量为2%fbs的dmem培养基将细胞配制成单个细胞悬液,用血球计数板将细胞调成一定浓度的细胞悬液。将细胞悬液分别与各核酸适配体预混后接种到96孔板中凝固的基质胶上,不添加核酸适配体的细胞悬液作为空白对照组,将细胞悬液与已知的抑制血管生成的药物索拉非尼(sorafenib)或星形孢菌素(staurosporine)预混作为阳性对照组,每孔细胞数为25000个/孔,核酸适配体、索拉非尼和星形孢菌素的浓度分别为1μm,每组3个复孔,然后将96孔板放入37℃、5%co2的细胞培养箱中继续培养。使用智能活细胞成像分析系统相差成像模式原位、实时拍摄不同时间节点(从将96孔板放入细胞培养箱时开始计时)下血管形成图片(图1),并通过image j对图片进行分析。
[0027]
不同核酸适配体对huvec体外血管形成的影响如图1所示(t=6h),利用image j相对定量(以空白对照组为基准)分析外源物质对huvec体外血管形成的影响结果如图2、表2和表3所示,其中,(a)通过交叉点数目量化血管网络结果图;(b)通过血管长度量化血管网络结果图;*p<0.05,**p<0.01,***p<0.001,****p<0.0001,t=6h,n=3。
[0028]
表2通过交叉点数目量化血管网络结果
[0029][0030]
表3通过血管长度量化血管网络结果
[0031]
[0032][0033]
结果表明,血管形成是一个动态过程,细胞在matrigel基质胶上迁移、黏附,6h左右形成丰富的血管网络结构。通过image j对6h的血管网络结构进行相对定量分析,结果表明适配体nc、c20-4 min、tba、t30695、pw17、at11对体外血管形成没有明显影响,而as1411抑制体外血管形成,是潜在的血管生成抑制剂;1μm索拉非尼对体外血管形成没有影响,而1μm星形孢菌素几乎无血管网络结构形成,其强烈抑制体外血管形成。
[0034]
mtt细胞毒性实验
[0035]
将对数生长期的huvec细胞从细胞培养箱中取出,用dmem完全培养基将细胞配制成单个细胞悬液,用血球计数板计数,调节细胞浓度,将调节好浓度的细胞悬液接种于96孔板,每孔100μl(细胞数量为5000个/孔),同时加入100μlpbs在铺板区域的边缘孔中,将接种细胞的96孔板放入培养箱内过夜培养,使细胞贴壁,然后在实验组的孔中加入相关外源物质(包括核酸适配体、索拉非尼和星形孢菌素),使外源物质的浓度梯度为1μm、0.5μm、0.25μm,同时设置对照组和空白组,实验组、对照组、空白组均设置5个复孔,将加完样的96孔板置于培养箱中继续培养24小时,然后每孔加入10μlmtt溶液(5g/l),继续培养4h后终止培养,肉眼可看到96孔板底部有蓝紫色沉淀,这是蓝紫色结晶甲臜(formazan),小心弃掉上清液,然后每孔加入100μl二甲基亚砜(dmso),将96孔板置摇床上低速震荡10min使甲臜充分溶解于二甲基亚砜中,最后将96孔板置于酶标仪中检测每孔在570nm的吸光度(od)。根据公式计算外源物质对细胞活力的影响:
[0036][0037]
其中,空白组即为调零孔,含有完全培养基、mtt和dmso,但没有接种细胞;对照组用dmem完全培养基代替外源物质培养细胞。
[0038]
mtt法评估外源物质与huvec细胞孵育24小时后细胞的相对活性结果如图3和表4所示;*p<0.05,**p<0.01,***p<0.001,****p<0.0001,n=3。mtt细胞毒性实验表明nc、
c20-4 min、tba、t30695、pw17、at11对huvec细胞活性几乎没有影响,但as1411使huvec细胞活性降低。内皮细胞增殖是血管生成的重要步骤,以上结果说明as1411可能通过抑制血管内皮细胞的增殖而影响血管生成。mtt细胞毒性实验还表明索拉非尼对细胞活性几乎没有影响,而星形孢菌素使细胞活性显著降低。有研究表明蛋白激酶c参与了对vegf的调控。星形孢菌素是蛋白激酶c抑制剂,其能够抑制vegf基因的表达,进而抑制vegf诱导的内皮细胞增殖,抑制肿瘤血管生成。与索拉非尼和星形孢菌素相比,as1411在1μm即对体外血管形成有抑制作用,且其对huvec细胞具有有限的细胞毒性,其细胞毒性显著低于星形孢菌素,此外,as1411适配体具有低免疫原性,易于合成和储存,易于修饰等优点,是非常有潜力的血管生成抑制剂。
[0039]
表4 mtt法评估外源物质与huvec细胞孵育24小时后细胞的相对活性结果
[0040][0041]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1