组蛋白去乙酰化酶抑制剂TMP195在制备促进成骨形成药物中的应用
组蛋白去乙酰化酶抑制剂tmp195在制备促进成骨形成药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及组蛋白去乙酰化酶抑制剂tmp195在制备促进成骨形成药物中的应用。
背景技术:
2.骨缺损是全球范围一种常见且亟待解决的临床难题之一,在临床中发病率高。创伤是引起骨缺损的最常见的病因,约5-10%的创伤会导致愈合延迟甚至不愈合。此外,严重感染、肿瘤、骨质疏松症、骨坏死和一些先天性畸形等多种因素也会引起骨缺损。虽然个体组织具有一定的自我修复能力,但大面积骨缺损的有效修复在临床中仍具有重要挑战性。
3.骨损伤的修复是一个复杂的连续性的动态过程,其中内部因素涉及到多种细胞以及信号通路的参与,此外还受到局部血供、稳定性、感染等外部因素影响。临床上有关骨缺损的治疗方式包括自体骨移植、同种异体骨移植和异种骨移植等。但这些移植物在临床手术中无法得到安全的持续提供,并且手术本身也存在缺点以及相应的并发症。
4.目前基因治疗能够对大块的骨缺损进行更有效的修复,并且在修复的过程中能够控制骨组织的生长发育。已发现可用于骨缺损修复的相关基因包括骨形态发生蛋白(bmp)、血管内皮生长因子(vegf)、血小板衍生生长因子(pdgf)、矮小相关转录因子-2(runx-2)等。已经有研究发现将围产期软骨细胞和成人骨髓间充质干细胞中条件性敲除runx2,分别减少了骨的延长和增厚。而runx2和mef2作为hdac4的下游靶点,当hdac4磷酸化降低,引起hdac4核内累积,从而绑定runx2和mef2并阻止其转录活性,导致软骨细胞肥大受到抑制。
5.mp195是一种新型的ⅱa类hdac抑制剂之一,其中三氟甲基恶二唑(tfmo)具有靶向性,能与ⅱa类hdac催化口袋底部的锌离子相互作用,从而起到特异性的抑制作用。目前tmp195已经有文献报道用于高血压病、动脉粥样硬化症、心肌肥大、急性肾损伤、慢性淋巴细胞白血病、结核病以及乳腺癌等肿瘤相关疾病的研究,但是目前未有关于tmp195对于骨损伤修复中的报道。
技术实现要素:
6.本发明提供了组蛋白去乙酰化酶抑制剂tmp195在制备促进成骨形成药物中的应用。
7.本发明由如下技术方案实现的:组蛋白去乙酰化酶抑制剂tmp195在制备促进成骨形成药物中的应用,所述tmp195在制备促进成骨缺损愈合药物中的应用。
8.进一步的,所述tmp195在促进新骨形成药物中的应用。
9.所述tmp195用量为100-400 nm。
10.本发明将tmp195分别注射到小鼠骨缺损部位,发现tmp195能促进骨缺损部位的愈合,证明hdac抑制剂tmp195具有治疗骨缺损的潜能,为临床骨缺损治疗药物的制备提供新思路。
附图说明
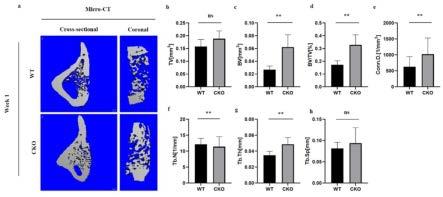
11.图1为小鼠胫骨缺损部位micro-ct重建图;图中:a. wt:野生型小鼠,cko:特异性hdac4敲除小鼠;b. tv(组织体积),两组之间无统计学差异;c. bv(骨体积),敲除组小鼠骨体积显著增加;d. bv/tv(骨体积分数),敲除组小鼠骨体积分数明显增加,说明缺损部位骨量增加;e. conn.d.(骨小梁连接密度),两组之间无统计学差异;f. tb.n(骨小梁数量),两组之间无统计学差异;g.tb.th(骨小梁厚度),两组之间无统计学差异;h.tb.sp(骨小梁分离度),两组间无统计学差异;图2为小鼠胫骨缺损部位he染色;wt:野生型小鼠,cko:特异性hdac4敲除小鼠;敲除组小鼠骨痂愈合相较于对照野生组小鼠更充分;从左往右依次是同一处理组6的个重复;图3为小鼠胫骨缺损部位番红固绿染色;wt:野生型小鼠,cko:特异性hdac4敲除小鼠;与野生组小鼠相比敲除组小鼠骨痂处成骨更多;从左往右依次是同一处理组6的个重复;图4为小鼠胫骨缺损部位masson染色。wt:野生型小鼠,cko:特异性hdac4敲除小鼠;与野生组敲除组小鼠骨痂处成骨更多;从左往右依次是同一处理组6的个重复;图5为小鼠胫骨缺损部位micro-ct重建图。a. dmso空白对照组,tmp195(100nm)低浓度治疗组,tmp195(400nm)高浓度治疗组;b.tv(组织体积),三组之间无统计学差异;c. bv(骨体积),高浓度组小鼠相较于另外两组小鼠骨体积显著增加。d. bv/tv(骨体积分数),高浓度组小鼠骨体积分数相对于对照组明显增加,但低浓度组与对照组相比无统计学差异;e. conn.d.(骨小梁连接密度),低浓度组与对照组两组之间无统计学差异,但高浓度组的骨小梁连接密度显著增加。; f. tb.n(骨小梁数量),低浓度组与对照组两组之间无统计学差异,但高浓度组的骨小梁连数目明显增加;g.tb.th(骨小梁厚度),三组之间无统计学差异;h.tb.sp(骨小梁分离度),低浓度组与对照组两组之间无统计学差异,但高浓度组骨小梁分离度相较于对照组明显降低;图6为tmp195治疗小鼠胫骨骨缺损部位he染色。dmso空白对照组,tmp195(100nm)低浓度治疗组,tmp195(400nm)高浓度治疗组;与对照组相比,低浓度治疗组小鼠骨痂形成增多但不明显,高浓度治疗组小鼠骨痂形成更多;从左往右依次是同一处理组6的个重复;图7为tmp195治疗小鼠胫骨骨缺损部位番红固绿染色。dmso空白对照组,tmp195(100nm)低浓度治疗组,tmp195(400nm)高浓度治疗组;与对照组相比,低浓度治疗组小鼠骨痂处有少量成骨形成,而高浓度治疗组小鼠骨痂处成骨明显增多;从左往右依次是同一处理组6的个重复;图8为tmp195治疗小鼠胫骨骨缺损部位masson染色。dmso空白对照组,tmp195(100nm)低浓度治疗组,tmp195(400nm)高浓度治疗组;与对照组相比,低浓度治疗组小鼠骨痂处有少量成骨形成,而高浓度治疗组小鼠骨痂处成骨明显增多;从左往右依次是同一处理组6的个重复;图9为茜素红染色鉴定 tmp195诱导骨髓间充质干细胞向成骨细胞分化。空白对照组(nc组),阳性对照组(pc组),tmp195(4μm)低浓度诱导组,tmp195(8μm)高浓度诱导组;相较于阳性对照组,4μm和8μm浓度tmp195均促进了骨髓间充质干细胞成骨分化,并且伴随浓度依赖性,8μm促进作用更明显。
具体实施方式
12.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
13.除非另有定义,所有在此使用的技术和科学术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
14.本领域技术人员意识到的通过常规实验就能了解到的描述的特定实施方案的等同技术,都将包含在本技术中。
15.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的实验材料,如无特殊说明,均为由常规生化试剂商店购买得到的。
16.一、agg-creert2;hdac4fl/fl条件基因敲除小鼠实验1、实验方法:agg-creert2;hdac4fl/fl小鼠的构建:应用hdac4fl/fl小鼠和agg-creert2小鼠交配产生agg-creert2;hdac4fl/fl条件基因敲除小鼠,10周龄腹腔注射tamoxifen(tm),敲除hdac4,12周建立胫骨骨缺损模型。hdac4fl/fl小鼠和agg-creert2小鼠为现有小鼠。
17.小鼠胫骨骨缺损模型:随机选取6只12周龄雄性hdac4fl/fl小鼠作为对照组(g1),同样随机选取6只agg-creert2小鼠作为实验组(g2)。手术前禁食禁水8h,在造模前一天将右后肢备皮,腹腔注射0.8%的戊巴比妥钠(70mg/kg)麻醉小鼠,使用75%酒精消毒皮肤,切开局部肌肉暴露胫骨,使用0.8mm直径执笔式小电钻贯通单侧皮质骨,深度约0.4mm,钻取过程中使用生理盐水冲洗。肌层采用7-0号带针缝线进行缝合,皮肤层使用0号丝线缝合,用碘伏棉球擦拭伤口预防感染。
18.扫描分析:于1周后收集小鼠胫骨,将小鼠胫骨标本放入micro-ct中,固定好,进行骨三维成像,防止扫描过程中机器震动影响图层形态,扫描条件为:70kvp,hr,10.1μm,300ms,选取50层进行分析。扫描完成后将骨缺损部位进行三维重建,并对骨体积(bv)、骨质密度(conn.d.)、骨小梁数目(tb.n)、骨小梁厚度(tb.th)、骨小梁分离度(tb.sp)等进行定量分析。然后将标本固定、脱水、包埋后进行组织学评估。小鼠造模后7d两组小鼠micro-ct扫描定量检测结果如表1所示。
19.染色:将石蜡切片脱蜡置水:将切片在二甲苯溶液中浸泡2次,20min/次;无水乙醇中浸泡2次,5min/次;随后依次浸泡于浓度95%、90%、80%、70%的酒精中,时间均为5min,最后用蒸馏水洗净。滴加苏木素染细胞核3-5min,自来水洗,用1%浓度的盐酸酒精进行分化,滴上即可,用自来水清洗,通过0.6%氨水反蓝,使用流水冲洗。滴加伊红染细胞质1-3min。脱水
处理:将切片依次经95%乙醇2次,5s/次;无水乙醇2次,5s/次;二甲苯2次,20s/次。待切片取出晾干后使用中性树胶进行封片处理,拍照观察。
20.番红固绿染色:将石蜡切片脱蜡置水:二甲苯溶液中浸泡2次,20min/次;无水乙醇中浸泡2次,5min/次;95%乙醇2次,5min/次;蒸馏水2次,5min/次,苏木素染细胞核3min,流水冲5min,盐酸酒精分化20s,固绿3min,2%乙酸10s,番红o染液5min,蒸馏水2次,脱水:95%乙醇2次,5s/次;无水乙醇2次,5s/次;二甲苯2次,20s/次,待切片取出晾干后使用中性树胶进行封片处理,拍照观察。
21.染色:将石蜡切片脱蜡置水:二甲苯溶液中浸泡2次,每次20min;无水乙醇中浸泡2次,每次5min;95%乙醇2次,每次5min;蒸馏水2次,每次5min,苏木素染细胞核3min,流水冲5min,盐酸酒精分化20s,masson蓝化液返蓝3-5 min,蒸馏水洗1min,丽春红品红染色8min,乙酸溶液洗1min,1%磷钼酸溶液洗1-2min,乙酸溶液洗1min,直接放入苯胺蓝溶液浸染1-2min,乙酸溶液洗1min,脱水:95%乙醇2次,5s/次;无水乙醇2次,5s/次;二甲苯2次,20s/次,待切片取出晾干后使用中性树胶进行封片处理,拍照观察。
22.、实验结果micro-ct分析显示:实验结果如图1所示,与野生型小鼠相比,hdac4特异性敲除小鼠骨体积(bv)、相对骨体积或骨体积分数(bv/tv)、连接密度(conn.d.)、骨小梁数量(tb.n)都明显增高,敲除组小鼠骨体积显著增加、骨体积分数明显增加,说明缺损部位骨量增加;说明敲除hdac4后成骨加速,从而更有效的修复骨缺损。
23.染色:实验结果如图2所示,与野生型小鼠相比,hdac4特异性敲除小鼠骨痂处新生骨量相较于野生型小鼠更多,敲除组小鼠骨痂愈合相较于对照野生组小鼠更充分;说明敲除hdac4对缺损部位的修复有促进作用。
24.番红固绿染色:实验结果如图3所示,与野生组小鼠相比敲除组小鼠骨痂处成骨更多。
25.染色:实验结果如图4所示,与野生组小鼠相比敲除组小鼠骨痂处成骨更多。
26.二、使用ⅱa类hdac抑制剂tmp195对缺损部位局部注射治疗1、实验方法tmp195治疗小鼠胫骨骨缺损:同样将18只12周龄的雄性c57bl/6小鼠分为3组(g1、g2、g3),每组随机分配6只。g1组的6只小鼠作为手术对照组,g2组作为低剂量治疗组,g3作为高剂量治疗组,每组6只,即:对照组、tmp195低剂量治疗组(100nm)、tmp195(400nm)高剂量治疗组,造模第二天局部开始给药,隔天一次(共打3次),每次注射40μl,1周后将小鼠处死,取胫骨进行micro ct扫描分析后,固定、脱水、包埋后进行组织学评估。
27.扫描分析:于1周后收集小鼠胫骨,将小鼠胫骨标本放入micro-ct中,固定好,进行骨三维成像,防止扫描过程中机器震动影响图层形态,扫描条件为:70kvp,hr,10.1μm,300ms,选取50层进行分析。扫描完成后将骨缺损部位进行三维重建,并对骨体积(bv)、骨质密度(conn.d.)、骨小梁数目(tb.n)、骨小梁厚度(tb.th)、骨小梁分离度(tb.sp)等进行定量分析。然后将标本固定、脱水、包埋后进行组织学评估。
28.小鼠造模后7d低、高浓度组以及对照dmso组处理小鼠micro-ct扫描定量检测结果如表2所示。
29.染色:将石蜡切片脱蜡置水:将切片在二甲苯溶液中浸泡2次,20min/次;无水乙醇中浸泡2次,5min/次;随后依次浸泡于浓度95%、90%、80%、70%的酒精中,时间均为5min,最后用蒸馏水洗净。滴加苏木素染细胞核3-5min,自来水洗,用1%浓度的盐酸酒精进行分化,滴上即可,用自来水清洗,通过0.6%氨水反蓝,使用流水冲洗。滴加伊红染细胞质1-3min。脱水处理:将切片依次经95%乙醇2次,每次5s;无水乙醇2次,每次5s;二甲苯2次,每次20s。待切片取出晾干后使用中性树胶进行封片处理,拍照观察。
30.番红固绿染色:将石蜡切片脱蜡置水:二甲苯溶液中浸泡2次,20min/次;无水乙醇中浸泡2次,5min/次;95%乙醇2次,5min/次;蒸馏水2次,5min/次,苏木素染细胞核3min,流水冲5min,盐酸酒精分化20s,固绿3min,2%乙酸10s,番红o染液5min,蒸馏水2次,脱水:95%乙醇2次,5s/次;无水乙醇2次,5s/次;二甲苯2次,20s/次,待切片取出晾干后使用中性树胶进行封片处理,拍照观察。
31.染色:将石蜡切片脱蜡置水:二甲苯溶液中浸泡2次,每次20min;无水乙醇中浸泡2次,每次5min;95%乙醇2次,每次5min;蒸馏水2次,每次5min,苏木素染细胞核3min,流水冲5min,盐酸酒精分化20s,masson蓝化液返蓝3-5 min,蒸馏水洗1min,丽春红品红染色8min,乙酸溶液洗1min,1%磷钼酸溶液洗1-2min,乙酸溶液洗1min,直接放入苯胺蓝溶液浸染1-2min,乙酸溶液洗1min,脱水:95%乙醇2次,5s/次;无水乙醇2次,5s/次;二甲苯2次,20s/次,待切片取出晾干后使用中性树胶进行封片处理,拍照观察。
32.、实验结果:tmp195分子式为:。
33.分析:micro-ct分析结果如图5所示,结果显示:我们在普通c57小鼠中使用ⅱa类hdac抑制剂tmp195局部注射到缺损部位,我们发现组织体积(tv)三组之间没有差异,tmp195高剂量组(400nm)骨体积(bv)、相对骨体积或骨体积分数(bv/tv)、连接密度(conn.d.)、骨小梁数量(tb.n)都明显增高。因此有效抑制hdac4,对骨缺损的修复有一定作用。
34.染色:结果如图6所示,使用tmp195治疗之后,相较于对照组(dmso),低剂量组(100nm)有轻微新骨形成但无统计学差异,而高剂量组(400nm)新骨形成较多,与对照组相比,低浓度治疗组小鼠骨痂形成增多但不明显,高浓度治疗组小鼠骨痂形成更多;说明tmp195对骨缺损的愈合具有促进作用。
35.番红固绿染色:结果如图7所示,与对照组相比,低浓度治疗组小鼠有轻微骨痂形成并伴有少量成骨,而高浓度治疗组小鼠骨痂明显增多,成骨也明显增加。说明tmp195促进了缺损部位的骨质形成。
36.染色:结果如图8所示,与对照组相比,低浓度治疗组小鼠有轻微骨痂形成并伴有少量成骨,而高浓度治疗组小鼠骨痂明显增多,成骨也明显增加。说明tmp195促进了缺损部位的骨质形成。
37.三、ⅱa类hdac抑制剂tmp195诱导骨髓间充质干细胞向成骨细胞分化1、实验方法人原代骨髓间充质干细胞提取:取手术室换髋手术患者股骨头用1ml注射器吸取培养基,将骨髓冲入10cm培养皿中,反复冲洗直至骨髓腔发白,补齐培养基后用移液枪将骨髓细胞吹散均匀,放培养箱培养,每3-5天换液一次,待细胞长满后传代,第2或3代细胞既可用于后续实验。
38.成骨细胞诱导实验:成骨诱导培养基:海星生物(型号:bmhx-d101);将细胞以2
×
104个/cm2/孔密度接种于24孔板培养,待细胞汇合度60-70%即可更换成骨诱导培养基,每3天换液一次。
39.染色鉴定:茜素红染色:诱导培养14天后,吸除培养基,用pbs洗1-2遍,更换4%多聚甲醛4
°
固定30min,去除固定液,用pbs洗2-3遍,吸除干净pbs后将配好的ar染液加入室温染色30min。
40.、实验结果茜素红染色:结果如图9所示,tmp195有促进骨髓间充质干细胞向成骨细胞分化潜能,并且伴随浓度依赖性。
41.本发明证明了hdac抑制剂tmp195具有治疗骨缺损的潜能,为临床骨缺损治疗药物的制备提供新思路。
42.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1