糖响应脂质体纳米颗粒、胰岛素递送体系及其制备方法和应用
本发明涉及一种糖响应脂质体纳米颗粒、胰岛素递送体系及其制备方法和应用。
背景技术:
1、近年来,糖尿病患病率逐年增高,严重威胁人类的生命健康。糖尿病以长期的高血糖为特征,这种代谢紊乱会使患者出现器官病变甚至衰竭等一系列严重的并发症。胰岛素是治疗1型和晚期2型糖尿病的唯一特效药。但胰岛素的剂量需要严格控制,注射过量将引起低血糖,严重者可能导致死亡。因此,需要开发一种葡萄糖响应型的胰岛素释放系统。在正常血糖状态下,血糖响应型的载体可维持胰岛素在基础水平;在高血糖状态下,载体可精确地控制胰岛素释放剂量,智能调节血糖,降低低血糖风险。
2、目前常见血糖响应型元件有葡萄糖氧化酶、苯硼酸、葡萄糖结合分子等。其中,苯硼酸(phenylboronicacid,pba)能与1,2-或1,3-顺式二醇(如葡萄糖)可逆结合,形成环状酯,使pba的亲水性和负电荷密度增加,这些性质的改变可用于设计糖响应系统。通过将pba的衍生物共价连接到材料上,得到基于pba的葡萄糖敏感材料。将其制备为适当的载体负载胰岛素。在高血糖状态下,葡萄糖与pba的结合会导致载体水溶性、电荷密度的变化,根据性质的变化程度释放出相应剂量的胰岛素。
3、基于pba与葡萄糖结合后负电荷密度增加的原理,一种电荷可反转复合物已在动物模型中验证了出色的糖响应性能,即通过pba基团修饰带正电的聚合物(例如4-羧基-3-氟苯基硼酸修饰的聚(l-赖氨酸))。在生理ph下,这种聚合物带正电荷,与胰岛素有较强的相互作用。在高血糖条件下,聚合物的正电荷逆转,与胰岛素的静电吸引力被削弱,释放胰岛素速度被加快。当血糖恢复正常时,聚合物电荷逆转受到抑制,胰岛素的释放率降低,因此这种聚合物的低血糖的风险更小。因此证明,糖响应电荷翻转机制是一种有效的,可用于构建糖响应胰岛素递送体系的方法。
技术实现思路
1、本发明为了解决现有胰岛素药物无法响应性释放胰岛素,导致易出现低血糖且控糖效果差的问题,从而提供了一种糖响应脂质体纳米颗粒、胰岛素递送体系及其制备方法和应用。本发明所述的糖响应脂质体纳米颗粒具有确定的结构,潜在毒性低,粒径稳定;基于其的胰岛素递送体系具有优异的血糖调节能力。
2、本发明采用以下技术方案解决上述技术问题。
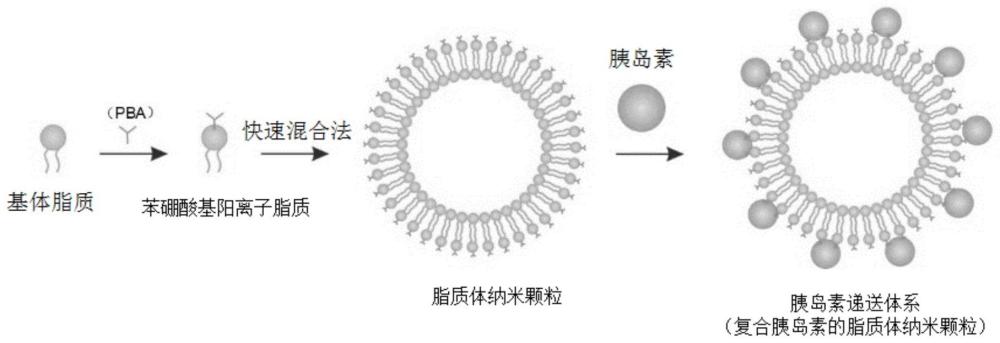
3、本发明还提供一种糖响应脂质体纳米颗粒的制备方法,其包括以下步骤:将苯硼酸基阳离子脂质的溶液与水混合,即得包含糖响应脂质体纳米颗粒的溶液;其中,所述苯硼酸基阳离子脂质的溶液中溶剂与苯硼酸基阳离子脂质的体积质量比为3~15μl/mg,所述苯硼酸基阳离子脂质的溶液和水的体积比为(1~20):200。
4、本发明中,所述苯硼酸基阳离子脂质的溶液中溶剂与苯硼酸基阳离子脂质的体积质量比表示每1mg苯硼酸基阳离子脂质对应的溶剂的体积。即,体积质量比为3~15μl/mg表示每1mg苯硼酸基阳离子脂质对应3~15μl的溶剂。若溶剂用量过少则得到的脂质体纳米颗粒不稳定,苯硼酸基阳离子脂质可能析出;若溶剂用量过多,苯硼酸基阳离子脂质会出现溶解,得到的脂质体纳米颗粒的粒径分布不均一。另外,溶剂的用量对反应速率也有影响。
5、本发明中,较佳地,所述苯硼酸基阳离子脂质的溶液中溶剂与苯硼酸基阳离子脂质的体积质量比为3~5μl/mg。
6、本发明中,所述苯硼酸基阳离子脂质的溶液(有机相)和水(水相)的体积比对制备得到的脂质体纳米颗粒的粒径及粒径分布有重要影响。若所述苯硼酸基阳离子脂质的溶液和水的体积比过小,不能形成脂质体,且形成的颗粒粒径较大。若所述苯硼酸基阳离子脂质的溶液和水的体积比过大,则脂质可能溶解而不是形成脂质体纳米颗粒。
7、较佳地,所述苯硼酸基阳离子脂质的溶液和水的体积比为(1~5):200,例如3:200。
8、本发明中,所述苯硼酸基阳离子脂质的溶液的溶剂可为本领域常规的能够溶解所述苯硼酸基阳离子脂质的有机溶剂,优选为极性溶剂,例如n,n-二甲基甲酰胺(dmf)、乙腈、二甲基亚砜或甲醇,较佳地为dmf。
9、本发明中,所述水优选为超纯水。
10、本发明中,所述混合可包括将水加入所述苯硼酸基阳离子脂质的溶液中。
11、较佳地,所述混合的操作包括:用移液枪将水一次性加入所述苯硼酸基阳离子脂质的溶液中,然后用移液枪吹打。其中,所述吹打是指用移液枪反复吸取并加回对应溶液。所述吹打的时间可为3~10s,例如5s。该混合方法通常称为“快速混合法”。
12、本发明中,所述糖响应脂质体纳米颗粒的制备方法还可包括以下步骤:将所述包含糖响应脂质体纳米颗粒的溶液冻干,得到冻干粉形式的糖响应脂质体纳米颗粒。
13、本发明中,所述苯硼酸基阳离子脂质可包括阳离子脂质和与之连接的苯硼酸基团,所述苯硼酸基团为取代基取代或未取代。其中,所述阳离子脂质较佳地为三级胺阳离子脂质。
14、较佳地,所述苯硼酸基阳离子脂质的化学结构如式i所示:
15、
16、其中,x选自-h,-f,-cl,-br,-ch3,-nh2和-oh中的一种或多种;
17、a1和a2各自独立地为
18、r1,r2各自独立地为:(n=6~14)、(n1=1~5,n2=2~16)、(n1,n2=6~14)、(n1,n2=6~12)、(n1,n2=6~12)、(n1,n2=6~12)、(n=6~14)、(n1,n2=4~12);
19、其中,所述l为以下结构:
20、
21、本发明中,中均是指基团的左侧与r1或r2相连。本发明中,较佳地,r1,r2各自独立地选自以下结构:
22、
23、
24、
25、较佳地,r1和r2均为
26、在本发明某些优选的实施方案中,所述苯硼酸基阳离子脂质为苯硼酸修饰的2,3-二油酰基-丙基-三甲胺(dodma-pba)、苯硼酸修饰的1,2-二油酰氧基-3-(二甲氨基)丙烷(dodap-pba)、3-氟苯硼酸修饰的2,3-二油酰基-丙基-三甲胺(dodma-fpba)或3-氟苯硼酸修饰的1,2-二油酰氧基-3-(二甲氨基)丙烷(dodap-fpba)。其中,
27、所述dodma-pba的化学结构如式i-1所示:
28、
29、所述dodma-fpba的化学结构如式i-2所示:
30、
31、所述dodap-pba的化学结构如式i-3所示:
32、
33、所述dodap-fpba的化学结构如式i-4所示:
34、
35、本发明中,所述苯硼酸基阳离子脂质实际是和阴离子一起以盐的形式存在,所述阴离子可为卤素离子,例如br-。
36、本发明中,所述苯硼酸基阳离子脂质可按照本领域常规的方法制备。较佳地,所述苯硼酸基阳离子脂质的制备方法包括以下步骤:将基体脂质和苯硼酸类化合物在溶剂中进行反应即可。
37、本发明中,所述基体脂质优选为三级胺基体脂质。
38、较佳地,所述基体脂质的化学结构如式ii所示:
39、
40、其中,所述a1、a2、r1和r2如前所定义。
41、本发明中,所述基体脂质较佳地为2,3-二油酰基-丙基-三甲胺(dodma)或1,2-二油酰氧基-3-(二甲氨基)丙烷(dodap)。
42、所述dodma的化学结构如式ii-1所示:
43、
44、所述dodap的化学结构如式ii-2所示:
45、
46、较佳地,所述苯硼酸类化合物的化学结构如式iii所示:
47、
48、其中,所述x的定义如前所述;
49、所述y为卤代烷基,优选为溴甲基。
50、本发明中,所述苯硼酸类化合物较佳地为4-(溴甲基)苯硼酸或3-氟-4-(溴甲基)苯硼酸。
51、本发明中,所述基体脂质与所述苯硼酸类化合物的摩尔比较佳地为1:(1~10),例如1:1。
52、本发明中,所述溶剂可为本领域常规的能够溶解所述基体脂质和所述苯硼酸类化合物的有机溶剂,优选为极性溶剂,例如n,n-二甲基甲酰胺(dmf)、乙腈、二甲基亚砜或甲醇,较佳地为dmf。
53、本发明中,所述溶剂的用量可为1~100ml/g,较佳地为10ml/g。“ml/g”表示每1g基体脂质对应的溶剂体积(ml)。
54、本发明中,所述反应的过程中,所述苯硼酸类化合物的苯硼酸基团共价连接到所述基体脂质上,得到阳离子脂质和与之连接的苯硼酸基团。
55、本发明中,所述反应的温度可为0~100℃,较佳地为室温。本发明中所述室温一般是指20~40℃。
56、本发明中,所述反应的时间可为0.5~100h,例如24h。
57、本发明中,较佳地,所述反应结束后还包括真空冷冻干燥去除溶剂的步骤。所述真空冷冻干燥去除溶剂后得到白色蜡状固体。
58、本发明还提供一种糖响应脂质体纳米颗粒,其由上述糖响应脂质体纳米颗粒的制备方法制得。
59、本发明中,较佳地,所述糖响应脂质体纳米颗粒为球状。
60、本发明中,较佳地,所述糖响应脂质体纳米颗粒的粒径为100~300nm。
61、本发明中,较佳地,所述糖响应脂质体纳米颗粒的表面带有正电荷。
62、本发明中,较佳地,所述糖响应脂质体纳米颗粒的zeta电位为20~70mv,例如30mv、40mv、50mv或60mv。
63、本发明还提供一种胰岛素递送体系的制备方法,其包括以下步骤:将包含所述糖响应脂质体纳米颗粒的溶液与胰岛素水溶液混合,即得;其中,所述胰岛素水溶液的ph为6~9。
64、本发明中,所述胰岛素水溶液的ph维持在6~9,在保持胰岛素的活性的同时,使胰岛素呈带负电的状态。所述胰岛素水溶液的ph较佳地为7~8,例如7.4。
65、本发明中,所述胰岛素水溶液中胰岛素的浓度可为0~10mg/ml,且不为0。
66、本发明中,所述胰岛素水溶液可采用本领域常规的方法制备,较佳地包括:先将胰岛素溶解在ph为2-5盐酸水溶液中,再用氢氧化钠调节ph至6~9。
67、本发明中,所述包含所述糖响应脂质体纳米颗粒的溶液中,所述糖响应脂质体纳米颗粒的浓度较佳地为0.1-50mg/ml。其中,所述糖响应脂质体纳米颗粒的浓度是指每1ml溶液包含的所述糖响应脂质体纳米颗粒的质量(mg)。
68、本发明中,较佳地,所述包含所述糖响应脂质体纳米颗粒的溶液由前述糖响应脂质体纳米颗粒的制备方法直接制得。
69、本发明中,所述包含所述糖响应脂质体纳米颗粒的溶液还可由冻干粉形式的糖响应脂质体纳米颗粒复溶得到。
70、本发明中,所述包含所述糖响应脂质体纳米颗粒的溶液与所述胰岛素水溶液的体积比较佳地为(0.1~10):1,例如2:1。
71、本发明中,所述糖响应脂质体纳米颗粒和所述胰岛素的摩尔比可为(2~50):1,较佳地为(2~10):1,例如4:1或8:1。
72、本发明中,较佳地,在所述混合后还包括超滤的步骤。所述超滤的目的是除去游离的胰岛素。超滤后得到的胰岛素递送体系在使用前用磷酸盐缓冲液(pbs)重悬。
73、其中,所述超滤较佳地为离心超滤。所述离心超滤采用超滤离心管进行。所述超滤离心管的截留分子量可为10~300kda,例如100kda。所述离心超滤的离心转速可为8000~14 800rpm,例如12 000rpm。所述离心超滤的时间可为15~60min,例如30min。
74、本发明还提供一种胰岛素递送体系,其由上述胰岛素递送体系的制备方法制得;所述胰岛素递送体系包括所述糖响应脂质体纳米颗粒和胰岛素,所述胰岛素负载在所述糖响应脂质体纳米颗粒的表面。
75、本发明中,所述糖响应脂质体纳米颗粒的表面带有正电荷,胰岛素带有负电荷,胰岛素通过静电吸引力负载在所述糖响应脂质体纳米颗粒的表面。
76、本发明中,所述胰岛素递送体系具有糖响应性。在高血糖时,葡萄糖与所述糖响应脂质体纳米颗粒的表面的苯硼酸基团结合,使所述糖响应脂质体纳米颗粒表面的正电性下降,实现电荷反转,与胰岛素的作用减弱,从而释放出胰岛素。但这种电性的变化会随着血糖降低而减弱,在正常血糖下,胰岛素不释放或只有极低水平的胰岛素释放。
77、本发明还提供一种所述糖响应脂质体纳米颗粒或所述胰岛素递送体系在制备治疗糖尿病药物中的应用。
78、本发明中,所述糖尿病可为1型糖尿病或晚期2型糖尿病。
79、本发明中,所述胰岛素递送体系在应用时,可用磷酸盐缓冲液重悬,通过皮下注射给药进行治疗。
80、在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
81、本发明所用试剂和原料均市售可得。
82、本发明的积极进步效果在于:
83、1、本发明的糖响应脂质体纳米颗粒具有确定的结构,粒径稳定,且所带正电荷单一,潜在毒性低。
84、2、本发明的胰岛素递送体系具有优异的血糖调节能力,与注射等量胰岛素相比,该胰岛素递送体系不会引起骤发的低血糖,同时维持血糖在正常水平的时间可增长至7h,减少了胰岛素的注射次数。
85、3、本发明的糖响应脂质体纳米颗粒及胰岛素递送体系的制备方法操作简单,条件温和。
- 还没有人留言评论。精彩留言会获得点赞!