聚乙二醇支载的阿比特龙前药及其制备方法与流程
1.本发明属于有机合成和药物领域,具体涉及的聚乙二醇支载的阿比特龙前药化合物。
背景技术:
2.前列腺癌发生和演变过程为:前列腺上皮
→
高分级前列腺上皮内瘤(hgpin)
→
早期组织学/潜伏性浸润性前列腺癌
→
局限于前列腺内前列腺癌
→
前列腺癌转移
→
非雄激素依赖性无限生长。早期前列腺癌通常没有明显的症状,但肿瘤侵犯或阻塞尿道、膀胱颈时,则会发生类似下尿路梗阻或刺激症状,严重者可能出现急性尿潴留、血尿、尿失禁。骨转移时可有骨痛、病理性骨折、贫血等症状,出现脊髓压迫可导致下肢瘫痪等严重后果。大部分前列腺癌经过一定时间治疗后,终将进展为临床难治的去势抵抗性前列腺癌,目前的治疗手段均难以提高其2~3年的生存期。前列腺癌的病因和发病机制仍未完全阐明,但研究表明雄激素在前列腺癌的发生和发展过程中具有重要作用。
3.醋酸阿比特龙最初是英国技术集团(btg)资助项目的一部分,在英国的癌症研究所(icr)合成,2004年授权cougar biotechnology用于晚期前列腺癌和乳腺癌激素疗法临床试验,2009年cougar biotechnology公司被johnson&johnson收购。2011年4月fda批准醋酸阿比特龙与泼尼松或泼尼松龙联用,治疗既往接受过多西他赛化疗的转移性去势抵抗性前列腺癌,商品名为剂型为250mg的口服片剂。2012年fda批准了新适应症:用于初治转移性去势抵抗性前列腺癌和新诊断的高危转移性内分泌治疗敏感性前列腺癌(mhspc)。
4.醋酸阿比特龙的水溶性较差,可溶于有机溶剂,但几乎不溶于水介质;另一方面,其具有高亲脂性,log p为5.12,且在caco-2单分子膜上的渗透性较低,与阿比特龙的渗透性相似,在生物药剂学分类系统中(bcs),醋酸阿比特龙归属为ⅳ类药物,即低溶解性和低渗透性。醋酸阿比特龙的生物利用度为5%,但因92%的阿比特龙在体内被代谢为非活性代谢物,其实际利用率仅为0.4%。低溶解、低渗透以及低生物利用度的特点导致服用醋酸阿比特龙时要保证每天1000mg(4片,250mg每片)的大剂量才能达到治疗水平。因此,提高溶解度和生物利用度是阿比特龙前药研究的关键所在。
5.中国专利cn114672013公开了一种用于前列腺肿瘤治疗的聚乙二醇单甲醚修饰阿比特龙化合物、含聚乙二醇单甲醚修饰阿比特龙化合物。其不足之处是,所合成的化合物只探讨了在碳酸氢钠溶液中的溶解度,其在水、5%葡萄糖溶液和ph1-3的缓冲溶液中的溶解度并不明了。
技术实现要素:
6.本发明的目的在于提供一种聚乙二醇支载的阿比特龙前药,从而提高阿比特龙的水溶性。
7.为达到上述目的本发明通过下述技术方案加以实现。通过氨基酸或寡肽把水溶性
的聚乙二醇与阿比特龙键接如下式ⅰ所示的化合物,即阿比特龙的前药。
[0008][0009]
式ⅰ中,阿比特龙上oh基,键接peg-[x-ch2-co-a-nh-co]n基团,取代h;
[0010]
x为o,或为ococh2,或为nh,或为nhcoch2;
[0011]
a为单一化学键,或为一种氨基酸,包括但不限制于苯丙氨酸、蛋氨酸、缬氨酸、丙氨酸、赖氨酸、异亮氨酸、甘氨酸、脯氨酸,或为寡肽;
[0012]
r为氨基酸的残基;
[0013]
n等于1或者2。
[0014]
本发明的另一方面,提供了上述聚乙二醇支载的阿比特龙前药的制备方法,包括以下步骤:
[0015]
(1)制备官能团化的化合物聚乙二醇二酸,其主要方法是通过聚乙二醇经甲苯共沸除水后与过量的丁二酸酐在干燥的二氯甲烷中,在吡啶的催化下回流搅拌48小时后得到化合物a;
[0016]
(2)化合物a在二甲酰胺中与羟基丁二酰亚胺,在二环己基碳二亚胺(dcc)和4-二甲氨基吡啶(dmap)作用下,室温反应薄层色谱监测反应完全停止,得到活泼酯b;
[0017]
(3)将活泼酯b溶于二甲基甲酰胺,将溶液滴加到氨基酸或者寡肽的碳酸氢钠水溶液中,常温下反应24小时得到聚乙二醇二酸与氨基酸或寡肽的连接物c;
[0018]
(4)将上述连有氨基酸或寡肽的聚乙二醇二酸化合物c与阿比特龙,在干燥的二氯甲烷中,在在二环己基碳二亚胺(dcc)和4-二甲氨基吡啶(dmap)作用下,先在0℃下反应4小时,随后恢复到常温再反应20小时,得到最终前药化合物。
[0019]
上述制备方法如下所示:
[0020][0021]
本发明所提供的聚乙二醇支载的阿比特龙前药及其制备方法,通过实施例表明,
针对阿比特龙水溶性差的问题,可明显改善溶解性,因此可以更有效的方式运输到患者体中治疗前列腺肿瘤。
[0022]
本发明的前药可以各种形式的运用。例如可制备成可注射的药物或以粉末使用,也可与药物稀释剂、载体或赋性剂混合,形成药物组合。可以静脉、口服或经其它途径向患者给药。通过此给药方式,可向患者提供有效剂量的阿比特龙。
附图说明
[0023]
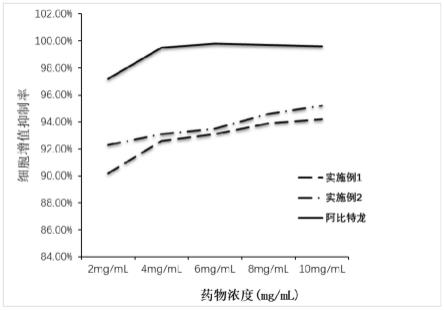
图1是聚乙二醇支载的阿比特龙前药采用mtt法测定实施例化合物对小鼠前列腺癌细胞rm-1,图示比较细胞抑制增值率。
具体实施方式
[0024]
下面通过实施例对本发明作进一步说明,其目的仅在于更好的理解本发明的内容而非限制本发明的保护范围:
[0025]
实施例1聚乙二醇-2000-二酸-甘氨酸-阿比特龙的合成
[0026]
步骤一:聚乙二醇-2000-二酸的合成
[0027]
称取10.0g(0.005mol)的聚乙二醇-2000溶于50ml甲苯中与甲苯共沸蒸馏除水,待甲苯蒸掉三分之二后向反应体系中加入15ml二氯甲烷和50g(0.05mol)丁二酸酐,并加入2ml吡啶,在60℃左右回流反应48小时。反应完毕后减压蒸干溶剂,而后加入20ml的0.1m的碳酸氢钠水溶液,再抽滤,滤液用0.1n的盐酸20ml酸化,用浓盐酸将溶液ph值调到3-4再用3x15 ml的乙酸乙酯洗涤,合并乙酸乙酯溶液用2x15 ml的饱和氯化钠水溶液洗涤,加入无水硫酸钠干燥,抽滤,加压旋转蒸干滤液中的溶剂,加入2ml的乙酸乙酯加热使之将残余物溶解,而后保持超声震荡向溶液中加入大量无水乙醚,冷冻结晶,抽滤,用少量乙醚洗涤滤饼得白色固体,产率88%。
[0028]
步骤二:聚乙二醇-2000-二酸-活泼酯的合成
[0029]
5.0g(2.28mmol)的聚乙二醇-2000-二酸溶于25ml干燥的二氯甲烷中,并冷却至0-5℃后,加入1.04g(50mmol)二环基碳二亚胺(dcc)和0.58g的n-羟基丁二酰亚胺(nhs)溶于25ml二氯甲烷的溶液,并在此温度下搅拌反应2小时,随后室温下反应24小时。反应完毕后用30ml的蒸馏水洗涤反应液用30ml饱和氯化钠溶液洗涤,加入无水硫酸钠干燥。一小时后过滤,浓缩滤液,在加入30ml二氯甲烷并加热使之溶解,再过滤溶液,浓缩滤液后加入3ml二氯甲烷加热便之溶解,在超声震荡中倾入30ml无水乙醚中,冷冻结晶,抽滤溶液,用少量乙醚洗涤滤饼得白色固体,真空干燥至恒重,产率90%。
[0030]
步骤三:聚乙二醇-2000-二酸-甘氨酸的合成
[0031]
将10g(0.418mmol)聚乙二醇-2000-二酸活泼酯溶于3ml干燥的n,n-二甲基甲酰胺(dmf)中,将0.1000g(1.0mmol)甘氨酸溶于4ml浓度为1m的nahco3溶液,并超声震荡10min使之充分溶解,向活泼酯的dmf溶液中滴加氨基酸的碳酸氢钠溶液,反应液变浑浊并且放热,室温下搅拌反应24小时。反应完毕后,减压蒸馏除去反应体系中的水和dmf,蒸馏后的残余物用20ml浓度为2%的hci溶解,放出大量co2气体,再用3x5 ml的二氯甲烷萃取,合并萃取液用10ml的蒸馏水洗涤溶液,10ml饱和氯化钠溶液洗涤至澄清,用无水硫酸钠干燥,过滤,滤液浓缩,加入30ml的乙醚,冷冻结晶,抽滤,用少量乙醚洗涤滤饼,真空干燥得白色固体。
[0032]
步骤四:聚乙二醇-2000-二酸-甘氨酸-阿比特龙的合成
[0033]
先将1.0当量的聚乙二醇-2000-二酸-甘氨酸加入茄形瓶中,再用移液管加入25ml/mmol的二氯甲烷,在冰水浴中搅拌至0℃,加入1.2当量的阿比特龙,0.5当量的对二甲基氨基吡啶(dmap)和1.0当量的二环己基碳二亚胺(dcc),搅拌反应,自然升温至室温,继续反应24h反应完毕后,向反应体系中滴加10%的hac/thf溶液。十分钟后加入浓度为0.1n的hcl溶液,洗涤有机相后用蒸馏水洗涤至中性,再用饱和氯化钠溶液洗去有机相中的水,加入少量无水硫酸钠干燥。一个小时后过滤,并浓缩滤液,再加入15ml二氯甲烷溶液,用脱脂棉过滤,再浓缩滤液,后加入2ml异丙醇溶液冷冻结晶,减压过滤,用乙醚洗涤,得聚乙二醇-2000-二酸-甘氨酸-阿比特龙化合物,为白色固体。
[0034]
核磁共振氢谱结果:1h nmr(600hz,cdcl3)δ9.04(brs,2h),8.47(s,2h),8.39(d,j=13.8,2h),7.70(d,j=9.0,2h),7.29(t,j=6.6,2h),5.96(t,j=3.0,2h),5.27(t,j=7.2,2h),4.56-4.73(m,2h),4.02-4.49(m,90h),4.16(s,4h),3.24-3.71(m,90h),2.61(t,j=4.2,4h),2.49(t,j=4.8,4h),1.06-2.31(m,34h),1.01(s,12h)。
[0035]
实施例2聚乙二醇-600-二酸-甘氨酸-阿比特龙的合成
[0036]
步骤一:聚乙二醇-600-二酸的合成
[0037]
称取6.0g(0.01mol)的聚乙二醇-600溶于20ml甲苯中与甲苯共沸蒸馏除水,待甲苯蒸掉三分之二后向反应体系中加入15ml二氯甲烷和5g(0.05mol)丁二酸酐,并加入2ml吡啶,在60℃左右回流反应48小时。反应完毕后减压蒸干溶剂,而后加入20ml的0.1m的碳酸氢钠水溶液,再抽滤,滤液用0.1n的盐酸20ml酸化,用浓盐酸将溶液ph值调到3-4再用3x15 ml的乙酸乙酯洗涤,合并乙酸乙酯溶液用2x15 ml的饱和氯化钠水溶液洗涤,加入无水硫酸钠干燥,抽滤,加压旋转蒸干滤液中的溶剂,加入2ml的乙酸乙酯加热使之将残余物溶解,而后保持超声震荡向溶液中加入大量无水乙醚,冷冻结晶,抽滤,用少量乙醚洗涤滤饼得白色固体,产率88%。
[0038]
步骤二:聚乙二醇-600-二酸-活泼酯的合成
[0039]
3.1g(0.5mmol)的聚乙二醇-600-二酸溶于10ml干燥的二氯甲烷中,并冷却至0-5℃后,加入0.10g(5mmol)二环基碳二亚胺(dcc)和0.06g的n-羟基丁二酰亚胺(nhs)溶于5ml二氯甲烷的溶液,并在此温度下搅拌反应2小时,随后室温下反应24小时。反应完毕后用蒸馏水洗涤反应液用饱和氯化钠溶液洗涤,加入无水硫酸钠干燥。一小时后过滤,浓缩滤液,在加入二氯甲烷并加热使之溶解,再过滤溶液,浓缩滤液后加入少量二氯甲烷加热使之溶解,在超声震荡中倾入无水乙醚,冷冻结晶,抽滤溶液,用少量乙醚洗涤滤饼得白色固体,真空干燥,产率92%。
[0040]
步骤三:聚乙二醇-600-二酸-甘氨酸的合成
[0041]
将3g(0.042mmol)聚乙二醇-600-二酸活泼酯溶于3ml干燥的n,n-二甲基甲酰胺(dmf)中,将0.01g(0.1mmol)甘氨酸溶于1ml浓度为1m的nahco3溶液,并超声震荡10min使之充分溶解,向活泼酯的dmf溶液中滴加氨基酸的碳酸氢钠溶液,反应液变浑浊并且放热,室温下搅拌反应24小时。反应完毕后,减压蒸馏除去反应体系中的水和dmf,蒸馏后的残余物用20ml浓度为2%的hci溶解,放出大量co2气体,再用3x5 ml的二氯甲烷萃取,合并萃取液用10ml的蒸馏水洗涤溶液,10ml饱和氯化钠溶液洗涤至澄清,用无水硫酸钠干燥,过滤,滤液浓缩,加入30ml的乙醚,冷冻结晶,抽滤,用少量乙醚洗涤滤饼,真空干燥得白色固体。
[0042]
步骤四:聚乙二醇-600-二酸-甘氨酸-阿比特龙的合成
[0043]
先将1.0当量的聚乙二醇-600-二酸-甘氨酸加入茄形瓶中,再用移液管加入25ml/mmol的二氯甲烷,在冰水浴中搅拌至0℃,加入1.2当量的阿比特龙,0.5当量的对二甲基氨基吡啶(dmap)和1.0当量的二环己基碳二亚胺(dcc),搅拌反应,自然升温至室温,继续反应24h反应完毕后,向反应体系中滴加10%的hac/thf溶液。十分钟后加入浓度为0.1n的hcl溶液,洗涤有机相后用蒸馏水洗涤至中性,再用饱和氯化钠溶液洗去有机相中的水,加入少量无水硫酸钠干燥。一个小时后过滤,并浓缩滤液,再加入15ml二氯甲烷溶液,用脱脂棉过滤,再浓缩滤液,后加入2ml异丙醇溶液冷冻结晶,减压过滤,用乙醚洗涤,得聚乙二醇-600-二酸-甘氨酸-阿比特龙化合物,为白色固体。
[0044]
核磁共振氢谱结果:1h nmr(600hz,cdcl3)δ9.04(brs,2h),8.47(s,2h),8.39(d,j=13.8,2h),7.70(d,j=9.0,2h),7.29(t,j=6.6,2h),5.96(t,j=3.0,2h),5.27(t,j=7.2,2h),4.56-4.73(m,2h),4.02-4.49(m,26h),4.16(s,4h),3.24-3.71(m,26h),2.61(t,j=4.2,4h),2.49(t,j=4.8,4h),1.06-2.31(m,34h),1.01(s,12h)。
[0045]
实施例3含聚乙二醇支载的阿比特龙前药的水溶性评价
[0046]
色谱条件:waterse2695高效液相色谱仪;c-18反相色谱柱(200x4.6mm,lubex);流动相a(0.1%三氟乙酸)和流动相b(乙腈)梯度洗脱色谱分离程序如下:0-5分钟流动相a由80%降到10%,5-10分钟流动相a维持10%不变,10-13分钟流动相a浓度上升到80%,13-15分钟流动相a维持80%不变;总运行时常为15分钟;流速为2ml/min;进样量10μl;uv检测器,检测波长为254nm;,样品进样前均经0.22μm滤过。该方法的定量限为0.5μg/ml,校准曲线在0.5~150μg/ml之间呈线性关系。
[0047]
溶解介质为纯水、5%葡萄糖溶液及ph值1-3的缓冲液,精密称取10mg待测物于10ml相应溶剂中,25℃振摇72h,静置,取1ml澄清溶液,10000rpm离心10min,取上清液,hplc进样测定,记录峰面积并计算待测物在溶剂中的饱和浓度(μg/ml),结果如表1所示。
[0048]
表1饱和浓度(μg/ml)测试结果
[0049]
待测物纯水5%葡萄糖溶液ph值1-3的缓冲液实施例1化合物100.28
±
0.4890.35
±
0.6580.76
±
0.45实施例2化合物150.63
±
1.12160.54
±
2.87150.92
±
2.54阿比特龙《0.5《0.5《0.5
[0050]
根据文献([1]solymosi t,et al.j chem eng data,2018,63(12),4453-4458.)报道,阿比特龙在纯水中的溶解度《0.5μg/ml低于检测限,无法检出。
[0051]
实施例4含聚乙二醇支载的阿比特龙前药的细胞毒性评价
[0052]
mtt法测定实施例化合物对小鼠前列腺癌细胞rm-1
[0053]
实验中各化合物设置的5组加药组中分别加入浓度为2mg/ml、4mg/ml、6mg/ml、8mg/ml、10mg/ml的二甲基亚砜药物溶液200μl,细胞加药处理24h,结果如下图1所示细胞抑制增值率。且聚乙二醇衍生物以前体药物形式发挥作用,需通过代谢过程方能起效,故细胞毒性低于本体药物。
[0054]
综上所述,聚乙二醇支载的阿比特龙前药化合物不仅能够提高阿比特龙的水溶性,且可以较好保持阿比特龙药效具有良好的抗前列腺癌活性。且聚乙二醇衍生物以前体药物形式发挥作用,需通过代谢过程方能起效,故细胞毒性低于本体药物。
[0055]
本发明并不局限于上述实施方式,如果对本发明的各种改动或变型不脱离本发明的精神和范围,倘若这些改动和变型属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变动。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1