α-亚麻酸在制备治疗变应性鼻炎药物中的应用及药物
1.本发明属于医药应用领域技术领域,具体涉及α-亚麻酸在制备治疗变应性鼻炎药物中的应用及药物。
背景技术:
2.变应性鼻炎(allergic rhinitis,ar)属于i型变态反应性疾病,是具有敏感体质的个体接触过敏原后,产生特异性抗体ige结合在肥大细胞表面,导致以组胺为主的多种炎性介质释放,从而引起鼻黏膜变态反应性、非感染性炎性病变,以鼻痒、阵发性打喷嚏、流清鼻涕和鼻塞等一系列过敏症状为主要临床表现。变应性鼻炎是呼吸道最常见的变态反应性疾病。ar在全球人口中发病率为10%-20%,在北京学龄前儿童的发病率高达48%。变应性疾病具有反复发作的特点,需要长期规范用药。目前,抗变态反应的局部和全身用药仍以糖皮质激素为主,但该药物治疗的副作用不容忽视。因此,迫切需要新的治疗机制的药物改变现状。
3.α-亚麻酸(ala)是一种ω-3多不饱和必需脂肪酸,具有多种生物学活性作用,如:降血脂、血压,抑制血小板凝聚、抗血栓形成,及抗炎抗过敏等。已有研究证实ω-3多不饱和脂肪酸对类风湿性关节炎、哮喘、肠炎等慢性炎症性疾病有益。
4.但是,α-亚麻酸作为抗变应性鼻炎药物的用途是当前研究的空白点。
技术实现要素:
5.为了克服上述现有技术的缺点,本发明的目的在于提供一种α-亚麻酸在制备治疗变应性鼻炎药物中的应用及药物。
6.为了达到上述目的,本发明采用以下技术方案予以实现:
7.本发明公开了α-亚麻酸在制备治疗鼻炎的药物中的应用。
8.进一步公开了α-亚麻酸在制备治疗变应性鼻炎的药物中的用途。
9.优选地,所述的药物为抑制鼻黏膜病理改变的药物。
10.进一步优选地,所述的药物为通过t细胞上il-4rα-jak2-stat3通路恢复ova诱导的ar的th1和th2的免疫细胞失衡的药物。
11.本发明还公开了一种治疗变应性鼻炎的药物,由α-亚麻酸添加或不添加药学上可接受的辅料制成。
12.优选地,所述的辅料包括稳定剂、增溶剂、润滑剂或崩解剂中的一种或几种。
13.优选地,所述药物的剂型为片剂、颗粒剂、胶囊剂、丸剂、冲剂、滴剂或喷剂。
14.进一步优选地,当药物剂型为滴剂时,制备方法如下:
15.按照(4~8)mg:0.5ml的用量比将α-亚麻酸溶于无水乙醇,用注射用水调节渗透压为280~310mmol/l,调整ph值至7.2~7.6,配制成质量浓度为1%~2%的溶液,注入10ml鼻滴剂专用塑料瓶封存包装,制得滴剂。
16.进一步优选地,当药物剂型为喷剂时,制备方法如下:
17.按照(4~8)mg:0.5ml的用量比将α-亚麻酸溶于无水乙醇,用注射用水调节渗透压为280~310mmol/l,调整ph值至7.2~7.6,最终配制成质量浓度1~2%的溶液,注入10ml鼻喷剂专用塑料瓶封存包装,制得喷剂。
18.与现有技术相比,本发明具有以下有益效果:
19.本发明公开了α-亚麻酸在制备抗变应性鼻炎药物中的应用,以babl/c小鼠建立ova诱导的ar动物模型,在给药3周后比较各组小鼠行为学评分,取血清进行炎症因子检测,并取鼻中隔黏膜通过病理图片染色。结果显示,各组小鼠均出现典型的ar症状,行为学叠加评分》5分,经α-亚麻酸干预后,ar症状减轻,行为学叠加评分较模型组均明显降低(p《0.01)。血清ige水平,与模型组比较,给药3周后,α-亚麻酸组小鼠血清ige水平显著下调。染色结果可见:与模型组比较,给药3周后,α-亚麻酸组小鼠肥大细胞、嗜酸性粒细胞和杯状细胞浸润显著减少。认为α-亚麻酸显著抑制ar模型小鼠鼻病理改变。通过流式结果发现,ala能够缓解ova诱导的ar的th1和th2的免疫细胞失衡。通过药理学相关实验证实ala通过t细胞上il-4rα-jak2-stat3通路恢复ova诱导的ar的th1和th2的失衡。因此,α-亚麻酸可用于制备治疗变应性鼻炎的药物。
附图说明
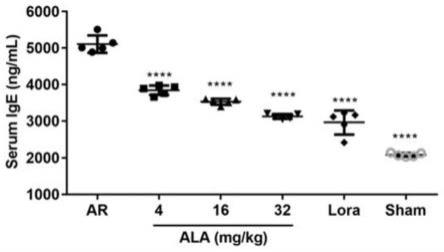
20.图1为ala对ar小鼠血清ige水平影响;数据以mean
±
sem形式表示,n=5;与ar模型组比较,****p《0.001;
21.图2为ala对ar小鼠鼻黏膜杯状细胞增生影响;数据以mean
±
sem形式表示,n=5;与ar模型组比较,****p《0.001;
22.图3为ala对ar小鼠th1/th2/treg/th17细胞因子水平影响;其中,a为各组小鼠血清il-4水平;b为各组小鼠nalf il-4水平;c为各组小鼠血清ifn-γ水平;d为各组小鼠nalf ifn-γ水平;数据以mean
±
sem形式表示,n=6;与ar模型组比较,****p《0.001;
23.图4为ala对ar小鼠il-4rα-jak2/stat3信号通路影响;其中,a为小鼠t细胞il-4rα水平;b为各组小鼠鼻黏膜组织p-jak2水平;c为各组小鼠鼻黏膜组织p-stat3水平;数据以mean
±
sem形式表示,n=6;与ar模型组比较,**p《0.01,***p《0.001,****p《0.0001。
具体实施方式
24.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
25.需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品
或设备固有的其它步骤或单元。
26.下面结合附图对本发明做进一步详细描述:
27.本发明实施例所用到的实验药物
28.α-亚麻酸,分子式为c
18h30
o2,cas号463-40-1。购买自宝鸡辰光生物科技有限公司。
29.本发明实施例所用到的实验动物
30.实验用4~6周龄balb/c雄性小鼠购自西安交通大学医学部实验动物中心,合格证编号:scxk(陕2013-003)。采取常规分笼饲养的方式,确保足量食物和水。
31.变应性鼻炎小鼠模型构建及治疗
32.1、实验原理
33.采用国内外比较成熟及公认的变应性鼻炎小鼠模型制备方法建立模型,基本过程是首先腹腔注射ova(卵清蛋白)-al(oh)3悬浮液进行全身基础致敏,使小鼠处于易敏状态,然后用ova溶液滴鼻进行局部攻击,诱导小鼠发生变应性鼻炎。滴鼻前1h灌胃α-亚麻酸或氯雷他定(阳性药物)干预治疗。
34.2、实验步骤
35.(1)将balb/c小鼠随机分为6组,每组10只,分组名称分别为阴性对照组、变应性鼻炎模型组、4mg/kgα-亚麻酸组(低剂量组)、16mg/kgα-亚麻酸组(中剂量组)、32mg/kgα-亚麻酸组(高剂量组)及氯雷他定组(阳性药物组)。
36.(2)变应性鼻炎模型组,各浓度α-亚麻酸及氯雷他定治疗组小鼠分别于第0、7和14天每只腹腔注射ova-al(oh)3悬浮溶液0.3ml,阴性对照组小鼠腹腔注射生理盐水0.3ml。
37.(3)从第21天到第34天开始持续两周的灌胃给药和滴鼻激发,每天一次,各组小鼠的处理分别是:
38.a)阴性对照组:每只小鼠灌胃0.2ml 0.01%乙醇溶液,1h后用移液枪在小鼠两侧鼻孔各滴入10μl生理盐水。
39.b)变应性鼻炎模型组:每只小鼠灌胃0.2ml 0.01%乙醇溶液,1h后用移液枪在小鼠两侧鼻孔各滴入10μl 1% ova。
40.c)α-亚麻酸组:每只小鼠灌胃0.2ml含4mg/kg、16mg/kg或32mg/kgα-亚麻酸的0.01%乙醇溶液,1h后用移液枪在小鼠两侧鼻孔各滴入10μl 1% ova。
41.d)氯雷他定组(阳性药物组):每只小鼠灌胃0.2ml 1.5mg/kg氯雷他定溶液,1h后用移液枪在小鼠两侧鼻孔各滴入10μl 1% ova。
42.3、观察指标
43.行为学分析:在最后一次滴鼻后,将小鼠放进观察笼中,观察30min内小鼠抓鼻和打喷嚏的情况,分别记录次数。观察者对小鼠行为学的观察采用单盲法。
44.小鼠血清ige含量检测:第35天用眼球摘除法取各组小鼠的外周血,置于预先准备好的装有10μl 1%肝素钠溶液的1.5ml ep管中,4℃,12000rpm,离心20min,收集上清。-80℃冷冻保存,备用。按照小鼠ige elisa试剂盒说明书的操作方法检测小鼠血清ige含量。
45.小鼠鼻黏膜组织取材:眼球摘除法取完血后,将小鼠断头,剥去上颌毛皮,沿小鼠头顶部眼眶后部骨缝连线处将脑部去除,保留鼻腔,剪除下颌部分,浸泡于4%多聚甲醛中,4℃,24h。然后转移至10% edta中脱钙,每隔3天换一次液,直至脱钙完全。流水冲洗12h,取距前鼻孔8mm处组织修平整,脱水机脱水,透明,浸蜡,包埋制成石蜡组织块,冠状位切片,厚
度为5μm,用于后续组织染色。
46.数据处理与统计学分析:所有实验数据均采用统计软件graphpad prism 6.0进行统计学分析,数据结果用平均值
±
标准误(mean
±
sem)表示,p《0.05表示有显著性差异。
47.ala对ar小鼠的相关药理活性实验
48.1、ala对ar小鼠挠鼻和打喷嚏行为影响
49.阵发性喷嚏、清水涕、鼻痒和鼻塞是ar的典型临床症状。通过行为学分析ala干预治疗前后ar小鼠挠鼻和打喷嚏次数的变化情况,以考察ala对ar小鼠鼻部过敏症状的改善效果。
50.末次滴鼻后立即观察并记录30min内各组小鼠挠鼻和打喷嚏次数,结果如表1所示,ar模型组、4mg/kg ala组、16mg/kg ala组、32mg/kg ala组、氯雷他定(阳性药物)组、阴性对照组小鼠挠鼻次数(a)分别为228.0
±
7.778,166.2
±
7.290,157.8
±
6.644,155.0
±
3.873,144.0
±
4.393,84.00
±
2.302,84.20
±
2.922;打喷嚏次数(b)分别为101.8
±
3.680,71.40
±
3.219,49.00
±
1.517,41.40
±
1.435,33.20
±
1.281,14.80
±
1.655。与阴性对照组相比,ar模型组的挠鼻和打喷嚏次数显著升高(p《0.01),表现出明显的过敏性鼻炎症状。与ar模型组相比,各浓度ala给药组和氯雷他定组的挠鼻和打喷嚏次数均显著减少,有统计学差异(p《0.01)。行为学分析结果表明ala具有减轻鼻部过敏症状的作用。结果如表1所示:
51.表1ala对ar小鼠鼻摩擦和打喷嚏行为的影响
[0052][0053][0054]
结果以每组5只小鼠的平均值
±
sem表示。*,p《.001,**,p《.0001vs ar模型组;^,p《.0001vs sham;#,p《.05,##,p《.01####,p《.0001vs氯雷他定治疗组。
[0055]
2、ala对ar小鼠血清ige水平影响
[0056]
通过elisa试剂盒检测各组小鼠血清ige水平,结果如图1所示,与阴性对照组(2070
±
21.59ng/ml)比较,ar模型组小鼠血清中ige含量(5009
±
52.02ng/ml)显著升高,差异有统计学意义(p《0.01),表明ar小鼠模型构建成功。4mg/kg ala组、16mg/kg ala组和32mg/kg ala组的血清ige含量分别为3889
±
46.87ng/ml,3563
±
20.08ng/ml和3107
±
29.60ng/ml,明显低于ar模型组(p《0.01),并且随着给药剂量增大,ala对血清ige的抑制作用逐渐增强。
[0057]
3、ala对ar小鼠鼻黏膜杯状细胞增生影响
[0058]
通过pas染色观察ala干预治疗后,ar小鼠鼻黏膜组织杯状细胞增生变化情况。图2为ar模型组、4mg/kg ala组、16mg/kg ala组、32mg/kg ala组、氯雷他定(阳性药物)组、阴性对照组小鼠鼻黏膜组织杯状细胞计数结果分别为31.67
±
2.028,15.67
±
1.764,9.333
±
1.764,0.6667
±
0.333,2.667
±
1.453,1.000
±
0.577。结果表明ala呈剂量依赖性减少ar小
鼠鼻黏膜杯状细胞增生。
[0059]
4、ala对ar小鼠th1/th2细胞分化失衡的影响
[0060]
th1、th2细胞主要通过分泌特定的细胞因子来调节炎症反应。通过检测ala对ar小鼠血清和nalf中ifn-γ(th1的标志性细胞因子)、il-4(th2的标志性细胞因子)水平的影响,来研究ala对ar小鼠th1/th2细胞免疫平衡的调节作用。
[0061]
结果如图3所示,图中a和b分析结果表明各浓度ala给药组小鼠血清和nalf中il-4浓度均显著性低于ar模型组(p《0.01);图中c和d分析结果表明各浓度ala给药组小鼠血清中ifn-γ浓度均显著性高于ar模型组(p《0.01),各组小鼠nalf中ifn-γ浓度无统计学差异(p>0.05);以上结果表明ala可以抑制il-4的表达水平和提高ifn-γ的表达水平,起到对th1/th2/细胞免疫平衡的调节作用。
[0062]
5、ala通过抑制t细胞il-4rα-jak2/stat3信号通路恢复th1/th2细胞免疫失衡
[0063]
通过检测ala对ar小鼠鼻粘膜组织上il-4rα,jak2,p-jak2,stat3,和p-stat3的水平的影响,来研究ala通过抑制t细胞il-4rα-jak2/stat3信号通路恢复ar小鼠th1/th2细胞免疫平衡的调节作用。
[0064]
结果如图4所示,图中a分析结果表明ala能够抑制il-4诱导的il-4rα的激活;图中b和c分析结果表明各浓度ala给药组小鼠鼻黏膜组织p-jak2和p-stat3表达均显著性低于ar模型组。
[0065]
综上所述,α-亚麻酸干预后小鼠搔鼻、喷嚏次数及流涕症状明显减轻,叠加评分与模型组有统计学差异。ova诱导的ar病变、鼻部症状、ige和细胞因子产生。ala治疗的小鼠表现出鼻部症状减轻、鼻部炎症、鼻中隔增厚、杯状细胞增生。小鼠的血清和鼻腔灌洗液中,ala降低了ige和il-4水平,并增加了th2免疫细胞。这项研究表明,ala有可能减少卵清蛋白诱导的ar症状、鼻粘膜病变和炎症。因此,可用于制备治疗变应性鼻炎的药物。
[0066]
由于鼻腔给药是临床治疗ar的常用途径,具有使用便捷、生物利用度高等特点,因此可将其制备成滴剂或喷剂产品。本发明用α-亚麻酸作为制备滴鼻制及喷鼻制剂的基本活性成分。由于α-亚麻酸不溶于水,因此用无水乙醇作为溶剂。且由于α-亚麻酸溶于无水乙醇后呈半透明、无嗅无味、较粘稠且放置24h无明显沉淀的液体。符合滴鼻剂和鼻喷剂要求药物无刺激性、溶解性好、有一定的粘附性的基本要求。同时也避免了添加辅料给实验结果带来的影响或辅料产生的副作用。其具体制备工艺为:将α-亚麻酸溶于无水乙醇,用注射用水调节渗透压为280~310mmol/l,用盐酸调整ph至7.2~7.6,最终配制成质量浓度1.34~2.67%的溶液,注入10ml鼻喷剂(或鼻滴剂)专用塑料瓶封存包装,即得滴鼻喷(或滴)剂。
[0067]
当然,也可以直接以α-亚麻酸为活性原料,按照制备片剂、胶囊剂或颗粒剂的常规工艺和辅料制成相应的制剂。
[0068]
实施例1α-亚麻酸滴鼻剂的制备
[0069]
称取8mgα-亚麻酸,溶于0.5ml无水乙醇,磁力搅拌助溶;然后用0.033ml注射用水调节渗透压为280~310mmol/l,用适量盐酸调整ph至7.5左右,使得α-亚麻酸的最终质量浓度为2%。注入10ml滴鼻剂专用塑料瓶封存包装,即得规格为10ml/只的2%α-亚麻酸变应性鼻炎治疗滴鼻剂。
[0070]
使用方法:滴鼻,3次/日,2周一个疗程,一般1~2个疗程。
[0071]
实施例2变应性鼻炎滴剂的制备
[0072]
称取4mgα-亚麻酸,溶于0.5ml无水乙醇,磁力搅拌助溶;然后用0.033ml注射用水调节渗透压为280~310mmol/l,用适量盐酸调整ph至7.5左右,使得α-亚麻酸的最终质量浓度为1%。注入10ml滴鼻剂专用塑料瓶封存包装,即得规格为10ml/只的1%α-亚麻酸变应性鼻炎治疗滴鼻剂。
[0073]
使用方法:滴鼻,3次/日,2周一个疗程,一般1~2个疗程。
[0074]
实施例3变应性鼻炎喷剂的制备
[0075]
称取8mgα-亚麻酸,溶于0.5ml无水乙醇,磁力搅拌助溶;然后用0.033ml注射用水调节渗透压为280~310mmol/l,用适量盐酸调整ph至7.5左右,使得α-亚麻酸的最终质量浓度为2%。注入10ml装微刻度专用塑料瓶鼻喷雾器封存包装,即得规格为10ml/只的2%α-亚麻酸变应性鼻炎治疗喷鼻剂。
[0076]
使用方法:喷鼻剂喷鼻,3次/日,2周一个疗程,一般1~2个疗程。
[0077]
实施例4变应性鼻炎喷剂的制备
[0078]
称取4mgα-亚麻酸,溶于0.5ml无水乙醇,磁力搅拌助溶;然后用0.033ml注射用水调节渗透压为280~310mmol/l,用适量盐酸调整ph至7.5左右,使得α-亚麻酸的最终质量浓度为1%。注入10ml装微刻度专用塑料瓶鼻喷雾器封存包装,即得规格为10ml/只的1%α-亚麻酸变应性鼻炎治疗喷鼻剂。
[0079]
使用方法:喷鼻剂喷鼻,3次/日,2周一个疗程,一般1~2个疗程。
[0080]
实施例5变应性鼻炎口服制剂的制备
[0081]
以α-亚麻酸为活性原料,以淀粉、羟丙基纤维素为辅料,混合、压片,得到片剂。每片含100mgα-亚麻酸。
[0082]
使用方法:2次/日,1片/次,2周一个疗程,共1-2疗程。
[0083]
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1