茶碱缓释片体内外相关性模型、构建方法及应用与流程
1.本发明涉及制药技术领域,尤其是涉及茶碱缓释片体内外相关性模型、构建方法及应用。
背景技术:
2.在现有仿制药的研发过程中,通常使用药物的溶出曲线对比的方式,在传统的溶出仪及介质中,简单模拟人体的生理环境,而后进行相关性评估,在人体试验之前,对仿制药与原研药的一致性进行评价,以期在正式人体试验时,仿制药表现出同原研药相似的pk特征。
3.但是,简单依靠溶出曲线无法区分仿制药不同处方的差异,无法区分仿制药同原研药的差异,特别是仿制药释药机理同原研不一致时,易导致产品开发无进展以及生物等效性试验失败。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于,提供一种茶碱缓释片体内外相关性模型的构建方法,期望采用该方法得到的茶碱缓释片体内外相关性模型,用于药效评价或者药物研发中,特别是仿制药的研发过程中,能够实现通过体外溶出曲线即可预测体内pk特征的技术效果,从而显著缩短药效评价和药物研发周期。
6.为了解决上述技术问题,实现上述目的,本发明提供以下技术方案:第一方面,本发明提供茶碱缓释片体内外相关性模型的构建方法,所述构建方法包括:获取茶碱缓释片的体外溶出曲线和体内药代动力学参数,依据体内药代动力学参数计算得到茶碱缓释片的体内吸收曲线,并构建体外溶出曲线和体内吸收曲线的相关性模型。
7.在可选的实施方式中,所述茶碱缓释片的体外溶出曲线通过往复筒溶出方法检测获得。
8.优选地,所述往复筒溶出方法的溶出介质为磷酸盐缓冲液。
9.优选地,所述磷酸盐缓冲液的ph为6.8。
10.优选地,所述往复筒溶出方法的往复速率为10~30dpm,更优选为25dpm,单位“dpm”为每分钟上下往复次数。
11.优选地,所述往复筒的上部无筛网,下部设有筛网。
12.优选地,所述筛网的规格为20~100mesh,更优选为40mesh。
13.优选地,所述往复筒溶出方法选取的溶出时间为0.5~6h。
14.优选地,所述往复筒溶出方法的取样体积为1~5ml,更优选为2ml。
15.在可选的实施方式中,所述体内药代动力学参数包括血药浓度曲线;优选地,所述体内药代动力学参数还包括c
max
、auc
0~t
或auc
0~inf
中至少一种。
16.优选地,所述t为48h。
17.在可选的实施方式中,依据体内药代动力学参数,通过反卷积计算得到茶碱缓释片的体内吸收曲线。
18.在可选的实施方式中,依据茶碱缓释片的体外溶出曲线,通过weibull函数构建体外释放模型。
19.在可选的实施方式中,采用excel规划构建茶碱缓释片的体内吸收曲线和体外释放模型的相关性模型。
20.在可选的实施方式中,所述相关性模型为fa =0.9498 fd +4.3025,所述fa为取样间隔1h条件下检测得到的茶碱缓释片体内吸收量百分比,所述fd为取样间隔0.25h条件下检测得到的茶碱缓释片体外溶出量百分比。
21.第二方面,本发明提供采用前述实施方式任一项所述构建方法得到的茶碱缓释片体内外相关性模型。
22.第三方面,本发明提供前述实施方式任一项所述构建方法或前述实施方式所述茶碱缓释片体内外相关性模型在药效评价或药物开发中的应用。
23.优选地,所述药物包括仿制药。
24.第四方面,本发明提供茶碱缓释片仿制药药效评价方法,所述药效包括获取体内药效动力学参数;所述评价方法包括,获取茶碱缓释片仿制药的体外溶出曲线,通过前述实施方式所述的茶碱缓释片体内外相关性模型计算得到茶碱缓释片仿制药的体内吸收曲线,对体内吸收曲线进行卷积得到茶碱缓释片仿制药的血药浓度曲线,并按照非房室模型计算药效动力学参数。
25.优选地,所述茶碱缓释片仿制药的体外溶出曲线通过往复筒溶出方法检测获得。
26.优选地,所述茶碱缓释片体内外相关性模型为fa =0.9498 fd +4.3025,所述fa为取样间隔1h条件下检测得到的茶碱缓释片体内吸收量百分比,所述fd为取样间隔0.25h条件下检测得到的茶碱缓释片体外溶出量百分比。
27.优选地,所述体内药代动力学参数还包括c
max
、auc
0~t
或auc
0~inf
中至少一种。
28.本发明提供了一种茶碱缓释片体内外相关性模型的构建方法,采用该方法得到的ivivc模型,能够用于准确评估茶碱缓释片的pk参数。经过用于模型建立的处方验证,其准确度>95%,说明整个计算过程正确;用于其他处方的外部验证,准确度大于85%,证明了所建立的模型是准确的。通过将待预测处方的pk参数与参比制剂进行比较,得到的ratio值满足80%~125%,即预测be等效。
附图说明
29.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
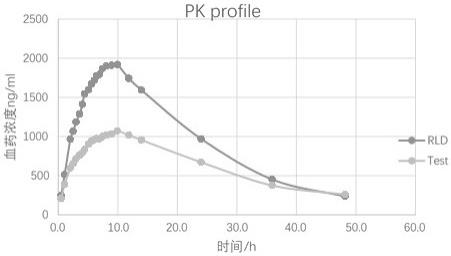
30.图1为本发明实施例1提供的处方一的平均血药浓度;图2为本发明实施例1提供的处方二的平均血药浓度;
图3为本发明实施例4构建得到的fa吸收曲线及fd溶出曲线的相关性方程。
具体实施方式
31.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。
32.因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.术语:“药代动力学(pk)参数”是指描述目标化合物的药代动力学性质的量度或特性,本文所述目标化合物指的是茶碱,本文使用的pk参数定义如下:“auc”是血浆浓度-时间曲线下总面积,是对于茶碱释放的量度,并且是单次剂量后或在稳态下的浓度-时间曲线的积分。auc以ng
·
h/ml(ng
×
h/ml)为单位表示。
[0034]“auc
0-t”是指施用单次剂量后0小时至t小时的auc。
[0035]“auc
0~inf
”ꢀ
是指施用单次剂量后0小时无穷长时间的auc。
[0036]“c
max”是指在施用包含特定化合物(本发明指的是茶碱)的组合物的剂量之后所观测到的茶碱的最大(峰值)血浆浓度。在进行2次或更多次给药的实施方式中,c
max
是指全部给药后的测量值。当茶碱浓度出现波动时,所述c
max
是指茶碱浓度达到稳态时的测量值。
[0037]“weibull函数”的公式为:;其中fd为特定取样间隔条件下检测得到的茶碱缓释片体外溶出量百分比,α和β为特定参数,其根据不同的处方组成会有所区别。
[0038]“ivivc”是指药物的体内/体外相关性。
[0039]“卷积”和反卷积是一种积分变换的数学方法,在本发明中卷积指将药物吸收量百分百-时间曲线转化成为药物血药浓度-时间曲线;反卷积指将药物血药浓度-时间曲线转化为药物吸收量百分百-时间曲线。
[0040]“excel规划”是指使用excel的规划求解功能,控制必须满足的项,如相关系数应满足大于0.98,达到建立体内吸收时间与体外溶出时间之间的转化关系。
[0041]“rld”是reference listed drug的缩写,是指参考清单药,即原研药。
[0042]“90%ci”是指90%可信区间。
[0043]“gmr”是指几何平均值。
[0044]
在某次具体的实施方式中,第一方面,本发明提供茶碱缓释片体内外相关性模型的构建方法,所述构建方法包括:获取茶碱缓释片的体外溶出曲线和体内药代动力学参数,依据体内药代动力学参数计算得到茶碱缓释片的体内吸收曲线,并构建体外溶出曲线和体内吸收曲线的相关性模型。
[0045]
在可选的实施方式中,所述茶碱缓释片的体外溶出曲线通过往复筒溶出方法检测
获得。
[0046]
优选地,所述往复筒溶出方法的溶出介质为磷酸盐缓冲液。
[0047]
优选地,所述磷酸盐缓冲液的ph为6.8。
[0048]
优选地,所述往复筒溶出方法的往复速率为10~30dpm,更优选为25dpm。
[0049]
优选地,所述往复筒的上部无筛网,下部设有筛网。
[0050]
优选地,所述筛网的规格为20~100mesh,更优选为40mesh。
[0051]
优选地,所述往复筒溶出方法选取的溶出时间为0.5~6h。
[0052]
优选地,所述往复筒溶出方法的取样体积为1~5ml,更优选为2ml。
[0053]
在可选的实施方式中,所述体内药代动力学参数包括血药浓度曲线;优选地,所述体内药代动力学参数还包括c
max
、auc
0~t
或auc
0~inf
中至少一种。
[0054]
优选地,所述t为48h。
[0055]
在可选的实施方式中,依据体内药代动力学参数,通过反卷积计算得到茶碱缓释片的体内吸收曲线。
[0056]
在可选的实施方式中,依据茶碱缓释片的体外溶出曲线,通过weibull函数构建体外释放模型。
[0057]
在可选的实施方式中,采用excel规划构建茶碱缓释片的体内吸收曲线和体外释放模型的相关性模型。
[0058]
在可选的实施方式中,所述相关性模型为fa =0.9498 fd +4.3025,所述fa为取样间隔1h条件下检测得到的茶碱缓释片体内吸收量百分比,所述fb为取样间隔0.25h条件下检测得到的茶碱缓释片体外溶出量百分比。
[0059]
第二方面,本发明提供采用前述实施方式任一项所述构建方法得到的茶碱缓释片体内外相关性模型。
[0060]
第三方面,本发明提供前述实施方式任一项所述构建方法或前述实施方式所述茶碱缓释片体内外相关性模型在药效评价或药物开发中的应用。
[0061]
优选地,所述药物包括仿制药。
[0062]
第四方面,本发明提供茶碱缓释片仿制药药效评价方法,所述药效包括获取体内药效动力学参数;所述评价方法包括,获取茶碱缓释片仿制药的体外溶出曲线,通过前述实施方式所述的茶碱缓释片体内外相关性模型计算得到茶碱缓释片仿制药的体内吸收曲线,对体内吸收曲线进行卷积得到茶碱缓释片仿制药的血药浓度曲线,并按照非房室模型计算药效动力学参数。
[0063]
优选地,所述茶碱缓释片仿制药的体外溶出曲线通过往复筒溶出方法检测获得。
[0064]
优选地,所述茶碱缓释片体内外相关性模型为fa =0.9498 fd +4.3025,所述fa为取样间隔1h条件下检测得到的茶碱缓释片体内吸收量百分比,所述fb为取样间隔0.25h条件下检测得到的茶碱缓释片体外溶出量百分比。
[0065]
优选地,所述体内药代动力学参数还包括c
max
、auc
0~t
或auc
0~inf
中至少一种。
[0066]
下面结合附图,对本发明的一些实施方式作详细说明。在不冲突的情况下,下述的实施例及实施例中的特征可以相互组合。
[0067]
实施例1
本实施例提供两份茶碱缓释片处方,如下:处方一组成为:69份的乙基纤维素、100份的茶碱、25份的羟甲基纤维素、36份的无水磷酸氢钙和0.23份的硬脂酸镁。
[0068]
处方二与处方一的区别在于还含有质量百分比5%的乳糖。
[0069]
实施例2采用往复筒法测定实施例1提供的处方一和处方二的体外溶出曲线,所述往复筒法的测定条件如下:装置往复筒法介质ph6.8磷酸盐缓冲液,250ml往复速率25dpm筛网孔径下筛网40mesh,上部无筛网取样时间0.5小时、1小时、2小时、3小时、4小时、6小时取样体积2ml得到的处方一和处方二的溶出数据如下:处方处方一处方二时间/h溶出%溶出%0000.517191273023947355674617567688使用weibull函数建立释放模型,得到的处方一和处方二的函数参数如下:处方αβ相关系数r处方一3.3250.8580.9984处方二2.6570.9050.9967实施例3对实施例1提供的处方一和处方二进行人体预实验,具体步骤如下:本试验为单中心、随机、开放、两制剂、单次给药、双周期、交叉餐后状态给药试验设计的人体生物等效性研究。给药剂量100mg/人,清洗期5天,12名受试者完成试验。
[0070]
餐后采血时间点为给药前(0h)和给药后0.5、1、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、9、10、12、14、24、36和48h(共计23个点)。
[0071]
受试者入选后,12名健康受试者随机分为3组,每组4人,禁食至少10h,给药,第2日早上7:30给予高脂餐,30min内吃完,并于8:00服用受试制剂100mg,统一用温水240ml送服。服药前1h至服药后2h内禁止额外饮水,其他时间可自由饮水。服药后4h内禁食。每个试验周期受试者应在相同特定时间点用标准餐。经过5天清洗期后进行交叉试验。受试者与试验期间禁食烟、酒、茶以及各种饮料,严禁剧烈运动。分别于给药前和给药后0.5、1、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、9、10、12、14、24、36和48h取肘静脉血4ml,置于事先已经
贴好标签的edta-k2抗凝试管内,于冰水浴中放置,采血后立即将采血管轻轻完全颠倒3次与抗凝剂混匀,于30min内3500rpm,4℃离心10min,冰水浴上分离血浆,血浆转移至2ml bp管中,暂放置于-20℃冰箱冷冻,待一个周期采血结束后,转移至-80℃冰箱保藏。
[0072]
而后采用lc-ms/ms方法(“lc-ms/ms法同时测定人血浆中4种茶碱类药物浓度”肖昌钱,李 贺,李 卫,李 力;中国临床药理学杂志,2014年,第8期)测定采样得到的血浆中茶碱的浓度,得到的处方一和处方二的平均血药浓度分别如图1和图2所示,主要的pk参数如下:实施例4对实施例3得到的处方一和处方二的血药浓度曲线进行反卷积计算得到处方一和处方二的体内吸收曲线,具体数据如下:
以处方二的fa吸收曲线及fd溶出曲线通过excel规划求解,求得满足线性相关的最佳解,结果如下:
实施例5对实施例4得到的ivivc模型进行验证:(1)模型处方内部验证以建立的fa-fd相关性曲线:fa =0.9498 fd +4.3025,计算用于模型建立的处方二的吸收曲线如下:
将吸收曲线进行卷积(参考参比制剂的t1/2为10.0h,vd为37104.7ng/(ng/ml)),照非房室模型计算pk预测的参数,并与实测值计算准确度如下:
(2)模型处方外部验证以建立的fa-fd相关性曲线:fa =0.9498 fd +4.3025,计算处方一的吸收曲线:
将吸收曲线进行卷积(参考参比制剂的t1/2为10.0h,vd为37104.7ng/(ng/ml)),照非房室模型计算pk预测的参数,并与实测值计算准确度如下:
由上可见,经过用于模型建立的处方验证,准确度为85%~115%>95%,说明整个计算过程正确;用于其他处方的外部验证,准确度大于85%,认为所建立的模型基本准确。
[0073]
实施例6本实施例提供了用于预测的预测处方一和预测处方二,组成如下:预测处方一:69份的乙基纤维素、100份的茶碱、25份的羟甲基纤维素、36份的无水磷酸氢钙和0.23份的硬脂酸镁、乳糖7.5%(w/w)预测处方二:69份的乙基纤维素、100份的茶碱、25份的羟甲基纤维素、36份的无水磷酸氢钙和0.23份的硬脂酸镁、乳糖12.5%(w/w)实施例7本实施例使用建立的fa-fd相关性曲线:fa =0.9498 fd +4.3025,计算预测处方一的吸收曲线如下:
再计算预测处方二的吸收曲线如下:
将吸收曲线进行卷积(参考参比制剂的t1/2为10.0h,vd为37104.7ng/(ng/ml)),照非房室模型计算pk预测的参数如下:
由上可以看出,待预测处方二的pk参数与参比制剂的ratio值满足80%~125%,即预测be等效,实现了药效评价效果,能够用于处方筛选。
[0074]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1